人教版高中化学必修1《硫及其氧化物》基础巩固练习题
- 格式:doc
- 大小:73.01 KB
- 文档页数:5

硫和氮的氧化物精品习题及答案A卷:1.最新研究表明:NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。
病毒学研究同时证实,NO对SARS病毒有直接抑制作用。
下列关于NO的叙述正确的是()A.NO是一种红棕色的气体B.常温常压下,NO不能与空气氧气直接化合C.含等质量的氧元素的NO和CO的物质的量相等D.NO易溶于水,不能用排水法收集2.2010年2月10日中国经济网发布的《第一次全国污染源普查公报》一文中有如下一组数据:A.SO2、NO x的大量排放会导致酸雨的发生B.煤与石油的大量燃烧是造成SO2、NO x大量排放的主要因素C.烟尘、粉尘属于固体污染物D.人类活动产生的气态污染物能全部进入大气中3.常温常压下,下列各组气体不能共存的是()A.SO2与O2B.NO2与NOC.O2与N2D.NO与O24.下列关于NO和NO2的叙述正确的是()A.NO是一种红棕色气体B.常温常压下,NO不能与空气中的氧气直接化合C.含等质量的氧元素的NO和CO的物质的量相等D.NO2可用排水法收集5.下列物质的转化必须加入氧化剂且通过一步反应就能完成的是()①N2→NO2②NO2→NO③NO2→HNO3④N2→NO⑤N2→NH3A.①B.②⑤C.④D.③④6. 某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。
若测得氮气和二氧化碳的物质的量之比为1∶2,则该氮的氧化物是()A. N2OB. NOC. NO2D. N2O57. 将a mL NO、b mL NO2和c mL O2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a∶b∶c不可能是()A. 1∶1∶1B. 2∶1∶1C. 3∶7∶4D. 1∶5∶28.一定条件下,将等体积的NO2和O2的混合气体置于试管并将该试管倒置于水槽中至液面不再上升时,剩余气体的体积约为原体积的() A.1/4 B.3/4C.1/8 D.3/89.氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾。

一、选择题1、把SO2通入NaOH溶液中,当SO2和NaOH完全反应时,其质量比为6∶5,则下列说法正确的是()A.反应后SO2有剩余B.溶液还可吸收SO2C.溶液中除OH-外,只存在一种阴离子D.溶液中溶质(正盐与酸式盐)的物质的量之比为1∶32、下列有关硫及其化合物说法不正确的是()A.大气中的硫可能以酸雨的形式进入土壤B.煤和石油中的硫燃烧生成三氧化硫进入大气C.化石燃料中的硫来自于形成化石燃料的生物体D.煤和石油燃烧产生的颗粒物可能是导致雾霾的成因之一3、可以鉴别稀硫酸和浓硫酸的简单方法是()A.加酚酞试液B.与铜片反应C.加BaCl2溶液和硝酸D.用玻璃棒各蘸一点滴在纸上4、下列与硫酸有关的化学方程式或离子方程式书写正确的是()A.FeO与足量浓硫酸反应:FeO+H2SO4====FeSO4+H2OB.氢氧化钡溶液和稀硫酸反应:2SO-+Ba2+====BaSO4↓4C.铜片在加热条件下与浓硫酸反应:Cu+2SO-+4H+Cu2++SO2↑+2H2O4D.小苏打溶液与稀硫酸反应:HCO-+H+====H2O+CO2↑35、除去粘在试管上的少量硫,可采用的方法是()A.用纯碱溶液清洗B.用盐酸洗涤C.用CS2溶解D.用热水煮沸6、如图,将A、B两瓶中的无色气体混合后,集气瓶中充满红棕色的气体,则对A、B瓶中气体成分判断正确的是()A.A是NO,B是空气B.A是NO2,B是水蒸气C.A是NH3,B是HCl D.A是NO,B是水蒸气7、意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。
已知N5是可用作烈性炸药的一种分子,下列关于N4、N5的说法正确的是() A.相同质量的N4、N5分子其原子数之比为5∶4B.N5、N4与N2互为同素异形体C.N4、N5均属于新型的化合物D.N5的摩尔质量为708、下列关于NO2和SO2的说法错误的是()A.NO2是一种红棕色、有毒、有刺激性气味的气体B.NO2和SO2溶于水后所得的溶液都呈酸性C.空气中的N2在闪电时,直接生成NO2D.SO2是一种无色、有刺激性气味的气体,能够漂白草帽等物质9、已知某氮的氧化物中氧元素的质量分数为0.696,则其化学式是() A.NO B.NO2C.N2O4D.N2O310、下列事实的解释正确的是()A.将SO2 、SO3混合气体通入氯化钡溶液中,出现浑浊是因为生成了BaSO4沉淀B.SO2通入溴水中,溴水褪色,是因为SO2的漂白性C.反应2C + SiO2Si +2CO ,是因为碳的非金属性强于硅的非金属性D.在NaHCO3的溶液中滴加NaAlO2溶液中有白色沉淀生成,是因为二者发生完全水解反应11、下列反应与Na2O2+SO2==Na2SO4相比较,Na2O2的作用相同的是()A.2Na2O2+2CO2==2Na2CO3+O2↑ B.2Na2O2+2SO3==2Na2SO4+O2↑C.Na2O2+H2SO4==Na2SO4+H2O2D.3Na2O2+Cr2O3==2Na2CrO4+Na2O 12、如果用排水法收集浓硝酸受热分解所产生的气体,则()A.收集到NO B.收集到NO2C.收集到O2D.收集不到任何气体二、非选择题13、A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系:据此判断:(1)在A、B、C这三种化合物中,必定含有乙元素的是.(用A、B、C字母填写)(2)单质乙必定是(填"金属"或"非金属"),其理由是.(3)单质乙的分子式可能是,则化合物B的分子式是14、中学教材高中化学第一册有如下图1所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图2所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。
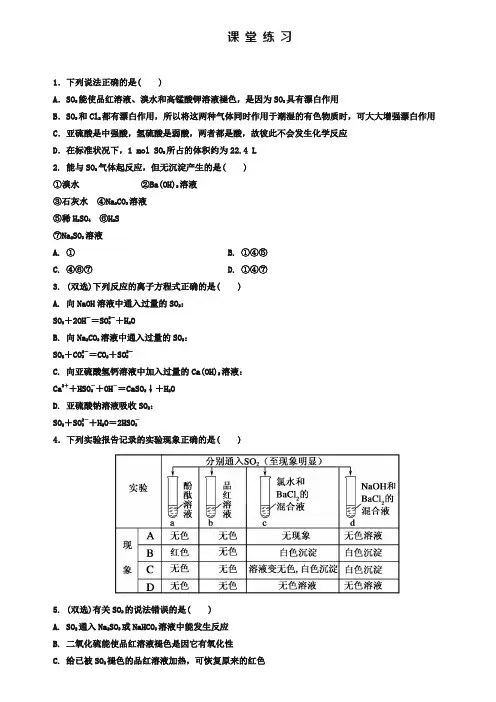
课堂练习1.下列说法正确的是( )A.SO2能使品红溶液、溴水和高锰酸钾溶液褪色,是因为SO2具有漂白作用B.SO2和Cl2都有漂白作用,所以将这两种气体同时作用于潮湿的有色物质时,可大大增强漂白作用C.亚硫酸是中强酸,氢硫酸是弱酸,两者都是酸,故彼此不会发生化学反应D.在标准状况下,1 mol SO2所占的体积约为22.4 L2. 能与SO2气体起反应,但无沉淀产生的是( )①溴水②Ba(OH)2溶液③石灰水④Na2CO3溶液⑤稀H2SO4⑥H2S⑦Na2SO3溶液A. ①B. ①④⑤C. ④⑥⑦D. ①④⑦3. (双选)下列反应的离子方程式正确的是( )A. 向NaOH溶液中通入过量的SO2:SO2+2OH-=SO2-3+H2OB. 向Na2CO3溶液中通入过量的SO2:SO2+CO2-3=CO2+SO2-3C. 向亚硫酸氢钙溶液中加入过量的Ca(OH)2溶液:Ca2++HSO-3+OH-=CaSO3↓+H2OD. 亚硫酸钠溶液吸收SO2:SO2+SO2-3+H2O=2HSO-34.下列实验报告记录的实验现象正确的是( )5. (双选)有关SO2的说法错误的是( )A. SO2通入Na2SO3或NaHCO3溶液中能发生反应B. 二氧化硫能使品红溶液褪色是因它有氧化性C. 给已被SO2褪色的品红溶液加热,可恢复原来的红色D. SO2和O2混合加热,可生成SO36. 能证明SO2具有漂白性的是( )A. 酸性KMnO4溶液中通入SO2气体后,紫色消失B. 显红色的酚酞通入SO2后,红色消失C. 品红溶液通入SO2后,红色消失D. 溴水中通入SO2后,橙色消失7. 下列物质均有漂白作用,但其中一种的漂白原理与其他三种不同,它是( )A. HClOB. SO2C. O3D. Na2O28. 向FeCl3和BaCl2的酸性混合溶液中,通入SO2气体,有白色沉淀生成,此沉淀是( )A. BaSO4B. FeSC. BaSO3D. S9.下列说法正确的是( )A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4溶液、石蕊试液褪色B.能使品红褪色的不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.盐酸能使滴有酚酞的NaOH溶液褪色,所以盐酸也有漂白性10.如下图所示是实验室制取SO2并验证SO2某些性质的装置图。

人教版高中化学必修二第五章第一节硫及其硫化物习题练习(附答案)四、单选题1.在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是 ()A.硫在空气中燃烧B.铜片与浓硫酸共热C.红热的木炭与浓硫酸反应D.亚硫酸钠与较大浓度硫酸反应2.根据硫元素的化合价判断下列物质中的硫元素不能表现氧化性的是()A. Na2S B. S C. SO2 D. H2SO43.下列反应中,调节反应物用量或浓度,不会改变反应产物的是()A.铁在硫蒸气中燃烧B. H2SO4与Cu反应C.二氧化硫通入澄清石灰水D.硫酸中加入锌粉4.下列现象或事实不能用同一原理解释的是()A. SO2和CO2都能使澄清石水变浑浊B.硫化钠和亚硫酸钠固体长期暴露在空气中变质C.常温下铁和铂都不溶于浓硫酸D. SO2和Na2SO3溶液都能使氯水褪色5.如下为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。
下列关于甲、乙、丙、丁的判断不正确的是()A.甲只具有还原性B.乙、丙均为酸性氧化物C.乙既有氧化性,又有还原性D.丁为黄色或淡黄色固体6.A~D是含同一元素的四种物质,相互之间有如图所示的转化关系,其中A是单质,D是最高价氧化物对应的水化物,A、B、C中所含同一元素的化合价不同。
那么A可能是()A. S B. Cl2 C. Fe D. Mg7.下列变化需要加入氧化剂才能实现的是()A. S2-→HS-B. Na2SO3→SO2C. SO2→S D. H2S→S8.在加热条件下:H2S S↓+H2,硫元素在此反应中表现出()A.酸性B.不稳定性 C.氧化性D.还原性9.已知硫代硫酸钠可作为脱氧剂,25.0 mL 0.100 mol·L-1的Na2S2O3溶液恰好把224 mL(标准状况下)Cl2转化为Cl-,则S2O将转化为()A. S2-B. S C. SO D. SO10.某同学从一瓶未知的无色溶液中检验出有Ba2+、Ag+,同时溶液的酸性较强,他还准备继续检验溶液中是否含有Cu2+、Cl-、CO、K+、SO、NO等离子。

第三节 硫和氮的氧化物一、选择题1.为除去混入CO 2中的SO 2和O 2,下列试剂的使用顺序正确的是 ( )①饱和Na 2CO 3溶液 ②饱和NaHCO 3溶液 ③浓硫酸 ④灼热的铜网 ⑤碱石灰A.①③④B.③④⑤C.②④③D.②③④2.CO 2气体中含少量SO 2,欲用如图所示装置得到干燥纯净的CO 2,则下列叙述正确的是( )A .先让混合气体通过盛有NaOH 溶液的洗气瓶(1),再通过盛有浓H 2SO 4的洗气瓶(2)B .先让混合气体通过盛有饱和NaHCO 3溶液的洗气瓶(1),再通过盛有浓H 2SO 4的洗气瓶(2)C .先让混合气体通过盛有浓H 2SO 4的洗气瓶(2),再通过盛有NaOH 溶液的洗气瓶(1)D .先让混合气体通过盛有饱和NaHCO 3溶液的洗气瓶(2),再通过盛有浓H 2SO 4的洗气瓶(1)3.下列关于N 2的说法错误的是( )A.通常情况下N 2性质很稳定,所以N 2可在电焊时作保护气B.反应N 2+O 2=====高温2NO 是汽车尾气造成污染的主要原因之一C.N 2的质量约占空气总质量的45D.在反应3Mg +N 2=====点燃Mg 3N 2中,N 2作氧化剂 4.下列有关二氧化硫说法中正确的是( )A.二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加B.二氧化硫能使品红褪色,加热后不恢复到红色C.二氧化硫使酸性高锰酸钾溶液褪色,体现了二氧化硫的漂白性D.二氧化硫属于碱性氧化物,可以用NaOH 溶液吸收5.将40 mL NO 2和NO 的混合气体通入倒立于水槽中盛满水的试管里,充分反应后试管中剩余20 mL 气体,则原混合气体中NO 2和NO 的体积比为( )A.2∶1B.1∶3C.3∶1D.1∶16.试管中装有12 mL NO ,然后间歇而又缓慢地通入8 mL O 2,下列是对最终状态的描述:①试管内气体呈红棕色 ②试管内气体呈无色 ③试管内液面不变 ④试管内液面上升 ⑤试管内气体是O 2 ⑥试管内气体是NO 其中正确的是( )A.①③B.②④⑤C.②④⑥D.②③⑤7.从绿色化学理念出发,下列做法不可取的是( )A.太阳能电池可采用硅材料制作,其应用有利环保,应大力推广B.发电厂燃煤经脱硫处理,人们购物时不用一次性塑料袋,都是对环保的贡献,应大力推广C.大型运动会的火炬,用丙烷作燃料,外形材料为铝合金和塑料,燃料环保,外形材料可回收D.磷是生物生长的营养元素,则含磷合成洗涤剂可以推广使用8.自然界的氮循环如图所示,下列说法不正确的是( )A.①中N 2与O 2反应生成NOB.②中合成氨属于人工固氮C.③中氮元素被氧化D.氧元素参与了氮循环9.对3NO 2+H 2O===2HNO 3+NO 反应的下列说法正确的是( )A .氧化剂与还原剂的质量比为1∶2B .氧化产物与还原产物的物质的量之比为1∶2C .NO 2是氧化剂,H 2O 是还原剂D .在反应中若有6 mol NO 2参与反应时,有3 mol 电子发生转移10.下列有关酸雨危害的说法不正确的是( )A.酸雨进入江湖,会导致鱼类难以生存,影响水生生物的繁殖B.酸雨进入土壤,易使一些营养元素流失,并使土壤逐渐酸化C.酸雨能使桥梁、雕塑等建筑物的腐蚀加快D.呈酸性的雨水就为酸雨11.已知标准状况下SO 3是一种无色固体,下列有关三氧化硫的说法中,正确的是( )A.三氧化硫极易溶于水,且与水反应生成H 2SO 4B.标准状况下,1 mol SO 3的体积约为22.4 LC.硫粉在过量的纯氧中燃烧可以生成SO 3D.SO 2、SO 3均具有漂白性,能使石蕊溶液褪色12.能证明SO 2具有漂白性的是( )A.酸性KMnO 4溶液中通入SO 2气体后紫红色消失B.滴有酚酞的NaOH 溶液中通入SO 2气体后红色消失C.品红溶液中通入SO 2气体后红色消失D.溴水中通入SO 2气体后橙色消失13.下列说法正确的是( )A.因为SO 2具有漂白性,所以它能使品红溶液、溴水、KMnO 4溶液、石蕊溶液褪色B.能使品红溶液褪色的不一定是SO 2C.SO 2、漂白粉、活性炭、Na 2O 2都能使红墨水褪色,其原理相同D.盐酸能使滴有酚酞的NaOH 溶液褪色,所以盐酸也有漂白性14.最新研究表明:NO 吸收治疗法可快速改善SARS 重症患者的缺氧状况,缓解病情。

word整理版学习参考资料第三节硫和氮的氧化物综合练习1 •下列现象的产生与人为排放大气污染物氮氧化物无关的是()A.闪电B.光化学烟雾C.酸雨D.臭氧层空洞2•除去混入NO中的少量NO:应将气体通过下列试剂中的()A. N比CO3(溶液)B. N A HCO3(溶液)C.HzOD.浓H:SO43.氮的某种氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。
若测得氮气和二氧化碳的物质的量之比为1 : 2,则这种氮的氧化物是()A・ N9 B・ NO C・ NO2D.N2O54・H5N1型禽流感病毒是造成禽流感的罪魁祸首之一,己知过氧乙酸是一种高效杀毒剂,可以有效杀死各种病毒,其分子式为:QHQ,它具有氧化性、漂白作用,下列物质中漂白作用原理与过氧乙酸不同的是()A.氯水B.臭氧C.二氧化硫D.过氧化氢5.将SO:和S03两种气体的混合物通入BaCl:溶液,其结果是()A.两种气体都被吸收,并有BaSO4沉淀生成B.只有BaSO4沉淀,SO?通入溶液中无沉淀生成C.生成BaSOs和BaSCu两种沉淀D.只生成BaSO4沉淀,S02从溶液中逸出6.实验室里为了吸收多余的二氧化硫气体,最好选择下列装置中的()word整理版学习参考资料7.对酸雨的pH描述中最准确的是()A.小于75・6〜7之间B.小于5.6C.在D.等于5.68.发射卫星的运载火箭,其推进剂引燃后发生剧烈反应, 产生大量高温气体从火箭尾部喷出。
引燃后产生的高温气体主要是CO"圧0、N:、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红烟。
产生红烟的原因是()A.高温下N二遇空气生成NOrB.NO遇空气生成NO:C.CO2与NO反应生成CO和NOzD.NO与H:O反应生成H2和NO;9.下列有关环境污染的说法正确的是()A•燃煤时加入适量石灰石,可减少废气中SO:的量B.臭氧的体积分数超过0・00005%的空气有利于人体健康C.pH在5.6~7之间的降水通常称为酸雨D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染10.已知氯水的漂白作用实际上是其中所含的次氯酸引起的。

硫及其重要化合物一、选择题1.下列关于硫及其化合物的说法中正确的是()A.自然界中不存在游离态的硫B.二氧化硫的排放会导致光化学烟雾C.二氧化硫能使滴有酚酞的氢氧化钠溶液退色,体现了其漂白性D.浓硫酸可用来干燥SO2、CO、Cl2等气体解析自然界中存在游离态的硫;排放二氧化硫会污染空气,形成酸雨,但不会导致光化学烟雾;二氧化硫能使滴有酚酞的氢氧化钠溶液退色,体现了酸性氧化物的性质;浓硫酸具有吸水性,可干燥SO2、CO、Cl2等气体。
答案 D2.下列说法正确的是()A.SO2和SO3都是酸性氧化物,二者的水溶液都是强酸B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化C.硫粉在适量的纯氧中燃烧可以生成大量的SO3D.富含硫黄的矿物在工业上可用于制造硫酸解析SO2溶于水生成的亚硫酸是弱酸,A错误;常温下铜片和浓硫酸不反应,加热条件下能反应,B错误;硫粉在过量的纯氧中燃烧生成大量的SO2,C错误。
答案 D3.将SO2气体通入下列溶液中,能生成白色沉淀且SO2过量时沉淀不溶解的是()①Ba(OH)2溶液②Ba(NO3)2溶液③BaCl2溶液④Ba(ClO)2溶液A.①②B.①③C.②④D.③④解析①向Ba(OH)2溶液中通入SO2,先产生BaSO3沉淀,继续通入过量的SO2,沉淀溶解,转化为Ba(HSO3)2,错误;②向Ba(NO3)2溶液中通入SO2,发生反应:2NO-3+3SO2+2H2O===2NO+3SO2-4+4H+、Ba2++SO2-4 ===BaSO4↓,正确;③BaCl2与SO2不发生反应,错误;④向Ba(ClO)2溶液中通入SO2,发生反应:ClO-+SO2+H2O===Cl-+SO2-4+2H+、Ba2++SO2-4===BaSO4↓,正确。
答案 C4.在探究SO2水溶液成分和性质的实验中,下列根据实验现象得出的结论正确的是()A.向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性B.向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO2-4C.将SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有还原性D.向KMnO4溶液中滴加SO2水溶液,溶液颜色退去,说明SO2水溶液具有漂白性解析A项,SO2溶于水生成H2SO3,H2SO3与NaHCO3反应生成CO2,酸性H2SO3>H2CO3,正确;B项,SO2溶于水显酸性,H+与NO-3结合成HNO3,HNO3会氧化SO2-3生成SO2-4,错误;C项,发生反应:SO2+2H2S===3S↓+2H2O,SO2作氧化剂,错误;D项,KMnO4具有强氧化性,可以氧化SO2生成SO2-4,SO2表现还原性,错误。

二氧化硫和三氧化硫1.下列有关三氧化硫的说法中正确的是( A )A.SO3极易溶于水,且与水反应生成H2SO4B.SO2、SO3均具有漂白性,均能使石蕊溶液变红色C.SO3可与碱反应,但不与碱性氧化物反应D.SO2在空气中易被氧化为SO3解析:SO3不具有漂白性,SO2不能漂白指示剂,两者均可使石蕊溶液变红色,B错误;SO3既可与碱反应,也可与碱性氧化物反应,故C错误;SO2不易被空气中的氧气氧化,只有在催化剂存在下加热才能被氧化为SO3,故D错误。
2.下列物质在一定条件下能够与硫黄发生反应,且硫作还原剂的是( A )A.O2B.FeC.H2D.Zn解析:硫是较活泼的非金属元素,能与许多金属、非金属发生反应。
硫与活泼非金属单质氧气反应时,表现出还原性;硫与金属单质、氢气等反应时,表现出氧化性;硫与变价金属反应时,一般生成低价金属的硫化物。
3.常温下单质硫主要以S8形式存在。
加热时,S8会转化为S6、S4、S2等。
当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。
下列说法中正确的是( B )A.S8转化为S6、S4、S2属于物理变化B.不论哪种硫分子,完全燃烧时都生成二氧化硫C.S2、S4、S6、S8都是硫元素形成的单质,为同种物质D.把硫单质在空气中加热到750 ℃即得S2解析:硫单质之间的转化为化学变化,A不正确;不论哪种硫分子,完全燃烧的产物都为二氧化硫,B正确;S2、S4、S6、S8都是硫元素形成的单质,但是,构成分子的原子数不同,不是同种物质,C不正确;硫单质在空气中加热会燃烧生成二氧化硫,不可能与S2相互转化,D不正确。
4.下列关于硫的叙述中不正确的是( C )A.在自然界中既有化合态的硫又有游离态的硫B.游离态的硫存在于火山喷口附近或地壳的岩层里C.实验室常用酒精除去附着在试管壁上的硫黄D.硫是黑火药的主要成分之一解析:硫在自然界中既能以化合态(主要为硫化物和硫酸盐)又能以游离态(火山喷口附近或地壳的岩层里)的形式存在。

学年高一化学必修一硫和氮的氧化物随堂练习
种元素,它们之间具有如下转化关系:甲乙丙.下列有关物质的推断不正确的是()
A.若甲为Cl2,则丁可能是铁
B.若甲为NH3,则丁可能是氧气
C.若甲为AlCl3溶液,则丁可能是氨水
D.若甲为NaOH,则丁可能是SO2
4.某燃煤发电厂的废气中有SO2,它是形成酸雨的罪魁之一.处理SO2一般用生石灰或类似物质来吸收.如图是处理该废气的装置示意图.下列说法不正确的是()
A.此过程中既有分解反应,也有化合反应
B.CaSO4既是氧化产物,又是还原产物
C.使用此废气处理装置可减少酸雨的形成
D.理论上整个过程每转移电子1mol,会对应生成1molCO2
5.如图是一种综合处理SO2废气的工艺流程.下列说法正确的是()
A.向B溶液中滴加KSCN溶液,溶液一定会变为血红色
B.此工艺优点之一是物质能循环使用
C.溶液酸性AC
D.溶液B转化为溶液C发生的变化的离子方程式为
4H++2Fe2++O2=2Fe3++2H2O
6.香烟烟雾中含有CO、CO2、SO2、H2O等气体.用a.无水硫酸铜b.澄清石灰水c.红热氧化铜d.生石灰e.品红溶液等可
将其一一检出,检出的正确顺序是()
A.混合气aeebdc
B.混合气cdeea
C.混合气aebadc
D.混合气beadc
小编为大家提供的高一化学必修一硫和氮的氧化物随堂练习,大家仔细阅读了吗?最后祝同学们学习进步。

一、选择题(本题包括5小题,每小题4分,共20分)1.下列说法中,不.正确的是()A.硫是一种淡黄色的不溶于水的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫易燃烧,其燃烧产物是大气污染物之一D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫解析:硫在空气中的燃烧产物是二氧化硫,在纯氧中燃烧产物也是SO2。
答案:D2.将SO2通入显红色的酚酞试液中,发现红色消失,主要原因是SO2()A.有漂白性B.有还原性C.有氧化性D.溶于水中显酸性解析:酚酞显红色说明溶液中存在着碱性的物质,而二氧化硫溶于水后显酸性,可将碱性物质中和,而使酚酞褪色。
答案:D3.下列有关三氧化硫的说法中,正确的是()A.三氧化硫极易溶于水,且与水反应生成H2SO4B.SO3不属于酸性氧化物C.硫粉在过量的氧气中燃烧生成SO3D.SO2、SO3均具有漂白性,能使石蕊试液褪色解析:因SO3+H2O===H2SO4,A正确。
SO3和SO2都属于酸性氯化物,B错误。
不管氧气量的多少,硫在氧气中燃烧的产物都是SO2,C错。
SO2具有漂白性,但SO3不具有漂白性,且SO2不能使石蕊试液褪色。
答案:A4.下列物质能使品红溶液褪色,且褪色原理基本相同的是()①活性炭②新制氯水③二氧化硫④臭氧⑤过氧化钠⑥双氧水A.①②④B.②③⑤C.②④⑤⑥D.③④⑥解析:新制氯水、臭氧、过氧化钠、双氧水都有强氧化性,都可以使品红褪色。
答案:C5.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是()A.饱和食盐水B.NaOH溶液C.足量澄清石灰水D.饱和碳酸氢钠溶液解析:CO2和SO2都能与NaOH溶液和石灰水反应,都不与饱和食盐水反应,因为H2SO3的酸性强于H2CO3。
故可用饱和NaHCO3溶液除去CO2中的SO2气体。
答案:D二、非选择题(本题包括3小题,共30分)6.(8分)某无色气体A中可能含有H2S、SO2、CO2、HCl气体中的一种或几种(1)将此气体通入氯水后溶液变得无色透明。

高中化学学习材料(精心收集**整理制作)硫和氮的氧化物 练习题一.选择题1.下列污染现象主要与SO 2有关的是A .臭氧空洞B .酸雨C .光化学烟雾D .温室效应2.下列名词与氮元素无关的是A .光化学烟雾B .水体富营养化C .酸雨D .地方性甲状腺肿3.能实现下列物质间直接转化的元素是单质――→+O 2氧化物――→+H 2O 酸或碱――――――→+NaOH 或HCl 盐A .硅B .硫C .铜D .铁4.下列物质不属于“城市空气质量日报”报道内容的是A .二氧化硫B .氮氧化物C .二氧化碳D .悬浮颗粒5.实验室中制取的下列气体中,可以用排空气法收集的是A .N 2B .SO 2C .COD .NO6.在NO 2被水吸收的反应中,发生还原反应和氧化反应物质的质量比为A .3∶1 B.1∶3 C .1∶2 D.2∶17.在常温常压下,下列各组气体不能共存的是A .SO 2与O 2B .NO 2与NOC .O 2与N 2D .NO 与O 28.下列物质能使品红溶液褪色的是①活性炭 ②过氧化钠 ③氯水 ④二氧化硫A .①③④B .②③④C .①②③④D .①④9.为了除去混入CO 2中的SO 2,最好将混合气体通入下列哪种溶液中A .饱和烧碱溶液B .饱和小苏打溶液C .饱和纯碱溶液D .浓硫酸10.将盛有N 2和NO 2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为原来的一半,则原混合气体中N 2和NO 2的体积比是A .1∶1B .1∶2C .1∶3D .3∶111.能鉴别SO 2和CO 2的试剂是 ( )A 、品红溶液B 、澄清石灰水C 、紫色石蕊试液D 、氯化钙溶液二.填空题12.A 、B 、C 三种气体都是大气的主要污染物,A 是一种单质,其水溶液具有杀菌消毒作用,B 是形成酸雨的主要污染物,C 是硝酸工业和汽车尾气中的有害物质之一,能与水反应。
请写出下列变化的化学方程式:(1)A 用于工业上制取漂白粉:____________________________________________.(2)B 的水溶液露置在空气中酸性增强:______________________,B 一定条件下与氧气反应: 。
高中化学必修一硫、二氧化硫的性质练习题一、单选题1.从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法中,不正确的是( )A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌B.在含I -的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应C.在碘水中加入几滴淀粉溶液,溶液变蓝色D.在碘水中加入CCl 4得到I 2的CCl 4溶液,该操作为“萃取”2.0.05 mol 某单质与0.8 g 硫在一定条件下完全反应,该单质可能是( ) ①2H ②2O ③K ④Zn ⑤F e ⑥C u A. ①②B. ③④C. ③⑤D. ③⑥3.下列说法不正确的是( ) A.硫是一种黄色的难溶于水的晶体B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.硫易燃烧,其燃烧产物是大气污染物之一D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 4.已知2--2S +Cl =2Cl +S ,下列说法正确的是( ) A.2Cl 是氧化剂 B.氧化性:2S >ClC.还原性:2--S <ClD.该离子方程式可以表示硫化氢溶液与氯气的反应5.下列各组物质反应时,硫表现还原性的是( ) A.硫与氧气B.硫与氢气C.硫与钠D.硫与铜6.下列有关物质的性质与用途对应关系正确的是( ) A.明矾易溶于水,可用作净水剂 B.HClO 显酸性,可用于杀菌消毒C.SO 2具有氧化性,可用于纸浆漂白D.铁粉具有还原性,可用作食品抗氧化剂7.下列情况会对人体健康造成较大危害的是( ) A.用SO 2漂白木耳制成银耳B.用漂白粉[Ca(ClO)2]稀溶液对餐具进行杀菌消毒C.用食醋清洗热水瓶胆内壁附着的水垢(CaCO 3)D.用小苏打(NaHCO 3)发酵面团制作馒头 8.有关2SO 的性质,下列说法不正确的是( )A.能使品红溶液褪色B.能与NaOH 溶液反应C.能与2H O 反应生成24H SOD.—定条件下能与2O 反应生成3SO9.下列说法中,正确的是( )A.硫在空气中燃烧生成二氧化硫,在氧气中燃烧生成三氧化硫B.在自然界里,硫的化合物常存在于火山喷口附近或地壳的岩层里C.二氧化硫具有还原性,可用于漂白纸被和草帽辫D.燃烧时,加入适量石灰石,可减少废气二氧化硫的量 10.下列实验报告记录的实验现象正确的是( )A.AB.BC.CD.D11.检验2SO 气体中是否混有2CO 气体,可采用的方法是( ) A.通过品红溶液 B.通过澄清石灰水C.先通过3NaHCO 溶液,再通过澄清石灰水D.先通过足量酸性4KMnO 溶液,再通过澄清石灰水 12.下列说法正确的是( )A.因为SO 2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO 4溶液、石蕊溶液褪色B.能使品红溶液褪色的不一定是SO 2C.SO 2、漂白粉、活性炭、Na 2O 2都能使红墨水褪色,其原理相同D.盐酸能使滴有酚酞的NaOH 溶液褪色,所以盐酸也有漂白性 13.SO 2和Cl 2均可用于漂白工业,对于二者的说法正确的是( ) A.利用SO 2的漂白性可使酸性高锰酸钾溶液褪色 B.漂白粉是一种混合物,其有效成分是Ca(ClO)2C.为便于储存和使用,可用液氯代替氯水漂白干燥棉布上的有色物质D.为增强漂白效果,可将等物质的量的SO 2和Cl 2混合使用以达到增强效果的目的 14.如图所示的实验中,通入足量的SO 2后,试管①和②中溶液的颜色分别是( )A.①为红色,②为红色B.①为蓝色,②为无色C.①为无色,②为蓝色D.①为红色,②为无色 15.某兴趣小组探究SO 2气体还原Fe 3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )A.能表明I -的还原性弱于SO 2的现象是B 中蓝色溶液褪色B. 装置C 的作用是吸收SO 2尾气,防止污染空气C. 为了验证A 中发生了氧化还原反应,加入KMnO 4溶液,紫红色褪去D. 为了验证A 中发生了氧化还原反应,加入用盐酸酸化的BaCl 2溶液,产生白色沉淀 16.下列现象或事实不能用同一原理解释的是( ) A.SO 2既能使氯水褪色,又能使酸性KMnO 4溶液褪色 B.Cl 2、SO 2分别通入品红溶液中,品红均褪色 C.食盐水和氯水中滴加AgNO 3溶液均产生沉淀 D.稀盐酸和氯水中加入小块CaCO 3均产生气泡 17.下列现象或事实可用同一原理解释的是( ) A .浓硫酸和浓盐酸长期暴露在空气中浓度降低 B .2SO 能使溴水和品红溶液褪色C .2SO 和4FeSO 溶液使酸性高锰酸钾溶液的紫色褪去D .新制的氨水、氯水放置时间较久而变质18.某同学设计的微型实验装置验证SO 2的性质,通过分析实验,下列结论表达正确的是( )A.a 棉球褪色,验证SO 2具有氧化性B.b 棉球褪色,验证SO 2具有酸性氧化物的通性C.c棉球蓝色褪去,验证SO2漂白性D.可以使用浓硫酸吸收尾气19.既能使石蕊试液变红,又能使品红试液变为无色的物质是()A.NH3B.HCl C.SO2D.CO2二、实验题20.下图是实验室制取SO2并验证SO2某些性质的装置图。
第一节硫及其化合物课时3 不同价态含硫物质的转化【基础巩固】1.根据硫元素的化合价判断下列物质中的硫元素不能表现氧化性的是 ( )222SO4答案:A2.如图是硫在自然界的循环,下列说法中不正确的是 ( )答案:B3.下列反应中能产生二氧化硫的是 ( )解析:氧化铜与稀硫酸反应生成硫酸铜和水,A项错误;亚硫酸钠与氧气反应生成硫酸钠,B项错误;三氧化硫与水反应生成硫酸,C项错误;铜与热的浓硫酸反应生成硫酸铜、二氧化硫和水,D项正确。
答案:D4.为了降低硫的氧化物造成的空气污染,一种方法是在含硫燃料(如煤)中加入生石灰,这种方法称为“钙基固硫”。
采用这种方法在燃烧过程中的“固硫”反应为 ( )①2CaO+2S2CaS+O2↑②S+O2SO2③CaO+SO2CaSO3④2CaSO3+O22CaSO4A.①②B.②③C.①④D.③④解析:含硫燃料中加入生石灰(CaO),与燃烧时产生的SO2发生反应SO2+CaO CaSO3,2CaSO3+O22CaSO4。
答案:D5.(2022·广东广州)某小组同学设计如下实验实现几种价态硫元素间的转化。
任务Ⅰ.从以下试剂中选择合适的试剂实现S(+6)→S(+4)的转化。
试剂:①浓硫酸②稀硫酸③酸性KMnO4溶液④Na2SO3溶液⑤Cu ⑥品红溶液(1)写出实现转化的化学方程式: 。
(2)设计实验,证明实现了该转化(写出操作和现象):。
任务Ⅱ.实现硫元素在0、+2、+4价之间的转化。
查阅资料:+2价硫元素在酸性条件下不稳定,自身易发生氧化还原反应。
(3)①中加入的物质是,该转化利用的是SO2的性质。
(4)写出③中反应的离子方程式: 。
解析:(1)由题意知,实现该转化的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。
(2)要证明实现了该转化,只需要证明产生了SO2,结合SO2的漂白性,可将反应后产生的气体通入品红溶液中,若溶液褪色,说明实现了该转化。
2014年高中化学硫及其氧化物基础巩固练习新人
教版必修1
【巩固练习】
一.选择题(每小题只有1个选项符合题意)
1.下列关于环境问题的说法正确的是()
A.燃煤时加入适量石灰石,可减少废气中的SO2
B.臭氧的体积分数超过10-5%的空气有利于人体的健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水污染
2.下列说法不正确的是()。
A.硫是一种黄色的不能溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中
C.硫在空气中燃烧的产物是二氧化硫
D.硫在纯氧中燃烧的产物是三氧化硫
3.下列反应中,SO2表现氧化性的是()。
A.2SO2+O2催化剂
加热
2SO3 B.SO2+H2O H2SO3
C.2H2S+SO2==3S↓+2H2O D.SO2+2H2O+Cl2==H2SO4+2HCl
4.检验SO2中是否混有CO2气体,可采用的方法是()。
A.通过品红溶液 B.先通过NaOH溶液,再通入澄清石灰水
C.通过澄清石灰水 D.先通过KMnO4酸性溶液,再通过澄清石灰水5.下列实验最终能看到白色沉淀的是()。
A.CO2和SO2气体通入CaCl2溶液
B.过量CO2通入澄清的石灰水
C.过量CO2通入Ba(OH)2溶液
D.过量SO3通入Ba(OH)2溶液
6.下列关于Cl2和SO2性质的叙述正确的是()。
A.相同条件下,Cl2比SO2更易溶于水
B.在一定条件下,SO2比Cl2更易液化
C.常温下,等体积的Cl2和SO2混合气体通入BaCl2溶液时,无明显现象
D.等体积的Cl2和SO2分别通入含石蕊的水中,溶液的紫色立即褪去
7.SO2和Cl2都是有漂白作用的物质,若将等物质的量的这两种气体混合,同时作用潮湿的红布条,可观察到的现象是()
A、慢慢褪色
B、立即褪色
C、先褪色后复色
D、不褪色
8.SO2既有氧化性,又有还原性,主要表现为还原性。
下列反应中,SO2表现为氧化性的反应是()
A、SO2+2H2S=3S↓+2H2O
B、SO2+NO2SO3+NO
C、SO2+2KOH=K2SO3+H2O
D、SO2+2H2O+Cl2=H2SO4+2HCl
9.下列说法正确的是
A.二氧化硫通入石蕊试液中,溶液先变红,后褪色
B.少量二氧化硫通入漂白粉溶液中的化学方程式:SO2+H2O+Ca(ClO)2==CaSO3↓+2HClO C.亚硫酸钠溶液使溴水褪色的离子方程式:SO32—+H2O+Br2==SO42—+2H++2Br—
D.亚硫酸钠溶液中加入硝酸的离子方程式:SO32—+2H+== SO2↑+H2O
10.检验未知溶液中是否含有SO42-,下列操作中最合理的是()A.加入硝酸酸化的硝酸钡溶液 B.先加硝酸酸化,再加入硝酸钡溶液
C.加盐酸酸化了的BaCl2溶液 D.先加盐酸酸化,再加入BaCl2溶液
11.为了除去CO2气体中的SO2气体,下列对于仪器和药品的组合中合理的是()。
仪器:①洗气瓶②干燥管
药品:③生石灰④苏打溶液⑤小苏打溶液
A.①⑤ B.②⑤ C.①③ D.①④
12.向BaCl2溶液中通入SO2至饱和,此过程看不到明显变化。
再向溶液中加入一种
物质,溶液变混浊。
加入的这种物质不.可能
..是()
A.FeCl3溶液 B.AlCl3溶液 C.Na2S溶液 D.AgNO3溶液。