2NaAlO2+3H2↑,
基础自知主识梳理 典例解析方法 考点能力突破
铝与强碱溶液反应的实质是什么? 提示:铝与强碱反应的实质:铝和碱溶液反应,不是直接和碱反应,而是 铝先和强碱溶液中的水反应生成 Al(OH)3,然后 Al(OH)3 再和强碱反应生成 偏铝酸盐。2Al+6H2O 2Al(OH)3+3H2↑,Al(OH)3+NaOH NaAlO2+2H2O,因此在 2Al+2H2O+2NaOH 2NaAlO2+3H2↑中,氧化剂是 H2O,而不是 NaOH 和 H2O。电子转移的方向和数目表示如下:
不足;Al
与 NaOH 溶液反应时,铝不足而 NaOH 溶液过量。
基础知识梳理 典考例:Al
+3 +1
Al,2 H
H2,故与酸或
碱反应时,铝与氢气的关系均为 2Al~3H2↑,利用此性质可以很方便地进行
有关计算。
基础知识梳理 典考例点解研析析方突法破 考点能力突破
第二节 铝及其重要化合物
最新考试说明要求 1 . 了解金属铝的主要性质及 应用 2 . 掌握铝的重要化合物的主 要性质及应用
命题热点预测
1.“铝三角”即铝及其化合物之间的转化关系及 相关的计算或实验 2 . 离子方程式的书写、离子共存的判断
基础自知主识梳理 典例解析方法 考点能力突破
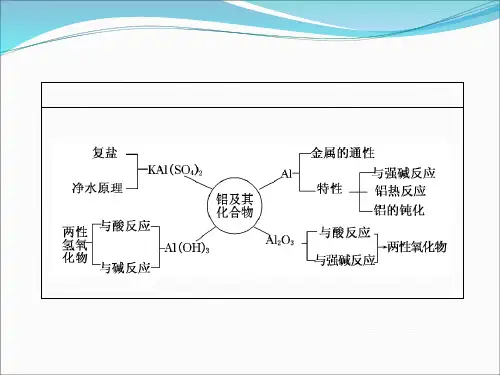
一、铝的存在与性质
。
基础自知主识梳理 典例解析方法 考点能力突破
二、铝的重要化合物
1.氧化铝(Al2O3) (1)氧化铝的物理性质:白色固体,熔点高、难溶于水。 (2)氧化铝的化学性质——两性氧化物。
2.氢氧化铝[Al(OH)3] (1)氢氧化铝的制备 在 Al2(SO4)3 溶液中滴加氨水时有白色胶状沉淀生成,反应的方程式为 Al2(SO4)3+6NH3·H2O 2Al(OH)3↓+3(NH4)2SO4。