有机化学
- 格式:doc
- 大小:1.40 MB
- 文档页数:9

第2章 烷烃1.解:(1)2,3,5,5-四甲基庚烷;(3)2,6-二甲基-4-乙基庚烷;(5)3-甲基-4-乙基庚烷2.解:(1)CH 3CCH 3 ; (3) CH 3CH 2CH 2CHCH 2CH 2CH 3; (5) CH 3CCH 2CHCH 3CH 3CH 3C(CH 3)3CH 3CH 3CH 33.解:最稳定构象 最不稳定构象 5.解:(2)(b)>(d)>(e)>(a)>(c)6.解:按稳定性由大到小排列有:(3)>(2)> (1)。
第3章 烯烃和二烯烃1.解:(2) (E)-2-溴-2-戊烯; (4) 4-甲基-3-乙基-1-戊烯;(6) (Z)-3,6,6-三甲基-4-异丙基-3-庚烯 2.解:(1) CH 3C=CH 2;(4) C=CCH 3CH 3CH 3CH 2HCH 2CH 2CH 34.解:(1) CH 3CCH 3;CH 3CHCH 2Br; (2) CH 2CH 2CHCH 2Cl; (3) CH 3CH 2CH 2CH 2OH; (4) CCl 3CH 2CH 2I (反马氏规则产物)CH 3Br CH 3OH(5) CH 3CH 2COOH; (6)CH 3CHCH=CH 2; CH 3CH CH CH 2Cl Cl Cl Cl5.解:(1) ; (2) H 2/Lindlar 催化剂;H 2/Ni; (3)BrBr(4)由于中间体,有4种形式:CH 3CCH=CH 2 CH 2=CCHCH 3 CH 3C=CHCH 2 CH 2C=CHCH 3CH 3CH 3++CH 3+CH 3+(A) (B) (C) (D)其中(A )最稳定。
故主要产物为:CH 3CCH=CH 2CH 3Br(5)由于中间体,有2种形式:CH 3CH=CHCHCH 2CH 3 CH 2CHCH=CHCH 2CH 3++稳定性,不好评价。
故此有2种产物。
BrCH 3CH=CHCHCH 2CH 3 CH 2CHCH=CHCH 2CH 3Br (A) (B)C C ==O OO (6)(7)COOCH 3COOCH 3CH 3CH 3(8) ;COCH 3BrBrCOCH 36.解:(3) >(2) >(5)>(4)>(1)9.解:(1)丙烯醛大于丙烯。

有机化学考试试卷(附答案)单选题(多选不给分,每小题2分,共24分)答案:1~6:CABCCD 7~12:DBACDD1、下列物质既能发生碘仿反应双能与饱和亚硫酸氢钠溶液作用产生沉淀的是:A、C6H5COCH3B、CH3CH2OHC、CH3CHOD、C2H5COC2H52、下列物质的烯醇式含量最高的是:A、C6H5COCH2COC6H5B、C、CH3COCH3D、3、化合物a、二乙胺,b、苯胺,c、NH3,d、乙酰苯胺,它们碱性的由强至弱顺序为:A、abcdB、acbdC、bacdD、cbda4、吲哚的结构式是A、NH B、N C、NH D、N5、化合物COOHCHOCH3O的系统命名正确的是:A、2-羧基-4-甲氧基苯甲醛B、4-羧基-3-甲酰基苯甲醚C、2-甲酰基-5-甲氧基苯甲酸D、3-甲氧基-6-甲酰基苯甲酸6、可用作重金属解毒剂的是A、乙硫醇B、二氯亚砜C、乙醚D、二巯基丙醇7、下列物质能发生缩二脲反应的是:A、尿素B、N-甲基甲酰胺C、异丙胺D、谷-胱-甘肽8、下列物质醇解速度最快的是:A、OOCCH3B、COBrC、COOCH3D、CONHCH39、下列物质能被Tollens试剂氧化且有变旋光现象的是:A、B、3CH3COCH2COCH3CH3COCH2CO2C2H5C 、D 、6H 510、下列物质中酸性最强的是: A 、苯甲酸 B 、对甲基苯甲酸 C 、对硝基苯甲酸 D 、对氯苯甲酸 11、能鉴别苯胺和N-甲基苯胺的试剂是: A 、Tollens 试剂 B 、Fehling 试剂 C 、Br 2/H 2O D 、兴斯堡试剂 12、在硫酸作用下,a CH 3CH 2CH 2OH 、b C 6H 5CH(OH)CH 3、c OH三种物质脱水活性由强至弱的排列顺序是:A 、abcB 、bacC 、cabD 、bca完成下列反应式(只写主要产物,注意立体构型,每小题2分,共24分)1、COOHOH+ NaHCO 3COONa OH2、CH H 3COOCCHCHO4HOCH 2CH CHCH 2OH3、OCHO+ HCHO40% NaOHOCH 2OH+ HCOONa4、CH 3CH OH C(CH 3)2OHHIO 4CH 3CHO + CH 3COCH 3 5、CH 3CCH 2CH 2COOC 2H 5O25(2)H 3O O O6、H 3C 23CH 3O-3H H 3C 25337、NH 3CH 2SO 4 + HNO 3NH 3CNO 28、CH 3N(CH 3)3+OH -9、O COOHCOOHHOOCOOOO10、OHCH3COCl3OOCCH3HO COCH311、O32OHCH312、OO2CH2(CH2)2CONH2OHCH2(CH2)2NH2OH。

有机化学考试题(附参考答案)一、单选题(共100题,每题1分,共100分)1.下列化合物中,能形成分子间氢键的是( )A、丙烷B、甲醇C、甲醚D、苯乙烯正确答案:B2.鉴别吡咯、呋喃可用的试剂为( )A、硫酸B、硫酸松木片C、盐酸D、盐酸松木片正确答案:D3.有机物种类繁多的重要原因之一是( )。
A、同分异构体B、碳是 4 价C、都是碳元素D、同素异形体正确答案:A4.下列说法正确的是( )。
A、所有的有机化合物都难溶于或不溶于水B、所有的有机化合物都容易燃烧C、所有的有机化学反应速率都十分缓慢D、所有的有机化合物都含有碳元素正确答案:D5.下列物质属于不饱和脂肪酸的是( )A、丙烯酸B、乙酸C、苯甲酸D、对苯二甲酸正确答案:A6.能生成金属炔化物的是( )A、乙烷B、乙烯C、乙炔D、.2-丁炔正确答案:C7.下列物质中不能发生水解反应的是( )A、苯酚钠B、油脂C、麦芽糖D、葡萄糖正确答案:D8.人体内酶不能消化的糖是:( )A、蔗糖B、糖元C、纤维素D、淀粉正确答案:C9.乙醇发生分子间脱水的条件是 ( )A、浓硫酸140℃B、浓硫酸170℃C、浓硝酸140℃D、浓硝酸170℃正确答案:A10.蔗糖水解的产物是: ( )A、果糖B、葡萄糖和果糖C、葡萄糖D、葡萄糖和半乳糖正确答案:B11.能将甲醛、乙醛和苯甲醛区分开来试剂是( )A、Schiff 试剂B、Fehling 试剂C、Tollens 试剂D、羰基试剂正确答案:B12.(±)-乳酸为( )A、内消旋体B、外消旋体C、对映异构体D、顺反异构体正确答案:B13.二甲胺的官能团是( )A、甲基B、次氨基C、氨基D、亚氨基正确答案:D14.乙酰基的结构简式是( )A、-CH3B、CH3-CO-C、-COOHD、CH3-O-正确答案:B15.下列物质中,不是烃类的是( )。
A、CH3-CH3B、CH2=CH2C、CH≡CHD、CHCl3正确答案:D16.食醋的主要成分是( )A、乙二酸B、乙酸C、碳酸D、甲酸正确答案:B17.“来苏儿”常用于医疗器械和环境消毒,其主要成分是( )A、肥皂B、甲酚C、苯酚D、甘油正确答案:B18.下列物质中, 属于合成高分子化合物的是( )A、聚乙烯B、纤维素C、淀粉D、蛋白质正确答案:A19.临床上化学方法检验糖尿病患者尿糖的常用试剂是 ( )A、托伦试剂B、希夫试剂C、溴水D、班氏试剂正确答案:D20.下列各组糖能生成相同糖脎的是( )A、葡萄糖和半乳糖B、核糖和脱氧核糖C、葡萄糖和果糖D、麦芽糖和乳糖正确答案:C21.既能发生酯化反应,又能与碳酸氢钠反应的有机物是( )A、乙酸B、乙醛C、甲醇D、苯酚正确答案:A22.醛的官能团是( )A、-CO-B、-CHOC、-OHD、-COOH正确答案:B23.下列化合物中,沸点最高的是 ( )A、乙醛B、乙醚C、乙醇D、乙烷正确答案:C24.下列各组物质中,不能发生反应的是( )A、乙酸与金属钠B、乙酸与乙醇C、乙酸和氢氧化钠D、乙酸和高锰酸钾溶液正确答案:D25.下列物质酸性最弱的是( )A、碳酸B、苯酚C、丁酸D、草酸正确答案:B26.下列糖遇碘显蓝紫色的是( )A、纤维素B、淀粉C、葡萄糖D、糖原正确答案:D27.下列物质中, 属于开链烷烃的是 ( )。

有机化学基础反应方程式汇总 1.甲烷(烷烃通式:C n H 2n +2) 甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 点燃2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+ClCH 3CH 2Cl 2CHCl 3(32.乙烯((1(2(3CH 3CH CH 3CH n CH 2=3.乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br =CHBr CHBr =CHBr+Br 2—CHBr 2与氢气加成:HC ≡CH+H 2催化剂H 2C =CH2图3乙炔的制取与氯化氢加成:HC≡CH+HCl催化剂CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH2=CHCl催化剂[CH2—]n乙炔加聚,得到聚乙炔:n HC≡CH催化剂[CH=CH]n4.1,3-丁二烯与溴完全加成:CH2=CH-CH=CH2+2Br2Br-CHBr-CHBr-CH2Br与溴1,2-加成:CH2=CH-CH=CH2+Br2Br-CHBr-CH=CH2与溴5.苯(1(2(制溴苯)+HO—苯硝化反应生成硝基苯,它是一种带有苦杏仁味、无色油状液体,有毒。
+HO—(3)加成反应(环己烷)6.甲苯(1(2)取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、开矿等。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。
CH3CH3BrCH3Br+Br2Fe(或 )+HBr(本反应用纯溴,催化剂时苯环上取代)CH3|+3HNO 浓硫酸O2N—CH3|—NO2|NO2+3H2O3。

有机化学反应方程式汇总1. 甲烷与氯气CH 4+Cl 2CH 3Cl+HCl CH 3Cl+Cl 2CH 2Cl 2+HClCH 2Cl 2+Cl 2CHCl 3+HCl CHCl 3+Cl 2CCl 4+HCl (分步取代)2. 甲烷的燃烧3. 烷烃的燃烧通式4. 甲烷的热分解 CH 4−−→−高温C+2H 25. 烷烃的热分解6. 乙烯实验室制法 CH 3CH 2OH H 2O + CH 2=CH 2 ↑(浓硫酸:催化剂,脱水剂)7. 乙烯的燃烧8. 乙烯通入溴水中9. 乙烯和氢气加成10. 乙烯和HCl 的反应 11. 乙烯水化制乙醇 12. 乙烯催化氧化制备乙醛13. 乙烯的加聚反应 14. 制取聚丙烯 CH 4 + 2O CO 2 + 2H 2O燃烧C n H 2n+2 + O n CO 2 + (n + 1)H 2O 3n+1 2燃烧△C 4H C 2H 4+C 2H 6△C 4H CH 4 + C 3H 6CH 2=CH 2 + 3O 2 2CO 2 + 2H 2O点燃2CH 2=CH 2 + O 2CH 3CHO催化剂加热加压CH 3CH=CH 2 + H CH 3CH 2CH 3催化剂CH 2=CH 2 + Br 2 CH 2BrCH 2BrCH 2=CH 2 + HCl CH3CH 2Cl 催化剂CH 2=CH 2 + H 2O CH 3CH 2OH催化剂―CH 2―CH 2―nn CH 2=CH 2催化剂―CH 2――nn CH 2=CH ―CH 催化剂15. 1,3-丁二烯的加成反应 1,2加成1,4加成完全加成16. 1,3-丁二烯的加成反应 17. 乙炔的制取 CaC 2+2H 2O →C 2H 2↑+Ca(OH)218. 乙炔的燃烧19. 乙炔通入溴水中20. 乙炔与氢气的加成反应21. 乙炔水化制备乙醛22. 聚氯乙烯的制备23. 苯的燃烧 24. 苯与液溴反应(FeBr 3作催化剂)25. 苯的硝化反应Cl+ Cl 2催化剂+ Cl 2催化剂Cl+ 2Cl 2催化剂Cl ClCl―CH 2―C=CH ―CH 2―nn CH 2=C ―CH=CH 2催化剂CH 3CH 32 C 2H 2 + 5 O 4 CO 2 + 2 H 2O (l) + 2600 kJ点燃1, 2 - 二溴乙烷HC CH +Br BrC C Br Br H H 1, 1 , 2 , 2 - 四溴乙烷+Br BrC C Br BrH H C C Br Br H Br Br H 催化剂HC CH+H 2H 2C CH 2CH ≡CH + HCl CH 2=CHCl 催化剂氯乙烯CH ≡CH + H 2O乙醛3C C OH 催化剂聚氯乙烯H 2C CHCln -CH 2-CH --Cln 点燃+ 15 O 12 CO 2 + 6 H 2O2+ Br 溴苯NO 226. 苯的磺化反应27. 苯与氢气加成生成环己烷28. 苯与氯气的加成反应29. 苯的同系物被高锰酸钾酸性溶液氧化30.甲苯和氯气的取代反应31. 甲苯的硝化反应32. 甲苯和氢气的加成反应33. 溴乙烷水解 CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr34. 溴乙烷消去反应 CH 3CH 2Br +NaOH CH 2=CH 2↑ + NaBr + H 2O35. 乙醇与钠反应 2CH 3CH 2OH + 2Na 2CH 3CH 2ONa + H 2↑36. 乙醇催化氧化 2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O37. 乙醇的燃烧 CH 3CH 2OH +3O 2→2CO 2 + 3H 2OH 2O,△ Cu △醇 △HO SO 3+△+ H 2O3H 苯磺酸催化剂2△ClCl Cl ClClCl + 3 Cl 2光照C H KMnO 4 (H +)CH 3HO NO 2+ 3浓硫酸+ 3 H 2OCH 3NO 2NO 2O 2N2,4,6-三硝基甲苯 (TNT)+ 3 H CH 3CH 3CH 3CH 3Cl+ Cl + HClFeCH 3ClCH 3+ Cl + HClFe38. 乙醇与浓氢溴酸的反应 CH 3CH 2OH +HBr →CH 3CH 2Br + H 2O39. 乙醇脱水(分子内、分子间) CH 3CH 2OH CH 2=CH 2 ↑+H 2O (消去反应)2CH 3CH 2OH CH 3CH 2—O —CH 2CH 3+ H 2O (取代反应)40. 苯酚的电离方程式 41. 苯酚与NaOH 溶液反应42. 苯酚与金属钠反应 43. 苯酚和碳酸钠溶液反应44. 苯酚钠和盐酸反应 45. 苯酚钠溶液中通入CO 2气体46. 苯酚和浓溴水反应(苯酚的定性检验和定量测定方法)47. 苯酚的硝化反应48. 苯酚与FeCl 3溶液49. 苯酚的加成反应浓H 2SO 4 140℃OH电离O -+ H+OH + NaOHONa + H 2OOH 2 + 2Na ONa 2 + H OH + Na 2CO ONa + NaHCO 3+ HCl OH + NaClONa + CO 2 + H 2OH + NaHCO 3ONa OH+ 3 HNO + 3 H 2OOHNO 2O 2NNO 2浓硫酸苦味酸OHFeCl 3溶液紫色,易溶于水的物质OHOH+ 3 H 2Ni环己醇OH+ 3 Br OHBr BrBr+ 3 HBr50. 苯酚的缩聚反应n + n + n H 2O2OHH C OH n51.苯酚的酯化反应52. 乙醛的加成反应(还原反应) 53. 乙醛的氧化反应—燃烧反应54. 乙醛的催化氧化反应 55. 乙醛与银氨溶液的反应 ③ CH 3CHO + 2 [Ag(NH 3)2]+3COO - + NH 4+3 + H 2O56. 乙醛与Cu(OH)2悬浊液反应57. 乙醛的制备方法乙醇氧化法乙烯氧化法乙炔水化法58. 醛的加成反应(还原反应)59. 醛的催化氧化反应OH+ CH 3COOH + H 2OOOCCH3乙酸酐CH 3CHO + H 23CH 2OH 2CH 3CHO + 5O 4CO 2 + 4H 2O点燃2 CH 3CHO + O 3COOH① Ag + + NH 3·H 2O AgOH + NH 4+② AgOH + 2 NH ·H 2O [Ag(NH3)2]+ + OH - + 2 H 2O2 CH 3CH 2OH + O 3CHO + 2 H 2O + H 23CHOHC CH 2 + O 22 CH 3CHO 加热 加压H 2C CH 2催化剂2R―CHO + O 2―COOHR ―CHO + H 2―CH 2OHCH 3CHO + 2 Cu(OH)23COOH + Cu 2O + 2 H 2OCu 2+ + 2 OH - Cu(OH)260. 醛与银氨溶液的反应 61. 醛与Cu(OH)2悬浊液反应 62. 甲醛的银镜反应 63. 甲醛与Cu(OH)2悬浊液反应 64. 乙酸与氢氧化铜悬浊液 2CH 3COOH + Cu(OH)2 = (CH 3COO)2Cu + 2H 2O65. 乙酸乙酯制取(用饱和碳酸钠溶液收集)CH 3COOH + CH 3CH 2OHCH 3COOC 2H 5 + H 2O66. 乙二酸和乙二醇反应C ―OH ∣C ―OH OOHO ―CH 2∣HO ―CH 2+ + 2H 2O 浓硫酸C C O CH 2CH 2O O OnHOOC ―COOH + nHOCH 2―CH 2OH + 2nH 2O ―C ―C ―OCH 2―CH 2O ―O On浓硫酸67. 乙醇和硝酸酯化CH 3CH 2OH + HNO 3 CH 3CH 2ONO 2 + H 2O浓硫酸68. 乙酸乙酯的水解CH 3COOC 2H 5 + H 2O CH 3COOH + CH 3CH 2OH 稀硫酸CH 3COOC 2H 5 + NaOH ==== CH 3COONa + CH 3CH 2OH69. 甲酸钠与银氨溶液反应HCOONa +2Ag(NH 3)2OH NH 4OCOONa +2Ag ↓+3NH 3↑+H2O浓硫酸△R ―CHO + 2Cu(OH)2 R ―COOH + Cu 2O ↓ + 2H 2OR ―CHO + 2Ag(NH 3)2OH R ―COONH 4 + 2Ag ↓ + 3NH 3 + H 2O HCHO + 4 Cu(OH)2 CO 2 + 2 Cu 2O + 5 H 2O HCHO + 4 [Ag(NH 3)2]+ + 4 OH - (NH 4)2CO 3 + 4 Ag + 6 NH 3 + 2 H 2O70.甲酸钠与新制氢氧化铜反应HCOONa+2Cu(OH)2+ NaOH Na2CO3+Cu2O↓+3H2O71.葡萄糖的银镜反应CH2OH(CHOH)4CHO+2Ag(NH3)2OHCH2OH(CHOH)4COONH4+2Ag↓+3NH3↑+H2O72.葡萄糖与新制氢氧化铜反应CH2OH(CHOH)4CHO+2Cu(OH)2 +NaOH CH2OH(CHOH)4COONa+Cu2O↓+3H2O 73. 蔗糖水解C12H22O11 + H2O 催化剂C 6H 12O6 + C6H12O6蔗糖葡萄糖果糖74. 麦芽糖水解C12H22O11 + H2O 催化剂2C6H12O6麦芽糖葡萄糖75. 淀粉水解(C6H10O5)n + nH2O 催化剂nC6H12O6淀粉葡萄糖76. 纤维素水解(C6H10O5)n + nH2O 催化剂nC6H12O6纤维素葡萄糖77. 工业制取肥皂(皂化反应)C17H35COO―CH2∣C17H35COO―CH∣C17H35COO―CH2+ 3NaOH 3 C17H35COONa +HO―CH2∣HO―CH∣HO―CH278.油酸甘油酯硬化79.工业制造乙苯 + CH2=CH280.制造硝酸纤维的反应81.甲苯与高锰酸钾酸性溶液反应5 +6KMnO4+9H2SO4→ 5 +3K2SO4+ 6MnSO4+ 14H2O82.甘油制取炸药83.甲醛与苯酚反应制取酚醛树脂代表物之间的转化关系:CH3CH3CH2=CH2 CH=CH CH2=CHCl CH3CH 2OHCH 2BrCH2BrCH2OHCH2OHCHOCHOCOOHCOOH[ CH2—CH ]nClCH3CHO CH3COOHCH3COOC2H5CH3CH2BrO=CO=CCH2CH2OO。


高中有机化学方程式汇总一、取代反应1、CH 4 + Cl 2 HCl + CH 3Cl ( 气态) 一氯甲烷CH 3Cl + Cl 2HCl + CH 2Cl2 ( 液态 ) 二氯甲烷CH 2Cl + Cl 2HCl + CHCl 3 ( 液态 ) 三氯甲烷或氯仿 CHCl 3+ Cl 2HCl +CCl 4 ( 液态 )四氯甲烷或四氯化碳 2、C 2H 6 + Cl 2 HCl + CH 3CH 2Cl3 + Br 2Br + HBr (真正催化剂是FeBr3)3 + Cl 22Cl + HCl3 + 3Cl 2 + 3HCl4 + HONO 2 2 + H 2O+ HOSO 3H 3H + H 2O5 + 3Br 2 + 3HBr+ 3HONO 2 + H 2O6、C 2H 5OH + HBr C 2H 5Br + H 2O C 2H 5Br C 2H 5OH + HBrC 2H 5Br CH 2 CH 2 + HBr7、CH 3COOC 2H 5 + H 2O CH 3COOH + C 2H 5 OH光照光照光照 光照光照Fe 光照无水AlCl 3Cl LNaOHH 2O NaOHC 2H 5OHBr L3H 2SO 4浓50-60℃2NO NO 2 LH 2SO 4浓50-60℃ H 2SO 4浓70-80℃ 无机酸或碱8、 + 3 NaOH + 3C 17H 35 COONa二、加成反应1、CH 2 CH 2 + H 2CH 3 CH 32、CH 2 CH 2 + HCl CH 3 CH 2Cl3、CH 3CH CH 2+ HClCH 3 CHClCH3(马氏加成)CH 3 CHCH 2 + HCl CH 3 CH 2 CH 2Cl (反马氏加成)4、CH CH + H 2 CH 2 CH 2 CH CH + 2 H 2 CH 3 CH 35、CH CH + 2HCl CH 3 CHCl 26、CH 3 CHO + 2 H 2 CH 3 CH 2OH 7+ 3 H 2 + H 2 CH 3 CH 2 CH 3+ H 2 CH 3 CH 2 CH 2 CH 3 ㊣ Pt 比Ni 催化效率高 8+ 3Cl 2 C 6H 6 Cl 69、 CH 2 CH 2 + H 2O CH 3 CH 2OHCH CH + H 2O 2CH 2 CH 2 + O 22 1、CH3 CH 2OH CH 2 2 + H 2O2、2CH 3 CH 2OH+ H 2O (分子间脱水) 3、C 2H 5 Cl CH 2 CH 2 + H ClOOOCH 2 O C C 17H 35 CH O C C 17H 35 CH 2 O C 17H 35CH 2CH OH CH 2 无水AlCl 3/HgCl 2/ZnCl 2150-160℃ 无过氧酸有过氧酸如CH 3COOOH 催化剂加热 HHC CH Cl +--+ H Cl无水AlCl 3 H 2SO 4 或 H 3PO 4 加热 加压HgSO 4(H +)OCH 3 C H高温、高压PdCl 2 或CuCl 2OCH 3 C H三、消去反应H 2SO 4浓170℃ H 2SO 4浓 140℃CH 3 CH 2 O CH 2 CH 3 NaOH C 2H 5OH四、酯化反应 (酯化反应也是取代反应)1、CH 3 COOH + CH 3 CH 2OH CH 3 COOCH 2 CH 3 + H 2O2、 + 3HONO 2+ H 2O3、[C 6H 7 O 2(OH) 3 ]n + 3n HONO 2 [C 6H 7 O 2(NO 2) 3 ]n + 3nH 2O 五、水解反应(卤代烃、酯、油脂的水解见上,也是取代反应)1、CH 3 COONa + H 2O 3 COOH + NaOH2、C 17H 35 COONa + H 2 C 17H 35 COOH + NaOH3、(C 6H 10O 5)n + nH 2O n C 6H 12O 64、C 12H 22O11 + H 2OC 6H 12O 6 + C 6H 12O 6C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖5、CH 3 COOCH 2 CH 3 + H 2O CH 3 COOH + CH 3 CH 2OH六、氧化反应①被强氧化剂氧化 1、2 CH 3 CH 2OH + O 2 2 + H 2O 2、2 + O 2 2 CH 3 COOH 3、2 CH 2 CH 2 + O 2 2 ②被弱氧化剂缓慢氧化1、CH 3 CHO + 2[Ag(NH 3)2] OH CH 3 COOH + 4 NH 3 + 2Ag + H 2O2、CH 3 CHO + 2 Cu(OH)2 CH 3 COOH + 2 Cu 2O + H 2O3、CH 2 OH(CHOH)4 CHO + 2[Ag(NH 3)2] OH CH 2 OH(CHOH)4 COOH + 4 NH 3 + 2Ag + H 2O4、CH 2 OH(CHOH)4 CHO +2 Cu(OH)2 OH(CHOH)4 COOH + 2 Cu 2O + H 2O5、HCOOH + 2[Ag(NH 3)2] OH CO 2 + 4 NH 3 + 2Ag + H 2OH 2SO 4浓 加热CH 2 OH CH OHCH 2 OHCH 2 O NO 2 CH O NO 2 CH 2 O NO 2 H 2SO 4浓 H 2SO 4浓H 2SO 4稀加热淀粉/纤维素 葡萄糖H 2SO 4稀加热蔗糖 葡萄糖 果糖H 2SO 4稀加热无机酸 或碱Cu 或Ag OCH3 C H OCH 3 C H Mn(AC)2 Mn(AC)2 OCH 3 C H 水浴加热 水浴加热 水浴加热6、HCOOH + 2 Cu(OH)2CO 2 + 2 Cu 2O + 2H 2O③有化合机物的燃烧 C x H y + (x+y /4) O 2xCO 2 + y /4 H 2O七、还原反应1、+ H 22、 + H 2 CH 3 CH 2OH3、 八、加聚反应1、n CH 2 CH 22、n CH CH3、 九、缩聚反应1、n+ nH 2O2、+ nH 2O 1、CH 4 C + 2H 2 C 16H 34 C 8H 16 + C 8H 18C 8H 18 C 4H 8 + C 4H 10 C 8H 16 CH 4 + C 7H 12十一、其它有机反应12 + H 2O 3 2、2CH 3 CH 2OH + 2Na 2CH 3 CH 2O Na + H 2 3、OH + 2Na 24、C 12H 22O 11 12C + 11 H 2O C + 2H 2SO 4(浓) CO 2 +2 SO 2 + 2H 2O5、氨基酸的两性点燃 O CH 3 C CH 3 CH 3 C CH 3 OCH 3 C H 2 CH 2 + H 2 2 CH 3nCH 2 CH CH 2 CH 2催化剂[ CH 2 CH CH 2 CH 2]nH N CH 2 C OH H O [N CH 2 C ]n H O催化剂COOH + nHO CH 2 CH 2 OH 催化剂O O CH 2 CH 2 O C C]n [ O 十、裂化反应高温 高温 高温 高温 H 2SO 4浓 + HClCH 2 COOH NH 2 CH 2 COOHNH 3Cl+ NaOHCH 2 COOH NH 2CH 2 COONa + NH 2H 2O。

有机化学方程式大全1.甲烷(1)氧化:CH4 + 2O2CO2 + 2H2O(2)取代:CH4 + HCl CH3Cl + H22.乙烯(官能团:C______C)(1)氧化①C H2______CH2 + 3O22CO2 + 2H2O②*CH2______CH2 + KMnO4K2SO4 + MnSO4 + H2O + CO2(2)加成①C H2______CH2 + HX CH3CH2X②C H2______CH2 + X2CH2XCH2X (与溴水无需反应条件)③C H2______CH2 + H2O CH3CH2OH④C H2______CH2 + H2CH3CH33.苯(键型:离域大π键)X(1)取代:+ X2+ HX(此处X2为Br2时特指液溴)NO2(2)硝化:+ HNO3+ H2O(3)加成:+ 3H24.乙醇(官能团:—OH,有类似水的性质)附:乙醇的化学式为了保险也可写CH2CH3OH(1)置换:2C2H5OH + 2Na 2C2H5ONa + H2↑(2)氧化:C2H5OH + 3O22CO2 + 3H2O(3)催化氧化:2C2H5OH + O22CH3CHO + 2H2O(4)*高锰酸钾氧化:5C2H5OH + 4KMnO4 + 6H2SO45CH3COOH +4MnSO4 + 11H2O + 2K2SO4(5)酯化:(见乙酸)5.乙酸(官能团:—COOH,有酸性,且强于碳酸)(1)与钠反应:2CH3COOH + 2Na 2CH3COONa + H2↑(2)与碱反应:CH3COOH + NaOH CH3COONa + H2O(3)与盐反应:2CH3COOH + Na2CO32CH3COONa + H2O + CO2↑浓硫酸(4)酯化反应:CH3COOH + C2H5OH CH3COOCH2CH3 + H2O 注意:酸脱羟基,醇脱氢!6.乙酸乙酯(官能团:—COO)浓硫酸(1)酸性水解:CH3COOCH2CH3 + H2O CH3COOH + C2H5OH(2)碱性水解:CH3COOCH2CH3 + NaOH CH3COONa + C2H5OH7.生物大分子化学(1)蔗糖水解:C12H22O11 + H2O C6H12O6 + C6H12O6蔗糖葡萄糖果糖(2)麦芽糖水解:C12H22O11 + H2O 2C6H12O6麦芽糖葡萄糖(3)淀粉(或纤维素)水解:+ H2O C6H12O6淀粉(或纤维素)葡萄糖(4)淀粉遇碘变蓝:淀粉+ I2(变蓝)(5)油脂的酸性水解:油脂+ 水高级脂肪酸+ 甘油(6)油脂的碱性水解:油脂+ 水高级脂肪酸钠+ 甘油(7)蛋白质水解:蛋白质+ 水氨基酸(8)蛋白质的颜色反应:蛋白质+ HNO3(变黄、烧焦羽毛味)(9)银镜反应:葡萄糖+ 银氨溶液Ag + 其他产物(10)斐林反应:葡萄糖+ Cu(OH)2Cu2O + 其他产物附:有机物燃烧通式:C x H y O z + O2CO2 + H2O需要注意的地方:●酯化反应必须使用可逆符号。

有机化学分类有机化学是一门涉及有机分子的化学学科,它不仅包含有机分子的结构和性质,还研究有机分子的合成及其反应,因此有机化学也被称为“有机合成化学”。
由于有机化学学科涵盖范围大,为了更好地理解有机物质的结构、性质、合成和反应,有机化学必须根据不同的分子结构特征进行分类。
据有机分子的结构特征,可以将有机分子分为碳氢化合物、氢氧化物、醛类、酮类和其他类别。
1、碳氢化合物碳氢化合物是最基本的有机分子,也是有机化学中最重要的一类化合物。
它们通常是由碳原子和氢原子的组成的单体,其中碳原子与氢原子的化学键数介于1至4之间。
碳氢化合物可分为烷烃、烯烃、芳烃和萜烃几类。
这些化合物在消除反应中极易形成自由基,因此在许多物理和化学反应中有着重要的作用。
2、氢氧化物氢氧化物是由碳原子、氢原子和氧原子组成的有机分子,它们形成多种化合物,如羰基、醛类、酮类、醇类和酯类等。
其中,羰基、醛类和酮类是氢氧化物的三个主要类别。
这些化合物具有不同的结构和性质,并参与一系列的化学反应,是有机化学中重要的组分之一。
3、醛类醛类是以醛基(C=O)为中心的环衍生物,它们以有机醛分子作为最常见的基本物质,并包括羧酸酯、甲醛、醋酸、醛酸和其他有机醛衍生物。
它们通常具有可溶性和极性性质,并可以受到酶的催化作用,参与有机物质的生物氧化作用。
4、酮类酮类是由碳原子、氢原子和氧原子组成的环衍生物,它们的特征是具有一个取代的氢原子的羰基片段。
酮类化合物的特性和性质受到羰基结构的影响,如羟基酮、羧酸酯、甲酮和甲酸酯等化合物。
它们在有机合成以及生物反应中发挥着重要作用。
5、其他类别除上述几类有机化合物外,还有更多其他有机分子。
例如,硝基化合物是由氮原子和碳原子组成的化合物,它通常具有极性性质,可与蛋白质进行结合,参与生命体抗病毒的过程。
另外,亚硝基化合物也是一类重要的化合物,它是有机过渡元素的重要组成部分,常用于合成药物和高分子材料。
有机化学是一门非常广泛的学科,它结合了物理化学和生物化学知识,被广泛应用于工业生产、药物开发、环境保护和其他领域。

有机化学知识点汇总一、有机化学基础概念。
1. 有机物定义。
- 有机物通常指含碳元素的化合物,但一些简单的含碳化合物,如一氧化碳(CO)、二氧化碳(CO₂)、碳酸盐、碳化物等,由于它们的性质与无机物相似,通常被归为无机物。
2. 有机物的特点。
- 多数有机物熔点低、受热易分解。
例如,蔗糖在加热到一定温度时会熔化,继续加热则会分解碳化。
- 大多数有机物难溶于水,易溶于有机溶剂。
如苯难溶于水,却能很好地溶解在四氯化碳等有机溶剂中。
- 有机物反应速率一般较慢,反应复杂且常伴有副反应发生。
例如,乙醇的酯化反应需要加热且反应时间较长,同时还可能发生乙醇的脱水等副反应。
二、烃。
1. 烷烃。
- 结构特点。
- 烷烃分子中的碳原子之间都以单键相连,其余价键都与氢原子结合,使每个碳原子的化合价都达到“饱和”,因此烷烃又称为饱和烃。
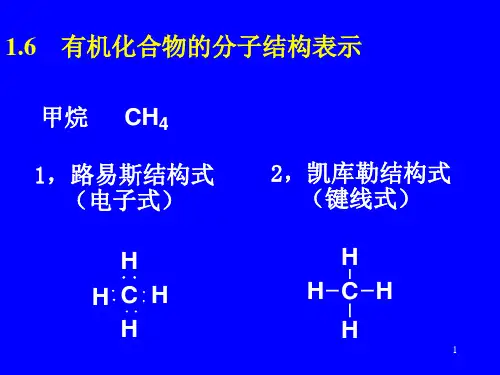
例如甲烷(CH₄),其分子结构为正四面体,碳原子位于正四面体的中心,四个氢原子位于正四面体的四个顶点。
- 通式:CₙH₂ₙ + ₂(n≥1)。
- 命名。
- 习惯命名法:对于直链烷烃,根据碳原子数称为“某烷”,碳原子数在十以内的,用甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示,碳原子数大于十的,用汉字数字表示。
例如,C₅H₁₂称为戊烷。
- 系统命名法。
- 选主链:选择最长的碳链作为主链,根据主链碳原子数称为“某烷”。
- 编号:从距离支链最近的一端开始给主链碳原子编号。
- 写名称:将支链的名称写在主链名称的前面,在支链的前面用阿拉伯数字注明它在主链上的位置,数字与名称之间用短线隔开。
如果有相同的支链,可以合并,用汉字数字表示支链的个数。
例如,CH₃CH(CH₃)CH₂CH₂CH₃命名为3 - 甲基戊烷。
- 化学性质。
- 稳定性:烷烃在常温下比较稳定,与强酸、强碱、强氧化剂等一般不发生反应。
- 可燃性:烷烃都能燃烧,完全燃烧的化学方程式为CₙH₂ₙ + ₂+(3n +1)/2O₂→nCO₂+(n + 1)H₂O。
常见有机物及其用途化学常见的有机物及其用途非常广泛,以下是一些常见的有机物以及它们的用途。
1. 乙醇:乙醇广泛用作溶剂,可以用于清洁、溶解、稀释等多种工业和实验室用途。
此外,乙醇还是能源行业的重要原料,可以作为汽油添加剂或用于生物燃料的生产。
2. 乙二醇:乙二醇是一种非常重要的溶剂和起泡剂。
它常用于制造化妆品、洗涤剂、润滑油、冷却液等产品。
3. 甲醇:甲醇是一种广泛应用于工业的溶剂和原料。
它可以用于制造塑料、合成树脂、合成纤维、胶粘剂等。
此外,甲醇还可以用作燃料,特别是在一些地方作为汽车燃料的替代品。
4. 正丁醇:正丁醇是一种常见的有机溶剂,被广泛用于涂料、油墨、清洗剂等领域。
此外,正丁醇还可以在一些工业反应中作为原料。
5. 苯:苯是一种无色具有特殊芳香气味的液体。
苯是许多工业化学品的重要原料,例如塑料、合成纤维、染料、涂料等。
此外,苯还可以用于制造药物和农药。
6. 乙酸:乙酸是一种常见的有机酸,被广泛用于许多工业领域。
它在食品工业中用作食品添加剂,也用于生产塑料、纤维、涂料、染料等。
此外,乙酸还是许多药物的重要原料。
7. 丙酮:丙酮是一种无色液体,具有较低的沸点和闪点。
丙酮被广泛用作溶剂,在许多工业和实验室应用中起着重要的作用。
8. 戊醇:戊醇是一种重要的工业溶剂,广泛用于涂料、胶水、清洗剂等领域。
9. 丁酮:丁酮是一种有机溶剂,被广泛用于油漆、涂料、染料、塑料等行业。
10. 甲苯:甲苯是一种无色液体,具有强烈的芳香气味。
甲苯被广泛用于塑料、合成纤维、染料、涂料等产业中。
以上是一些常见的有机物及其用途,它们在工业和实验室中起着非常重要的作用。
有机化学的发展使这些有机物得以广泛应用,推动了工业的发展和现代社会的进步。
常见有机分子及其化合价、化学式、化学
方程式
常见有机分子及其化学性质
一、甲烷(CH4)
- 化学式:CH4
- 化学方程式:CH4 + 2O2 → CO2 + 2H2O
- 化学价:碳的价为+4,氢的价为+1
二、乙烷(C2H6)
- 化学式:C2H6
- 化学方程式:C2H6 + 3.5O2 → 2CO2 + 3H2O
- 化学价:碳的价为+4,氢的价为+1
三、乙烯(C2H4)
- 化学式:C2H4
- 化学方程式:C2H4 + 3O2 → 2CO2 + 2H2O
- 化学价:碳的价为+2,氢的价为+1
四、乙炔(C2H2)
- 化学式:C2H2
- 化学方程式:C2H2 + 2.5O2 → 2CO2 + H2O
- 化学价:碳的价为+2,氢的价为+1
五、甲醇(CH3OH)
- 化学式:CH3OH
- 化学方程式:CH3OH + 1.5O2 → CO2 + 2H2O
- 化学价:碳的价为+4,氧的价为-2,氢的价为+1 六、乙醇(C2H5OH)
- 化学式:C2H5OH
- 化学方程式:C2H5OH + 3O2 → 2CO2 + 3H2O - 化学价:碳的价为+4,氧的价为-2,氢的价为+1
七、乙酸(CH3COOH)
- 化学式:CH3COOH
- 化学方程式:CH3COOH + 3O2 → 2CO2 + 2H2O
- 化学价:碳的价为+4,氧的价为-2,氢的价为+1
以上是一些常见有机分子及其化学性质的简要介绍。
请注意,这些化学方程式仅作为例子,实际反应可能存在多种情况。
判断题A正确第一章:绪论互为同系物的物质,它们的分子式一定不同;互为同分异构体的物质,它们的分子式一定相同。
(A)C-X键极化度的大小顺序为C-I>C-Br>C-Cl>C-F。
(A)任何成π键的两个碳原子之间必定有σ键。
(A)π键沿轨道轴垂直方向成键,重叠小、不稳定、能绕健轴自由旋转。
(D)由不相同的原子形成的双原子分子不一定是极性分子。
66、二元羧酸比一(D)第二章:链烃10、氢原子的“酸”性大小顺序是:CH=_CH>CH2=CH2>CH3-CH3。
(A)11、π键沿轨道轴垂直方向成键,重叠小、不稳定、能绕健轴自由旋转。
(D)12、烯烃的亲电加成比炔烃活泼。
(A)13、对于烷烃,同碳数,支链数增加,熔点减少,但对称性增加,熔点增加。
(A)14、甲烷分子C-H键的键能等于离子键。
(D)16、乙烷只存在两种构象:交差式和重叠式。
(D)18、不同杂化轨道电负性顺序:sp>sp2>sp3。
(A)19、所有的烯烃都要顺反异构现象。
(D)20、共轭效应沿共轭链传递时逐渐减小。
(D)21、对于双原子分子,其键能等于离解能。
(A)22、D型化合物一定为右旋物质,L型化合物一定为左旋物质。
(D)第三章:脂环烃23、环己烷的椅式构象比船式构象稳定。
(A)24、有机分子中如果没有对称面,则分子就必然有手性。
(D)25、环丙烷中含有丙烷杂质,可加入溴水洗涤后分离。
(D)26、拜尔张力学说认为环烷烃具有平面多边形的结构,能够成功的解释所有环烷烃的稳定性问题。
(D)27、环丙烃是小环不稳定,因此环越大的环烷烃就越稳定。
(D)第四章:芳香烃29、苯环上烃基都能被酸性高锰酸钾溶液氧化成羧基。
(D)30、凡是使苯环活化的基因,都是邻、对位定位基。
(D)31、烷基苯在光照条件下与氯反应,首先是α-C的氢被氯代。
(A)32、苯环上烃基只要α位有H原子就能被酸性高锰酸钾溶液氧化。
(A)33、间位定位基都是使苯环活化的基因。
有机化学知识点总结1. 有机化学概述1.1 定义:研究含碳化合物的化学性质、结构、合成及其应用的科学。
1.2 特点:碳的四价性、碳链结构、官能团的存在。
2. 有机化合物的分类2.1 烃类:仅含碳氢元素的有机化合物。
2.1.1 饱和烃:碳原子之间全为单键,如烷烃。
2.1.2 不饱和烃:含有双键或三键,如烯烃、炔烃。
2.2 衍生物:由烃类通过取代或加成反应生成的化合物。
2.2.1 醇、酚:含羟基的化合物。
2.2.2 醛、酮:含羰基的化合物。
2.2.3 羧酸、酯:含羧基的化合物。
2.2.4 胺、酰胺:含氨基的化合物。
3. 有机化学反应类型3.1 取代反应:化合物中的一个原子或基团被另一个取代。
3.1.1 核式取代:如卤代反应。
3.1.2 亲核取代:如醇的生成。
3.2 加成反应:不饱和化合物与另一个分子结合形成饱和化合物。
3.2.1 电子对受体与亲电试剂的反应。
3.3 消除反应:化合物中的两个原子或基团脱离形成不饱和化合物。
3.4 重排反应:分子内部原子的重新分布。
3.5 聚合反应:单体分子通过重复的化学反应形成大分子链。
4. 有机分子的结构4.1 碳原子的杂化:sp、sp2、sp3杂化。
4.2 立体化学:手性、对映体、消旋体。
4.3 分子轨道理论:分子的电子结构。
5. 有机化学中的分析技术5.1 光谱分析:红外光谱、核磁共振光谱、紫外-可见光谱。
5.2 色谱分析:气相色谱、液相色谱、薄层色谱。
6. 有机合成策略6.1 逆合成分析:目标分子的合成路径设计。
6.2 保护基策略:对活性官能团的保护与去保护。
6.3 绿色化学:环保、可持续的合成方法。
7. 有机化学的应用7.1 药物合成:药物分子的设计、合成与改良。
7.2 材料科学:高分子材料、生物材料的开发。
7.3 能源化学:生物质能源、太阳能转换。
8. 有机化学的发展趋势8.1 新合成方法的开发。
8.2 新材料的设计与合成。
8.3 生物有机化学的交叉研究。
《有机化学》第三单元练习题
专科2012级
班级 姓名 学号
一、命名下列化合物或写出结构式:
(1)
(2)
⑴2,4,4-三甲基-2-溴-戊烷 ⑵2-甲基-5-氯-2-溴已烷
(3) (4)
⑶对氯乙基苯 ⑷(Z)-1-溴-1-丙烯
(5) (6)
(5)顺-1-氯-3-溴环已烷 (6)2-甲基-5-氯-2-溴已烷;
(7) (8)
(7)1-异丁基-1, 4-二氯环己烷 (8)4-甲基-5-溴-2-戊炔
(9) (10)
(9)2-(2,-氯乙基)-1-戊烯 (10)1, 3-二溴苯
Br
Br
CH2=C-CH2CH2-Cl
CH2CH2CH
3
CH
3
CH3-C≡C-CHCH2-Br
Cl
Cl
CH2CH(CH3)
(11) (12)
(11)
2-甲基-4-氯-1-丁烯 (12)(E)-2-氟-1-碘丙烯
二、完成下列反应式
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
CC
FCH3H
I
Cl
(9)
(10)
(11)
(12)
. (13)( )CH2CH3CH3H3CHICCHCH2CH3CH3IH3CCH3
三、选择题:
1)
比较下列物质与AgNO3-乙醇反应的难易程度:
D>B>C>A
2)
下列物质进行SN2反应速率最快的是:
A.1-溴丁烷 B.2,2-二甲基-1-溴丁烷 C.2-甲基-1-溴丁烷 D.3-甲基-1-溴丁烷
A>D>C>B
3)下列化合物按SN1历程反应的活性最大的是( ) (B)> (C) > (A)
(A) (CH3)2CHBr (B) (CH3)3CI (C) (CH3)3CBr
4)
下列化合物中,哪些不能在干乙醚中与镁粉生成较为稳定的格氏试剂? (2、3、4)
5) 在KI丙酮溶液中反应活性最大的是( )。(A)
A. CH3CH2CH2CH2Br
B. CH3CH2 HCH3C.C
Br
CH3CCH
3
CH
3
Br
6)在AgNO3酒精溶液中,反应活性最大的是( )。(B)
A.
B.
C.
CH2Cl
CH2ClCH3CH2Cl
NO
2
7)下列试剂中亲核性最强的是( )。D
8)按E1反应,速率最快的是( )。(A)
CH3OCHBrCHCH3CH3A.B.O2NCBrHCH3CH3HC
C.CH3CBrHCH3CH3HC
9)在浓KOH的醇溶液中脱卤化氢,速率最快的是( ),速率最慢的是( )。
A, D;
A. 2-溴-2-甲基丁烷 B. 1-溴戊烷; C. 2-溴戊烷; BrD.
10)下列描述SN2反应性质的说法中,哪一项是错误的?( )D;
A. 通常动力学上呈二级反应,对反应物和亲核试剂浓度各呈一级。
B. 进攻试剂亲核能力对反应速度有显著影响。
C. 产物构型翻转。
D. 叔卤烃比仲卤烃反应快。
11)下列描述不.属于SN1反应的是( )
A:中间体是正碳离子 B: 产物的绝对构型完全转化
C: 叔卤代烷比仲卤代烷反应快 D: 有重排产物生成
12)下列化合物与AgNO3醇溶液的反应活性由大到小的顺序是: C>A>D>B 。
A.(CH3)2CHCl B. CH3CH=CHCl
C. CH2=CHCH2Cl D. CH3CH2CH2Cl
13.、卤代烷与氢氧化钠在水-乙醇溶液中进行反应,下列反应属于SN2机理的是( )。
(1)产物发生Walden转化;
(2)增加溶剂的含水量反应明显加快;
(3)有重排反应;
(4)叔卤代烷反应速率大于仲卤代烷;
(5)反应只有一步。
A、(2)、(3)和(4) B、(1)、(2)和(3)
C、(1)和(5) D、(1)、(3)和(5)
14. 卤代烷的烃基结构对SN1反应速度影响的主要原因是( )
A.空间位阻 B.正碳离子的稳定性 C.中心碳原子的亲电性 D.a和c
15. 比较下列各离子的亲核性大小( ):
A.HO-;B.C6H5O-;C.CH3CH2O-;D.CH3COO-
A.C>A>B>D B.D>B>A>C C.C>A>D>B D.B>C>D>A(答案为A,碱性
越强,亲核性越强)
四、用简便化学方法鉴别下列各组化合物
⑴ CH3CH2CH2Br 、(CH3)3CBr、CH2=CH-CH2Br、HBrC=CHCH
⑵ 对氯甲苯 氯化苄 β-氯乙苯
⑶ 3-溴环己烯 氯代环己烷 碘代环己烷 甲苯 环己烷
五、推断以下化合物的结构:
1.分子式为C4H8的化合物(A),加溴后的产物用NaOH/醇处理,生成C4H6(B),(B)能使溴水褪色,
并能与AgNO3的氨溶液发生沉淀,试推出(A)(B)的结构式并写出相应的反应式。
A. CH3CH2CH=CH2 B. CH3CH2C≡CH
2.某烃C3H6(A)在低温时与氯作用生成C3H6Cl2(B),在高温时则生成C3H5Cl(C)。使(C)与碘化乙基镁
作用得C5H10(D),后者与NBS作用生成C5H9Br(E)。使(E)与氢氧化钾的洒精溶液共热,主要生成
C5H8(F),后者又可与丁烯二酸酐发生双烯合成得(G),写出各步反应式,以及由(A)至(G)的
构造式。
.
E:CH3CH2CHCHCH2Br
3.某卤代烃(A),分子式为C6H11Br,用乙醇溶液处理得(B)C6H10,(B)与溴 反应的生成物再用KOH-乙醇
处理得(C),(C)可与进行D-A反应生成(D),将(C)臭氧化及还原水解可得
,试推出(A)(B)(C)(D)的结构式,并写出所有的反应式.
4. 化合物A的分子式为C6H14,光氯化时得到3种一氯代烷B、C和D,B和C在叔丁醇钾在叔丁醇溶
液中发生消除反应生成同一种烯烃E,D不能发生消除反应,试推测A、B、C、D和E的结构。
六、用指定原料合成目标化合物
1、DCH3CH3Br
2. 以苯为原料(其它试剂任选)合成 。
3.
4.由环己醇合成碘代环己烷
CH
3
Br
KOH/C2H5OH
CH
3
HBr
ROOR
CH
3
Br
Mg
Et2O
CH
3
MgBr
D2O
D
CH
3
5. 由溴代正丁烷制备1,1,2,2-四溴丁烷
6.由CH3CH=CH2合成: