2023届高考化学一轮专题复习--物质结构与性质专题训练
- 格式:docx
- 大小:3.15 MB
- 文档页数:39

第 1 页 共 16 页 2023课标版化学高考第一轮专题练习 第十一章 物质结构与性质
第1节 原子结构与元素的性质 考点 原子结构与元素的性质 1.(1)[2021广东广州阶段训练,2分]基态Ti原子的未成对电子数是 ,基态Ti原子4s轨道上的1个电子激发到4p轨道上形成激发态,写出该激发态的价层电子排布式: 。 (2)[2021河南鹤壁联考,2分]下列状态的铝中,电离最外层的一个电子所需能量最小的是 (填标号)。 A.[Ne]○↑ 3s B.[Ne]○↑↓ 3s C.[Ne] D.[Ne]○↑○↑○↑○ 3s3px3py3pz (3)[2分]基态镍原子的价层电子中能量最高的电子所占能级的原子轨道有 个伸展方向。 (4)[4分]钪(Sc)为21号元素,其基态原子M能层电子数为 ;基态镝(Dy)原子的核外电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为 。 (5)[2021河北邯郸三模,4分]基态氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,电子重排后氧原子的价电子排布图为 ,电子重排后的氧原子能量有所升高,原因是不符合 (填“泡利原理”或“洪特规则”)。 (6)[2分]Cd与Zn同族且相邻,若基态Cd将次外层的1个d电子激发进入最外层的p能级,则该激发态原子的外围电子排布式为 。 (7)[2021山西太原二模,2分]对具有下列价电子排布的Ni或As进行光谱实验,用光谱仪一定能摄取到原子发射光谱的是 (填标号)。 A.Ni:3d10 B.As:4s24p𝑥14p𝑦14p𝑧1
C.As:4s↑↓ 4p↑↓↑ D.Ni:3d↑↓↑↑↓↑↑↓ 4s↑↓ 第 2 页 共 16 页
2.[4分]P能形成众多单质与化合物,P在成键时,能将一个3s电子激发进入3d能级而参与成键,该激发态原子的核外电子排布式为 。
用4-甲氧基重氮苯四氟硼酸盐(结构如图所示)处理黑磷纳米材料,可以保护材料并控制其性质,该盐的构成元素中C、N、O、F的电负性由大到小的顺序为 。 3.(1)[2021广东惠州一调,6分]第四周期中基态原子未成对电子数与基态Ni原子相同的元素有 种;铁、钴、镍三种元素中,铁元素的常见化合价有+2和+3,而钴元素和镍元素的常见化合价为+2,请从原子结构的角度解释铁的常见化合价中有+3的原因: 。基态Cu+比Cu2+稳定的原因是 。 (2)[2022河北模拟,4分]MAlH4(M=Li,Na,K)等复合氢化物是重要的有机还原剂。MH中基态H-的核外电子的电子云轮廓图形状为 。

2023高考一轮复习 第二专题 物质的组成性质和分类 测试题选择题(每小题只有一个正确选项,每小题4分,共100分) 1. 分类是化学学习与研究的常用方法,下列分类正确的是( )A .NO 2、SO 2、P 2O 5均属于酸性氧化物B .淀粉溶液、蛋白质溶液、氢氧化铁胶体都是胶体C .醋酸、氨水、氢氟酸都是弱电解质D .石墨烯、天然橡胶、聚乙烯塑料都是高分子材料2. 分类思想是研究化学的常用方法,下列分类叙述正确的是( )A .既有单质参加又有单质生成的反应一定是氧化还原反应B .淀粉、纤维素、油脂均属于天然高分子C .根据丁达尔效应可以将分散系分为溶液、胶体和浊液D .碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物3. 油条配方中的主要成分为KAl(SO 4)2·12H 2O 、Na 2CO 3、NaCl ,发生反应为2KAl(SO 4)2·12H 2O +3Na 2CO 3===2Al(OH)3↓+3Na 2SO 4+K 2SO 4+3CO 2↑+21H 2O 。
下列判断不正确的是( ) A .油条配方中的“矾、碱、盐”主要成分均为盐 B .该反应中元素化合价均未发生改变 C .发生的反应中,反应物和生成物均为电解质D .反应的离子方程式为2Al 3++3CO 2-3+3H 2O===2Al(OH)3↓+3CO 2↑ 4. 反应NH 4Cl+NaNO 2NaCl+N 2↑+2H 2O 放热且产生气体,可用于冬天石油开采。
下列表示反应中相关微粒的化学用语正确的是( )A .中子数为18的氯原子:1817Cl B .N 2的结构式:N=N C .Na +的结构示意图:D .H 2O 的电子式:5.下列有关化学用语表示正确的是( )A .质量数为31的磷原子:B .氟原子的结构示意图:C .CaCl 2的电子式:D .明矾的化学式:Al 2(SO 4)36. 某学习兴趣小组讨论辨析以下说法,其中说法正确的是( )①通过化学变化可以实现16O 与18O 间的相互转化 ②煤的气化与液化都是物理变化 ③碱性氧化物一定是金属氧化物 ④只由一种元素组成的物质一定为纯净物3115P⑤石墨和C60互为同素异形体⑥糖类、蛋白质、油脂属于天然高分子A.③⑤⑥B.①②C.③⑤D.①③④7.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。

第十一单元物质结构与性质A卷新题基础练一、选择题:本题共14个小题,每小题4分,共56分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关化学键的说法正确的是A.任何离子和原子之间都可能存在化学键B.只有直接相邻的原子或离子之间才存在相互作用C.离子键是指阴、阳离子之间的相互吸引力D.分子和分子之间不存在化学键2.(2021·辽宁·大连八中)下列化学用语使用正确的是A.Cu+价层电子的轨道表达式为B.空间填充模型可以表示甲烷分子,也可以表示四氯化碳分子C.用电子式表示水的形成过程:→D.2Fe+的结构示意图:3.(2021·辽宁实验中学)下列说法正确的是A.原子轨道与电子云都是用来形象描述电子运动状态的B.电子的运动状态可从能层、能级、轨道3个方面进行描述C.气体单质中,一定有σ键,可能有π键D.1个乙烯分子中含有4个σ键,1个π键4.(2021·辽宁沈阳·)以下现象与原子核外电子的跃迁有关的是①节日焰火②棱镜分光③激光④LED灯光⑤凹透镜聚光⑥钢铁生锈A.③⑥B.①③④C.①③④⑤D.①②③⑤⑥5.(2021·全国·)如图是物质的微观结构示意图,请认真观察两图,判断下列说法正确的是A.两种物质在一定条件下都会自动形成有规则几何外形的晶体B.I形成的固体物理性质有各向异性C.II形成的固体一定有固定的熔点D.二者的X射线衍射图谱是相同的6.(2021·全国·)下列有关电子排布式或排布图的结论错误的是N的电子排布图:7.(2021·辽宁·辽河油田第一高级中学)已知A、B、C、D、E是原子序数依次增大的前四周期元素,其元素性质成原子结构如表:下列说法错误的是A.B有3个未成对电子B.A、B、C三种元素的原子半径由大到小的顺序:A>B>CC .D 元素基态原子的价电子排布图为:D .E 的基态原子的简化电子排布式为:[]2Ar 4s8.(2021·江苏·)在气体分析中,常用CuCl 2的盐酸溶液吸收并定量测定CO 的含量。

2023届高考化学第一轮专题复习真题试卷模拟——物质的结构与性质①和②配位原子提供孤电子对的能力与元素的电负性大小有关,易提供孤电子对。
则对于配合物①该晶体中,锌的配位数为___________。
②已知空间利用率η=晶胞中含有原子的体积晶胞的体积r2cm,则该晶体的空间利用率为(列出计算式即可)___________。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。
若A点原子的分数坐标为(0,0,0),则B点原子的分数坐标为___________。
2.(2023·西藏拉萨·统考一模)Na、Cl、Cu是中学化学中常见的成盐元素,它们之间能形成多种化合物。
回答下列问题:(1)Na和Cl两种元素能形成多种化合物,如常见的NaCl,其晶胞结构如图1所示,氯离子位于晶胞的顶点和面心。
①Cl的基态原子核外电子排布式为___________。
②图1所示晶胞中,与钠离子最近的钠离子共有_______个。
③在高压下,Na与Cl可产生新的化合物,晶胞结构如图2所示,钠离子位于晶胞的顶点和体心,该物质的化学式为_________。
④Na与Cl在某条件下还能形成一种团簇分子,分子结构如图3所示,氯原子位于顶点和面心。
该团簇分子的分子式为______。
(2)Cu、NH3、Cl可以形成[Cu(NH3)4]Cl2。
NH3分子的空间构型为________,[Cu(NH3)4]2+中提供空轨道的是__________,1mol该配合物中含有σ键的数目为___________(N A为阿伏加德罗常数的值)。
(3)金属铜采取面心立方最密堆积方式,Cu晶胞的边长为a pm,其晶胞及相关结构如图甲、乙、丙所示:①铜晶体的密度ρ=____________g·cm-3。
②根据图丙求出铜原子的半径r=_______pm。
(4)镍白铜(铜镍合金)常用作海洋工程应用材料。
某镍白铜合金的晶胞结构如图所示。

【高考化学】河南郑州2023届高考备考第一轮复习物质结构与性质提升练习1.(2022·河南郑州·高三期末)碳、氢、氧、氮等元素形成的各种各样的化合物在生活、生产中都有着重要的用途。
(1)我国科学家徐光宪根据光谱数据归纳出下列近似规律:对于原子的外层电子,(n+0.7l)越大,则能量越高。
注:n 的取值与电子层数相同;l 取0、1、2、3……表示s 、p 、d 、f……的电子。
则能量:6s_______4f(填“>”“<”或“=”)。
(2)乙醛是一种化工原料,检验乙醛中的醛基常用新制氢氧化铜悬浊液。
基态Cu +的价层电子轨道表示式为_______,基态氧原子有_______种能量不同的电子。
(3)NH 3与CH 4的中心原子均为sp 3杂化,但是的键角小于的键角,原因是____。
H-N-H H-C-H (4)一水合甘氨酸锌[]是一种饲料添加剂,该化合物中所涉及的第二周()2222H NCH COO Zn H O ⋅期元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
(5)2,5-二氨基甲苯(A)可用作毛皮染料,其中一种同分异构体是2,3-二氨基甲苯(B),二者中沸点较高的是_______(填“A”或“B”),原因是_______。
(6)AlP 因杀虫效率高、廉价易得而被广泛应用。
已知AlP 的晶胞结构如图所示。
①A 、B 点的原子坐标如上图所示,则C 点的原子坐标为_______。
②磷化铝的晶胞参数,其密度为_______(列出计算式即可,设()-12a=546.35pm 1pm=10m 3g/cm 表示阿伏加德罗常数的值)。
A N 2.(2021·全国·高三专题练习)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。
回答下列问题:(1)氟原子激发态的电子排布式有_______,其中能量较高的是_______。
(填标号)a. b. c. d.22411s 2s 2p 3s 22421s 2s 2p 3d 2121s 2s 2p 22321s 2s 2p 3p(2)①一氯乙烯分子中,C 的一个_______杂化轨道与Cl 的轨道形成_______()23C H Cl x 3p C-Cl 键,并且Cl 的轨道与C 的轨道形成3中心4电子的大键。

2023届高考化学一轮练习题:物质结构与性质1.(2022·安徽·高三开学考试)砷化镓(GaAs)半导体材料与传统的硅材料相比,同样条件下,它能更快地传导电流。
且它不仅可以用来制作发光二极管、光探测器,还能用来制备半导体激光器,广泛应用于光通信等领域。
回答下列问题:(1)Ga基态原子核外电子排布式为___________第四周期主族元素中,第一电离能介于Ga、As之间的元素是___________(填元素符号)。
(2)砷与卤素可形成AsXs、AsX3型两类化合物,其中三卤化砷的熔点和沸点数据如下表所示。
砷的卤化物AsF3AsCl3AsBr3AsI3熔点/℃-6-1831.1140.9沸点/℃57.8130.2221424℃三卤化砷晶体类型是___________其熔点变化规律及原因是:___________℃已知AsCl5的空间构型是三角双锥,则它是___________(填“极性”、“非极性”)分子。
(3)在GaH3、NH3、AsH3中,GaH3是平面三角形分子而AsH3是三角锥形分子,判断的依据是_______三种氢化物中,易与H+形成配位键的是________。
(4)砷化镓的立方晶胞结构如下图所示,晶胞参数为anm,砷化镓晶体的密度为ρg/cm3。
则Ga的配位数是___________,阿伏加德罗常数N A=___________/mol(用含a、ρ的式子表示)2.(2022·重庆市第七中学校高三阶段练习)物质结构的多样性使人类使用的材料精彩纷呈,请回答下列问题。
(1)氧化锆(ZrO2)材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性,氧化锆陶瓷在许多领域获得广泛应用。
锆是与钛同族的第五周期元素,则锆原子的价电子排布式为____。
(2)同主族元素所形成的物质具有性质相似的特点,H2O的熔沸点均比H2S高,其原因是____。
(3)Mn和Fe的部分电离能数据如表:元素Mn Fe电离能(kJ·mol-1)I1717759 I215091561 I332482957气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是____。
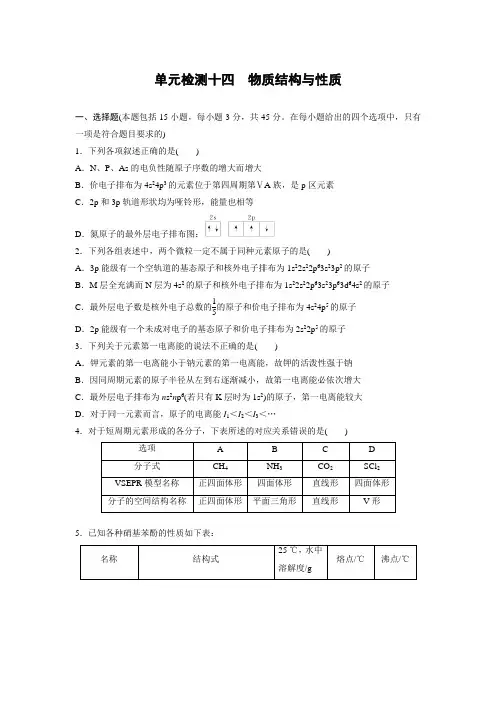
单元检测十四 物质结构与性质一、选择题(本题包括15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项是符合题目要求的) 1.下列各项叙述正确的是( )A .N 、P 、As 的电负性随原子序数的增大而增大B .价电子排布为4s 24p 3的元素位于第四周期第ⅤA 族,是p 区元素C .2p 和3p 轨道形状均为哑铃形,能量也相等D .氮原子的最外层电子排布图:2.下列各组表述中,两个微粒一定不属于同种元素原子的是( )A .3p 能级有一个空轨道的基态原子和核外电子排布为1s 22s 22p 63s 23p 2的原子B .M 层全充满而N 层为4s 2的原子和核外电子排布为1s 22s 22p 63s 23p 63d 64s 2的原子C .最外层电子数是核外电子总数的15的原子和价电子排布为4s 24p 5的原子D .2p 能级有一个未成对电子的基态原子和价电子排布为2s 22p 5的原子 3.下列关于元素第一电离能的说法不正确的是( )A .钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠B .因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大C .最外层电子排布为n s 2n p 6(若只有K 层时为1s 2)的原子,第一电离能较大D .对于同一元素而言,原子的电离能I 1<I 2<I 3<…4.对于短周期元素形成的各分子,下表所述的对应关系错误的是( )选项 A B C D 分子式 CH 4 NH 3 CO 2 SCl 2 VSEPR 模型名称 正四面体形四面体形直线形 四面体形 分子的空间结构名称正四面体形 平面三角形直线形V 形5.已知各种硝基苯酚的性质如下表:名称结构式25 ℃,水中溶解度/g熔点/℃沸点/℃邻硝基苯酚0.2 45 100 间硝基苯酚 1.4 96 194 对硝基苯酚 1.7 114 295下列关于各种硝基苯酚的叙述不正确的是()A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另两种硝基苯酚B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小6.下列有关原子晶体的叙述不正确的是()A.金刚石和二氧化硅晶体的最小结构单元都是正四面体B.1 mol金刚石中的C—C数目是2N A,1 mol SiO2晶体中的Si—O数目是4N AC.水晶和干冰在熔化时,晶体中的共价键都会断裂D.SiO2晶体是原子晶体,所以晶体中不存在分子,SiO2不是它的分子式7.元素周期表是安置元素的一座“大厦”,已知原子的下列结构或性质,能确定其在周期表中的“单元号和房间号”即位置的是()A.某元素原子的第二电子层电子排布图为B.某元素在某种化合物中的化合价为+4C.某元素的原子最外层电子数为6D.某元素的原子价电子排布式为5s25p18.硫酸盐(含SO2-4、HSO-4)气溶胶是雾霾的成分之一。

等级考专题——结构解释性质的表述题1、用原子结构解释Na、Mg、Al元素性质递变的规律Na、Mg、Al处在元素周期表中同一周期,电子层数相同,核电荷数逐渐增大,原子半径逐渐减小,原子核对核外电子的吸引能力增强,失电子的能力逐渐减弱,Na、Mg、Al元素金属性逐渐减弱。
2、用原子结构解释P、S、Cl元素性质递变的规律P、S、Cl处在元素周期表中同一周期,电子层数相同,核电荷数逐渐增大,原子半径逐渐减小,原子核对核外电子的吸引能力增强,得电子的能力逐渐减增强,P、S、Cl元素非金属性逐渐增强。
3、用原子结构解释第Na、K族元素性质递变的规律Na、K处在元素周期表中同一主族,最外层电子数相同均为1,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的吸引减弱,原子失电子的能力逐渐增强,因此,元素的金属性逐渐增强。
4、用原子结构解释第Cl、Br、I元素性质递变的规律Cl、Br、I元素处在元素周期表中同一主族,最外层电子数相同均为7,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的吸引减弱,原子得电子的能力逐渐减弱,因此,元素的非金属性逐渐减弱。
5、用原子结构解释O元素在周期表中的位置,并解释其性质氧原子有2层电子故处在元素周期表中第二周期,最外层电子数为6,处在第VIA族。
因其电子层数较小,最外层电子数较大,原子核对核外电子的吸引能力较强,故有较强的得电子能力,非金属性较强。
6、从结构角度解释HCl、HBr、HI分子稳定性HCl、HBr、HI分子结构相似,Cl、Br、I原子半径逐渐增大,H—Cl、H—Br、H—I键键长逐渐变长,键能变小,分子稳定性变弱。
7、从元素周期律角度解释HCl、HBr、HI分子稳定性Cl、Br、I元素处在元素周期表中同一主族,最外层电子数相同均为7,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的吸引减弱,原子得电子的能力逐渐减弱,因此,元素的非金属性逐渐减弱,对应的气态氢化物稳定性逐渐减弱。

高考热点微专题“位——构——性”综合推断题1.元素周期律的两大应用: (1)比较元素的性质。
如比较H 2SO 4和H 2SeO 4的酸性强弱,因为S 、Se 同主族,自上至下,元素的非金属性减弱,最高价氧化物对应的水化物酸性减弱,故酸性:H 2SO 4>H 2SeO 4。
(2)预测未知元素的性质。
如已知卤族元素的性质递变规律,可预测未知元素砹(At)应为有色固体,与氢气难化合,HAt 不稳定,水溶液呈酸性,AgAt 难溶于水等性质。
2.“位、构、性”三者关系的解读: (1)原子结构――→决定 元素在周期表中的位置。
(2)原子结构――→决定 元素的化学性质。
(3)位置原子结构和元素性质。
3.原子结构与元素在周期表中位置的关系:(1)核外电子层数=周期序数。
(2)主族元素的最外层电子数=价电子数=主族序数=最高正价数。
(3)质子数=原子序数=原子核外电子数=核电荷数。
(4)最低负价绝对值=8-主族序数(ⅣA~ⅦA)。
【典例】(2020·全国Ⅱ卷)一种由短周期主族元素组成的化合物(如图所示)①,具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24②。
下列有关叙述错误的是( )A.该化合物中,W、X、Y之间均为共价键B.Z的单质既能与水反应,也可与甲醇反应C.Y的最高化合价氧化物的水化物为强酸中原子均为8电子稳定结构D.X的氟化物XF3[解题思维] 解答本题的思维流程如下:提取信息①化合物的结构:;②元素W、X、Y、Z的原子序数依次增大、且总和为24信息 转化联想 质疑XF 3分子中X 原子是什么杂化类型?分子空间构型是什么? 提示:sp 2杂化、平面三角形。
【解析】选D 。
Z 的阳离子带一个正电荷,再由“元素W 、X 、Y 、Z 的原子序数依次增大、且总和为24”,确定Z 为Na ,再结合阴离子中各原子的成键个数可知,W 为H ,X 为B ,Y 为N 。
H 、B 、N 为非金属元素,之间形成共价键,A 正确;Na 能与水、甲醇发生反应,B 正确;氮的最高化合价氧化物的水化物是HNO 3为强酸,C 正确;BF 3中F 原子为8电子稳定结构,B 最外层只有6个电子,D 错误。

第30讲分子结构与性质1.下列叙述中正确的是()A.以非极性键结合起来的双原子分子一定是非极性分子B.BCl3与NCl3均为三角锥形结构,均为极性分子C.非极性分子只能是双原子单质分子D.非极性分子中一定含有非极性键【答案】A【解析】B错误,BCl3为平面三角形结构,为非极性分子;C错误,某些共价化合物,如CH4、C2H4等也是非极性分子;D错误,非极性分子中不一定含有非极性键,如CH4、CO2等。
2.硒是人体必需的微量元素之一,价电子排布式为2n s n2n p2n。
下列说法错误的是()A.沸点:H2Se>H2O B.稳定性:H2Se<HFC.电负性:Se<Br D.分子极性:SeO2>SO3【答案】A【解析】根据s轨道上最多排2个电子可知,硒的价电子排布式为4s24p4,故其位于第四周期第ⅥA族。
H2O分子间能形成氢键,故H2O的沸点高于H2Se,A错误。
3.下列事实不能用分子间作用力或氢键解释的是()A.HF、H2O的沸点分别比HCl、H2S的沸点高很多B.正戊烷的沸点比新戊烷的沸点高C.的沸点比的沸点低D.Na2O的熔点比MgO的熔点低【答案】D【解析】Na2O和MgO均为离子晶体,其熔点与分子间作用力和氢键无关,D符合题意。
4.下列说法正确的是()A.甘油(CH2OH—CHOH—CH2OH)分子中含有1个手性碳原子B.互为手性异构体的化合物,所含化学键的种类和数目完全相同C.互为手性异构体的化合物,在三维空间不能重合,但物理、化学性质却几乎完全相同D.互为手性异构体的化合物,分子组成不同,所以物理、化学性质也不同【答案】B【解析】CH2OH—CHOH—CH2OH分子中不存在手性碳原子,故A错误;互为手性异构体的化合物,物理性质不同,光学活性不同,故C错误;互为手性异构体的化合物,分子组成相同,故D错误。
5.已知几种共价键的键能如下:下列说法错误的是()A.键能:N≡N>N===N>N—NB.H(g)+Cl(g)===HCl(g)ΔH=-431.8 kJ·mol-1C.H—N键能小于H—Cl键能,所以NH3的沸点高于HClD.2NH3(g)+3Cl2(g)===N2(g)+6HCl(g)ΔH=-463.9 kJ·mol-1【答案】C【解析】C项,NH3的沸点高于HCl是由于NH3能形成分子间氢键,而HCl不能,错误。
2023届高考化学一轮专题复习--物质结构与性质专题训练1.化合物G 是一种治疗关节疼痛的药物,其一种合成路线如图所示(部分反应条件已经略去):回答下列问题:(1)有机物A 的名称为_______。
(2)由B 生成C 的反应类型为_______。
(3)C 中官能团的名称为_______;E 中手性碳(注:连有4个不同的原子或基团的碳)的个数为_______。
(4)F 生成G 时,还会有硫酸铵生成,写出反应的化学方程式:_______。
(5)比G 少5个碳原子的G 的同系物为X ,其同分异构体有多种,写出同时符合以下条件的X 的同分异构体的结构简式_______。
①属于芳香酯 ①核磁共振氢谱中有四组峰,且峰的面积之比为3:2:2:1(6)已知222R-CN+H R-CH NH 一定条件−−−−→设计以苯甲醛()为原料制备苯甲胺)的合成路线:_______(其他试剂任选)。
2.环丁基甲酸是有机合成中一种有用的中间体。
某研究小组以丙烯醛为原料,设计了如图所示路线合成环丁基甲酸(部分反应条件、产物已省略)。
已知:①;①。
回答下列问题:(1)化合物A 中的官能团名称为___________。
(2)B→D的化学反应类型为___________。
(3)写出化合物F的结构简式:___________。
(4)下列说法中不正确的是___________(填字母)。
Na CO溶液反应A.化合物A能与23C H OB.化合物G的化学式为684C.化合物B和C能形成高聚物1mol HD.1mol化合物B与足量金属钠能反应生成2(5)写出C→E的化学方程式:___________。
(6)环丁基甲酸与苯酚反应生成一种酯X,化合物X满足下列条件的所有同分异构体有___________种,写出其中一种的结构简式:___________。
FeCl溶液变紫色①能使3①含有丙烯醛中所有的官能团①核磁共振氢谱有5组峰,且峰面积之比为6:2:2:1:1(7)结合已知信息,其他无机试剂任选,设计以2-甲基-1,3-丁二烯和化合物E为原料制备的合成路线___________。
3.F是某些药物合成的中间体,以芳香烃A为原料制备F的合成路线如图所示:已知:。
回答下列问题:(1)光照条件下,A发生一氯取代生成B,则A的化学名称是_______。
(2)B的结构简式是_______,B生成C的条件是_______。
(3)C所含的官能团名称是_______,在浓硫酸和加热条件下,C与冰醋酸反应的化学方程式是_______。
(4)C→D,E→F的反应类型分别为_______、_______。
(5)下列关于D的说法正确的是_______(填序号)。
A .能与Na 反应生成2HB .能使酸性4KMnO 溶液褪色C .能与银氨溶液发生银镜反应D .1mol D 最多能与3mol ,发生加成反应(6)X 是E 的同分异构体,写出符合下列条件的X 的结构简式:_______(任写一种)。
①含有苯环,某环上含有3个取代基 ①不能与Na 反应①加热时能与新制()2Cu OH 反应生成砖红色沉淀4.α-松油醇是生产香精的重要原料,其合成路线如图所示:回答下列问题:(1)α-松油醇中所含官能团的名称为___________。
(2)C→D 的反应类型为___________。
(3)E→F 的反应中有副产物X(与F 互为同分异构体)生成,写出X 的结构简式:___________。
(4)已知:RBr Mg无水乙醇−−−−→ RMgBr(R 表示烃基)。
写出以溴乙烷和2-溴丙烷为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)___________。
5.氯苯是一种重要的有机合成原料,用氯苯合成染料中间体F 的两条路线如下图所示。
路线1:路线2:333CH OH CH COOH Fe /HClG H I F NaO a Ht −−−−−→−−−−−→−−−−−−→−−−−→试剂℃ (1)试剂a 为_______。
(2)A→B 的反应类型为取代反应,该反应的化学方程式为_______。
(3)B→C 的反应类型为_______。
(4)C 与3CH COOH 的相对分子质量之和比D 的相对分子质量大18,D→E 的取代反应发生在甲氧基(3OCH -)的邻位,F 的结构简式为_______。
(5)G 的结构简式为_______。
(6)有机物I 与对苯二甲酸()发生聚合反应的化学方程式为____。
(7)I 与3CH COOH 反应生成的有机产物除F 外,还可能有_______(写出结构简式)。
(8)满足下列条件的C 的同分异构体有_______种。
①与3FeCl 溶液发生显色反应 ①分子中含有2NH - ①苯环上有3种氢6.有A 、B 、C 三种烃,已知:①B 完全燃烧的产物n (CO 2)①n (H 2O)=2①3;①C 为饱和链烃,通常状况下呈气态,其二氯代物有三种;①A 是B 分子中的氢原子全部被甲基取代后的产物;A 遇Br 2的CCl 4溶液不褪色,其一氯代物只有一种。
请回答下列问题:(1)B 的最简式为___________,分子式为___________,其二溴代物有___________种。
(2)C 的三种二氯代物的结构简式分别为___________、___________、___________。
(3)A 的结构简式为___________,名称为___________。
7.心脏病治疗药左西孟坦中间体属于哒嗪酮类化合物,其合成路线如图:回答下列问题:(1)K 中含氧官能团的名称是___。
(2)C 的名称为___,D→E 的反应类型是___。
(3)条件1是___,I 的结构简式为___(用“*”标注手性碳原子)。
(4)写出K→L 反应的化学方程式:___。
(5)化合物K 的同分异构体中,写出满足下列条件的同分异构体有___种。
①能发生水解反应; ①属于芳香族化合物。
(6)设计由丙酮( )和OHC—CHO 为原料,结合本题合成路线中的无机试剂 制备的合成路线:___(合成需要三步)。
8.已知有机物F 和高分子N 的合成路线如图所示:已知:RCH=CHR 'RCOOH+R 'COOH ,RCH=CHR ' RCHO+R 'CHO()1Q 只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为9:1:6,经测定Q 的相对分子质量是128。
1molQ 可与21molBr 加成,并能与31molNaHCO 恰好完全反应,且分子中无支链。
Q 的分子式是 ______________。
()2A 所含官能团的名称是 ___________、 _____________;A B →的反应类型是 ________________; ()3写出C 与银氨溶液反应的化学方程式: _______________;()4G 的结构简式是 _______________;Q 的反式结构简式是 ____________。
()5下列说法正确的是 _________________。
A .C 能与苯酚在一定条件下生成高分子化合物B .D 催化加氢的产物与F 互为同分异构体C .F 能发生氧化反应、取代反应、加成反应D .高分子N 的每条分子链中含有()n 1-个酯基9.呫吨酮衍生物是治疗糖尿病的有效药,某呫吨酮衍生物的合成路线如下。
已知:I.232K CO H22Pd CPhOH PhCH Cl PhOCH Ph PhOH -+−−−→−−−→ II.Ph -为苯基:回答下列问题:(1)A→B 的反应类型为_______,该反应的目的是_______。
(2)C→D 的过程中,被还原的官能团是_______(写名称)。
(3)下列有关说法错误的是_______。
A .化合物A 的名称是2,6-二羟基苯甲酸乙酯B .化合物B 含4种不同官能团C .化合物E 既有酸性又有碱性D .用3NaHCO 溶液可以鉴别化合物F 和G (4)化合物F 易溶于水,主要原因是_______。
(5)化合物E 的同分异构体中,仅含-CONH 2、-OH 和苯环结构的有_______种。
F→G 的反应会生成一种副产物H ,H 与化合物G 互为同分异构体,H 的结构简式为_______。
(6)请你以及苯酚为原料参照上述流程信息合成呫吨酮():_______(其他无机试剂任选)。
10.化合物M 是合成医药替米沙坦的重要中间体,其合成路线如下:已知:i.ii.(1)B的含氧官能团名称有_______。
(2)C→D所需的试剂是_______。
(3)化合物E还可以由A按如下路线合成:①Y→Z的反应类型为_______。
①A→X的化学方程式为_______。
(4)写出结构简式:化合物N_______,M_______。
(5)化合物A的同分异构体H有多种①同时满足以下条件的有_______种。
i.既能发生水解反应,又能发生银镜反应ii.苯环上的一氯代物只有2种FeCl溶液发生显色反应iii.1mol H能与4mol NaOH反应,但不能与3①试写出一种能发生缩聚反应的H的结构简式_______。
11.活性亚甲基化合物和α,β-不饱和羰基化合物发生缩合生成-羰烷类化回答下列问题:(1)芳香化合物A的化学名称是_______。
(2)C中所含官能团的名称是_______。
(3)F的结构简式为_______,由F生成G的反应类型是_______。
(4)已知I的分子中:①含有三个六元环;①不含甲基;①含有两个羰基。
I的结构简式为____。
(5)芳香化合物X是C的同分异构体,可发生银镜反应,分子中有五种不同化学环境的氢。
写出两种符合上述条件的X的结构简式_______。
(6)H分子中有_______个手性碳(碳原子上连有4个不同的原子或基团时,该碳称为手性碳)。
如果要合成化合物H′()参照上述合成路线,写出相应的D′和G′的结构简式:_______、_______。
12.乙烯的产量可以用来衡量一个国家石油化工发展水平。
已知乙烯能发生如下转化:试回答下列问题。
(1)B、C、D的结构简式分别是:B_______C_______D_______。
(2)B、C、D中官能团名称分别是:B_______C_______D_______。
(3)反应①和①的反应类型分别是:①_______①_______。
(4)写出B与D反应生成乙酸乙酯的化学方程式:_______。
13.用于制造隐形眼镜的功能高分子材料E的合成路线如下:(1)A的结构式为___________。
(2)B→C的反应类型是___________。
(3)请写出D→E反应的化学方程式___________。