原电池与电解池比较(苍松参考)
- 格式:doc
- 大小:352.00 KB
- 文档页数:4


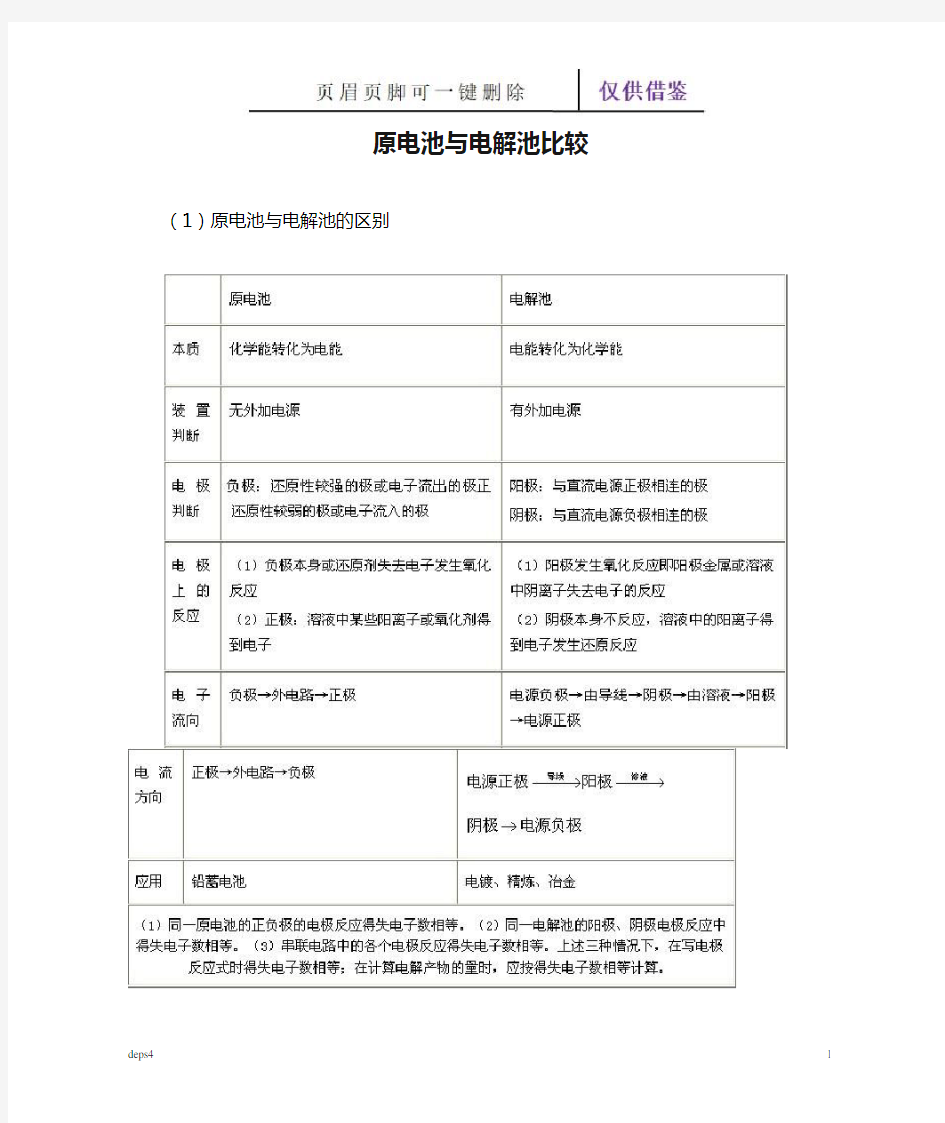
原电池与电解池比较
(1)原电池与电解池的区别
(2)可逆原电池的充电过程:可逆原电池的充电过程就是电解。
(3)电极名称:不管是原电池还是电解池,只要发生氧化反应的电极就是阳极,只要发生还原反应的就是阴极。
①原电池:
A.根据组成原电池两极的材料来判断电极。两极材料为活泼性不同的金属时,则活泼性相对较强的一极为负极,另一极为正极。
由一种金属和另一种非金属(除氢外)作电极时,金属为负极,非金属为正极。
B.根据原电池内两极上发生的反应类型或现象来判定电极。
原电池的负极一般为金属,并且负极总是发生氧化反应:
,故负极表现为渐渐溶解,质量减小。由此可判定,凡在原电池工作过程中发生氧化反应或质量减少的一极为负极;凡发生还原反应或有物质析出的一极为正极。注意:原电池的电极有两套称谓:负极又可称为阳极,正极又可称为阴极(不要把负极称为阴极;正极称为阳极)。其中正负极一套称谓是对外电路而言,在物理中常用,阴阳极一套称谓是对内电路而言。原电池也是作为电源向用电器提供电能的,所以一般都用外电路的电极名称,称为正负极而不称为阴阳极。
②电解池:
A.电解池是在外电源作用下工作的装置。电解池中与电源负极相连的一极为阴极,阳离子在该极接受电子被还原;与电源正极相连的一极为阳极,阴离子或电极本身(对电镀而言)在该极失去电子被氧化。
B.电解池(或电镀池)中,根据反应现象可推断出电极名称。凡发生氧化的一
极必为阳极,凡发生还原的一极必为阴极。例如用碳棒做两极电解溶液,析出Cu的一极必为阴极;放出的一极必为阳极
。
注意:电解池中,与外电源正极相连的为阳极,与负极相连的为阴极,这一点与原电池的负对阳,正对阴恰恰相反。
·电解池的电极常称阴阳极,不称正负极。
·电镀池是一种特殊的电解池,电极名称的判定同电解池。
4.电解过程中水溶液的pH变化
用铂或石墨等惰性电极电解某些物质的水溶液时,溶液的pH往往发生变化,其原因主要有两个方面。其一为电解时溶液的浓度发生变化,如果溶质是酸或碱,则它们浓度的改变使其pH也发生变化。其二为析出电解产物时,可能引起水的电离平衡移动,使或相对过剩。一般是自水溶液中析氢气时,消耗,使水的电离平衡向生成的方向移动,使浓度加大,pH上升。若是析出氧气时,
则因而消耗了,使水电离平衡向生成方向移动,而使
浓度加大,pH下降。这就是电解水溶液时所说的“析氢常伴碱,析氧常伴酸”。用惰性电极电解电解质溶液时的总结
常见的电解电极反应方程式总结
1.电解CuCl2溶液
阳极:2Cl- - 2e- == Cl2↑阴极:Cu2+ + 2e- == Cu
总反应式:
2.电解精炼铜
阳极(粗铜):Cu - 2e- == Cu2+ 阴极(纯铜) :Cu2+ + 2e- == Cu
总反应式:无
3.电镀铜
阳极(纯铜):Cu - 2e- == Cu2+ 阴极(待镀金属,如Fe):Cu2+ + 2e- == Cu
总反应式:无
4.电解饱和食盐水
阳极:2Cl- - 2e- == Cl2↑阴极:2H2O + 2e- == H2↑+ 2OH-
总反应式:
5.电解HCl溶液
阳极:2Cl- - 2e- == Cl2↑阴极:2H+ + 2e- == H2↑
总反应式:
6.电解NaOH溶液
阳极:4OH- - 4e- == O2↑+ 2H2O 阴极:4H2O + 4e- == 2H2↑+ 4OH-
总反应式:2H2O 2H2↑+ O2↑
7.电解H2SO4溶液
阳极:2H2O - 4e- == O2↑+ 4H+ 阴极:4H+ +4e- == 2H2↑
总反应式:
8.电解KNO3溶液
阳极:2H2O - 4e- == O2↑+ 4H+ 阴极:4H2O + 4e- == 2H2↑+ 4OH-
总反应式:
9.电解CuSO4溶液
阳极:2H2O - 4e- == O2↑+ 4H+ 阴极:2Cu2+ + 4e- == 2Cu ↓
总反应式:
10.电解AgNO3溶液
阳极:2H2O - 4e- == O2↑+ 4H+ 阴极:4Ag+ + 4e- == 4Ag ↓
总反应式: