植物抗坏血酸氧化酶及多酚氧化酶活性的测定
- 格式:doc
- 大小:34.00 KB
- 文档页数:2

实验一茶鲜叶多酚氧化酶的活性测定(3学时)一、目的要求1、通过实验,掌握茶叶多酚氧化酶活性的测定方法。
2、理解酶活性测定常规方法及一般原理。
二、基本原理茶叶多酚氧化酶是茶树体内最重要的酶类之一,它不仅在茶树生理代谢过程中起着重要作用,而且在茶叶加工,尤其在红茶制造过程中,催化多酚类物质的氧化也起着主导作用。
多酚氧化酶的活性检测方法,包括检压法、分光光度法、氧电极法和滴定法等。
多酚氧化酶是一种含铜的氧化酶,在一定的温度、pH 条件下,有氧存在时,能使催化邻苯二酚氧化生成有色物质,单位时间内有色物质在460nm处的吸光度与酶活性强弱成正相关,即可计算出多酚氧化酶的活力和比活性。
反应式如下:多酚氧化酶邻苯二酚(儿茶酚)+ 1 / 2 02 --------------------- > 邻醌 + H20三、仪器及试剂1、材料:茶树鲜叶。
2、仪器:72 1 型分光光度计;离心机;恒温水浴;研钵或匀浆机;试管;移液管;纱布袋等。
3、试剂:聚乙烯吡咯烷酮(PVP); 0.1M磷酸缓冲液(pH6.5);硫酸铵;1% 邻苯二酚溶液;0.1%脯氨酸溶液;6M 尿素溶液或20%三氯醋酸。
四、操作步骤1、粗酶液的制备:称取洗尽茶树鲜叶5.0g于研钵(或匀浆机)中,加入2g不溶性聚乙烯吡咯烷酮(事先用蒸馏水浸洗,然后过滤以除去杂质)和100ml 0.1M pH6.5 磷酸缓冲液,磨成匀浆,用几层纱布袋过滤,滤液加入30%饱和度硫酸铵,离心除沉淀,上清液再加硫酸铵使达60%饱和度,离心收集沉淀。
将所得沉淀溶于2~3ml 0.1M pH6.5磷酸缓冲液中,即为粗制酶液。
2、活性酶的测定:取酶液1ml于离心管中,加入3ml反应混合液(2.0ml 0.1M pH6.5 磷酸缓冲液,0.6ml 1%邻苯二酚溶液;0.4ml 0.1%脯氨酸溶液),在37C恒温水浴中保温10min,立即加入6M尿素溶液3ml或20%三氯醋酸1ml终止反应。

多酚氧化酶活性的测定-紫外分光光度法1 范围本非标方法规定了番茄酱、土豆、香蕉等易褐变食品中多酚氧化酶紫外测定方法。
本非标方法适用于番茄酱、土豆、香蕉等易褐变食品中多酚氧化酶活性的测定。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 6682 分析实验室用水规格和试验方法3 原理多酚氧化酶是一种含铜的氧化酶,在有氧的条件下,能使一元酚和二元酚氧化产生醌。
用紫外分光光度法在408nm波长下测其吸光度,即可计算出多酚氧化酶的活力,反应式如下:多酚氧化酶邻苯二酚(儿茶酚)+1∕2 O2→邻醌+ H2O4 试剂和材料除非另有规定,本方法所用试剂均为分析纯。
水为 GB/T 6682 规定的二级水或去离子水。
4.1 磷酸盐缓冲液[PH7.0]:0.2mol/LNaH2PO4:0.2mol/LNa2HPO4=39:61;0.2mol/L的NaH2PO4:准确称取NaH2PO4·2H2O 3.12g加重蒸水至100ml溶解;0.2mol/L的 Na2HPO4:准确称取Na2HPO4·12H2O 7.16g加重蒸水至100ml溶解。
4.2 邻苯二酚溶液[c=0.04mol/L]:准确称取0.44g邻苯二酚加重蒸水至100ml溶解。
5 仪器5.1 紫外分光光度计。
5.2 高速冷冻离心机,50ml离心管。
5.3 分析天平:感量0.0001g。
5.4 超声波清洗仪(可调温)。
6 试样的制备和保存6.1 试样的制备:ppo粗酶提取液番茄酱:取适量样品搅拌均匀,称取2g样品放入离心管里,加入10mL(固液比为20%)磷酸盐缓冲液(pH7.0),涡旋直至固液混合均匀。
土豆:新鲜土豆先用自来水、再用蒸馏水洗净,擦干,削去1cm厚果皮后,切块,放入打浆机中打成匀浆状,称取5g样品放入离心管中,加入8.23mL(固液比为60.6%)磷酸盐缓冲液(pH7.0),涡旋直至固液混合均匀。

植物生理学实验报告实验题目:过氧化物酶活性的测定姓名班级学号一、实验原理和目的原理:过氧化物酶广泛分布于植物的各个组织器官中。
在有过氧化氢存在下,过氧化物酶能使愈创木酚氧化生成醌类化合物,此化合物进一步缩合或与其它分子缩合,生成茶褐色物质,该化合物在470nm处有最大的吸收值,可用分光度计测量生成物的含量。
目的:学习测定植物组织中过氧化物酶活性的方法。
二、实验器具和步骤材料:女贞树叶器具:分光光度计、离心机、秒表、天平、研钵、磁力搅拌器试剂:0.1mo1/L过氧化氢;,0.1mo1/L磷酸缓冲液pH7.0;0.3%愈创木酚反应液:100 mmo1/L磷酸缓冲液(pH 7.0)100 ml于烧杯中,加入愈创木酚0.3ml ,于磁力搅拌器上加热搅拌,直至愈创木酚溶解。
步骤:1.称取植物材料约0.2g,加入,0.1mo1/L磷酸缓冲液(pH7.0) 6ml(分次加入[2ml,2ml,2ml],最后用于洗研钵),在研钵中研磨成匀浆,过滤或以8000r/min 离心15min,上清液为酶的提取液。
0.1mo1/L过氧化氢,最后加酶液200ul (视酶活性大小而定,如酶浓度高可稀释后再测定),摇匀,立即在分光光度计470nm下测吸光度,从加入酶液时立即开启秒表记录时间,1min读数一次(也可2min,视材料而定)。
3.以每分钟吸光度变化0.01为一个酶活力单位。
过氧化物酶活性(U)=△A470 ×三、实验数据和作业过氧化物酶活性(U)=△A470 ×=(0.133-0.124)*20/(0.2*2*0.01)=45四、数据分析△A470的值太小可能是由于叶片放置过久导致过氧化物酶活性丧失。
五、思考题1)过氧化物酶在植物体内的主要作用是什么?答:它与光合作用、呼吸作用及生长素的氧化等都有关系。
在植物生长发育过程中它的活性不断发生变化。
一般老化组织中活性较高,幼嫩组织中活性较弱。
这是因为过氧化物酶能使组织中所含的某些碳水化合物转化成木质素,增加木质化程度,而且发现早衰减产的水稻根系中过氧化物酶的活性增加,所以过氧化物酶可作为组织老化的一种生理指标。

实验七植物组织内过氧化物酶(POD)活性的测定
一、实验目的
掌握植物组织内过氧化物酶活性测定的原理和方法。
二、实验原理
过氧化物酶广泛存在于植物的各个组织器官中。
在有过氧化氢存在的条件下,过氧化物酶可以使愈创木酚氧化,产生茶褐色物质,在470nm处有最大吸收峰,可根据单位时间内A470的变化值,计算POD活性大小。
三、实验材料与设备
1.实验设备与仪器
电子天平、冰冻高速离心机、可见光分光光度计、电动玻璃匀浆剂等。
2.实验材料与试剂
20mM KH2PO4,
100mM PBS:取0.2M Na2HPO4,87.7ml与0.2MNaH2PO4,12.3ml混合。
反应液:取100mM PBS 50ml,加入愈创木酚28μl,搅拌溶解,待溶液冷却后加入30%的H2O219μl,混合均匀保存于冰箱中备用。
四、实验步骤
1.酶液制备
取1.0g植物叶片剪碎,置入玻璃匀浆杯中,加入预冷的20mM KH2PO45ml进行冰浴研磨提取。
匀浆液低温离心8500rpm 15min,上清液为酶粗提液,定容到50ml供测定。
2.酶活性测定
取光程为1cm的玻璃比色杯2只,一只加入反应液3ml,20mMKH2PO41ml作为调零管。
另一只加入反应液3ml,提取的酶液1ml,立即开始计时,在470nm波长处进行比色,开始记录数据,然后每隔一分钟记录一次吸光度值,共测3min。
3.计算
以每分钟A470的化变值0.01为一个相对酶活单位,计算植物组织内过氧化物酶酶活力的大小(单位:U/g鲜重)。

不同单株大叶女贞对冬季低温的生理响应近年来,由于全球气候多变,极端天气频发,温带气候区的木本植物在自然周年生长过程中经常遭受环境低温胁迫的威胁[1-2],甚至出现因冷害导致植物死亡的现象。
低温伤害每年都给全世界农林生产造成巨大损失。
研究表明,植物受低温冷害时,体内的细胞膜透性、渗透调节系统及代谢过程等一系列生理过程都会发生显著的变化[4- 5]。
5种酢浆草属植物经过自然低温处理,结合形态特征观测,测定相对电导率、丙二醛含量、可溶性蛋白含量等指标,评价其抗寒性,结果表明在自然低温处理下,5种植物的生理生化指标变化趋势基本一致,与自然低温处理下的观测结果一致。
王娜等研究八角金盘、夹竹桃、阔叶十大功劳、樟叶槭4种常绿植物的抗寒性表明,在低温下植物体的可溶性糖含量、游离脯氨酸含量、过氧化物酶活性和相对电导率整体呈上升趋势。
也有研究表明,低温可以诱导黄瓜幼苗叶片中苯丙氨酸解氨酶的基因表达。
叶片中相对电解质渗漏率和丙二醛含量显著升高,提高了胞内抗氧化酶(过氧化氢酶、抗坏血酸过氧化物酶)活性,可有效地清除活性氧分子,维持抗氧化物质抗坏血酸(AsA)氧化还原状态,缓解低温引起的光损伤和氧化损伤。
大叶女贞(Ligustrun lucidum)别称蜡树,又名女贞、高杆女贞、冬青等,为木樨科女贞属常绿阔叶乔木,原产亚热带地区。
中国栽培以长江以南及西南地区为主,甘肃南部与华北南部少有栽培;其叶片光洁亮绿,经冬不落,是南方园林绿化中的主要树种之一。
随着中国北方城市园林绿化的发展,大叶女贞已引种到北京、上海、青岛等地。
然而我国绝大部分北方地区冬季寒冷,大叶女贞常表现较严重的冻害,影响其观赏价值和经济价值。
选育出适合北方发展优良抗寒品种,安全越冬已成为推广大叶女贞在北方地区生产栽培发展中的重要制约因素。
本试验通过对青岛农业大学校园内栽植的大叶女贞冬季受冻情况进行全面调查并分级,初选出部分优良抗寒单株。
而表型选择通常会受到环境因子的影响,为确定初选的耐寒植株、正常植株及受冻严重的植株之间在生理水平上是否有差异,笔者通过不同抗寒性植株枝条水分含量以及防御性酶活性的变化,进一步在生理水平上对筛选出的耐寒植株进行评定,以期为培育大叶女贞优良抗寒品系提供科学依据。


某农业大学《植物生理学》课程试卷(含答案)__________学年第___学期考试类型:(闭卷)考试考试时间:90 分钟年级专业_____________学号_____________ 姓名_____________1、判断题(10分,每题5分)1. 蛋白质的可逆磷酸化是生物体内一种普遍的翻译后修饰方式。
()[扬州大学2019研]答案:正确解析:蛋白质磷酸化是指由蛋白质激酶催化的把ATP的磷酸基转移到底物蛋白质氨基酸残基(丝氨酸、苏氨酸、酪氨酸)上的过程,或者在信号作用下结合GTP,是生物体内一种普通的调节方式,在细胞信号转导的过程中起重要作用。
蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍,也是最重要的机制。
2. 高等植物如果较长时间进行无氧呼吸,由于底物的过度消耗,能量供应不足,加上有毒物质的积累,因而对植物是不利的。
()[扬州大学2019研]答案:正确解析:高等植物如果较长时间进行无氧呼吸,产生的能量不足且可能会造成酒精中毒。
2、名词解释(55分,每题5分)1. 临界日长答案:临界日长是指昼夜周期中,引起长日植物成花的最短日照长度或引起短日植物成花的最长日照长度。
解析:空2. 长日植物[沈阳农业大学2019研]答案:长日照植物是指在一定的发育时期内,每天的光照时间只有大于某一时数(临界日长),并经过一定的天数才能开花的植物。
例如大麦、小麦、菠菜、向日葵等。
这类植物生长在小于临界日长的光照下,就会保持营养生长状态。
用人工方法延长光照时间,可提早开花。
解析:空3. enzymelinked receptor答案:enzymelinked receptor的中文名称是酶联受体,是指与酶连接的细胞表面受体,又称催化性受体,目前已知的酶联受体都是跨膜蛋白,当胞外信号(配体)与受体结合即激活受体胞内段的酶活性。
其类型主要包括:①受体酪氨酸激酶;②受体酪氨酸磷酸酯酶;③受体丝氨酸苏氨酸激酶;④酪氨酸蛋白激酶偶联的受体;⑤受体鸟苷酸环化酶。


班级:11级生科2班组员:XX XXX题目:过氧化物酶活性的测定过氧化物酶(P O D)在植物体内普遍存在,是活性较高的一种酶,与植物代谢作用和抗逆性等都有一定关系。
其主要生理功能:1.参与活性氧代谢过程2.参与木质素和木栓质的合成3.参与生长素的降解【实验原理】在过氧化物酶(P O D)催化下,H2O2将愈创木酚氧化成茶褐色产物。
此产物在470n m处有最大光吸收值,故可通过测470n m下的吸光度变化测定过氧化物酶的活性。
【材料、设备与试剂】1.材料:植物叶片或其它任何植物材料。
2.仪器设备:分光光度计;低速冷冻离心机(配套的离心管);恒温水浴锅;微波炉;研钵;容量瓶;移液管;试管;洗耳球等。
3.试剂及配制:0.2 m o l·L-1磷酸缓冲液(p H6)反应液(100 m l 0.2 m o l·L-1磷酸缓冲液中加入0.5 m l愈创木酚、1m l30%H2O2,充分摇匀。
最好在使用前配制。
)【方法与步骤】1.酶液提取:称取植物叶片0.2g,剪碎置于已冷冻过的研钵中,加入少量石英砂,分两次加入总量为5m l p H6磷酸缓冲液,研磨成匀浆后,倒入离心管中,在4000 r/m i n 离心15 m i n,上清液即为粗酶提取液,倒入小试管低温下放置备用。
2.酶活性测定:吸取反应液3m l于试管中,加入酶提取液0.1m l,迅速摇匀后倒入光径1c m的比色杯中,以未加酶液之反应液为空白对照,在470n m波长处,测定O D值。
每隔1m i n记录1次吸光值,共记录5次。
3.结果计算:按下式计算酶的相对活性。
取相对稳定的每分钟吸光度变化值(ΔA 470),代入下式计算出过氧化物酶的活性,即用每m i n内O D变化0.01为1个过氧化物酶活力单位(U)表示。
酶活性(U·g-1·m i n-1)=(△A470×V t)/W×V s×0.01×t式中:ΔA470——反应时间内吸光度的变化值。
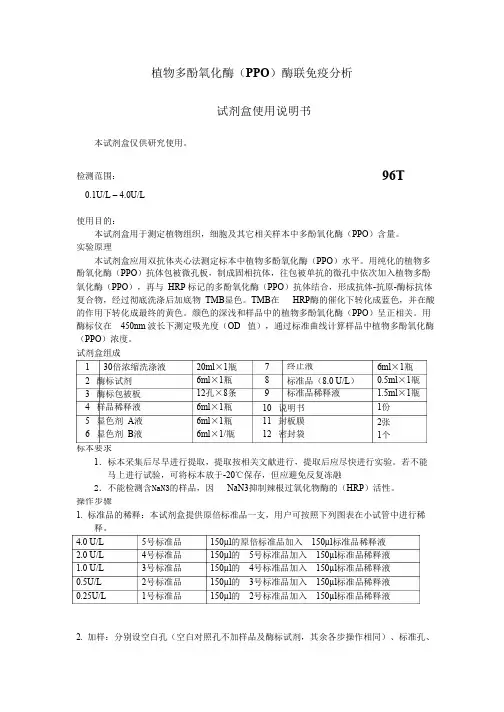
植物多酚氧化酶(PPO)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:96T0.1U/L – 4.0U/L使用目的:本试剂盒用于测定植物组织,细胞及其它相关样本中多酚氧化酶(PPO)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中植物多酚氧化酶(PPO)水平。
用纯化的植物多酚氧化酶(PPO)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入植物多酚氧化酶(PPO),再与HRP 标记的多酚氧化酶(PPO)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的植物多酚氧化酶(PPO)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中植物多酚氧化酶(PPO)浓度。
试剂盒组成1 30倍浓缩洗涤液20ml×1瓶6ml×1瓶12孔×8条6ml×1瓶6ml×1瓶6ml×1/瓶789终止液6ml×1瓶0.5ml×1瓶1.5ml×1瓶1份2 酶标试剂标准品(8.0 U/L)标准品稀释液3 酶标包被板4 样品稀释液5 显色剂A液6 显色剂B液10 说明书11 封板膜12 密封袋2张1个标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
4.0 U/L 2.0 U/L 1.0 U/L 0.5U/L 0.25U/L 5号标准品4号标准品3号标准品2号标准品1号标准品150µl的原倍标准品加入150µl标准品稀释液150µl的5号标准品加入150µl标准品稀释液150µl的4号标准品加入150µl标准品稀释液150µl的3号标准品加入150µl标准品稀释液150µl的2号标准品加入150µl标准品稀释液2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
实验四植物组织中过氧化物酶活性的测定一、实验目的:1、学习测定植物组织中过氧化物酶活性的方法。
二、实验原理:过氧化物酶(POD)广泛存在于植物体中,该酶催化H2O2氧化,以清除H2O2对细胞生物功能分子的破坏作用。
在有H2O2存在的条件下,过氧化物酶使愈创木酚氧化,生成茶褐色物质,可用分光光度计测定470nm处茶褐色物质的生成量以检测POD活性。
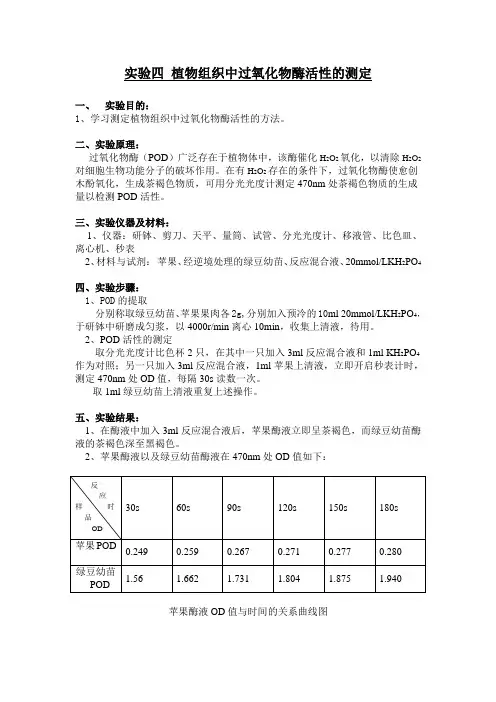
三、实验仪器及材料:1、仪器:研钵、剪刀、天平、量筒、试管、分光光度计、移液管、比色皿、离心机、秒表2、材料与试剂:苹果、经逆境处理的绿豆幼苗、反应混合液、20mmol/LKH2PO4四、实验步骤:1、POD的提取分别称取绿豆幼苗、苹果果肉各2g,分别加入预冷的10ml 20mmol/LKH2PO4,于研钵中研磨成匀浆,以4000r/min离心10min,收集上清液,待用。
2、POD活性的测定取分光光度计比色杯2只,在其中一只加入3ml反应混合液和1ml KH2PO4作为对照;另一只加入3ml反应混合液,1ml苹果上清液,立即开启秒表计时,测定470nm处OD值,每隔30s读数一次。
取1ml绿豆幼苗上清液重复上述操作。
五、实验结果:1、在酶液中加入3ml反应混合液后,苹果酶液立即呈茶褐色,而绿豆幼苗酶液的茶褐色深至黑褐色。
2、苹果酶液以及绿豆幼苗酶液在470nm处OD值如下:苹果酶液OD值与时间的关系曲线图以每分钟光密度(OD470nm)变化0.01为一个过氧化物酶活力单位,即:苹果POD活性=[ΔOD470/(0.01×wt)] ×D=[(0.28-0.249)/(0.01×3×2)] ×D=0.52D(此值忽略稀释倍数)其中w为样品鲜重,t为反应时间,D为稀释倍数绿豆幼苗酶液OD值与时间的关系曲线图绿豆幼苗POD活性=[ΔOD470/(0.01×wt)] ×D=[(0.940-1.56)/(0.01×3·2)] ×D =6.3 D(此值忽略与苹果酶液相同的稀释倍数)由于绿豆幼苗酶液浓度较大,测OD值前稀释了两倍,所以绿豆幼苗酶液POD 活性为12.67D六、结果分析:1、由苹果酶液OD值与时间的关系曲线图中,OD值与时间的关系基本呈线性关系,故任取变化较均匀的一段数据均可计算出POD活性。
苯丙氨酸氨裂解酶(PAL)是苯酚合成途径中的关键酶,作为植物活性素的酚类物质的积累被认为是植物对许多生物和非生物胁迫的主要诱导反应。
多酚氧化酶(PPO)催化酚类化合物的氧化,在水果和蔬菜的切割或受损表面上产生棕色颜料,并可能导致重大经济损失过氧化物酶(POD)是过氧化物酶体的标志酶,是其一类氧化还原酶,它们能催化很多反应。
过氧化物酶是以过氧化氢为电子受体催化底物氧化的酶。
主要存在于载体的过氧化物酶体中,以铁卟啉为辅基,可催化过氧化氢,氧化酚类和胺类化合物和烃类氧化产物,具有消除过氧化氢和酚类、胺类、醛类、苯类毒性的双重作用。
谷胱甘肽还原酶(GR)是人体氧化还原体系中最为重要的酶之一,是维持细胞中还原型谷胱甘肽(GSH)含量的主要黄素酶。
在NADPH参与下,氧化型谷胱甘肽转化为还原型谷胱甘肽,后者在防止血红蛋白的氧化分解、维持巯基蛋白的活性、保证巯基蛋白的还原性及细胞的完整性具有重要的作用。
超氧化物歧化酶(SOD)是生物体内存在的一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用,与很多疾病的发生、发展密不可分。
过氧化氢酶(CAT),是催化过氧化氢分解成氧和水的酶,存在于细胞的过氧化物酶体内。
过氧化氢酶是过氧化物酶体的标志酶,约占过氧化物酶体酶总量的40%。
过氧化氢酶存在于所有已知的动物的各个组织中,特别在肝脏中以高浓度存在。
过氧化氢酶在食品工业中被用于除去用于制造奶酪的牛奶中的过氧化氢。
过氧化氢酶也被用于食品包装,防止食物被氧化。
维生素C(Vc 抗坏血酸),又称维他命C,是一种多羟基化合物,化学式为C6H8O6。
结构类似葡萄糖,其分子中第2及第3位上两个相邻的烯醇式羟基极易解离而释出H+,故具有酸的性质,又称L-抗坏血酸。
维生素C具有很强的还原性,很容易被氧化成脱氢维生素C,但其反应是可逆的,并且抗坏血酸和脱氢抗坏血酸具有同样的生理功能,但脱氢抗坏血酸若进一步水解,生成二酮古乐糖酸,则反应不可逆而完全失去生理效能。
抗坏血酸过氧化物酶活性测定试剂盒使用说明分光光度法货号:BC0220规格:50管/48样产品内容:试剂一:液体×1瓶,4℃保存;试剂二:粉剂×1瓶,4℃保存。
临用前加入5ml 双蒸水充分溶解;试剂三:液体×1支,4℃保存。
产品说明:APX 是植物清除活性氧的重要抗氧化酶之一,也是抗坏血酸代谢的关键酶之一。
APX 具有多种同功酶,分别定位于叶绿体、胞质、线粒体、过氧化物和乙醛酸体,以及过氧化体和类囊体膜上。
APX 催化H 2O 2氧化AsA,是植物AsA 的主要消耗者。
APX 的活性直接影响到AsA 的含量,在胁迫和解胁迫条件下,APX 与AsA 具有一定的负相关性。
APX 催化H 2O 2氧化AsA,通过测定AsA 的氧化速率,可计算得APX 活力。
试验中所需的仪器和试剂:低温离心机、紫外分光光度计、1ml 石英比色皿、移液枪、研钵、冰和蒸馏水。
操作步骤:一、粗酶液提取:按照组织质量(g):试剂一体积(ml)为1:5~10的比例(建议称取约0.1g 组织,加入1ml 试剂一)进行冰浴匀浆。
13000g,4℃离心20min,取上清置冰上待测。
二、测定操作表:1.分光光度计预热30min 以上,调节波长到290nm,用蒸馏水调零。
2.试剂一在25℃中预热30min以上。
3.测定管:依次在1ml石英比色皿中加入100μl上清液、700μl预热的试剂一、100μl试剂二和100μl试剂三,迅速混匀后在290nm测定10s和130s光吸收A2和A1,△A=A2-A1。
APX活力计算:(1)按样本蛋白浓度计算活性单位定义:每毫克蛋白每分钟氧化1μmol AsA为1U。
APX(μmol/min/mg prot)=△A÷(ε×d)×V反总×106÷(Cpr×V样)÷T=1.79×△A÷Cpr(2)按样本质量计算单位的定义:每g组织每分钟氧化1μmol AsA为1U。
抗氧化酶(SOD、POD、CAT)活性测定方法抗氧化酶(SOD、POD、CAT)活性测定方法一、超氧化物歧化酶(SOD)活性测定(氮蓝四唑光化还原法)1、试剂的配制(1)0.05mol/L磷酸缓冲液(PBS,pH7.8):A母液:0.2mol/L磷酸氢二钠溶液: 取Na2HPO4·12H2O(分子量358.14)71.7g;B母液:0.2mol/L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量156.01)31.2g。
分别用蒸馏水定容到1000ml。
0.05mol/L PBS(pH7.8)的配制:分别取A母液(Na2HPO4) 228.75ml,B母液(NaH2PO4) 21.25ml,用蒸馏水定容至1000ml。
加入10gPVP(聚乙烯吡咯烷酮)参考文献:李合生主编:植物生理生化实验原理和技术.高等教育出版社,2000:267~268。
(2)130mmol/L甲硫氨酸溶液:取1.399g Met用磷酸缓冲液(pH7.8)定容至100ml。
网上说定容到100ML我也不懂。
拜托(3)100μmol/L EDTA-Na2溶液:取0.03721g EDTA-Na2用磷酸缓冲液定容至1000ml;(4)100μM核黄素溶液:取0.0075g核黄素用蒸馏水定容至100ml,避光保存,随用随配,并稀释10倍(5)750μmol/L氮蓝四唑(NBT)溶液:称取0.06133g NBT用磷酸缓冲液定容至100ml 避光保存;酶液制备:取一定部位的植物叶片(视需要定,去叶脉)0.5g于预冷的研钵中,加2ml 磷酸缓冲液在冰浴下研磨成浆,加缓冲液使终体积为10ml。
取5ml于10000r/min下离心10min,上清液即为SOD粗提液。
提取酶液时如何保存;如果没有测完的需要放在4℃的冰箱里。
2、酶活性测定2.显色反应取试管(要求透明度好)5支,3支为样品测定管,1支为对照管,另外1支作为空白,按表39-1加入各溶液。
植物抗坏血酸氧化酶及多酚氧化酶活性的测定
作者:《果蔬贮藏加工学实
验指导》
来源:华南农大 浏览数:2949 录入:2007-6-16 14:53:40
植物抗坏血酸氧化酶及多酚氧化酶活性的测定
一、原理
抗坏血酸氧化酶能利用空气中的氧氧化抗坏血酸成为脱氢抗坏血酸; 多酚
氧化酶可催化
空气中的氧氧化多酚,成为相应的醌,形成的醌能被抗坏血酸还原。
因此, 在酶提取液中加入抗坏血酸,可测定抗坏血酸氧化酶的活性,加入
抗坏血酸及焦
儿茶酚, 可测定抗坏血酸及多酚氧化酶两者的活性,相减即可求出多酚氧化酶
的活性。抗坏
血酸的消耗量, 可用碘液滴定剩余的抗坏血酸。碘酸钾在酸性条件下与碘化钾
反应放出碘,
放出的碘与抗坏血酸作用,将之氧化成脱氢抗坏血酸,多余的碘能使淀粉变为蓝
色。
二、材料与设备
材料:马铃薯块茎
设备:水浴锅、台秤、离心机
试剂:pH6.0 1/15mol/L磷酸缓冲液、0.1%抗坏血酸、0.02mol/L焦儿茶酚、
10%三氯乙
酸、1%淀粉。
0.05mol/L碘液: 碘化钾2.5g溶于200ml蒸馏水, 加冰醋酸1ml, 再加
0.1mol/L碘酸钾
12.5ml,定容至250ml。
三、试验步骤
(一) 酶液制备:
称取马铃薯块茎10.0g, 用预冷pH6.0 1/15mol/L磷酸缓冲液,研磨匀浆,
定容至50ml,
在18-20℃水浴浸提30分钟,中间摇动数次,再于3000×g离心10分钟,取上
清液,4℃保存备
用。
(二) 酶活性测定:
1. 取6个三角瓶(50-100ml),标上号码,分别加入下列试剂(ml):
┌──┬────┬───────┬─────────┬──┬────
─┐
│瓶号│ 蒸馏水 │0.1%抗坏血酸 │0.02mol/L焦儿茶酚 │ 酶 │煮5分
钟酶 │
├──┼────┼───────┼─────────┼──┼────
─┤
│ 1 │ 4 │ 2 │ │ 2 │
│
│ 1' │ 4 │ 2 │ │ 2 │
│
│ 2 │ 4 │ 2 │ │ │ 2
│
│ 3 │ 3 │ 2 │ 1 │ 2 │
│
│ 3' │ 3 │ 2 │ 1 │ 2 │
│
│ 4 │ 3 │ 2 │ 1 │ │ 2
│
└──┴────┴───────┴─────────┴──┴────
─┘
1、3瓶各作一次重复,2、4瓶作空白
将6个三角瓶放入18-20℃水浴反应5分钟,立即分别加入10%三氯乙酸
1ml,摇匀,终止酶
反应。
2. 滴定
冷却后, 分别加入3滴1%淀粉(马铃薯可不加,因其本身含的淀粉已足
够),用碘液滴
定至蓝色。
3. 计算
A. 抗坏血酸氧化酶活性=[2号瓶滴定毫升数-1号瓶滴定毫升数]×K
B. 多酚氧化酶活性=[(4号瓶滴定毫升数-3号瓶滴定毫升数)×K]-A
酶提取液总量(ml)×0.44
K= ---------------------------------------------
测定时酶液用量(ml)×样品重(g)×测定时间(min)
0.44为每毫升0.005mol/L碘液氧化抗坏血酸的毫克数, 两种酶的活性单
位均用每克干重
每分钟氧化抗坏血酸的毫克数来表示。