影响化学平衡移动的因素及图像
- 格式:ppt
- 大小:339.00 KB
- 文档页数:35

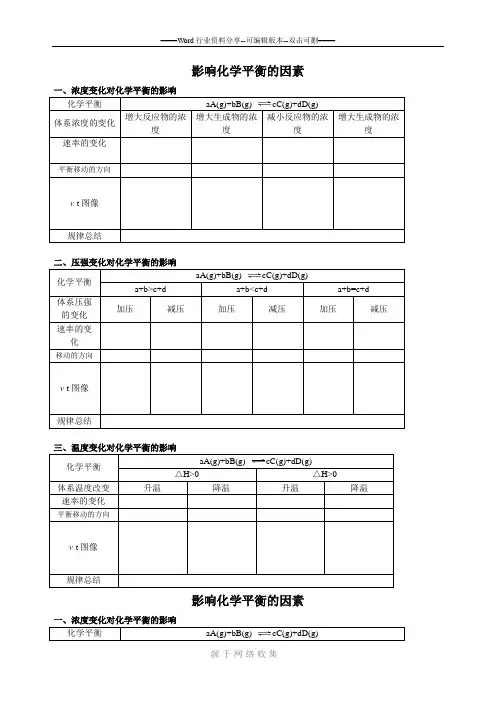
影响化学平衡的因素一、浓度变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)体系浓度的变化增大反应物的浓度增大生成物的浓度减小反应物的浓度增大生成物的浓度速率的变化平衡移动的方向v-t图像规律总结二、压强变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)a+b>c+d a+b<c+d a+b=c+d体系压强的变化加压减压加压减压加压减压速率的变化移动的方向v-t图像规律总结三、温度变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)△H>0 △H>0体系温度改变升温降温升温降温速率的变化平衡移动的方向v-t图像规律总结影响化学平衡的因素化学平衡aA(g)+bB(g)cC(g)+dD(g)体系浓度的变化增大反应物的浓度增大生成物的浓度减小反应物的浓度增大生成物的浓度速率的变化平衡移动的方向v-t图像规律总结二、压强变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)a+b>c+d a+b<c+d a+b=c+d体系压强的变化加压减压加压减压加压减压速率的变化移动的方向v-t图像规律总结化学平衡aA(g)+bB(g)cC(g)+dD(g)△H>0 △H>0体系温度改变升温降温升温降温速率的变化平衡移动的方向v-t图像规律总结。

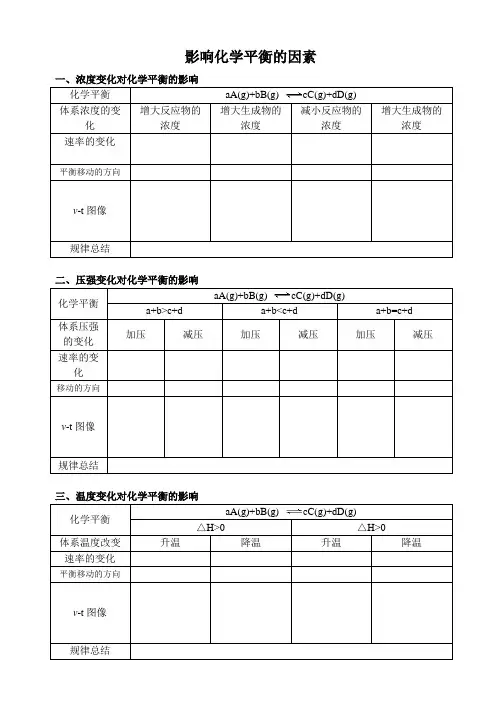
一、浓度变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)体系浓度的变化增大反应物的浓度增大生成物的浓度减小反应物的浓度增大生成物的浓度速率的变化平衡移动的方向v-t图像规律总结二、压强变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)a+b>c+d a+b<c+d a+b=c+d体系压强的变化加压减压加压减压加压减压速率的变化移动的方向v-t图像规律总结化学平衡aA(g)+bB(g)cC(g)+dD(g)△H>0 △H>0体系温度改变升温降温升温降温速率的变化平衡移动的方向v-t图像一、浓度变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)体系浓度的变化增大反应物的浓度增大生成物的浓度减小反应物的浓度增大生成物的浓度速率的变化平衡移动的方向v-t图像规律总结二、压强变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)a+b>c+d a+b<c+d a+b=c+d体系压强的变化加压减压加压减压加压减压速率的变化移动的方向v-t图像规律总结化学平衡aA(g)+bB(g)cC(g)+dD(g)△H>0 △H>0体系温度改变升温降温升温降温速率的变化平衡移动的方向v-t图像。


第三节影响化学平衡移动的因素及图像问题(一)【考纲解读】1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,认识其一般规律。
2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
3.了解等效平衡思想,能够运用于解题。
【复习过程】一、化学平衡移动1.概念2.过程3.平衡移动方向与反应速率的关系(1)v正____v逆,平衡向正反应方向移动。
(2)v正____v逆,平衡不移动。
(3)v正____v逆,平衡向逆反应方向移动。
二、影响化学平衡移动的条件1.影响化学平衡的外界因素若其他条件不变,改变下列条件对平衡的影响如下:条件的改变(其他条件不变) 化学平衡的移动浓度增大反应物浓度或减小生成物浓度向______方向移动减小反应物浓度或增大生成物浓度向______方向移动压强(对有气体存在的反应) 反应前后气体分子数改变增大压强向______________的方向移动减小压强向______________的方向移动反应前后气体分子数不变改变压强温度升高温度向____反应方向移动降低温度向____反应方向移动催化剂使用催化剂2.勒夏特列原理如果改变影响化学平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够____________的方向移动。
注意:该原理适用于化学平衡、电离平衡、溶解平衡、水解平衡等动态平衡。
【例1】恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是( ) A. a>b+c B. a<b+c C. a=b+c D. a=b=c【变式练习1】(2010重庆高考)COCl2(g) CO(g)+Cl2(g)ΔH>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒通入惰性气体,能提高COCl2转化率的是()A.①②④B.①④⑥C.②③⑥D.③⑤⑥【变式练习2】将NO2装入带活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是( )A.升高温度,气体颜色加深,则此反应为吸热反应B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅【变式练习3】下列事实不能用勒夏特列原理解释的是()①氯化铁溶液加热蒸干最终得不到氯化铁固体②铁在潮湿的空气中容易生锈③实验室可用排饱和食盐水的方法收集氯气④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)K(g)+NaCl(l)⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深A.①②③B.②⑥C.①③④⑤D.②⑤⑥三、图像问题1.以物质的量(浓度)-时间(n(c)-t)图像【例2】右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:(1)该反应的反应物是;(2)反应物的转化率是;(3)该反应的化学方程式为.2.以速率----时间图(v-t图像)【例3】已知合成氨的反应为:N2+3H22NH3+92.4KJ在一定条件下达到化学平衡,现升高温度使平衡发生移动,下列图像中能正确描述正、逆反应速率(v)变化的是()【变式练习4】对于达到平衡的可逆反应:X+Y W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )A.Z、W为气体,X、Y中之一为气体B.Z、W中之一为气体,X、Y为非气体C.X、Y、Z皆为气体,W为非气体D.X、Y为气体,Z、W中至少有一种为气体【课后反思】第三节化学平衡移动的图像问题(二)1.以物质的量(浓度)-时间(n(c)-t)图像2.以速率----时间图(v-t图像)3.含量—时间—温度(压强)图【例4】在密闭容器中进行如下反应:H2(g) +I2(g)2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是()A.T1>T2,ΔH>0B.T1>T2,ΔH<0C.T1<T2,ΔH>0D.T1<T2,ΔH<0【变式练习5】在温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是()A、P1>P2,n<3B、P1<P2,n=3C、P1<P2,n>3D、P1>P2,n>3【变式练习6】反应2X(g)+Y(g)2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n z)与反应时间(t)的关系如图所示.下列判断正确的是()A.T1<T2, P1<P2 C.T1>T2,P1>P2B.T1<T2,P1>P2 D.T1>T2,P1<P24.恒压(温)线【例5】、对于反应mA(g)+nB(g) pC(g)+gD(g);△H,改变反应条件时,A的转化率变化情况如图所示,符合题意的是()A、m+n=p+g;H∆<0∆<0 B、m+n<p+g;HC、m+n<p+g;H∆>0∆>0 D、m+n>p+g;H【变式练习7】在可逆反应A2(g)+2B2(g) 2AB2(g)(正反应为放热反应)趋向平衡时,图中符合勒夏特列原理的是()5.其它图像【例6】对于mA(固)+nB(气)pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是()A.m+n<p B.x点的状态是v正>v逆C.n>p D.x点比y点的反应速度慢课堂巩固练习1.如图(Ⅰ)表示反应:mA(g)+nB(g) pC(g)+qD(g);△H。



高中化学平衡移动知识点总结化学是一门基础的自然科学。
在学习过程中,学生普遍感到化学“一听就懂,一学就会,一做就错”。
究其原因关键在于基本功不扎实。
化学知识点多而零碎,学习过程中若不能融会贯通,尤其是一些“特殊”之处,往往致使解题陷人“山重水复”之境。
为了理解、巩固和掌握这些知识,消除盲点。
今天给同学们准备了化学平衡相关知识点的总结,看完大家要多多记笔记,以后慢慢消化哦~一、化学平衡的移动01化学平衡的移动(1)定义达到平衡状态的反应体系,条件改变,引起平衡状态被破坏的过程。
(2)化学平衡移动的过程02影响化学平衡移动的因素(1)温度:在其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。
(2)浓度:在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
(3)压强:对于反应前后总体积发生变化的化学反应,在其他条件不变的情况下,增大压强,化学平衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动。
(4)催化剂:由于催化剂能同时同等程度地增大或减小正反应速率和逆反应速率,故其对化学平衡的移动无影响。
03勒夏特列原理在密闭体系中,如果改变影响化学平衡的一个条件(如温度、压强或浓度等),平衡就向能够减弱这种改变的方向移动。
二、外界条件对化学平衡移动的影响01外界条件的变化对速率的影响和平衡移动方向的判断在一定条件下,浓度、压强、温度、催化剂等外界因素会影响可逆反应的速率,但平衡不一定发生移动,只有当v正≠v逆时,平衡才会发生移动。
对于反应mA(g)+nB(g)pC(g)+qD(g),分析如下:02浓度、压强和温度对平衡移动影响的几种特殊情况(1)改变固体或纯液体的量,对平衡无影响。
(2)当反应混合物中不存在气态物质时,压强的改变对平衡无影响。
(3)对于反应前后气体体积无变化的反应,如H2(g)+I2(g)2HI(g),压强的改变对平衡无影响。

影响化学平衡移动的因素及图像问题第三节影响化学平衡移动的因素及图像问题(⼀)【考纲解读】1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,认识其⼀般规律。
2.了解化学平衡的调控在⽣活、⽣产和科学研究领域中的重要作⽤。
3.了解等效平衡思想,能够运⽤于解题。
【复习过程】⼀、化学平衡移动1.概念2.过程3.平衡移动⽅向与反应速率的关系(1)v正____v逆,平衡向正反应⽅向移动。
(2)v正____v逆,平衡不移动。
(3)v正____v逆,平衡向逆反应⽅向移动。
⼆、影响化学平衡移动的条件1.影响化学平衡的外界因素2.勒夏特列原理如果改变影响化学平衡的条件之⼀(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够____________的⽅向移动。
注意:该原理适⽤于化学平衡、电离平衡、溶解平衡、⽔解平衡等动态平衡。
【例1】恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的⼀半且达到新平衡时, X的物质的量浓度由0.1mol/L增⼤到0.19mol/L, 下列判断正确的是( )A. a>b+cB. a<b+cC. a=b+cD. a=b=c【变式练习1】(2010重庆⾼考)COCl2(g) CO(g)+Cl2(g)ΔH>0,当反应达到平衡时,下列措施①升温②恒容通⼊惰性⽓体③增加CO的浓度④减压⑤加催化剂⑥恒通⼊惰性⽓体,能提⾼COCl2转化率的是()A.①②④B.①④⑥C.②③⑥D.③⑤⑥【变式练习2】将NO2装⼊带活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变下列⼀个条件,其中叙述正确的是( )A.升⾼温度,⽓体颜⾊加深,则此反应为吸热反应B.慢慢压缩⽓体体积,平衡向右移动,混合⽓体颜⾊变浅C.慢慢压缩⽓体体积,若体积减⼩⼀半,压强增⼤,但⼩于原来的两倍D.恒温恒容时,充⼊惰性⽓体,压强增⼤,平衡向右移动,混合⽓体的颜⾊变浅【变式练习3】下列事实不能⽤勒夏特列原理解释的是()①氯化铁溶液加热蒸⼲最终得不到氯化铁固体②铁在潮湿的空⽓中容易⽣锈③实验室可⽤排饱和⾷盐⽔的⽅法收集氯⽓④常温下,将1 mL pH=3的醋酸加⽔稀释⾄100 mL,测得其pH<5⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)K(g)+NaCl(l)⑥⼆氧化氮与四氧化⼆氮的平衡体系,加压后颜⾊加深A.①②③B.②⑥C.①③④⑤D.②⑤⑥三、图像问题1.以物质的量(浓度)-时间(n(c)-t)图像【例2】右图表⽰800℃时A、B、C三种⽓体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:(1)该反应的反应物是;(2)反应物的转化率是;(3)该反应的化学⽅程式为.2.以速率----时间图(v-t图像)【例3】已知合成氨的反应为:N2+3H22NH3+92.4KJ在⼀定条件下达到化学平衡,现升⾼温度使平衡发⽣移动,下列图像中能正确描述正、逆反应速率(v)变化的是()【变式练习4】对于达到平衡的可逆反应:X+Y W+Z,增⼤压强则正、逆反应速率(v)的变化如图所⽰,分析可知X、Y、Z、W 的聚集状态可能是( )A.Z、W为⽓体,X、Y中之⼀为⽓体B.Z、W中之⼀为⽓体,X、Y为⾮⽓体C.X、Y、Z皆为⽓体,W为⾮⽓体D.X、Y为⽓体,Z、W中⾄少有⼀种为⽓体【课后反思】第三节化学平衡移动的图像问题(⼆)1.以物质的量(浓度)-时间(n(c)-t)图像2.以速率----时间图(v-t图像)3.含量—时间—温度(压强)图【例4】在密闭容器中进⾏如下反应:H2(g) +I2(g)2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所⽰.符合图⽰的正确判断是()A.T1>T2,ΔH>0B.T1>T2,ΔH<0C.T1<T2,ΔH>0D.T1<T2,ΔH<0【变式练习5】在温度⼀定时,压强分别为P1,P2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的分数与时间t,压强P 1,P2的关系如图所⽰,则下列结论正确的是()A、P1>P2,n<3B、P1<P2,n=3C、P1<P2,n>3D、P1>P2,n>3【变式练习6】反应2X(g)+Y(g)2Z(g),在不同温度(T和T2)及压强(P1和P2)下,产物Z的物质的量(n z)与反应时间(t)的关系如图所⽰.下列判断正确的是()A.T1T2,P1>P2B.T1P2 D.T1>T2,P14.恒压(温)线【例5】、对于反应mA(g)+nB(g) pC(g)+gD(g);△H,改变反应条件时,A的转化率变化情况如图所⽰,符合题意的是()A、m+n=p+g;H<0<0 B、m+n<p+g;HC、m+n<p+g;H>0>0 D、m+n>p+g;H(g)+2B2(g) 2AB2(g)(正反应为放热反应)趋向平衡时,图【变式练习7】在可逆反应A中符合勒夏特列原理的是()5.其它图像【例6】对于mA(固)+nB(⽓)pC(⽓)+Q的可逆反应,在⼀定温度下B的百分含量与压强的关系如图所⽰,则下列判断正确的是()A.m+n<p B.x点的状态是v正>v逆C.n>p D.x点⽐y点的反应速度慢课堂巩固练习1.如图(Ⅰ)表⽰反应:mA(g)+nB(g) pC(g)+qD(g);△H。