2018年高考化学二轮复习压轴题热点题型提分练:题型六Word版含答案
- 格式:pdf
- 大小:100.77 KB
- 文档页数:3

河北衡水中学2018年高考押题试卷化学试卷(二)可能用到的相对原子质量:H- 1 C -12 N -14 O-16 Ca -40 Cu -64 Br -80第Ⅰ卷选择题:本题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符含题目要求的。
7.化学与社会、生活密切相关,对下列现象或亊实的解释不正确的是8.下列说法正确的是A.H2C=CHCH3分子中所有原子在同一平面上B.分子式为C3H5Br2的有机物共有4件同分异构体(不含立体异构)C.乙二醇和甘油互为同系物D.结构式为…-CH =CH—CH =CH—CH =CH—CH=CH-…的高分子化合物,其单体是乙烯9.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是10.合成药物异搏定路线中某一步骤如图所示,下列说法错误的是A.物质X 的分子中存在2种含氧官能团B.物质Y 可以发生水解和消去反应C.1molZ 最多可与2molBr 2发生加成反应D.等物质的量的X 、Y 分别与NaOH 溶液反应,最多消耗的NaOH 的物质的量之比为1:111. 锌银(Zn-Ag 2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是A.K +向a 极移动B.b 极的电极反应式为 Ag 2O+H 2O+2e -=2Ag+2OH -C.用该电池给铁棒镀铜,则铁棒与 b 极相连D.电池工作一段时间后,电解液的pH 减小12.短周期主族元素 X 、Y 、Z 、W 的原子序数依次增大,四种元素形成的单质依次为m 、n 、p 、q ;r 、t 、u是这些元素组成的二元化合物,其中u 为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L 的v 溶液中:)()(-+OH c H c= 1.0×10-10。
上述物质的转化关系如图所示,下列说法不正确的是A.简单离子半径:W>Y>Z>XB.W ,Y 分別与X 元素形成的简单化合物的沸点: Y> WC.Z 2Y 和ZX 都只存在离子键D.能抑制水的电离,u 的水溶液能促进水的电离 13.室温下,下列关亍电解质的说法中正确的是A.中和等体积、等浓度的氨水和氢氧化钠溶液至pH 等于7,前者消耗的盐酸多B.向NaHS 溶液中加入适量 KOH 后:c(Na +)=c(H 2S)+c(HS -)+c(S 2-)C.将amol ·L -1的醋酸与0.01 mol ·L -1的氢氧化钠溶液等体积混合,溶液中:c(Na +)=c(CH 3COO -),醋酸的电离常数K a =01.01029-⨯-a (用含a 的代数式表示)D.向NH 4Cl 溶液中加入少量等浓度的稀盐酸,则)()(234O H NH c NH c ⋅+的值减小26. (15分)溴化钙易溶于水,医学上可用于治疗神经衰弱、癫痫等症。

2018北京卷高考压轴卷理科综合化学能力测试本试卷共300分。
考试时长150分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16第一部分(选择题共120分)本部分共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是()A.31d和33d属于同种核素B.气态氢化物的稳定性:a>d>eC.工业上常用电解法制备单质b和cD.a和b形成的化合物不可能含共价键7.下列实验的反应原理用离子方程式表示正确的是( )A.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑C.用碳酸氢钠溶液检验水杨酸中的羧基:+2HCO3-→+2H2O+2CO2↑D.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O8.用N A表示阿伏伽德罗常数,下列说法正确的是A.0.2 mol H2O2完全分解转移的电子数为0.4N AB.含N A个Na+的Na2O溶于1L水中,Na+的物质的量浓度为1mol·L-1C.在标准状况下,2.8g N2和2.24LCO所含电子数均为1.4N AD. 2.24L SO2与O2混合气体中所含氧原子数为0.2N A9.某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质。
为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。
下列说法的是()A.起始滤液常温下pH = 7B.试剂Ⅰ为Ba(NO3)2溶液C.上图过程须经2次过滤D.步骤③目的是除去CO32-10.化学与日常生活密切相关,下列说法正确的是()A.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸B.做衣服的棉和麻均与淀粉互为同分异构体C.煎炸食物的花生油和牛油都是可皂化的饱和酯类D.装饰材料释放的甲醛会造成污染11.已知氯水中存在反应:Cl2+H2O H++Cl﹣+HClO,取5mL饱和氯水进行如下实验.下列说法中,正确的是()A.加5 mL水,c (H+)增大B.加少量NaCl固体,c (H+)不变C.加少量碳酸钙粉末,c(HClO)升高D.加少量Na2SO3固体,溶液pH升高12.在日常生活中,下列解决问题的方法不可行的是()A.为加快漂白精的漂白速率,使用时可滴加几滴醋酸B.为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中C.为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素CD.为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土第二部分(非选择题共180分)本部分共11小题,共180分。

2013·新课标全国卷Ⅱ7.L6 在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:CHCH2OCOR1OCOR2CH2OCOR3动植物油脂+3R′OH短链醇催化剂△R′OCOR1R′OCOR2R′OCOR3生物柴油+CHCH2OHOHCH2OH甘油下列叙述错误的是( )A.生物柴油由可再生资源制得B.生物柴油是不同酯组成的混合物C.动植物油脂是高分子化合物D.“地沟油”可用于制备生物柴油7.C 生物柴油可通过油脂与醇的交换反应制得,属于可再生资源,A项正确;生物柴油的组成是不同的酯,属于混合物,B项正确;油脂的相对分子质量小于10 000,不是高分子化合物,C项错误;“地沟油”是油脂,可用于制备生物柴油,D项正确。
8.K3 I1下列叙述中,错误的是( )A.苯与浓硝酸、浓硫酸共热并保持55~60 ℃反应生成硝基苯B.苯乙烯在合适条件下催化加氢可生成乙基环己烷C.乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷D.甲苯与氯气在光照下反应主要生成2,4二氯甲苯8.D 苯与浓硝酸在浓硫酸催化剂条件下加热发生硝化反应得到硝基苯,A项正确;苯乙烯分子全部加氢可得乙基环己烷,B项正确;乙烯与溴加成得到1,2二溴乙烷,C项正确;甲苯在光照条件下发生甲基上的取代反应而非苯环上的取代反应,D项错误。
9.A1 A4N0为阿伏加德罗常数的值。
下列叙述正确的是( )A.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2N0B.12 g石墨烯(单层石墨)中含有六元环的个数为0.5N0C.25 ℃时pH =13的NaOH溶液中含有OH-的数目为0.1N0D.1 mol的羟基与1 mol的氢氧根离子所含电子数均为9N09.B 1.0 L 1.0 mol·L -1NaAlO 2溶液中含1 mol NaAlO 2,其中含有氧原子数为2N 0,但溶液中水分子也含有氧原子,故A 项错误;石墨烯中每个碳原子为三个六元环所共有,因此,每个六元环含碳原子数为6×13=2个,故1 mol 石墨中含有六元环数为0.5N 0,B 项正确;25 ℃时pH =13的NaOH 溶液中c (OH -)=0.1 mol·L -1,但题目中未给出溶液的体积,无法求出n (OH -),C 项错误;OH -中含10个电子,故1 mol OH -含有电子数为10N 0,D 项错误。

河南省名校2018届高三压轴第二次考试理综化学试题1. 下列说法正确的是A. 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点B. 饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变C. 乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液D. KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质【答案】B【解析】A项,天然植物油常温下一般呈液态,难溶于水,天然植物油属于混合物,没有恒定的熔点、沸点,A项错误;B项,饱和石灰水中加入少量CaO,CaO与水发生反应:CaO+H2O=Ca (OH)2,溶剂水减少,Ca(OH)2增多,恢复至室温后析出Ca(OH)2固体,所得溶液仍为Ca (OH)2的饱和溶液,c(OH-)不变,溶液的pH不变,B项正确;C项,加入Na2CO3与乙酸反应生成CH3COONa、H2O和CO2,但乙醇与水以任意比互溶,不会出现分层现象,不能用分液法分离,C项错误;D项,KClO3属于电解质,SO3溶于水后能导电,但导电的离子不是SO3电离产生的,而是SO3与水反应生成的H2SO4电离产生的,SO3为非电解质,D项错误;答案选B。
点睛:本题考查天然油脂的物理性质、影响固体溶解度的因素、物质的分离和提纯、电解质的判断。
易错点是电解质的判断,电解质溶于水或熔融状态下能导电,导电的离子必须是电解质自身电离产生的,如SO2、SO3、NH3等化合物的水溶液也能导电,但导电的离子是由它们与水反应的生成物电离产生的,SO2、SO3、NH3等化合物属于非电解质。
2. 用N A表示阿伏加德罗常数的值,下列说法中正确的数目是①12.0g熔融的NaHSO4中含有的阳离子数为0.2N A②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3N A③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6N A④7.8g中含有的碳碳双键数目为0.3N A⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为N A⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2N A个电子⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5N A⑧常温常压下,17 g甲基(一14CH3)中所含的中子数为9N AA. 3B. 4C. 5D. 6【答案】A【解析】①n(NaHSO4)==0.1mol,NaHSO4在熔融状态下的电离方程式为NaHSO4=Na++HSO4-,12.0g熔融的NaHSO4中含有的阳离子物质的量为0.1mol,①错误;②Na2O和Na2O2中阴、阳离子个数之比都为1:2,1molNa2O和Na2O2混合物中含有的阴、阳离子总物质的量为3mol,②正确;③NO2和N2O4的实验式都是NO2,n(NO2)==2mol,常温常压下92g的NO2和N2O4混合气体中所含原子物质的量为6mol,③正确;④苯中不含碳碳双键,④错误;⑤n(FeCl3)=1.0mol/L1L=1mol,根据反应FeCl3+3H2O Fe(OH)3(胶体)+3HCl,生成1molFe(OH)3,氢氧化铁胶粒是一定数目Fe(OH)3的集合体,氢氧化铁胶粒的物质的量小于1mol,⑤错误;⑥若1molSO2全部反应则转移2mol电子,而SO2与O2的反应是可逆反应,1molSO2与足量O2在一定条件下充分反应生成SO3,转移电子物质的量小于2mol,⑥错误;⑦用双线桥分析该反应:,每生成3molI2转移5mol电子,⑦正确;⑧n(-14CH3)==1mol,所含中子物质的量为8mol,⑧错误;正确的有②③⑦,答案选A。
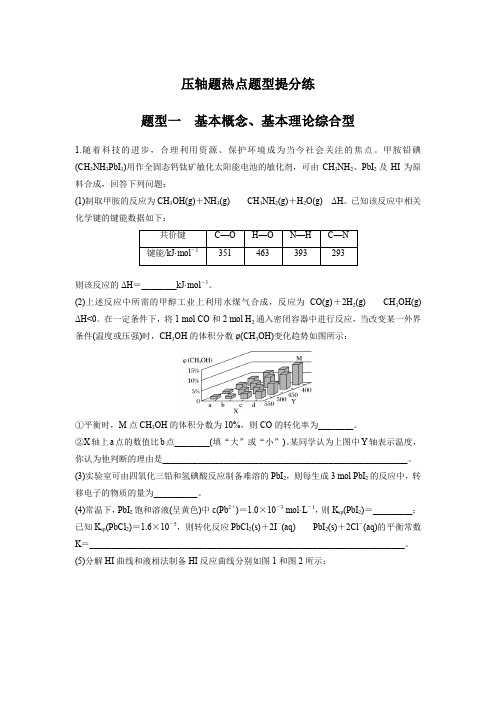
压轴题热点题型提分练题型一基本概念、基本理论综合型1.随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。
甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)ΔH。
已知该反应中相关化学键的键能数据如下:则该反应的ΔH=________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)CH3OH(g)ΔH<0。
在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
②X轴上a点的数值比b点________(填“大”或“小”)。
某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________________________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为__________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则K sp(PbI2)=_________;已知K sp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq)PbI2(s)+2Cl-(aq)的平衡常数K=________________________________________________________________________。
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:①反应H 2(g)+I 2(g)2HI (g) 的ΔH __________(填大于或小于)0。

题型三 “整套装置型” 定性、定量实验探究1.CuCl 晶体呈白色,熔点为430 ℃,沸点为1 490 ℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H 3CuCl 4,反应的化学方程式为 CuCl(s)+3HCl(aq)H 3CuCl 4(aq)。
(1)实验室用下图所示装置制取CuCl ,反应原理:2Cu 2++SO 2+8Cl -+2H 2O===2CuCl 3-4+SO 2-4+4H +CuCl 3-4(aq)CuCl(s)+3Cl -(aq)①装置C 的作用是_____________________________________________________________。
②装置B 中反应结束后,取出混合物进行如下图所示操作,得到CuCl 晶体。
混合物――→冷却ⅰ――→倒入溶有SO 2的水中ⅱ――→过滤ⅲ――→洗涤ⅳ――→干燥ⅴCuCl 晶体 操作ⅱ的主要目的是___________________________________________________________。
操作ⅳ中宜选用的试剂是________________________。
③实验室保存新制CuCl 晶体的方法是________________________________________________________________________。
④欲提纯某混有铜粉的CuCl 晶体,请简述实验方案:________________________________________________________________________。
(2)某同学利用如下图所示装置,测定高炉煤气中CO 、CO 2、N 2和O 2的百分组成。
已知:ⅰ.CuCl 的盐酸溶液能吸收CO 形成Cu(CO)Cl·H 2O 。
ⅱ.保险粉(Na 2S 2O 4)和KOH 的混合溶液能吸收氧气。
2018全国Ⅱ卷高考压轴卷理科综合化学测试可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 S 32 K39 Cr 52 Mn 55 Fe 567. X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的一种单质具有杀菌、消毒能力,Y单质与X单质在不同条件下反应会生成两种不同化合物,Z简单离子半径是同周期元素简单离子中最小的,W原子最外层电子数是其电子层数的2倍。
下列说法不正确的是A. 气态氢化物的稳定性:X>WB. Y、Z、W的最高价氧化物对应水化物之间能两两反应C. 原子半径:Y>Z>W>XD. 工业上获得Y、Z单质的主要方法是电解其熔融的氯化物...8.下列有关物质的分类或归类不正确的是()①混合物:石炭酸、福尔马林、水玻璃、水银②化合物:CaCl2、烧碱、苯乙烯、HD③电解质:明矾、冰醋酸、硫酸钡④纯净物:干冰、冰水混合物、浓硫酸、水晶⑤同素异形体:足球烯、石墨、金刚石⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2.A.①②③④ B.②④⑤⑥ C.①③④⑤ D.①②④⑥9.N A代表阿伏加德罗常数,下列说法正确的是()A.同一物质的固、液、气三种状态的熵相同B.0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3N A个电子转移C.等物质的量的钠分别在足量的氧气和氯气中燃烧,转移电子数相等D.1.5 mol NO2与足量H2O反应,转移的电子数为2N A10.下列有关实验装置进行的相应实验,能达到实验目的是()A .用图1装置制取并收集干燥纯净的NH 3B .用图2所示装置可除去NO 2中的NOC .用图3所示装置可分离CH 3COOC 2H 5和饱和碳酸钠溶液D .用图4装置制备Fe (OH )2并能较长时间观察其颜色11.有机物A 的结构简式为:则A 的同分异构体中带苯环的化合物共有( ) A .3种 B .4种 C .5种 D .6种12.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。
2018届上海市高考压轴卷化学一、选择题(本题共10分,每小题2分,每题只有一个正确选项)1. 化学与人类生活、环境保护、能源开发、资源利用等密切相关。
下列说法不正确的是A. 在食用盐中添加适量的碘酸钾B.用聚氯乙烯塑料袋包装食品C.在食品加工中科学使用食品添加剂D.研发高效低毒的农药,降低蔬菜的农药残留量2.下列有关化学用语表示正确的是A.乙酸的结构简式: CH3COOHB.NH3的电子式:C.氯原子的结构示意图:D.邻羟基苯甲酸的结构简式:3.下列叙述正确的是:A.离子晶体中,只存在离子键,不可能存在其它化学键B.在氧族元素(O、S、Se、Te)的氢化物中,水的沸点最低C.NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:2D.晶体的熔点:金刚石>碳化硅>单晶硅4.铋(Bi)在医药方面有重要应用,下列关于20983Bi和21083Bi的说法正确的是A.两者互为同素异形体 B.20983Bi和21083Bi的物理性质往往不同C.20983Bi转化成21083Bi是物理变化 D.两者分别含有126和127个质子5.水是最宝贵的资源之一。
下列表述正确的是A .H 2O 的电子式为....H :O:H -+⎡⎤⎢⎥⎣⎦B .4℃时,纯水的pH=7C .162D O 中,质量数之和是质子数之和的两倍D .273K 、101kPa ,水分子间的平均距离d :d (气态)>d (液态)>d (固态)二、选择题(本大题共36分,每小题3分,每题只有一个正确选项) 6. 下列有关实验原理或实验操作正确的是 A. 用水湿润pH 试纸测量某溶液的pHB. 用50mL 酸式滴定管可准确量取25.00mLKMnO 4溶液C. 用湿润的蓝色石蕊试纸检验氨气D. 盛放NaOH 溶液时,使用带玻璃塞的磨口瓶7.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲丁乙丙。
下列有关物质的推断不正确的是A .若甲为焦炭,则丁可能是O 2B .若甲为SO 2,则丁可能是氨水C .若甲为Fe ,则丁可能是盐酸D .若甲为NaOH 溶液,则丁可能是CO 28. 人工光合作用能够借助太阳能,用CO 2和H 2O 制备化学原料。
2018年高考全国卷II理综化学试题与详细解析(word版可编辑修改)2018年高考全国卷II理综化学试题与详细解析(word版可编辑修改) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018年高考全国卷II理综化学试题与详细解析(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018年高考全国卷II理综化学试题与详细解析(word版可编辑修改)的全部内容。
2018年高考全国卷II理综化学试题与详细解析(word版可编辑修改)绝密★启用前2018 年普通高等学校招生全国统一考试理科综合能力测试试题卷(化学)注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上.2.作答时,务必将答案写在答题卡上.写在本试卷及草稿纸上无效。
3.考试结束后,将本试卷和答题卡一并交回.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 P31 S 32 Fe 56一、选择题:本题共7个小题,每小题 6 分,共 42 分.在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关.下列说法错误的是A。
碳酸钠可用于去除餐具的油污B. 漂白粉可用于生活用水的消毒C. 氢氧化铝可用于中和过多胃酸D。
碳酸钡可用于胃肠X 射线造影检查【答案】 D【解析】分析: A.碳酸钠溶液显碱性;B。
漂白粉具有强氧化性;C.氢氧化铝能与酸反应;D.碳酸钡可溶于酸。
详解: A. 碳酸钠水解溶液显碱性,因此可用于去除餐具的油污,A 正确;B. 漂白粉具有强氧化性,可用于生活用水的消毒, B 正确;C。
参考答案·化学参考答案·化学第一部分 特色练专题一 化学基本概念能力卷1.C 医用消毒酒精属于混合物,A 项错误;某些有沉淀生成的过程可能没有发生化学反应,如饱和溶液降温结晶,B 项错误;泡沫灭火器中的药剂为硫酸铝溶液和小苏打溶液,D 项错误。
2.A 海带提碘过程中涉及I -转化为I 2等氧化还原反应;氯气溶于水与水反应生成盐酸和次氯酸,氯元素化合价发生变化;电解水生成H 2和O 2属于氧化还原反应。
3.B 根据质量守恒知Z 为CO 2。
反应中O 2是氧化剂,甲醛被氧化,A 项错误;Z 的摩尔质量为44 g·mol -1, C 项错误;甲醛分子中碳为0价,Z(CO 2)中碳为+4价,1 mol 甲醛被O 2氧化为CO 2时,转移4 mol e -,D 项错误。
4.D 加入KSCN 试液显红色的溶液中含有Fe 3+,Fe 3+与OH -结合生成Fe(OH)3沉淀,A 错误;加入石蕊试液显蓝色的溶液呈碱性,OH -和NH +4不能大量共存,B 错误;由水电离的c (H +)=1×10-14 mol·L-1的溶液可能呈酸性或碱性,HCO -3都不能大量存在,C 错误;氯水具有强氧化性,而Al 3+、Cu 2+、NO -3、SO 2-4都不能被氧化,故能大量共存,D 正确。
5.D 纳米四氧化三铁分散在适当分散剂中形成胶体,具有丁达尔效应,A 项正确;反应②中环丙胺不参加反应,但能加快反应速率,即加快了氯化铁水解,C 项正确;反应③的化学方程式为6FeOOH +CO===2Fe 3O 4+3H 2O +CO 2,生成1 mol Fe 3O 4时,转移的电子数为N A ,D 项错误。
6.D 产生的刺激性气体是SO 2,是SO 2-3和硫酸中的H +反应生成的,由化合价分析,NH 4CuSO 3中Cu 是+1价,有红色金属生成说明有Cu ,溶液呈蓝色是因为有Cu 2+,A 、B 两项均错误;硫酸是足量的,酸性环境下不会生成氨气,C 项错误;1 mol NH 4CuSO 3中,有0.5 mol Cu 被氧化,同时有0.5 mol Cu 被还原,转移的电子数是0.5 mol ,D 项正确。
题型六物质结构与性质(选考)
1.自然界存在的元素中,金属元素种类更多,非金属元素丰度更大。
Ⅰ.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子的价电子排布图是________________,N2F2分子中N原子的杂化方式是________,1 mol N2F2含有________个σ键。
(2)高温陶瓷材料Si3N4晶体中键角N—Si—N________(填“>”、“<”或“=”)Si—N—Si,原因是________________________________________________________________________。
Ⅱ.金属元素在现代工业中也占据极其重要的地位。
其中钛也被称为“未来的钢铁”,具有
质轻、抗腐蚀、硬度大,是宇航、航海、化工设备等的理想材料,是一种重要的战略资源,
越来越受到各国的重视。
(1)基态钛原子核外共有________种运动状态不相同的电子。
金属钛晶胞如下图1所示,为________(填堆积方式)堆积。
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2。
化合物乙的沸点明显高
于化合物甲,主要原因是__________________________________________________。
化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为
________________________________________________________________________。
(3)钙钛矿晶体的结构如图3所示。
假设把氧离子看作硬球接触模型,钙离子和钛离子填充氧
离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,钙离子位于立方晶胞的体
心,一个钙离子被________个氧离子包围。
钙钛矿晶体的化学式为________________。
若氧离子半径为 a pm,则钙钛矿晶体中两个钛离子间最短距离为________pm。
图3
答案Ⅰ.(1)sp2 1.806×1024
(2)>Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N—Si—N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si—N—Si键角小于109°28′
Ⅱ.(1)22六方最密
(2)化合物乙形成分子间氢键O>N>C
(3)12CaTiO36a
解析Ⅱ.(3)钛离子位于立方晶胞的顶角,被6个氧离子包围成配位八面体;钙离子位于立
方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边
长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×1
4
=3,则晶胞
的化学式为CaTiO3;若氧离子半径为 a pm,则正八面体的棱长为2a pm,则2个正四面体的连接面为正方形,该正方形棱长为2a pm,Ti位于正方形的中心,两个钛离子间最短距离正
方形对角线长度,故两个钛离子间最短距离为22a pm,图中立方体中心钙离子与顶点上钛
离子之间距离最短,为体对角线长度的1
2
,则二者最短距离为
1
2
×3×22a pm=6a pm。
2.铜是应用较为广泛的有色金属。
(1)基态铜原子的核外电子排布式为______________________________________________。
(2)金属化合物Cu2Zn合金能导电,熔点较高,强度、硬度较大。
Cu2Zn合金的晶体类型是__________。
(3)某含铜化合物的离子结构如图所示。
①该离子中存在的作用力有______________;
a.离子键
b.共价键
c.配位键
d.氢键
e.范德华力
②该离子中第二周期的非金属元素的第一电离能由大到小的顺序是______________;
③该离子中N原子的杂化类型有____________。
(4)下图是某铜矿的立方晶胞图,该铜矿用于炼铜时,会产生能使品红溶液褪色的气体,则
X的元素符号是________,此晶胞的化学式________,与X等距离且最近的X原子个数为________。
若该晶胞参数为 d nm,N A表示阿伏加德罗常数的值,该晶体的密度为________g·cm-3。
答案(1)1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)金属晶体
(3)① bc② N>O>C③ sp2、sp3
(4)S Cu2S83.2×1023 d3·N A
解析(4)根据性质,X应为S,Cu:4,S:1+8×1
8
=2,所以其化学式为Cu2S。
(d×10-7)3·ρ·N A=2M(Cu2S)。