年全国化学竞赛(初赛)试题与答案
- 格式:doc
- 大小:948.50 KB
- 文档页数:11
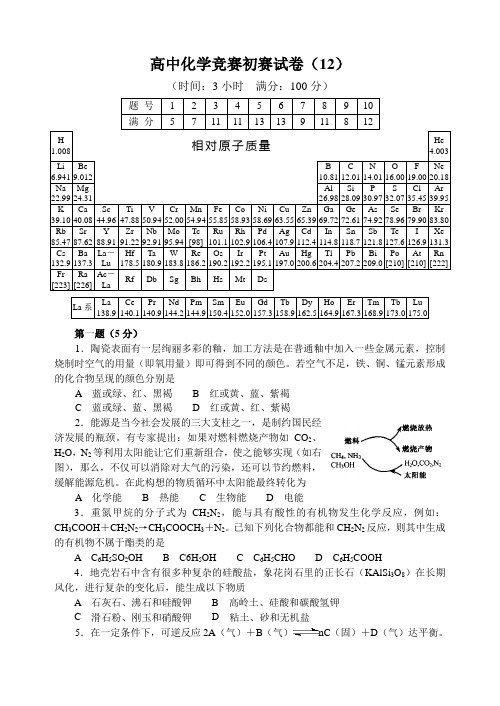
高中化学竞赛初赛试卷(12)(时间:3小时满分:100分)题号 1 2 3 4 5 6 7 8 9 10 满分 5 7 11 11 13 13 9 11 8 12H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-LaRf Db Sg Bh Hs Mt DsLa系La138.9Ce140.1Pr140.9Nd144.2Pm144.9Sm150.4Eu152.0Gd157.3Tb158.9Dy162.5Ho164.9Er167.3Tm168.9Tb173.0Lu175.0第一题(5分)1.陶瓷表面有一层绚丽多彩的釉,加工方法是在普通釉中加入一些金属元素,控制烧制时空气的用量(即氧用量)即可得到不同的颜色。
若空气不足,铁、铜、锰元素形成的化合物呈现的颜色分别是A 蓝或绿、红、黑褐B 红或黄、蓝、紫褐C 蓝或绿、蓝、黑褐D 红或黄、红、紫褐2.能源是当今社会发展的三大支柱之一,是制约国民经济发展的瓶颈。

选择题:1. 下列哪个化学反应是一个氧化反应?a) 2Na + Cl2 → 2NaClb) Fe2O3 + 3CO → 2Fe + 3CO2c) CH4 + 2O2 → CO2 + 2H2Od) AgNO3 + NaCl → AgCl + NaNO32. 下列关于化学平衡的描述中,正确的是?a) 改变温度会改变平衡常数K值b) 增加反应物浓度会使平衡向生成物一侧移动c) 使用催化剂会改变平衡浓度d) 在平衡状态下,反应物和生成物的浓度会保持不变3. 下列哪种原子轨道能容纳最多电子?a) s轨道b) p轨道c) d轨道d) f轨道4. 在化学键中,共价键通常是由两个原子共享几对电子?a) 1对电子b) 2对电子c) 3对电子d) 4对电子填空题:1. 当pH=5时,溶液中氢离子的浓度是__________M。
答案:1 × 10^-5 M2. 在标准温度和压强下,1 mol理想气体其体积为__________。
答案:22.4 升3. 在化学反应速率方程式中,指数n通常代表对于反应物的__________。
答案:浓度的影响程度4. 一种化合物中氧元素的化合价为__________。
答案:通常为-2。
应用题:1. 将30 g NaOH 溶解在500 mL水中得到的溶液,求该溶液的pH值。
答案:首先计算NaOH的摩尔量,然后计算氢离子浓度,再计算pH值,最终得到答案。
2. 对于化学反应N2(g) + 3H2(g) → 2NH3(g),如果开始时N2和H2各有1 mol,并且所有物质均为理想气体,在达到平衡时氢气的摩尔数为多少?答案:通过构建反应表,计算出N2和H2的消耗量,最终得到氢气的摩尔数。
3. 如有2 mol 氢气和1 mol 氮气,反应生成氨气,求反应结束后氢气、氮气和氨气的摩尔数。
答案:首先通过摩尔比求出反应物的消耗量,然后通过生成物的物质平衡关系求出生成物的摩尔数。
4. 1 mol CO 和1 mol H2 经反应生成乙醇,求反应结束后乙醇的摩尔数。

高中化学竞赛试题精选及答案班级 姓名1. 在一定条件下将a 体积NO 2和b 体积O 2同时通入倒立于水中且盛满水的容器内充分反应后,容器内残留a 9体积的气体,该气体遇空气即变为红色,则a 与b 的比值为--------------------------------------------------------------------------------------[B]A 、1:6B 、6:1C 、8:3D 、3:8〖提示〗:残留的a 9体积的NO 气体是由剩余的39a NO 2与水反应得到有,故与O 2参加反应的NO 2的体积为a-39a =69a ,消耗O 2的体积为69a 的四分之一。
2. 某学生为测定一瓶失去标签的铁的氧化物样品的成份,称取14.00克该样品用足量的CO 在适宜的条件下使其全部还原,将生成的CO 2用足量的澄清石灰水吸收生成26.25克沉淀,据此可推断出该样品是--------------------------------[A]A 、Fe 2O 3B 、Fe 3O 4C 、不纯的Fe 2O 3D 、FeO〖提示〗:CO 与之反应后均生成CO 2,其中的一个氧原子全部来自铁的氧化物,所以生成的CO 2的物质的量(0.2625摩)也就是铁氧化物中所含的氧原子的量,其中每1摩氧原子所对应的式量=1400026255333...= 3. a 在常温下为离子晶体,由X 、Y 两元素构成,在a 中X m+和Y n-的电子层结构相同。
已知下列反应: (1)a+H 2O 电解−→−−H 2+b+c (2)H 2+c →d (气) (3)b+c →a+e+H 2O 则a 、e 、f 依次是-----------------------------------------------------------------------[B] A 、NaCl NaClO HCl B 、CaCl 2 Ca(ClO)2 HClO C 、Na 2S Na 2SO 3 H 2SO 3 D 、K 2S K 2SO 3 H 2SO 4 4.将amol/L 的碳酸氢钙溶液跟bmol/L 的烧碱溶液等体积混合后的溶液中含有四种生成物,则下列a 与b 的关系正确的是----------------------------------------------[B] A 、a:b ≥1:2 B 、1:2<a:b<1:1 C 、2a=b D 、a=2b 5.①将0.1升1.0mol/L 的纯碱溶液逐滴加入到0.1升1.25mol/L 的盐酸中②将0.1升1.25mol/L 的盐酸逐滴加入到0.1升1.0mol/L 的纯碱溶液中,两种操作产生二氧化碳的体积比为------------------------------------------------------------------------[A] A 、5:2 B 、2:5 C 、2:1 D 、1:1 6.二种短周期元素组成的化合物中,原子个数比为1:3,若二种元素的原子序数分别为a 和b ,则a 、b 的关系可能是------------------------------------------[D] ①a=b+5 ②a+b=8 ③a+b=30 ④a=b+8 A 、①②③ B 、①②④ C 、②③④ D 、①②③④ 7. 某离子晶体的空间构型如图所示,则该晶体中X 、Y 的离子个数比为[BD]A、XY4B、XY2C、YXD、YX28.向含有a摩AlCl3溶液中加入含有b摩KOH溶液,生成沉淀的物质的量可能是-------------------------------------------------------------------------------------------------[A]①a摩②b摩③a/3摩④b/3摩⑤0摩⑥(4a-b)摩A、①③④⑤⑥B、①②③④⑤C、①④⑤⑥D、①④⑤9.用H2还原某+n价的金属氧化物,如有1克H2恰好还原a克氧化物时,则该金属的相对原子质量(原子量)为-----------------------------------------------------[B]A、(8-a)nB、(a-8)nC、an+8nD、an+16n10.25℃时,在0.1mol/LNaX溶液中,水的电离度为α1;在0.1mol/L盐酸中,水的电离度为α2,若αα12=109,则NaX溶液的PH值为----------------------[C]A、5B、7C、10D、1111.已知[Co(NH3)6]3+呈正八面体结构:各NH3分子间距相等,Co3+位于正八面的中心。

全国高中学生化学竞赛(省级赛区)试题答案第1题(4分) 2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X 和Y 。
X 是用高能48Ca 撞击Am 24395靶得到的。
经过100微秒,X 发生α-衰变,得到Y 。
然后Y 连续发生4次α-衰变,转变为质量数为268的第105号元素Db 的同位素。
以X 和Y 的原子序数为新元素的代号(左上角标注该核素的质量数),写出上述合成新元素X 和Y 的核反应方程式。
答案: Am 24395+ 4820Ca =288115+3n (2分)不写3n 不得分。
答291115不得分。
288115 = 284113 + 4He (2分) 质量数错误不得分。
4He 也可用符号α。
(答下式不计分:284113-44He = 268105或268105Db )(蓝色为答案,红色为注释,注释语不计分,下同)第2题(4分)2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮, 这种高聚氮的N-N 键的键能为160 kJ/mol (N 2的键能为942 kJ/mol),晶体结构如图所示。
在这种晶体中,每个氮原子的配位数为 ;按键型分类时,属于 晶体。
这种固体的可能潜在应用是 ,这是因为: 。
答案: 3 原子晶体 炸药(或高能材料) 高聚氮分解成N 2释放大量能量。
(各1分)第3题(6分)某实验测出人类呼吸中各种气体的分压/Pa 如下表所示:气体吸入气体 呼出气体79274 7584821328 1546340 3732 667 62653-1 请将各种气体的分子式填入上表。
3-2 指出表中第一种和第二种呼出气体的分压小于吸入气体分压的主要原因。
答案:气体吸入气体呼出气体N279274 75848O221328 15463CO240 3732H2O 667 6265(每空1分,共4分)呼出气中的N2的分压小于吸入气中的分压的主要原因是呼出气中的CO2和水蒸气有较大分压,总压不变,因而N2的摩尔分数下降(1分);呼出气中的O2的分压小于吸入气中的分压的主要原因是吸入的O2被人体消耗了。

第33届中国化学奥林匹克(初赛)试题答案与解析安徽黄山巨人教育胡征善【答案】1-1、A CO2分子式C2H4O 结构简式CH3CHO1-2、+1 直线型+3 八面体(拉长)1-3、【解析】1-1、乙烯催化氧化,得到CO2(A)和与A相对分子质量相同的产物(一定含C、O元素):O=C=O从式量上分析CH 4从价键上分析—CH3,—H CH3CHO 环氧乙烷CH3CHO1-2、CsAuCl3呈抗磁性,Cs+和Cl—中均无但电子,Au外围电子组态5d106s1,在此化合物中Au的平均氧化态为+2,则Au+(5d10)和Au3+(5d8且空出1个5d轨道)数1︰1。
晶胞为四方晶系,化学式为Cs+[Au+Cl2]—·Cs+[Au3+Cl4],由2个单元Cs+[Au+Cl2]—和Cs+[Au3+Cl4]—构成。
晶胞参数c=x+y,其中x<a,y>a。
1-3、将芳香族聚酰亚胺结构重复一次, 可清楚地看到邻苯二甲酸酐和—NH 2失水而聚合。
再根据提供A 的分子式和氧化得B(二邻苯二甲酸酐),推出A 的结构。
【答案】2-1、4820Ca+24998Cf==294Og+310n 2-2、H 2O 2 2-3、CH 4【解析】2-2、二元氧化物含氧量最高=要求另一元素A r 最小——H 且O 原子数要大。
可以是臭氧酸HO 3或超氧酸HO 2,但它们都不稳定。
稳定的只有H 2O 2。
2-3、电子的摩尔质量为1/1836 g/mol ,故有:n (e —)=0.003227×1836=5.925 mol 。
设二元气体化合物的摩尔质量为M ,分子中含x 个电子,故有:x ×9.413 g/M =5.925 mol ,M ≈1.6x二元化合物只有甲烷。
【答案】3-1、p(CO)=p(CO2)=600 kPa 3-2、K2=600 kPa3-4、C A 3-5、C A【解析】3-1、平衡体系中(2个平衡反应)的总压为1200 kPa,且第(1)个平衡的K1=1.00,故平衡体系中p(CO)=p(CO2)=600 kPa,而第(2)个平衡的K2= p(CO)。

全国中学生化学竞赛(安徽赛区)初赛试题注意:考试时间2.5小时,满分150分。
请在答题卡上答题,容许使用非编程计算器。
一、本题涉及15小题,每题2分,共30分。
每题仅有1个选项符合题意。
1.下列生活常识与化学原理有关,对旳旳选项是①福尔马林具有防腐杀菌旳作用,是由于甲醛可以使蛋白质变性②人体血液pH保持弱碱性(7.35-7.45),重要是血液中存在H2CO3—HCO3-缓冲体系③硫酸亚铁补铁剂应与维生素C同服,是由于维生素C可以避免Fe2+被氧化④油炸食品容易产生“哈喇”味而不能食用,是由于被氧化产生过氧化物和醛类A.①②③④B.①②③C.②③④D.①③④2.缺铁性贫血是世界上最普遍旳营养性问题,一种简朴旳解决措施是生产铁强化酱油,即在酱油中加入易吸取旳铁添加剂——Na2FeY,其中Y4-是乙二胺四乙酸(H4Y)旳酸根形式,H4Y构造如下左图。
生产铁强化酱油产生旳废水可用绿色消毒剂X(如下右图)来杀菌。
下列有关说法对旳旳是A.从酸碱质子理论来说,H4Y只有酸性B.X可以杀菌旳因素是其水解可产生次氯酸C.H4Y和X在一定条件下均能发生水解反映D.可用萃取法从铁强化酱油中分离出Na2FeY3.某未知溶液也许含Cl-、CO32-、Na+、SO42-、Al3+等离子中旳一种或多种。
将溶液滴在蓝色石蕊试纸上.试纸变红。
取少量试液,滴加硝酸酸化旳氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。
下列判断不合理...旳是A.一定有Cl-B.一定有SO42- C.一定有Al3+ D.一定没有CO32-4.下列有关实验操作中错.误.旳是A.萃取分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出B.检查容量瓶与否漏水旳措施是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看与否漏水C.为加速固体物质旳溶解常采用搅拌、加热等措施D.酸式滴定管装入原则溶液前,必须用蒸馏水润洗三次,不得用原则溶液润洗5.“酸化”是实验中常常采用旳措施,下列酸化过程对旳旳是A.增强高锰酸钾旳氧化能力,用浓盐酸酸化B.克制Fe2+旳水解,用稀硝酸酸化C.检查卤代烃中旳卤元素,加碱溶液并加热后,用稀硫酸酸化,再检查D.确认溶液中具有SO42-时,用盐酸酸化,再检查6.近年来,科学家合成了一系列具有独特化学特性旳氢铝化合物(AlH3)n。
1995年全国高中学生化学竞赛(江苏浙江赛区)初赛试题原子量及有关数据:Sn:118.7 Cl:35.45 H:1 C:12 S:32 Na:23 O:16 Br:80 Cr:51.9 Mn:54.9 Pb:207 Al:27 Mg:24 Cu:64 lg2=0.30101.本试卷内容限3小时完成;2.全卷满分为150分;3.可使用计算器一.选择题(共10小题,每题3分,共30分.每小题可能有1个或2个正确选项。
如果多选、漏选或一对一错都不给分。
)1.制取下列物质的方案能够达到目的的是A 用生锈的废钢铁与稀硫酸反应制绿矾B 用碳酸钠与稀H2SO4反应制CO2C 用食盐、二氧化锰和稀H2SO4共热制Cl2D 用铁与稀盐酸反应制氯化铁2.两种盐的混和物,加热或遇水均能放出使澄清石灰水变浑浊的气体,这两种盐不可能的是A NaHSO4和Na2CO3B Al2(SO4)3和NaHCO3C NaHSO4和KHCO3D MgSO4和Na2CO33.A、B是短周期元素,最外层电子排布式分别为ms x,ns x np x+1。
A与B形成的离子化合物加蒸馏水溶解后可使酚酞试液变红,同时有气体逸出,该气体可使湿润的红色石德试纸变蓝,则该化合物的分子量是A 38B 55C 100D 1354.已知,常温下CH3COOH的电高平衡常数为1.76×10-5,常温下将pH=3的CH3COOH溶液用水稀释一后,溶液的pH值为A 3B 3.15C 3.3D 2.75.某无色溶液中加入过县盐酸有沉淀产生,过滤后向油液中加入过量纯碱溶液又有沉淀产生,下列溶液中符合此条件的是①Ag+、Fe3+、Na+②Ag+、Al3+、K+③Ag+、Ba2+④SiO32-、AlO2-、K+⑤Ag+、NH4+、H+⑥SiO32-、K+、Al3+A 各组均符合B ②③④⑥C ②③④D ①②③④⑥6.某元素x的原子量为a,它的最高价氧化物的水化物的分子式为H m XO n(m>1),下列有关叙述正确的是A 该酸的水溶液中,[H+]︰[XO n m-]=m︰1B 该酸的摩尔质量为(m+a+16n)克C 100毫升该酸溶液只能中和4克NaOHD 若0.1摩/升该酸溶液的pH=1,则Na m XO n的水溶液的pH值>77.常温时,下列三个反应都能自发的向右进行:2W-+X2=2X-+W22Y-+W2=2W-+Y22X-+Z2=2X-+Z2由此得出的正确结论是A X-、Y-、Z-、W-中,Z-还原性最强B X2、Y2、Z2、W2中,Z2的氧化性最弱C 2Z-+Y2=2Y-+Z2不能自发向右进行D 还原性X->Y-8.某密闭容器中放入一定量的NO2,发生反应2NO 2N2O4+Q,达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是A 通入N2B 通入NO2C 通入N2O4D 升高温度9.甲酰胺的氮原子上两个氢原子都被甲基取代后所得到的产物称为N,N-二甲基甲酰胺,简称为DMF,是现在常用的溶剂。
1995年全国高中学生化学比赛(江苏浙江赛区)初赛试题原子量及相关数据:Sn:118.7Cl :35.45H:1C:12S:32Na:23O:16Br :80Cr :51.9 Mn : 54.9Pb: 207Al : 27Mg : 24Cu:64lg2= 0.30101.本试卷内容限2.全卷满分为3 小时达成;150 分;3.可使用计算器一.选择题(共 10 小题,每题 3 分,共 30 分.每题可能有 1 个或 2 个正确选项。
假如多项选择、漏选或一对一错都不给分。
)1.制取以下物质的方案能够达到目的的是A用生锈的废钢铁与稀硫酸反响制绿矾B用碳酸钠与稀 H2SO4反响制 CO2C用食盐、二氧化锰和稀 H2SO4共热制 Cl 2D用铁与稀盐酸反响制氯化铁2.两种盐的混和物,加热或遇水均能放出使澄清石灰水变污浊的气体,这两种盐不行能的是A NaHSO 4和 Na2CO3B Al 2(SO4)3和 NaHCO 3C NaHSO 4和 KHCO 3D MgSO 4和 Na2CO33.A 、 B 是短周期元素,最外层电子排布式分别为ms x, ns x np x+1。
A 与 B 形成的离子化合物加蒸馏水溶解后可使酚酞试液变红,同时有气体逸出,该气体可使润湿的红色石德试纸变蓝,则该化合物的分子量是A38 B 55C100 D 1354.已知,常温下CH3COOH的电高均衡常数为 1.76× 10-5,常温下将pH= 3 的CH 3COOH 溶液用水稀释一后,溶液的pH 值为A3 B 3.15C 3.3 D 2.75.某无色溶液中加入过县盐酸有积淀产生,过滤后向油液中加入过度纯碱溶液又有积淀产生,以下溶液中切合此条件的是① Ag +、 Fe3+、 Na+② Ag +、Al 3+、K +③ Ag +、 Ba2+④ SiO32-、 AlO 2-、 K +⑤ Ag +、NH 4+、 H +⑥ SiO 32-、 K +、 Al 3+A各组均切合B②③④⑥ C ②③④ D ①②③④⑥6.某元素 x 的原子量为 a,它的最高价氧化物的水化物的分子式为H m XO (n m>1),以下相关表达正确的选项是A该酸的水溶液中,+m-[H ]︰[XO n]= m︰ 1B该酸的摩尔质量为( m+ a+ 16n)克C D 100 毫升该酸溶液只好中和 4 克 NaOH若 0.1 摩 /升该酸溶液的pH = 1,则 Na m XO n的水溶液的pH值> 77.常温时,以下三个反响都能自觉的向右进行:--2W +X2=2X+W2--2Y +W2=2W+Y2--2X +Z2=2X +Z2由此得出的正确结论是A X -、 Y -、 Z-、 W-中, Z-复原性最强B X 2、Y2、Z2、W 2中, Z2的氧化性最弱C2Z -+ Y2= 2Y-+ Z2不可以自觉向右进行D复原性 X ->Y-8.某密闭容器中放入必定量的NO2,发生反响2NO2N2O4+ Q,达均衡后,若分别独自改变以下条件,从头达到均衡后,能使混随和体均匀分子量增大的是A 通入N2B 通入NO2C通入NO4D 高升温度29.甲酰胺的氮原子上两个氢原子都被甲基代替后所获得的产物称为N,N-二甲基甲酰胺,简称为DMF ,是此刻常用的溶剂。
全国化学奥林匹克初赛试题及答案第1题(6分)合成氨原料气由天然气在高温下与水和空气反应而得。
涉及的主要反应如下:(1)CH4(g)+H2O(g)CO(g)+3H2(g)(2)2CH4(g)+O2(g)2CO(g)+4H2(g)(3)CO(g)+H2O(g)H2(g)+CO2(g)假设反应产生的CO全部转化为CO2,CO2被碱液完全吸收吸收,剩余的H2O通过冷凝干燥除去。
进入合成氨反应塔的原料气为纯净的N2和H2。
1-1为使原料气中N2和H2的体积比为1:3,推出起始气体中CH4和空气的比例。
设空气中O2和N2的体积比为1:4.所有气体均按理想气体处理。
1-2计算反应(2)的反应热。
已知:(4)C(s)+2H2(g)CH4(g) ΔH4=-74.8kJ·mol-1(5)C(s)+1/2O2(g)CO(g) ΔH5=-110.5kJ·mol-1第2题(5分)连二亚硫酸钠是一种常用的还原剂。
硫同位素交换和顺磁共振实验证实,其水溶液中存在亚磺酰自由基负离子。
2-1写出该自由基负离子的结构简式,根据VSEPR理论推测其形状。
2-2连二亚硫酸钠与CF3Br反应得到三氟甲烷亚硫酸钠。
文献报道,反应过程主要包括自由基的产生、转移和湮灭(生成产物)三步,写出三氟甲烷亚磺酸根形成的反应机理。
第3题(6分) 2013年,科学家通过计算预测了高压下固态氮的一种新结构:N8分子晶体。
其中,N8分子呈首位不分的链状结构;按价键理论,氮原子有4种成键方式;除端位以外,其他氮原子采用3种不同类型的杂化轨道。
3-1画出N 8分子的Lewis 结构并标出形式电荷。
写出段位之外的N 原子的杂化轨道类型。
3-2画出N 8分子的构型异构体。
第4题(5分)2014年6月18日,发明开夫拉(Kevlar )的波兰裔美国化学家Stephanie Kwolek 谢世,享年90岁。
开夫拉的强度比钢丝高5倍,用于制防弹衣,也用于制从飞机、装甲车、帆船到手机的多种部件。
全国化学竞赛(初赛)试题 第1题 (15分) 1-1 2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。117号元素是用249Bk轰击48Ca靶合成的,总共得到6个117号元素的原子,其中1个原子经p次α衰变得到270Db后发生裂变;5个原子则经q次α衰变得到281Rg后发生裂变。用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角和左下角分别标出质量数和原子序数)。
1-2 写出下列结构的中心原子的杂化轨道类型:
FFFFFI
[(C6H5)IF5]
Xe
(C6H5)2Xe I+ [I(C6H5)2]+ 1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如下简式表示。请依样画出其他所有八面体构型的异构体
。OOCl
BrNN
第2题 (5 分) 最近我国有人报道,将0.1 mol L1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol L1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。 2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu2+/Cu)和φӨ(S/S2)分别为0.345 V和 0.476 V,nFEӨ =RTlnK,EӨ表示反应的标准电动势,n为该反应得失电子数。计算25oC下硫离子和铜离子反应得到铜的反应平衡常数,写出平衡常数表达式。
2-2金属铜和混浊现象均出现在蛋壳外,这意味着什么? 2-3 该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH = 6,写出反应的离子方程式。 2-4 请对此实验结果作一简短评论。 第3题 ( 7分) 早在19世纪人们就用金属硼化物和碳反应得到了碳化硼。它是迄今已知的除金刚石和氮化硼外最硬的固体。1930年确定了它的理想化学式。左下图是2007年发表的一篇研究论文给出的碳化硼晶胞简图。 3-1 该图给出了晶胞中的所有原子,除“三原子”(中心原子和与其相连的2个原子)外,晶胞的其余原子都是B12多面体中的1个原子,B12多面体的其他原子都不在晶胞内,均未画出。图中原子旁的短棍表示该原子与其他原子相连。若上述“三原子”都是碳原子,写出碳化硼的化学式。
3-2该图有什么旋转轴?有无对称中心和镜面?若有,指出个数及它们在图中的位置(未指出位置不得分)。
3-3 该晶胞的形状属于国际晶体学联合会在1983年定义的布拉维系七种晶胞中的哪一种?(注:国际晶体学联合会已于2002年改称Bravais systems为lattice systems, 后者尚无中文译名。)
第4题 (8分) 4-1分别将O2、KO2、BaO2 和O2[AsF6]填入与O—O键长相对应的空格中。
O—O键长 112 pm 121 pm 128 pm 149 pm 化学式 4-2 在配合物A和B中,O2为配体与中心金属离子配位。A 的化学式为[Co2O2(NH3)10]4+,其O—O的键长为147 pm;B的化学式为Co(bzacen)PyO2,其O—O的键长为126 pm,Py是吡啶(C5H5N),bzacen是四齿配体 [C6H5−C(O)=CH−C(CH3)=NCH2−]2。B具有室温吸氧,加热脱氧的功能,可作为人工载氧体。画出A和B的结构简图(图中必须明确表明O—O与金属离子间的空间关系),并分别指出A和B中Co的氧化态。 配合物 A B 结构简图 Co的氧化态 第5题 ( 11分) 把红热的玻棒插入橙红色固体A中,A受热后喷射出灰绿色粉末B和无色无味气体C。镁在C中加热生成灰色固体D。B在过量的NaOH溶液中加热溶解,得到绿色溶液E。将适量H2O2加入E中,加热,得到黄色溶液F。F酸化后变为橙色溶液G。向G中加入Pb(NO3)2溶液,得到黄色沉淀H。
5-1 写出A、B、C、D、E、F、G和H的化学式。
5-2 写出由E转变为F,F转变为G,G 转变为H的离子方程式。
5-3 A中的金属元素M可以形成MO2和ZnM2O4, 它们均为磁性材料,广泛用于制作磁带和磁盘。分别写出MO2和ZnM2O4中M的价电子组态。
5-4 A中的金属元素M可以形成不同形式的羰基化合物或者羰基阴离子,按照18电子规则画出Na2[M2(CO)10]的阴离子结构,指出M的氧化态。
第6 题(8分)在我国青海、西藏等地有许多干涸盐湖盛产一种钠盐Q。Q为一种易溶于水的白色固体。Q的水溶液用硫酸酸化,得到弱酸X。X为无色小片状透明晶体。X和甲醇在浓硫酸存在下生成易挥发的E。E在空气中点燃呈现绿色火焰。E和NaH反应得到易溶于水的白色固态化合物Z(分子量37.83)。
6-1写出由Q得到X的离子方程式。
6-2 写出X在水中的电离方程式。 6-3 写出X和甲醇在浓硫酸存在下生成E的化学方程式。 6-4 写出E燃烧反应的化学方程式。 6-5 写出由E和NaH制备Z的化学反应方程式。
6-6 Z在水溶液里的稳定性与溶液pH有关,pH越大越稳定。为什么? 6-7近年来,用Z和过氧化氢构建一种新型碱性电池已成为热门的研究课题。该电池放电时,每摩尔Z释放8摩尔电子,标准电动势大于2 V。写出这种电池放电反应的离子方程式。
第7题 (13分) 分子筛是一种天然或人工合成的泡沸石型水合铝硅酸盐晶体。人工合成的分子筛有几十种,皆为骨架型结构,其中最常用的是A型、X型、Y型和丝光沸石型分子筛,化学组成可表示为Mm[AlpSiqOn(p+q)]·xH2O。 7-1 Si4+、Al3+ 和O2 的离子半径分别为41 pm、50 pm和140 pm,通过计算说明在水合铝硅酸盐晶体中Si4+和Al3+ 各占据由氧构成的何种类型的多面体空隙。
7-2 上述化学式中的n等于多少?说明理由。若M为2价离子,写出m与p的关系式。 7-3 X光衍射测得Si-O键键长为160 pm。此数据说明什么?如何理解? (2分) 7-4 说明以下事实的原因: ① 硅铝比(有时用SiO2/Al2O3表示)越高,分子筛越稳定;②最小硅铝比不小于1。
7-5 人工合成的A型分子筛钠盐,属于立方晶系,正当晶胞参数a=2464 pm,晶胞组成为Na96[Al96Si96O384]·xH2O。将811.5克该分子筛在1.01325×105 Pa、700℃加热6小时将结晶水完全除去,得到798.6升水蒸气(视为理想气体)。计算该分子筛的密度D。
第8题 ( 6分) 在25℃和101.325 kPa下,向电解池通入0.04193 A的恒定电流,阴极(Pt,0.1 mol L1 HNO3)放出氢气,阳极(Cu,0.1 mol L1 NaCl)得到Cu2+。用0.05115 mol L1的EDTA标准溶液滴定产生的Cu2+,消耗了53.12 mL。 8-1 计算从阴极放出的氢气的体积。
8-2 计算电解所需的时间(以小时为单位)。
第9题 (11 分) 9-1画出下列转换中A、B、C和D的结构简式(不要求标出手性)。 A (C14H26O4)B (C12H22O2)C (C12H24O2)D (C12H22Br2)
1. Mg/苯回流1. LiAlH
4
无水醚
2. H2O2. H2O
9-2 画出下列两个转换中产物1、2和3的结构简式,并简述在相同条件下反应,对羟基苯甲醛只得到一种产物,而间羟基苯甲醛却得到两种产物的原因。
CHO
OHCH3(CH2)11Br, K2CO3
丙酮,回流
1
CH3(CH2)11Br, K2CO3
丙酮,回流
2
CHOOH3
+
原因: 第10题 ( 7 分) 灰黄霉素是一种抗真菌药,可由A和B在三级丁醇钾/三级丁醇体系中合成,反应式如下:
(CH3)3COK/ (CH3)3COHOOOCH3H3COClO
OOCH3
H3COCl
OHCH3OH3COCCCCH+AB灰黄霉素OCHCH3CH3
10-1在下面灰黄霉素结构式中标出不对称碳原子的构型。 10-2 写出所有符合下列两个条件的B的同分异构体的结构简式: ① 苯环上只有两种化学环境不同的氢;② 分子中只有一种官能团。 10-3写出由A和B生成灰黄霉素的反应名称。 第11题 ( 9分) 化合物A由碳、氢、氧三种元素组成,分子量72,碳的质量分数大于60%。A分子中的碳原子均为sp3杂化。A与2-苯基乙基溴化镁在适当条件下反应后经水解生成B。B在质子酸的催化作用下生成C。经测定B分子只含1个不对称碳原子,其构型为R。请根据上述信息回答下列问题: 11-1 写出A的分子式。
11-2 画出A、B和C的结构简式(列出所有可能的答案)。
11-3 简述由手性化合物B合成C时手性能否被保留下来的理由。
2010年全国化学竞赛(初赛)试题与答案 第1题 (15分) 1-1 482492942097117CaBk Uus3n 482492932097117CaBk Uus4n
每式1分,画箭头也得 1分。两式合并为 23n+Uns5+Uns=Bk6+Ca629397294117249974820也得满分。 (2分) 1-2 sp3d3(1分)sp3d(1分)sp3(1分) 1-3