硫酸腐蚀原理及特点
- 格式:doc
- 大小:16.00 KB
- 文档页数:1

1 硫酸腐蚀原理及特点市面上的硫酸常见的浓度、状态及腐蚀特点表1特点备注腐蚀性浓度状态浓度以下的稀硫酸在所有温度都为还原性;1)65%电化学腐蚀特稀硫)稀硫酸对碳钢的腐蚀速率随浓度的提高而增2为主,腐蚀<5% 酸溶液是电化学腐蚀速50%强;达到一定浓度后(47%~性一般度的峰值点),腐蚀速率随浓度的提高而急剧下降;)同一浓度的稀硫酸随着温度的增加,腐蚀性会3电化学腐蚀加大;~5稀硫酸为主,腐蚀)杂质对腐蚀也有很大的影响,如含氟、氯等其465%溶液性非常强他离子;)介质流速越大、固相颗粒多也会加剧稀硫酸溶5 液的腐蚀性。
~~85%硫酸低温下为还原性,高温或沸点下65浓硫酸电化学腐蚀1)65%85%为主为氧化性;溶液硫酸及发烟硫酸在所有温度下都呈2)85%~100%高浓度氧化性腐蚀~85 氧化性;为主硫酸100% 浓硫酸具有吸水性,空气中水份也会使敞空的3) 浓硫酸变稀,对碳钢的腐蚀性增大;期间,随温度上升,其对碳钢的腐蚀4)65%~85% 速率下降;的硫酸中可形成钝化保护膜,5)~100%碳钢在80%发烟硫氧化性腐蚀>100%60℃~无冲刷、无充气、密封时可耐受在无流速、酸为主 80℃;以上的发烟硫酸,会破坏钝化膜,腐蚀速6)102%的发烟硫酸是120%度上升,碳钢和铸铁耐不了。
氧化性腐蚀的峰值点。
硫酸金属储罐外壁腐蚀主要为气相腐蚀,只是弱腐蚀,一般采取涂装防腐即可,不是这里讨论的重点。
碳钢在硫酸中发生的腐蚀过程是典型的电化学腐蚀。
其化学反应式表述如下:H2+FeS04Fe+H2S04→、温度都会值) 金属材料的本质、表面状态及金属阴极相杂质、硫酸浓度(pH影响到金属的氢去极化腐蚀。
此外,一些物理因素如介质流速、固相颗粒、结垢等也会影响硫酸的腐蚀性。
硫酸储罐的设计2类型及概况2.1也分为压力容器类和非压力容器类硫酸储塑料储罐和玻璃钢储罐,分钢制储罐、罐,还分为立式和卧式硫酸储罐。
本文仅讨论常压硫酸储罐。

硫酸储罐腐蚀穿孔原因及应对措施摘要:根据硫酸储罐在运行中发生的腐蚀、穿孔和渗漏问题,从硫酸腐蚀的发生、流速、液位波动、差压变送器、吹管、罐壁清洗等几个方面,对硫酸储罐腐蚀、穿孔和渗漏的成因进行了分析。
为了有效地控制硫酸储罐的腐蚀速度,分析其影响因素,确保硫酸储罐长时间的安全使用,还应根据硫酸储罐的具体服役情况,从而提出相应的处理措施。
关键词:硫酸储罐腐蚀温度液位硫酸是一种有机酸,其腐蚀强度很高。
它是化肥,医药,冶金,染料,人造纤维,精细化工,矿物加工,制药,炼油厂,以及各类有机及无机化学品的原材料。
在化学工业中得到了广泛的应用,素有“化工之母”的美称。
由于硫酸与三大元素(氨,磷,钾)和硫肥的母体是密不可分的,所以又被称作“肥料之母”。
由于硫酸极具腐蚀性,因此,在生产、运输、使用中,安全贮存是十分重要的。
合理选用硫酸储罐材料,合理对硫酸储罐进行设计,合理地管理和运用电化学保护、钝化保护和涂层保护,以保证硫酸储罐在生产中能够进行正常服役[[1]]。
1硫酸腐蚀原理及特点碳钢的腐蚀是一种典型的电化学腐蚀方法。
其化学反应如下:金属材料属性、表面条件、杂质、硫酸浓度(pH)、温度等因素都会对金属进行氢去极化腐蚀。
另外,平均流速、固体颗粒、污垢等物理因素也会对其产生一定的影响。
2硫酸储罐的设计2.1类型及概况硫酸的贮存可分为钢、塑料和玻璃纤维三种。
硫化胶又可分成印刷版和未印版两大类。
根据储罐的摆放方式又可分为垂直和横向两种。
在这篇文章中,只讨论了常温下的硫酸贮存。
由于没有大的水蒸汽压强,所以没有必要采用内部悬架。
为了隔绝空气,雨水和其他污染,需要用一块坚固的布来阻止容器内的液体泄露。
水箱的外壁装有加固件及其它支架,保证不会出现裂纹或其他问题。
为了安全起见,操作平台通常不安装在硫酸储罐顶部。
为了方便使用和维护,可以安装单独的工作台。
如果需要安装罐顶平台,在罐顶设计中应充分考虑罐顶平台、管道支架和其他设备的自重以及附加荷载。

硫酸盐对钢筋的腐蚀的原理
硫酸盐对钢筋的腐蚀原理主要涉及以下几个方面:
1. 酸性环境:硫酸盐可以溶于水形成硫酸溶液,其中产生的H+离子会使溶液呈酸性。
酸性环境会破坏钢筋表面的氧化膜,并加速钢筋的电化学反应。
2. 腐蚀电位差:钢筋和硫酸溶液之间存在电子交换,从而形成腐蚀电池。
在钢筋表面较高氧化态区域,金属会发生氧化反应,损失电子,转化为较低氧化态的离子。
在硫酸溶液中较低氧化态区域,硫酸盐会接受电子,转化为较高氧化态的物质。
这种电子的交换会导致钢筋表面发生电化学腐蚀。
3. 硫酸盐离子的侵蚀性:硫酸盐离子具有较强的侵蚀性,可以直接侵蚀钢筋表面的氧化膜,进而影响钢筋的物理性能和耐腐蚀性。
综上所述,硫酸盐对钢筋的腐蚀主要是通过酸性环境、腐蚀电位差以及硫酸盐离子的侵蚀性等方式,导致钢筋表面的氧化膜破坏,进而加速钢筋的腐蚀过程。

浓硫酸烧伤皮肤的原理浓硫酸烧伤皮肤的原理什么是浓硫酸烧伤浓硫酸烧伤是一种严重的化学烧伤,常常导致严重的组织损伤和疤痕形成。
浓硫酸具有强酸性,与皮肤接触后会引起剧烈的化学反应,导致组织腐蚀和破坏。
硫酸的化学性质硫酸(H2SO4)是一种无色、无臭的液体,具有强烈的腐蚀性。
它能够与水反应,释放出大量的热量,并且与许多物质发生反应。
硫酸具有很强的溶解性,可以溶解许多物质,使其分解或转化成其他化合物。
浓硫酸烧伤的原理1.吸湿反应:浓硫酸具有很强的亲水性,能够迅速吸湿,将水分从空气中吸收到其分子中。
当浓硫酸接触到皮肤上的水分时,会发生剧烈的吸湿反应,释放出大量的热量。
2.脱水反应:硫酸分子中的氢离子(H+)具有很强的氧化性,它可以与皮肤上的氢氧根离子(OH-)反应,形成水分子。
这个过程被称为脱水反应,通过脱去水分,使皮肤组织中的细胞和蛋白质发生严重损伤。
3.组织腐蚀:浓硫酸能够与皮肤中的脂肪酸和蛋白质等有机物质发生反应,形成破坏组织的硫酸酯。
这些硫酸酯具有强烈的腐蚀性,可以导致皮肤组织的溶解和破坏。
浓硫酸烧伤的损伤程度浓硫酸烧伤的损伤程度取决于以下因素:1.浓度:浓硫酸的浓度越高,其腐蚀和破坏作用越强。
2.接触时间:接触时间越长,硫酸对皮肤的腐蚀作用就越充分。
3.面积:烧伤的面积越大,损伤就越严重。
4.处理方式:及时冲洗是处理浓硫酸烧伤的关键步骤,能够减轻其对皮肤的损伤程度。
急救处理在遇到浓硫酸烧伤时,应采取以下急救处理措施:1.立即将受伤部位放入冷水中冲洗,持续冲洗至少20分钟。
2.打电话召唤急救人员,并告知他们有关伤情和接触的化学物质。
3.尽量避免烧伤部位的摩擦或揉搓,以免加重损伤。
4.尽快将伤员送至医院,接受专业治疗。
结论浓硫酸烧伤是一种严重的化学烧伤,其烧伤原理主要包括吸湿反应、脱水反应和组织腐蚀。
了解烧伤原理可以增强我们对浓硫酸烧伤的防范意识,并在发生事故时采取及时有效的急救措施保护受伤者。

硫酸腐蚀原理及特点硫酸是世界上使用最广泛的工业化学品之一,有着广泛的应用领域。
然而,它也是一种非常强腐蚀性的化学物质,具有高度危险性。
在了解硫酸腐蚀的原理和特点之前,我们先来了解一下硫酸的化学性质。
硫酸(H2SO4)是一种无色、无臭的液体,具有很强的酸性。
它可以与许多物质发生反应,生成有机、无机化合物。
硫酸具有三个质子,因此它可以与金属、无机盐、有机物等广泛反应。
硫酸腐蚀的原理主要包括以下几个方面:1.水解反应:硫酸具有很强的亲水性,容易吸湿。
当硫酸与水接触时,会发生水解反应,生成大量的热量。
这种水解反应使得硫酸具有较强的腐蚀性,可以溶解金属。
H2SO4+H2O→H3O++HSO4-2.中和反应:硫酸酸性较强,它可以与碱反应,中和产生盐和水。
这种中和反应是硫酸腐蚀的另一重要原理。
H2SO4+2NaOH→Na2SO4+2H2O3.氧化反应:硫酸中的氧原子有很强的氧化性。
它可以与许多物质发生氧化反应,导致物质的腐蚀和损坏。
HSO4-+3e-→SO4^2-+H2O硫酸腐蚀的主要特点如下:1.强腐蚀性:硫酸是一种具有很强腐蚀性的酸,能够溶解金属,损坏有机物和无机物。
它可以破坏物质表面的保护层,导致物质的腐蚀和损坏。
2.速度较快:由于硫酸的强腐蚀性,它可以迅速反应并溶解物质。
在一些情况下,腐蚀速度甚至达到令人惊讶的程度。
因此,在处理硫酸的过程中需要特别小心。
3.影响广泛:硫酸的腐蚀性很强,可以影响很多不同的材料和物质。
它可以腐蚀金属、玻璃、陶瓷等无机物,也可以损坏有机物,如纺织品、橡胶等。
4.容易溅溶:硫酸是一种极易溅溶的物质,它可以溅溶到空气中或人体上,对环境和人体健康造成严重伤害。
因此,在使用和储存硫酸时需要注意安全措施。
总结起来,硫酸腐蚀的原理主要包括水解、中和和氧化等反应。
它具有强腐蚀性,速度较快,对不同的材料和物质都有影响。
在使用硫酸时,必须小心谨慎,并采取适当的安全措施,以减少腐蚀的危害。


硫酸的危险特性及防护措施硫酸是一种广泛使用的化学物质,具有很多危险特性,需要我们在使用和处理时采取相应的防护措施。
本文将探讨硫酸的危险特性,并提供一些有效的防护措施。
1. 硫酸的危险特性硫酸是一种强酸,具有腐蚀性和氧化性。
以下是硫酸的一些危险特性:1.1 腐蚀性:硫酸可以与许多金属和有机物发生反应,导致他们的腐蚀和破坏。
当硫酸接触皮肤、眼睛或呼吸道时,会引起灼伤、刺激和组织损害。
1.2 氧化性:硫酸具有强氧化性,可以促使其他物质的氧化反应。
当与可燃物质接触时,容易引发火灾或爆炸。
1.3 蒸汽和气体:硫酸在常温下是一种无色液体,但在加热或喷雾时,会产生腐蚀性、有毒的蒸汽和气体。
这些蒸汽和气体可以引起眼睛和呼吸道的刺激,对人体健康造成危害。
2. 防护措施为了保护自身以及周围环境的安全,我们需采取适当的防护措施来处理硫酸。
以下是一些有效的防护措施:2.1 个人防护装备:在与硫酸接触时,必须佩戴适当的个人防护装备,包括护目镜,化学防护口罩,橡胶手套,橡胶靴等。
这些装备可以防止硫酸接触到皮肤、眼睛和呼吸道,减少相关伤害的风险。
2.2 通风设施:硫酸的使用和存储地点应该配备良好的通风设施,确保室内气体的流通,降低有害蒸汽和气体的浓度。
这可以保护工作人员的健康,并防止爆炸等意外事件的发生。
2.3 储存和处理:硫酸应储存在特定的安全容器中,并与其他物质隔离开来。
储存区域应标明警示标志,以提醒人们注意腐蚀和氧化的危险性。
在处理硫酸时,需要采取安全操作,并确保在安全环境下进行。
任何泄露都应立即妥善处理,避免进一步的伤害和污染。
2.4 废物处理:处理硫酸废物时,必须遵守相关法规和环境保护政策。
废物应经过正确的处理和处置,以减少对环境的污染。
2.5 应急响应计划:建立一个全面的应急响应计划,以应对可能发生的事故和泄漏。
培训员工如何处理紧急情况,并提供相关应急设备和材料,以确保及时有效的应对。
总结:硫酸是一种危险的化学物质,具有腐蚀性和氧化性。
硫酸储罐的选材与防腐措施文/本刊特约撰稿人欧阳自强摘要:本文为51fangfu论坛有关硫酸储罐防腐精华贴的总结,它系统分析了不同浓度、不同温度、不同状态硫酸腐蚀的原理及特点,探讨了各种状况下硫酸储罐的选材、防腐和安全问题,并提出了相应的防腐保护措施,尤其是对“树脂重防腐”在硫酸储罐领域的应用作了较深度的分析。
关键词:硫酸储罐;防腐蚀;树脂重防腐中图分类号:文献标识码:文章编号:0前言硫酸是活泼的无机强酸之一,它是化肥、医药、冶金、染料、化纤、精细化工、矿物加工、制药、石油炼制和各类有机无机化工行业的不可或缺的催化剂、溶剂和生产原料,因此在化工行业的广泛应用而号称“化工之母”。
硫酸因与肥料三要素(氨、磷、钾)及硫基肥所制造的母体作用有密不可分的联系,更是被称为“化肥之母”。
由于硫酸具有很强的腐蚀性,所以在生产、运输和使用过程中,硫酸的安全储存是一个非常重要的环节。
为了保证储存设施能安全运行,应正确选材、合理设计、妥善管理,系统地运用电化学保护、钝化、覆盖层保护等多种手段加以保护。
欧阳依据多年的经验,对此问题进行了一些研究和探讨,汇总了51fangfu论坛相关精华帖观点[1],以期与同行商榷、探讨。
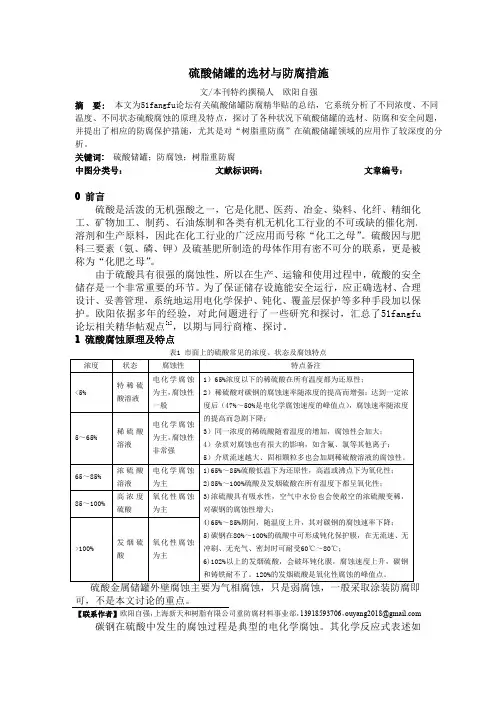
1硫酸腐蚀原理及特点表1市面上的硫酸常见的浓度、状态及腐蚀特点浓度状态腐蚀性特点备注<5%特稀硫酸溶液电化学腐蚀为主,腐蚀性一般1)65%浓度以下的稀硫酸在所有温度都为还原性;2)稀硫酸对碳钢的腐蚀速率随浓度的提高而增强;达到一定浓度后(47%~50%是电化学腐蚀速度的峰值点),腐蚀速率随浓度的提高而急剧下降;3)同一浓度的稀硫酸随着温度的增加,腐蚀性会加大;4)杂质对腐蚀也有很大的影响,如含氟、氯等其他离子;5)介质流速越大、固相颗粒多也会加剧稀硫酸溶液的腐蚀性。
5~65%稀硫酸溶液电化学腐蚀为主,腐蚀性非常强65~85%浓硫酸溶液电化学腐蚀为主1)65%~85%硫酸低温下为还原性,高温或沸点下为氧化性;2)85%~100%硫酸及发烟硫酸在所有温度下都呈氧化性;3)浓硫酸具有吸水性,空气中水份也会使敞空的浓硫酸变稀,对碳钢的腐蚀性增大;4)65%~85%期间,随温度上升,其对碳钢的腐蚀速率下降;5)碳钢在80%~100%的硫酸中可形成钝化保护膜,在无流速、无冲刷、无充气、密封时可耐受60℃~80℃;6)102%以上的发烟硫酸,会破坏钝化膜,腐蚀速度上升,碳钢和铸铁耐不了。

硫酸储罐安装安全技术规范硫酸是基本化学工业中重要产品之一,在国民经济中的应用十分广泛,是有色冶化纤、化肥工业以及各种有机和无机化学工业的重要原料。
由于硫酸对金属具有很强的腐蚀性,所以在生产、运输和使用过程中,硫酸的安全储存是非常重要的环节。
1.硫酸腐蚀的原理碳钢在硫酸中发生的腐蚀过程是典型的电化学腐蚀。
金属材料的本质、表面状态及金属阴极相杂质、pH值、温度都会影响到金属的氢去极化腐蚀。
商业上得到的一般是如下浓度的硫酸:50%、77.67%、93%、 98%、99%、100%,不同浓度的硫酸,其腐蚀性具有如下突出特征:在一定的温度下,稀硫酸对碳钢的腐蚀速率随浓度的提高而增强;达到一定浓度后,腐蚀速率随浓度的提高而急剧下降。
硫酸的腐蚀的另一个特点是,同一浓度的硫酸随着温度的增加,腐蚀性会大大增加。
硫酸的腐蚀性除与浓度和温度有关外,酸中的杂质对腐蚀也有很大的影响。
一些物理因素如介质流速、固相颗粒、结垢等也影响腐蚀性。
2.硫酸储罐区的设计2.1罐设计浓度为68-99.5%的硫酸,在40℃下对碳钢的腐蚀速率<0.75 -1 mm/a。
这在保证一定的腐蚀裕量及在储存的情形下,通常是可以接受的。
由于稀硫酸即使在较低的温度下腐蚀性也很大,因此需要采用更耐腐蚀的材料,如在一定的浓度及温度下可以釆用316L不锈钢。
因此,常温下的浓硫酸储罐通常选用碳钢材料就可以满足要求,稀硫酸储罐可以用玻璃钢或PVC、钢衬PO储罐的,具体还可以查《腐蚀数据与选材手册》。
2.2结构设计硫酸储罐一般应至少包括如下管口:硫酸进口、硫酸出口、溢流口、放空口(呼吸阀)、顶部人孔、底部人孔。
为减少泄漏,硫酸进口般设置在罐顶,并使管口距离罐顶内壁至少1200mm,防止进酸时对罐顶部位形成冲刷,腐蚀进口管附近部位。
为保护罐底,在罐底正对进口管末端的相应位置设置防冲板,用耐酸瓷板或红硅酸盐石板代替。
为防止介质的虹吸现象,硫酸人口管线应开放空孔,一般只需要加在进酸管线上。

硫酸腐蚀性及防护技术硫酸是一种具有极强腐蚀性的化学物质,广泛应用于许多工业领域,如炼油、化肥生产、金属处理等。
然而,由于其强腐蚀性,必须采取适当的防护技术来降低潜在的危害。
本文将介绍硫酸的腐蚀性特点,同时探讨一些常用的硫酸防护技术。
一、硫酸的腐蚀性特点硫酸是一种无色、无臭的液体,具有强烈的腐蚀性。
其腐蚀性主要体现在以下几个方面:1. 腐蚀物质:硫酸能与许多金属及其氧化物反应生成相应的金属硫酸盐,导致金属结构的破坏和材料的腐蚀。
2. 刺激性:硫酸可造成皮肤、眼睛等人体组织的灼伤和刺激,严重时可引发组织坏死。
3. 放热性:硫酸与水反应时会放出大量的热量,可能引发热量积聚和爆炸。
基于硫酸的腐蚀性特点,我们有必要采取相应的防护技术来确保人身安全和设备的正常运行。
二、硫酸防护技术为了降低硫酸的腐蚀性带来的危害,可以采取以下几种硫酸防护技术:1. 个人防护措施在接触硫酸时,应采取必要的个人防护,包括佩戴防护眼镜、手套和防护服等。
同时,注意在通风良好的环境下操作,避免硫酸蒸气对呼吸系统的伤害。
2. 设备防护对于与硫酸接触的设备,可以采用以下措施来保护其免受腐蚀:a. 材料选择:选择对硫酸有良好抗腐蚀性的材料,如不锈钢、聚丙烯等。
b. 涂层保护:在设备表面涂覆陶瓷、聚合物等腐蚀抗性涂层,形成防护层,减少硫酸对设备的侵蚀。
3. 密封措施在硫酸的储存和运输过程中,需要采取密封措施,防止硫酸泄漏造成环境污染和人员伤害。
同时,确保储罐、管道等设施的完整性,防止硫酸通过漏洞进一步侵蚀其他设备和建筑物。
4. 废液处理硫酸使用后产生的废液必须经过专业处理,禁止随意排放到环境中。
采用合适的废液处理方法,如中和、沉淀、稀释等,将废液处理至达标排放标准,降低对环境的污染风险。
总结:硫酸具有极强的腐蚀性,对人体和设备造成潜在的危害。
为了减少腐蚀带来的危险,必须采取一系列的防护技术措施,包括个人防护、设备防护、密封措施和废液处理等。
只有合理应用这些防护技术,才能够确保硫酸的安全使用,减少腐蚀带来的危害。
硫酸的用途和特点是什么硫酸是一种常见的无机化合物,其化学式为H2SO4。
它是一种无色、无臭、油状液体,在常温下比重较大,具有强酸性。
硫酸的应用非常广泛,涵盖了许多不同领域,以下是其主要用途和特点。
一、用途:1. 工业用途:硫酸是许多工业过程中的关键原料。
它用于制造肥料、洗衣粉、染料、塑料、纸张、石膏、玻璃等各种日常生活和工业用品。
例如,在化肥生产中,硫酸用于制造磷酸铵、钾硫酸等。
在纸浆和造纸工业中,硫酸用于脱墨和漂白过程。
在矿业和冶金工业中,硫酸用于从矿石中提取金属等。
2. 实验室用途:硫酸是一种常用的酸性试剂,在化学实验室中用于处理和分析各种物质。
它可以用作酸性媒介溶解有机和无机物质,促进反应的进行。
此外,硫酸还用于控制实验室中的PH值和温度。
3. 蓄电池用途:硫酸是一种重要的电解质,用于蓄电池的正负极板之间的电解液。
在蓄电池中,硫酸通过化学反应释放离子,并在正负极板之间形成电势差,从而产生电能。
4. 医药用途:硫酸是许多医药制剂的原料。
它用作氯化亚铁的溶剂,用于治疗贫血。
此外,硫酸还用于制造药片、胶囊和注射液等药物的配制过程。
5. 石油工业用途:硫酸在石油开采和炼油过程中起到重要作用。
它用于清洗和脱硫石油管道、储罐和设备,以去除残留物和杂质。
6. 纺织工业用途:硫酸是染料和纤维素纤维处理的重要化学药剂。
它用于染料固定、废水处理以及棉、麻、维尼纶等纤维的脱胶和增白过程。
二、特点:1. 强酸性:硫酸是一种强酸,具有强烈的腐蚀性。
它能与许多物质反应,产生大量的热和气体。
因此,在使用硫酸时需要特别小心,并采取必要的安全措施。
2. 易溶性:硫酸是一种极易溶解于水的物质。
在与水接触时会迅速溶解,并释放出大量的热量。
这种溶解性使得硫酸易于在各个领域中应用,并能与其他物质充分混合和反应。
3. 腐蚀性:由于硫酸的强酸性和易溶性,它对许多物质具有强烈的腐蚀作用。
因此,在处理硫酸时需要注意避免与皮肤、眼睛和其他敏感部位的接触,并采取适当的安全措施。
硫酸腐蚀的原理硫酸能在水中电离生成 H+、HSO4+和 SO42-,其电离度随着浓度的上升而增大,当含量达到 85%时,电离度最大,浓度再上升,电离度急剧减少,非电离的分子态硫酸迅速增加。
硫酸的氧化性和还原性大致可作如下划分:含量<65%,在一切温度下均呈还原性;含量为 65%~85%,在低温下呈还原性,在高温或沸点下呈氧化性;含量>85%或发烟酸,在一切温度下都呈氧化性。
硫酸的氧化性和还原性主要受氢离子浓度和氧的溶解度影响。
在 25℃时,氢离子浓度随着硫酸浓度的增加而增加,直到浓度约为 30%时达到最大值,然后下降。
氧的溶解度在低酸浓度时是最高的,在大约 75%的硫酸时达到最低。
氧气的溶解度随着温度的升高而增加,在大约 80℃时达到最大值,然后在沸点时降低到零。
二者综合的影响是,沸腾的稀酸和中等浓度的硫酸具有高度的还原性和腐蚀性,因为它具有较高氢离子浓度和较低溶解度的氧。
浓酸是强氧化性的,因为它具有高溶解度的氧和较低的氢离子浓度。
稀硫酸是典型的还原性酸,在氢气的作用下腐蚀金属(如锌、铁)。
当浓度上升至 25%,硫酸开始变得具有氧化性,在室温下被细碎的镍还原,在沸点下被合金 400(67%镍,30%铜;N04400)还原。
温热的25%酸对钢或不锈钢仍有还原作用。
(稀硫酸中的氢离子浓度在25-30%的酸中达到最大约 2g/L,在 70%时减少到约 0.8g/L)。
浓硫酸(>70%)既可以作为还原性酸,也可以作为氧化性酸,这取决于所接触的具体材料和介质中的杂质。
在与钢或铸铁接触时,阴极反应是典型还原性酸的析氢反应,只有通过不溶性硫酸亚铁的积累(即阳极极化)才能抑制腐蚀。
该原理允许在没有氧化性杂质的情况下,含 28%钼的镍基合金(如合金 B-2[N10665]、B-3[N10675]和 B-4[N10629])在高温下使用。