(新课标)2020高考化学二轮复习第Ⅱ(四)物质结构与性质(选考)[含答案]
- 格式:pdf
- 大小:341.36 KB
- 文档页数:9

2.(20xx·湖南名校大联考)钛被称为继铁、铝之后的第三金属,回答下列问题:(1)基态钛原子的价电子排布图为________________________,金属钛晶胞如图1所示,为________(填堆积方式)堆积。
(2)已知TiCl4在通常情况下是无色液体,熔点为-24℃,沸点为136℃,可知TiCl4为________晶体。
图1(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。
化合物乙的沸点明显高于化合物甲,主要原因是______________ ________________。
化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________。
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为________。
(5)钙钛矿晶体的结构如图4所示。
钛原子位于立方晶胞的顶角,被________个氧原子包围成配位八面体;钙原子位于立方晶胞的体心,被________个氧原子包围,钙钛矿晶体的化学式为________。
[解析] (1)Ti为22号元素,由构造原理可知基态Ti原子的3d 能级和4s能级上各有2个电子,则其价电子排布图为;由题图1可知,钛晶体的堆积方式为六方最密堆积。
(2)根据TiCl4在通常情况下呈液态,且熔沸点较低,可知TiCl4为分子晶体。
(3)化合物乙能形成分子间氢键,而化合物甲不能形成分子间氢键,故化合物乙的沸点明显高于化合物甲。
化合物乙中采取sp3杂化的原子有C、N、O,第一电离能N >O>C。
(4)如题图3所示,每个O原子被2个Ti原子共用,每个Ti原子被2个O原子共用,由均摊法可知该阳离子中Ti、O原子个数之比为1∶1,结合Ti为+4价,O为-2价,故该阳离子的化学式为TiO2+(或[ TiO]2n+n)。
(5)钛原子位于立方晶胞的顶角,被6个氧原子包围成配位八面体;钙原子位于立方晶胞的体心,被12个氧原子包围;每个晶胞中含有的钛原子和钙原子均为1个,晶胞的12个边上各有一个氧原子,根据均摊法可知每个晶胞实际占有的氧原子数为12×1 4=3,故该钙钛矿晶体的化学式为CaTiO3。

绝密★启用前2020年高考化学二轮复习验收测试《物质结构与性质》本试卷共100分,考试时间90分钟。
一、单选题(共15小题,每小题4.0分,共60分)1.下列说法不正确的是()A.离子晶体的晶格能越大,离子键越强B.阳离子的半径越大则可同时吸引的阴离子越多C.通常阴、阳离子的半径越小、电荷越大,该阴阳离子组成的离子化合物的晶格能越大D.拆开1mol离子键所需的能量叫该离子晶体的晶格能2.对下列物质溶于水时破坏的作用力描述错误的是()A.氯化钠,破坏了离子键B.氯化氢,破坏了共价键C.蔗糖,破坏了分子间作用力D.二氧化碳,没有破坏作用力3.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )A. HeB.C. 1s2D.4.设N A为阿伏加德罗常数的值。
下列叙述正确的是()A.在SiO2晶体中1mol硅原子形成的Si-O键为2N AB. 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1N AC.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5N A D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1N A 5.在[Cu(NH3)4]2+离子中NH3与中心离子Cu2+结合的化学键是() A.离子键B.非极性键C.极性键D.配位键6.下列物质中含有非极性键的共价化合物是()A. CCl4B. Na2O2C. C2H4D. CS27.有关晶体的叙述中正确的是()A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子B.在28g晶体硅中,含Si-Si共价键个数为4N AC.金刚石的熔沸点高于晶体硅,是因为C-C键键能小于Si-Si键D.镁型和铜型金属晶体的配位数均为128.下列化合物中含有手性碳原子的是()A. C F2B. CH3CH3C.——COOHD. CH3CH2OH9.报道合成和分离含高能量的正离子N5+的化合物N5AsF6,下列叙述正确的是()A. N5+与H2S是等电子体B. N5+中氮氮原子间以共用电子对结合C. N5AsF6化合物是共价合物D. N5AsF6是极性分子10.下列化学式表示物质分子组成的是()A. NaClB. CO2C. CuD. SiO211.Co(Ⅲ)的八面体配合物为CoCl m·n NH3,若1 mol该配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是()A.m=1,n=5B.m=3,n=4C.m=5,n=1D.m=4,n=512.下列排序正确的是( )A.酸性:H2CO3<C6H5OH<CH3COOHB.碱性:Ba(OH)2<Ca(OH)2<KOHC.熔点:MgBr2<SiCl4<BND.沸点:PH3<NH3<H2O13.下列晶体熔沸点由高到低的顺序正确的是()①SiC②Si③HCl④HBr⑤HI⑥CO⑦N2⑧H2A.①②③④⑤⑥⑦⑧B.①②⑤④③⑥⑦⑧C.①②⑤④③⑦⑥⑧D.⑥⑤④③②①⑦⑧14.下列说法正确的是( )A.分子晶体中一定存在分子间作用力,不一定存在共价键B.分子中含两个氢原子的酸一定是二元酸C.含有金属离子的晶体一定是离子晶体D.元素的非金属型越强,其单质的活泼型一定越强15.下列分子构型为正四面体的是( )①P2②NH3③CCl4④CH4⑤H2S ⑥CO2A.①③④⑤B.①③④⑤⑥C.①③④D.④⑤二、非选择题(共4小题,每小题10.0分,共40分)16.X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体。

×12=+12孤电子对数为2=6+2中氧原子的价层电子对数为+1 2②若KIO 3晶胞中处于左下角顶角的K 原子的坐标参数为(0,0,0).位于下底面面心位置的O 原子的坐标参数为⎝ ⎛⎭⎪⎫12,12,0.在KIO 3晶胞结构的另一种表示中.I 处于各顶角位置.设左下角顶角的I 原子的坐标参数为(0,0,0).则K 原子的坐标参数为____________。
[解析] (1)①该晶胞中含有黑球个数为8×18+6×12=4.白球个数为8.根据UO 2的化学式可知.白球代表氧原子;一个U 原子周围有8个氧原子与其最邻近.则U 原子的配位数为8。
②由晶胞结构可知.该晶胞中含有的U 原子数为4.含有的O 原子数为8.则晶胞中原子的总体积为43πr 31×4+43πr 32×8) cm 3.由晶体的密度及晶胞的结构可得该晶胞的体积为238×4+16×8dNAcm 3.所以该晶胞的空间利用率为43πr31×4+43πr32×8238×4+16×8dNA×100%。
,(2)①NiO 和FeO 均为离子晶体.且晶体中阴、阳离子所带电荷数均相同.由于半径:Fe 2+>Ni 2+.则晶格能:FeO<NiO.由此可判断熔点:NiO>FeO 。
②由均摊法可知.该晶胞中La 原子个数为8×18=1.Ni 原子个数为8×12+1=5.则该合金的化学式为LaNi 5。
由晶胞图示可知晶胞体积为a ×a ×sin60°×c cm 3=32a 2c cm 3.则有1NA ×(139+59×5)g·mol -1=ρ×32a 2c g.解得N A =8683a2cρmol -1。
,(3)①K 、O 构成面心立方结构.K 的配位数为12;该晶胞中K 的个数为8×18=1.I 的个数为1.O 的个数为6×12=3.则晶体密度为(39+127+16×3)/[N A ·(a ×10-7)3] g·cm -3或214/[N A ·(a ×10-7)3] g·cm -3。

目夺市安危阳光实验学校课时跟踪检测(三十九)“物质结构与性质”选考题1.钛及其化合物的应用越来越受到人们的关注。
(1)基态Ti原子核外电子排布的能量最高的能级符号是______。
与钛同周期的元素中,基态原子的未成对电子数与钛相同的有________种。
(2)钛比钢轻,比铝硬,是一种新兴的结构材料。
钛硬度比铝大的原因是_________________________________________________________________ _______。
(3)催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图所示。
①M中,碳原子的杂化形式有________种。
②M中,不含________(填标号)。
a.π键b.σ键c.配位键d.氢键e.离子键(4)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。
其晶胞结构(晶胞中相同位置的原子相同)如图所示。
①4个微粒A、B、C、D中,属于氧原子的是________。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,________,________);钛氧键键长d=________(用代数式表示)。
解析:(1)基态Ti原子核外电子排布式为1s22s22p63s23p63d24s2,能量最高的能级符号为3d。
钛的3d能级上有2个未成对电子,第四周期元素中,基态原子的未成对电子数为2的元素还有Ni(3d84s2)、Ge(4s24p2)、Se(4s24p4),共3种。
(2)钛、铝均为金属晶体,其硬度取决于金属键强弱。
Ti原子的价电子数比Al多,金属键更强,因此钛硬度比铝大。
(3)①M 的结构如图,1类碳原子的杂化类型为sp2,2类碳原子的杂化类型为sp3。
②M 中,C—C键、C—H键、C—O键、Ti—Cl键属于σ键,苯环中存在大π键、Ti与O间存在配位键,M中不存在氢键与离子键。

2020年普通高等学校招生全国统一考试理科综合能力测试化学可能用到的相对原子质量:H1C12N14O16Mg24S32Fe56Cu64一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的。
1.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。
挹其水熬之则成胆矾,烹胆矾则成铜。
熬胆矾铁釜,久之亦化为铜”。
下列有关叙述错误的是A.胆矾的化学式为CuSO4B.胆矾可作为湿法冶铜的原料C.“熬之则成胆矾”是浓缩结晶过程D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应【答案】A【解析】【详解】A.胆矾为硫酸铜晶体,化学式为CuSO4 5H2O,A说法错误;B.湿法冶铜是用铁与硫酸铜溶液发生置换反应制取铜,B说法正确;C.加热浓缩硫酸铜溶液可析出胆矾,故“熬之则成胆矾”是浓缩结晶过程,C说法正确;D.铁与硫酸铜溶液发生置换反应生成铜,D说法正确。
综上所述,相关说法错误的是A,故选A。
2.某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉淀。
根据实验现象可判断其组成为A.KCl、NaClB.KCl、MgSO4C.KCl、CaCO3D.MgSO4、NaCl【答案】B【解析】【详解】①混合物溶于水,得到澄清透明溶液,则不含CaCO3,排除C选项;②做焰色反应,通过钴玻璃可观察到紫色,可确定含有钾元素,即含有KCl;③向溶液中加碱,产生白色沉淀,则应含有MgSO4,综合以上分析,混合物由KCl和MgSO4两种物质组成,故选B。
3.二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。
下列叙述错误的是A.海水酸化能引起3HCO -浓度增大、23CO -浓度减小B.海水酸化能促进CaCO 3的溶解,导致珊瑚礁减少C.CO 2能引起海水酸化,其原理为3HCO -H ++23CO -D.使用太阳能、氢能等新能源可改善珊瑚的生存环境【答案】C【解析】【详解】A .海水酸化,H +浓度增大,平衡H ++2-3CO ⇌-3HCO 正向移动,2-3CO 浓度减小,-3HCO 浓度增大,A 正确;B .海水酸化,2-3CO 浓度减小,导致CaCO 3溶解平衡正向移动,促进了CaCO 3溶解,导致珊瑚礁减少,B 正确;C .CO 2引起海水酸化的原理为:CO 2+H 2O ⇌H 2CO 3⇌H ++-3HCO ,-3HCO ⇌H ++2-3CO ,导致H +浓度增大,C 错误;D .使用太阳能、氢能等新能源,可以减少化石能源的燃烧,从而减少CO 2的排放,减弱海水酸化,从而改善珊瑚礁的生存环境,D 正确;答案选C 。

绝密★启用前人教版 2020 寒假高三化学二轮复习物质结构与性质(选考) 练习本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间150分钟。
分卷I一、单选题(共10小题,每小题4.0分,共50分)1.下列各组表述中,两个原子不属于同种元素原子的是()A. 3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子C. M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子2.下列化学式表示物质分子组成的是()A. NaClB. CO2C. CuD. SiO23.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是()A.开始滴加氨水时形成的难溶物为Cu(OH)2B.沉淀溶解后,将生成深蓝色的配合离子[Cu(OH)4]2+,配位数为4C.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道4.下列描述中正确的是()A. ClO2-的空间构型为平面三角形B. SiF4和SO32-的中心原子均为sp3杂化C.在所有的元素中,氟的第一电离能最大D. C2H5OH分子中共含有8个极性键,1个π键5.正硼酸(H3BO3)是一种层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。
下列有关说法正确的是()A.正硼酸晶体属于原子晶体B. H3BO3分子的稳定性与氢键有关C.分子中硼原子最外层为8电子稳定结构D.含1mol H3BO3的晶体中有3mol氢键6.下列说法错误的是()A.如果某化合物只含共价键,则其一定是共价化合物B.焓变小于0而熵变大于0的反应肯定是自发反应C.对于给定条件下反应物之间同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的比率D.绿色化学的核心是利用化学原理对产生的环境污染进行治理7.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5则下列有关比较中正确的是()A.第一电离能:④>③>②>①B.原子半径:④>③>②>①C.电负性:④>③>②>①D.最高正化合价④>③=②>①8.下列关于晶体的叙述中,正确的是()A.原子晶体中,共价键的键能越大,熔、沸点越高B.分子晶体中,分子间的作用力越大,该分子越稳定C.分子晶体中,共价键的键能越大,熔、沸点越高D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体9.下列判断错误的是()A.熔点:Si3N4>NaCl>SiI4B.沸点:NH3>PH3>AsH3C.酸性:HClO4>H2SO4>H3PO4D.碱性:NaOH>Mg(OH)2>Al(OH)310.下列有关作用力的说法正确的是()A.金属键、离子键、分子间作用力都没有方向性和饱和性B.键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱C.离子键、金属键、氢键、范德华力本质上都是静电作用D.乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键二、双选题(共4小题,每小题5.0分,共20分)11.关于下列分子的说法不正确的是________。
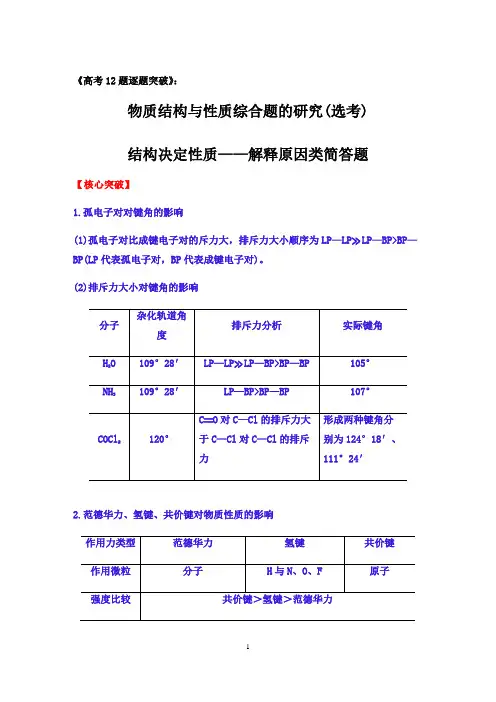
《高考12题逐题突破》:物质结构与性质综合题的研究(选考)结构决定性质——解释原因类简答题【核心突破】1.孤电子对对键角的影响(1)孤电子对比成键电子对的斥力大,排斥力大小顺序为LP—LP≫LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)。
(2)排斥力大小对键角的影响2.范德华力、氢键、共价键对物质性质的影响3.晶体熔、沸点高低的比较(1)一般情况下,不同类型晶体的熔、沸点高低规律:原子晶体>离子晶体>分子晶体,如:金刚石>NaCl>Cl2;金属晶体>分子晶体,如:Na>Cl2(金属晶体熔、沸点有的很高,如钨、铂等,有的则很低,如汞等)。
(2)形成原子晶体的原子半径越小、键长越短,则键能越大,其熔、沸点就越高,如:金刚石>石英>碳化硅>晶体硅。
(3)形成离子晶体的阴、阳离子的电荷数越多,离子半径越小,则离子键越强,熔、沸点就越高,如:MgO>MgCl2,NaCl>CsCl。
(4)金属晶体中金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔、沸点就越高,如Al>Mg>Na。
(5)分子晶体的熔、沸点比较规律①组成和结构相似的分子,相对分子质量越大,其熔、沸点就越高,如:HI>HBr >HCl;②组成和结构不相似的分子,分子极性越大,其熔、沸点就越高,如:CO>N2;③同分异构体分子中,支链越少,其熔、沸点就越高,如:正戊烷>异戊烷>新戊烷;④同分异构体中的芳香烃及其衍生物,邻位取代物>间位取代物>对位取代物,如:邻二甲苯>间二甲苯>对二甲苯。
4.答题模板——结构决定性质简答题首先叙述结构,然后阐述原理,最后回扣本题结论。
【经典例题】例(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。
从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________________________________________________________________ ___。

[全国卷]1.(2019·全国卷Ⅲ)磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。
回答下列问题:(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________,其中Fe的配位数为________。
(3)苯胺()的晶体类型是________。
苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是____________。
(4)NH4H2PO4中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。
焦磷酸根离子、三磷酸根离子如图所示:这类磷酸根离子的化学式可用通式表示为________(用n代表P 原子数)。
[解析](1)由元素周期表中的“对角线规则”可知,与Li的化学性质最相似的邻族元素是Mg;Mg为12号元素,M层只有2个电子,排布在3s轨道上,故M层的2个电子自旋状态相反。
(2)Fe 能够提供空轨道,而Cl能够提供孤电子对,故FeCl3分子双聚时可形成配位键。
由常见AlCl3的双聚分子的结构可知FeCl3的双聚分子的结构式为,其中Fe的配位数为4。
(3)苯胺为有机物,结合题给信息中苯胺的熔、沸点可知苯胺为分子晶体。
苯胺中有—NH2,分子间可形成氢键,而甲苯分子间不能形成氢键,分子间氢键可明显地提升分子晶体的熔、沸点。

2020 届高考化学二轮通用题:原子构造与性质练习及答案专题:原子构造与性质一、选择题1、( 2020 四川岳池中学选练)以下各电子层中不包括p 原子轨道的是()A. N B. M C. L D . K答案D分析K 层只有 s 原子轨道,从L 层开始才出现p 原子轨道。
2、对于电子云的表达不正确的选项是()A.电子云是用小点的疏密程度来表示电子在空间出现概率大小的图形B.电子云实质是电子运动形成的近似云同样的图形C.小点密集的地方电子在那边出现的概率大D.轨道不同,电子云的形态也不同样答案B分析用统计的方法描绘电子在核外空间出现的概率大小的图形称为电子云;常用小点的疏密程度来表示电子在原子核出门现概率的大小,小点密集的地方,表示电子在那边出现的概率大,小点稀少的地方,表示电子在那边出现的概率小。
3、以下元素中,基态原子的外头电子排布不正确的选项是()A. As4s24p3B. Cr3d44s2C. Ar 3s23p6 D . Ni3d84s2答案B分析能量同样的原子轨道在全充满(p6和 d10)、半充满 (p3和 d5)和全空 (p0和 d0)状态时,体系能量较低,原子较稳固。
故 B 项中 Cr 原子的外头电子排布应为3d54s1。
4、以下说法正确的选项是()A. Na、 Mg、 Al 的第一电离能渐渐增大B. V、 Cr、Mn的最外层电子数渐渐增大C. S2-、 Cl -、 K+的半径渐渐减小D. N、 O、F 的电负性渐渐减小答案C分析Mg 的 3s 轨道处于全充满状态,较稳固,难以失掉电子,第一电离能最大,A项错误;V 、 Cr、 Mn 的最外层电子数分别为2、 1、 2,B 项错误; S2-、 Cl -、 K+的核外电子排布相同,原子序数越小,离子半径越大, C 项正确; N 、O、 F 位于同一周期,同周期主族元素从左到右,电负性挨次增大, D 项错误。
5、以下变化需要汲取能量的是()A. 1s22s 22p63s 1→ 1s22s 22p6B. 3s23p5→ 3s23p6C. 2p x22p y12p z1→ 2p x12p y12p z2D. 2H→ H—H答案A分析 A 项所示为 3s 轨道上失掉 1个电子,失掉电子需要汲取部分能量, A 项正确; B 项表示得一个电子,为放出能量的变化; C 项中 p 能级的 3 个轨道 p x、 p y、 p z能量相当,故不选; D 项中是表示 2 个 H 原子联合为 H2分子的过程,是放热过程。

专题04 物质结构与性质(选修)【母题来源1】2020年高考山东卷第4题【母题题文】下列关于C 、Si 及其化合物结构与性质的论述错误的是 A .键能C C>Si Si —— 、C H>Si H ——,因此C 2H 6稳定性大于Si 2H 6 B .立方型SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 C .SiH 4中Si 的化合价为+4,CH 4中C 的化合价为-4,因此SiH 4还原性小于CH 4D .Si 原子间难形成双键而C 原子间可以,是因为Si 的原子半径大于C ,难形成p p π— 键 【答案】C【试题解析】A .因键能C —C >Si —Si 、C —H >Si —H ,故C 2H 6的键能总和大于Si 2H 6,键能越大越稳定,故C 2H 6的稳定性大于Si 2H 6,A 正确;B .SiC 的成键和结构与金刚石类似均为原子晶体,金刚石的硬度很大,类比可推测SiC 的硬度和很大,B 正确;C .SiH 4中Si 的化合价为-4价,C 的非金属性强于Si ,则C 的氧化性强于Si ,则Si 的阴离子的还原性强于C 的阴离子,则SiH 4的还原性较强,C 错误;D .Si 原子的半径大于C 原子,在形成化学键时纺锤形的p 轨道很难相互重叠形成π键,故Si 原子间难形成双键,D 正确;故选C 。
【母题来源2】2020年高考山东卷第7题【母题题文】B 3N 3H 6(无机苯)的结构与苯类似,也有大π键。
下列关于B 3N 3H 6的说法错误的是 A .其熔点主要取决于所含化学键的键能 B .形成大π键的电子全部由N 提供 C .分子中B 和N 的杂化方式相同 D .分子中所有原子共平面 【答案】A【试题解析】A .无机苯是分子晶体,其熔点主要取决于分子间的作用力,A 错误;B .B 原子最外层3个电子,与其它原子形成3个键,N 原子最外层5个电子,与其它原子形成3个键,还剩余2个电子,故形成大键的电子全部由N 原子提供,B 正确;C .无机苯与苯等电子体,分子中含有大键,故分子中B 、N 原子的杂化方式为sp 2杂化,C 正确;D .无机苯与苯等电子体,分子中含有大键,故分子中B 、N原子的杂化方式为sp2杂化,所以分子中所有原子共平面,D正确;答案选A。

绝密★启用前2020年高考化学二轮专题复习测试《物质结构与性质(选考)》本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷一、单选题(共10小题,每小题4.0分,共40分)1.只有阳离子而没有阴离子的晶体是()A.金属晶体B.原子晶体C.离子晶体D.分子晶体2.干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为a(其中a为立方体棱长)的CO2有()A. 4个B. 8个C. 12个D. 6个3.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。
下列说法正确的是( )A.石墨烯与石墨互为同位素B. 0.12 g石墨烯中含有6.02×1022个碳原子C.石墨烯是一种有机物D.石墨烯中的碳原子间以共价键结合4.下列物质中不含非极性共价键的是()①Na2O2②CCl4③C2H6④NH4Cl ⑤H2O2⑥Ca(OH)2A.①②③④B.④⑤⑥C.②④⑥D.②③⑤5.在乙烯分子中有5个σ键和1个π键,它们分别是()A. sp2杂化轨道形成σ键,未杂化的2p轨道形成π键B. sp2杂化轨道形成π键,未杂化的2p轨道形成σ键C. C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键D. C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键6.下列有关金属的说法正确的是()A.金属原子的核外电子在金属晶体中都是自由电子B.镁型和铜型的原子堆积方式空间利用率最高C.金属原子在化学变化中失去的电子数越多,其还原性越强D.温度升高,金属的导电性将变强7.下列各组原子中,彼此化学性质一定相似的是()A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子C. 2p轨道上只有两个电子的X原子与3p轨道上只有两个电子的Y原子D.最外层都只有一个电子的X、Y原子8.PH3一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。
专题17物质结构与性质(选修)2020年高考真题1.(2020年山东新高考)下列关于C 、Si 及其化合物结构与性质的论述错误的是A .键能C C>Si Si ——、C H>Si H ——,因此C 2H 6稳定性大于Si 2H 6B .立方型SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度C .SiH 4中Si 的化合价为+4,CH 4中C 的化合价为-4,因此SiH 4还原性小于CH 4D .Si 原子间难形成双键而C 原子间可以,是因为Si 的原子半径大于C ,难形成p pπ—键2.(2020年山东新高考)B 3N 3H 6(无机苯)的结构与苯类似,也有大π键。
下列关于B 3N 3H 6的说法错误的是A .其熔点主要取决于所含化学键的键能B .形成大π键的电子全部由N 提供C .分子中B 和N 的杂化方式相同D .分子中所有原子共平面3.(2020年新课标Ⅰ)Goodenough 等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。
回答下列问题:(1)基态Fe 2+与Fe 3+离子中未成对的电子数之比为_________。
(2)Li 及其周期表中相邻元素的第一电离能(I 1)如表所示。
I 1(Li)>I 1(Na),原因是_________。
I 1(Be)>I 1(B)>I 1(Li),原因是________。
(3)磷酸根离子的空间构型为_______,其中P 的价层电子对数为_______、杂化轨道类型为_______。
(4)LiFePO 4的晶胞结构示意图如(a)所示。
其中O 围绕Fe 和P 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
每个晶胞中含有LiFePO 4的单元数有____个。
电池充电时,LiFeO 4脱出部分Li +,形成Li 1−x FePO 4,结构示意图如(b)所示,则x=_______,n(Fe 2+)∶n(Fe 3+)=_______。
2020年二轮复习理综化学部分试卷(二)试卷明细表66.答案解析:(易)考查物质的分类知识,答案:D。
明矾[KAl(SO4) 2·12H2O]、胆矾(CuSO4·5H2O)、石膏(CaSO4·2H2O)等结晶水水合物有一定的组成,是纯净物。
玻璃是多种硅酸盐的混合物;冰是水的固态,是纯净物;蔗糖有固定的组成(C12H22O11),是纯净物;天然橡胶是高分子化合物,一般来说,高分子化合物都不是纯净物,天然物质通常含有多种物质。
王水是硝酸和盐酸的混合物。
弱酸H2SiO3、H2CO3是弱电解质;NaHCO3是强电解质;SO2、CO2、CH3CH2OH、NH3非电解质;Cl2是单质,既不是电解质也不是非电解质。
7.根据中学化学教材所附元素周期表判断,下列叙述正确的是()A.L电子层为奇数的所有元素都是非金属B.第三、四、五、六周期元素的数目分别是8、18、32、32C.由左至右第8、9、10三列元素中没有非金属元素D.只有第ⅡA族元素的原子最外层有2个电子7.答案解析:(中难)考查元素周期表(长式)的结构(周期、族)及其应用,答案:C。
L 层电子数为奇数的有锂、硼、氮、氟4种元素,锂是金属,硼、氮、氟是非金属。
第三、四、五、六周期元素的数目分别是8、18、18、32。
由左至右第8、9、10三列为Ⅷ族,是过渡元素,都是金属。
最外层电子数为2的除第ⅡA族外,还有零族的He以及某些过渡元素。
8.设N A为阿伏加德罗常数,下列说法中正.确.的是()A.Cl2的摩尔质量与N A个Cl2分子的质量在数值和单位上都相等。
B.活泼金属从盐酸中置换出1molH2,转移电子数为N AC.500mL0.5mol·L-1Al2(SO4)3溶液中,含SO42-数目为0.75N AD.常温常压下,0.5 N A个一氧化碳分子所占体积是11.2L8.答案解析:(易)考查对物质的量、阿伏加德罗常数相关知识的理解,答案:C。