高中化学选修四 沉淀溶解平衡和溶度积
- 格式:pptx
- 大小:1.49 MB
- 文档页数:22

化学沉淀溶解平衡知识点化学沉淀溶解平衡是指在溶液中,溶解物质与沉淀物质之间达到动态平衡的过程。
在这个过程中,溶解物质会从溶液中析出形成沉淀,而沉淀物质也会重新溶解进入溶液。
沉淀溶解平衡的调控因素主要有溶度积、离子浓度、温度等。
沉淀溶解平衡的相关知识点如下:1.溶度积:溶度积是沉淀溶解平衡的一个特征参数,表示在一定温度下,溶液中沉淀物质的最大溶解度。
溶度积的大小决定了沉淀能否生成或溶解。
当溶液中的离子浓度乘积大于溶度积时,沉淀会生成;当离子浓度乘积小于溶度积时,沉淀会溶解;当离子浓度乘积等于溶度积时,沉淀处于平衡状态。
2.酸碱溶解法:这是一种通过加入酸或碱来调控沉淀溶解平衡的方法。
例如,在碳酸钙中加入盐酸,氢离子会消耗碳酸根离子,促使碳酸钙溶解。
3.盐溶解法:这是一种通过加入可溶性盐来调控沉淀溶解平衡的方法。
例如,向硫酸钡沉淀中加入氯化钠,氯化钠会与硫酸钡反应生成可溶性的硫酸钠,从而使硫酸钡沉淀溶解。
4.生成配合物使沉淀溶解:这是一种通过生成配合物来调控沉淀溶解平衡的方法。
例如,在氯化银沉淀中滴加氨水,沉淀会溶解并形成银氨溶液。
5.发生氧化还原反应使沉淀溶解:这是一种通过氧化还原反应来调控沉淀溶解平衡的方法。
例如,在硫化铜沉淀中加入稀硝酸,硫化铜会氧化生成硫淡∗∗沉淀。
6.溶度积的计算:溶度积是指在一定温度下,沉淀物质的最大溶解度。
可以通过实验方法或理论计算得到。
已知溶度积后,可以判断在一定条件下沉淀能否生成或溶解。
7.判断沉淀生成和溶解的方法:通过比较溶液中的离子浓度乘积(Qc)与溶度积(Ksp)的大小。
当Qc > Ksp时,溶液过饱和,有沉淀析出;当Qc = Ksp时,溶液饱和,处于平衡状态;当Qc < Ksp时,溶液未饱和,无沉淀析出。
总之,化学沉淀溶解平衡是一个涉及溶度积、离子浓度、温度等多个因素的复杂过程。
了解和掌握这些知识点,有助于我们更好地理解沉淀溶解现象,并在实际应用中调控溶液的组成。

高三化学专题复习【沉淀溶解平衡】一、沉淀溶解平衡与溶度积1.溶解平衡状态(1)定义:在一定温度下的水溶液里,沉淀溶解速率和离子生成沉淀速率相等,固体的量和溶液中各离子浓度不再改变时的状态。
(2)表示方法:如PbI2的沉淀溶解平衡可表示为。
2.溶度积(1)定义:沉淀溶解平衡的平衡常数叫溶度积常数或溶度积,通常用符号来表示。
(2)表达式:当难溶强电解质A m B n溶于水形成饱和溶液时,建立沉淀溶解平衡:A m B n(s)m A n+(aq)+n B m-(aq),其溶度积的表达式为K sp=。
(3)影响因素:K sp只与难溶电解质的和有关,而与沉淀的量....无关。
(4)意义:K sp反映了在水中的程度。
通常,对于相同类型....的难溶电解质(如AgCl、AgBr和AgI),K sp越大,难溶电解质在水中的溶解程度就。
微点拨:(1)溶液中离子浓度的变化只能使平衡发生移动,并不改变溶度积。
(2)K sp与溶解度(S)都可用来表示物质的溶解程度,但是Ksp..............小的物质溶解度不一定也小.。
二、沉淀溶解平衡的应用1.沉淀的溶解与生成(1)原理:通过改变条件使溶解平衡移动,最终使溶液中的离子转化为沉淀或沉淀转化为溶液中的离子。
(2)判断:在难溶电解质溶液中,①当Q K sp时,就会有沉淀生成。
②当Q K sp时,处于平衡状态。
③当Q K sp时,就会使沉淀溶解。
(3)应用①利用生成沉淀来达到分离或除去某些离子的目的。
②用来解释某些生活现象。
如溶洞中石笋、钟乳石的形成,所涉及的化学反应有,。
2.沉淀的转化(1)实质:是的移动。
(2)特点①通常,一种沉淀可以转化为更难溶的沉淀。
②两种难溶物的差别越大,越容易转化。
(3)应用除去废水中的Cu 2+、Hg 2+、Pb 2+等,常用 、 等难溶物作沉淀剂。
如可用FeS 等难溶杂质作为沉淀剂除去废水中的重金属离子Hg 2+,沉淀转化反应为 。
微点拨:沉淀转化虽然是利用的沉淀溶解平衡的移动,但是因为沉淀能够完全转化,所以反应方程式用“===”,不用“”。
第3节 沉淀溶解平衡 知识与技能:1. 知道难溶电解质在水中存在沉淀溶解平衡,并能结合实例进行描述;2. 能描述沉淀溶解平衡,能写出溶度积的表达式,知道溶度积常数(溶度积)的含义,知道溶度积是沉淀溶解平衡的平衡常数、溶度积可以反映难溶电解质在水中的溶解能力;3. 能够运用平衡移动的观点对沉淀的溶解、生成与转化过程进行分析,知道沉淀转化的本质并能够对相关实验的现象以及生活中的一些相关问题进行解释。
过程与方法:利用栏目和补充实例展开讨论,从而激发兴趣,在“观察思考”先演示在解释现象,更深层次的建立沉淀溶解平衡概念。
从前面所学分析平衡问题的思路出发,遵循规律进而解决一些简单问题。
情感态度与价值观:提高认识水平和解决问题的能力,并培养起可持续发展的观点。
教学重点:溶度积常数的含义,沉淀的溶解、生成和转化的本质 教学难点:沉淀的转化 课时安排:2课时 教学过程: 第一课时一、沉淀溶解平衡与溶度积【引入】已知牙齿表面有一层坚硬的牙釉质羟基磷酸钙[ Ca 5(PO 4)3(OH)],它对牙齿起到保护作用。
使用含氟牙膏能生成更难溶且耐酸的氟磷酸钙[Ca 5(PO 4)3F]覆盖在牙齿表面,抵抗H+的侵袭 。
另外溶洞的形成是石灰石岩层在经历了数万年的岁月侵蚀之后形成的。
它是难溶性的CaCO 3与溶洞中的CO 2以及地下水作用生成了可溶性的Ca(HCO 3)2,后Ca(HCO 3)2在受压或地壳运动产生的热量的作用下又分解成CaCO 3、CO 2和H 2O,这些变化都与难溶电解质的在水溶液中的行为有关,即与难溶电解质的沉淀溶解有关。
我们知道:物质的溶解是绝对的,不溶是相对的。
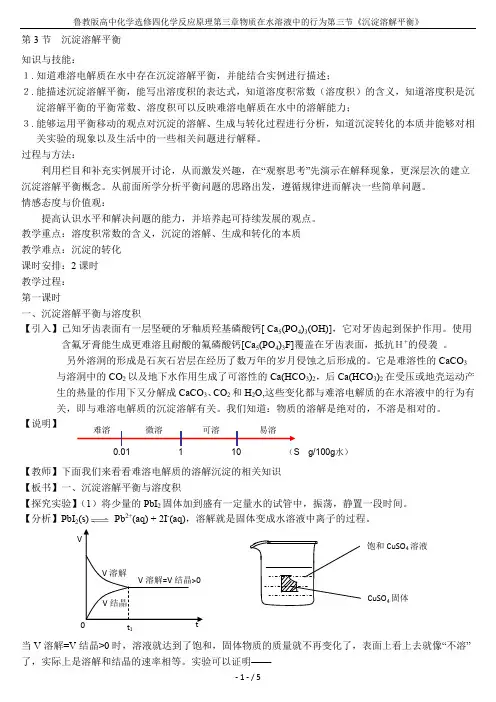
【说明】【教师】下面我们来看看难溶电解质的溶解沉淀的相关知识 【板书】一、沉淀溶解平衡与溶度积【探究实验】(1)将少量的PbI 2固体加到盛有一定量水的试管中,振荡,静置一段时间。
【分析】PbI 2(s) Pb 2+(aq) + 2I -(aq),溶解就是固体变成水溶液中离子的过程。


第四节难溶电解质的溶解平衡第1课时沉淀溶解平衡与溶度积1.知道沉淀溶解平衡的概念及其影响因素。
2.明确溶度积和离子积的关系,并由此学会判断反应进行的方向。
(重点)沉淀溶解平衡[基础·初探]教材整理1.沉淀溶解平衡的概念在一定温度下,当沉淀溶解和生成速率相等时,即建立了动态平衡,叫做沉淀溶解平衡。
如AgCl溶于水有AgCl(s)溶解沉淀Ag+(aq)+Cl-(aq)。
2.沉淀溶解平衡的特征动态平衡,溶解速率和沉淀速率不等于0。
溶解速率和沉淀速率相等。
平衡状态时,溶液中的离子浓度保持不变。
当改变外界条件时,溶解平衡发生移动。
3.沉淀溶解平衡的移动固体物质的溶解是可逆过程:固体物质溶解沉淀溶液中的溶质(1)v溶解>v沉淀固体溶解(2)v溶解=v沉淀溶解平衡(3)v溶解<v沉淀析出晶体4.生成难溶电解质的离子反应的限度(1)25 ℃时,溶解性与溶解度的关系(2)反应完全的标志对于常量的化学反应来说,化学上通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时,沉淀就达完全。
[探究·升华][思考探究]物质的溶解度只有大小之分,没有在水中绝对不溶解的物质。
所谓难溶电解质是指溶解度小于0.01克的物质。
它可以是强电解质如BaSO4、AgCl等,也可以是弱电解质如Fe(OH)3、Mg(OH)2等。
但由于它们的溶解度都很小,溶解的极少部分,在水溶液中都可以认为是100%的电离,所以我们不区分其强弱,统称为难溶电解质。
问题思考:(1)在AgCl溶于水的起始阶段,v溶解和v沉淀怎样变化?当v溶解=v沉淀时,可逆过程达到一种什么样的状态?画出v-t图。
【提示】AgCl溶于水的起始阶段,v溶解开始大,后逐渐减小,v沉淀开始为0,后逐渐增大,直到v溶解=v沉淀,说明溶解达到平衡状态。
v-t图如下:(2)向AgCl饱和溶液中加水,AgCl的溶解度增大吗?溶解平衡移动吗?K sp 是否增大?升高温度K sp如何变化?【提示】向AgCl饱和溶液中加水,AgCl溶解平衡向正向移动,但是AgCl 的溶解度不增大,K sp不变。



第3节沉淀溶解平衡知识点核心知识点及知识点解读一、沉淀溶解平衡和溶度积1、沉淀溶解平衡的建立:一定条件下,强电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。
2、沉淀溶解平衡常数--溶度积(1)定义:在一定条件下,难溶性物质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫做溶度积常数或溶度积。
(2)表达式:以PbI2(s)溶解平衡为例:PbI2(s)Pb2+(aq)+2I-(aq)K sp=[Pb2+][I-]2=7.1×10-9mol3L-3(3)意义溶度积反映了物质在水中的溶解能力。
对于阴阳离子个数比相同的电解质,K sp的数值越大,电解质在水中的溶解能力越强。
(4)影响K sp的因素K sp与其他化学平衡常数一样,只与难溶性电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。
3、沉淀溶解的特征:等、动、定、变。
等——v溶解 = v沉淀(结晶)动——动态平衡, v溶解 = v沉淀≠0定——达到平衡时,溶液中离子浓度不再改变。
变——当外界条件改变,溶解平衡将发生移动。
4、影响溶解平衡的因素(1)内因:电解质本身的性质①绝对不溶的电解质是没有的。
②同是难溶电解质,溶解度差别也很大。
③易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。
(2)外因:遵循平衡移动原理①浓度:加水,平衡向溶解方向移动。
②温度:升温,多数平衡向溶解方向移动。
③同离子效应:向沉淀溶解平衡体系中,加入相同的离子,使平衡向沉淀方向移动,但K sp 不变。
④其他:向沉淀溶解平衡体系中,加入可与体系中某些离子反应生成更难溶物质或气体的离子,使平衡向溶解的方向移动,K sp不变。
二、沉淀溶解平衡的应用1、溶度积规则通过比较溶度积与溶液中有关离子浓度幂的乘积--浓度商Q C的现对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:Q C>K sp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。


