第五章 热力学第二定律课后答案
- 格式:pdf
- 大小:469.00 KB
- 文档页数:8

热力学第二定律参考答案热力学第二定律参考答案热力学第二定律是热力学中的一条基本定律,它描述了热量的自然流动方向和热量转化的不可逆性。
热力学第二定律的提出和发展,对于我们理解自然界中的热现象和能量转化过程具有重要的意义。
本文将从热力学第二定律的历史背景、基本原理和应用等方面进行探讨。
热力学第二定律的历史背景可以追溯到19世纪初,当时物理学家们开始对热现象进行深入研究。
在这个时期,人们普遍认为热量是一种物质,即所谓的“热质”。
然而,随着科学的发展,人们逐渐认识到热量并不是一种物质,而是一种能量形式。
这一认识的转变为热力学第二定律的提出奠定了基础。
热力学第二定律的基本原理可以用不同的表述方式来描述,其中最常见的是克劳修斯表述和开尔文表述。
克劳修斯表述指出,热量不会自发地从低温物体传递到高温物体,而是自发地从高温物体传递到低温物体。
这个表述可以用来解释为什么我们感觉到的热量总是从热的物体流向冷的物体。
开尔文表述则指出,不可能通过循环过程将热量完全转化为功而不产生其他影响。
这个表述可以用来解释为什么我们无法制造一个永动机,即从热源中获取无限的能量。
热力学第二定律的应用涵盖了广泛的领域,其中最重要的应用之一是热机的效率。
热机是将热能转化为功的装置,如汽车发动机和蒸汽机等。
根据热力学第二定律,热机的效率不可能达到100%,总是存在一定的能量损失。
这个能量损失被称为热机的热损耗,它限制了热机的效率提高的上限。
因此,热力学第二定律对于热机的设计和改进具有指导作用。
除了热机,热力学第二定律还可以应用于其他领域,如能源转化和环境保护等。
能源转化是指将一种形式的能量转化为另一种形式的能量,如化学能转化为电能。
根据热力学第二定律,能源转化过程总是伴随着能量的损失,因此我们需要在能源转化过程中尽量减少能量损失,提高能源利用效率。
环境保护方面,热力学第二定律的应用可以帮助我们理解能源消耗和环境污染的关系,从而制定相应的环境保护政策和措施。

热力学第二定律课后习题答案习题1在300 K ,100 kPa 压力下,2 mol A 和2 mol B 的理想气体定温、定压混合后,再定容加热到600 K 。
求整个过程的S 为若干已知C V m A = 15 R ,C V m B = 2 5 R[题解] ⎪⎩⎪⎨⎧B(g)2mol A(g)2mol ,,纯态 3001001K kPa,()−→−−−− 混合态,,2mol A 2mol B 100kPa 300K1+==⎧⎨⎪⎪⎩⎪⎪p T 定容()−→−−2 混合态,,2mol A 2mol B 600K 2+=⎧⎨⎪⎩⎪T S = S 1 + S 2,n = 2 molS 1 = 2nR ln ( 2V / V ) = 2nR ln2 S 2 = ( 15nR + 25nR ) ln (T 2 / T 1)= 4nR ln2所以S = 6nR ln2= ( 6 2 mol 8314 J ·K 1·mol 1 ) ln2 = 6915 J ·K 1[导引]本题第一步为理想气体定温定压下的混合熵,相当于发生混合的气体分别在定温条件下的降压过程,第二步可视为两种理想气体分别进行定容降温过程,计算本题的关键是掌握理想气体各种变化过程熵变的计算公式。
习题22 mol 某理想气体,其定容摩尔热容C v ,m = ,由500 K ,405 2 kPa 的始态,依次经历下列过程:(1)恒外压202 6 kPa 下,绝热膨胀至平衡态; (2)再可逆绝热膨胀至101 3 kPa ; (3)最后定容加热至500 K 的终态。
试求整个过程的Q ,W ,U ,H 及S 。
[题解] (1)Q 1 = 0,U 1 = W 1,nC V m (T 2-T 1))(1122su p nRT p nRT p --=, K400546.2022.405)(5.11221211212====-=-T T kPa p kPa p T p T p T T ,得,代入,(2)Q 2 = 0,T T p p 3223111535325=-=-=--()γγγγ,, T T 320.42303==-()K(3)V = 0,W 3 = 0,Q U nC T T V 3343232831450030314491==-=⨯⨯⨯-=∆,()[.(.)].m J kJp p T T 434350030310131671==⨯=(.).kPa kPa 整个过程:Q = Q 1 + Q 2+ Q 3 =491kJ ,U = 0,H = 0,Q + W = U ,故W =-Q =-491 kJ∆S nR p p ==⨯=--ln (.ln ..).141128314405616711475J K J K ··[导引]本题的变化过程为单纯pVT 变化,其中U 、H 和S 是状态函数,而理想气体的U 和H 都只是温度的函数,始终态温度未变,故U = 0,H = 0。

5.-5 答:热力学第二定律的两种说法反映的是同一客观规律——自然过程的方向性 是一致的,
只要一种表述可能,则另一种也可能。
假设热量Q2能够从温度T2的低温热源自动传给温度为T1的高温热源。
现有一循环热机在两热源间工作,并且它放给低温热源的热量恰好等于Q2。
整个系统在完成一个循环时,所产生的唯一效果是热机从单一热源(T1)取得热量Q1-Q2,并全部转变为对外输出的功W 。
低温热源的自动传热Q2给高温热源,又从热机处接受Q2,故并未受任何影响。
这就成了第二类永动机。
违反了克劳修斯说法,
必须违反了
开尔文说法。
反之,承认了开尔文说法,克劳修斯说法也就必然成立。
5-10从点a 开始有两个可逆过程:定容过程a –b 和定压过程a –c ,b 、c 两点在同一条绝热线上(见图5–34),问q a –b 和q a –c
哪个大?并在T –
s 图上表示过程a –b 和a –c 及q a –b 和q a –c 。
答:可逆定容过程a-b 和可逆定压过程a-c 的逆过程c-a 以及可逆绝热线即定熵线上过程b-c 构成一可逆循环,它们围成
的面积代表了对外
作功量,过程a-b 吸热,过程c-a 放热,根据热力学第一定律,必然有∣q a-b ∣>∣q c-a ∣,才能对外输出净功。
也就是,q a-b >q a-c 。
图中,q a-b 为abs b s a a 围成的面积,q a-c
为acs b s a a 围成的面
积。
5-10. 答:由图5-2可知
为1-a-b-2-1的面积; 为1-a-c -2-1的面积
图5–34。




第三章热力学第二定律【复习题】【1】指出下列公式的适用范围。
(1)S R n ln x ;min B BB(2)S nR ln p1C P lnT2nR lnV2C v ln T2; p2T1V1T1(3)dU TdS pdV;(4)G Vdp(5)S, A, G作为判据时必须满足的条件。
【解】( 1)封闭体系平衡态,理想气体的等温混合,混合前后每种气体单独存在时的压力都相等,且等于混合后气体的总压力。
( 2)非等温过程中熵的变化过程,对一定量的理想气体由状态 A ( P1、V 1、 T1)改变到状态 A ( P2、 V 2、 T2)时,可由两种可逆过程的加和而求得。
( 3)均相单组分(或组成一定的多组分)封闭体系,非体积功为成可变的多相多组分封闭体系,非体积功为 0 的可逆过程。
0 的任何过程;或组(4)非体积功为 0,组成不变的均相封闭体系的等温过程。
(5)S:封闭体系的绝热过程,可判定过程的可逆与否;隔离体系,可判定过程的自发与平衡。
A :封闭体系非体积功为0 的等温等容过程,可判断过程的平衡与否;G:封闭体系非体积功为 0 的等温等压过程,可判断过程的平衡与否;【2】判断下列说法是否正确,并说明原因。
(1)不可逆过程一定是自发的,而自发过程一定是不可逆的;(2)凡熵增加过程都是自发过程;(3)不可逆过程的熵永不减少;(4)系统达平衡时,熵值最大, Gibbs 自由能最小;(5)当某系统的热力学能和体积恒定时,S<0的过程不可能发生;(6)某系统从始态经过一个绝热不可逆过程到达终态,先在要在相同的始、终态之间设计一个绝热可逆过程;(7)在一个绝热系统中,发生了一个不可逆过程,系统从状态 1 变到了状态2,不论用什么方法,系统再也回不到原来状态了;(8)理想气体的等温膨胀过程,U0 ,系统所吸的热全部变成了功,这与法不符;(9)冷冻机可以从低温热源吸热放给高温热源,这与Clausius 的说法不符;(10)C p恒大于C V。

⼤学物理课后答案——第五章管靖主编第五章习题5.1 试由热⼒学第⼆定律证明:任何两条绝热线不能相交.证设绝热线相交于A 点,如题解图5.1.作等温线与⼆绝热线交于B 、C 两点,则可构成正循环ABCA .在正循环ABCA 中,系统只能在过程BC 中由⼀个温度恒定的热源吸收热量⽽对外作功,于是构成单源热机,违反热⼒学第⼆定律的开尔⽂表述,是不可能的.所以任何两条绝热线不能相交.题解图5.15.2 试由热⼒学第⼆定律证明:⼀条等温线与⼀条绝热线不能相交两次.证设⼀条绝热线和⼀条等温线交于A 、B 两点,于是可构成正循环ABA ,如题解图5.2.在正循环ABA 中,系统只能在经等温线的过程中由⼀个温度恒定的热源吸收热量⽽对外作功,于是构成单源热机,违反热⼒学第⼆定律的开尔⽂表述,是不可能的.所以⼀条等温线与⼀条绝热线不能相交两次.题解图5.2 *5.3 热⼒学第⼆定律的普朗克表述为:不可能制成⼀种机器,在它的⼀个循环动作中能把⼀个重物提⾼,为此⽽付出的唯⼀代价是使⼀热源冷却.试证明普朗克表述与开尔⽂表述等价.证设普朗克表述不对,即机器在⼀个循环动作中能把⼀个重物提⾼,对外作功,为此⽽付出的唯⼀代价是使热源B 冷却.则可以⽤⼀个⽐热源B 温度⾼的恒温热源(温度为T ),给热源B 补充它所失去的热量Q ,如题解图5.3(1)所⽰.这样就构成了单源热机,则开尔⽂表述也不对.再设开尔⽂表述不对,即热机能在没有其它影响的条件下,只从恒温热源(温度为T )中吸收热量⽽对外作功.可以⽤单源热机输出的能量把⼀个重物提⾼;再⽤⼀个温度⾼于T 的热源B 给温度为T 的恒温热源补充它所失去的热量Q ,热源B 温度降低,如题解图5.3(2)所⽰.这样就说明普朗克表述也不对.题解图5.3因为若普朗克表述不对,则开尔⽂表述也不对;若开尔⽂表述不对,则普朗克表述也不对;这就证明了普朗克表述与开尔⽂表述等价.5.4 ⼀个容器被⼀薄铜⽚隔成两部分,⼀边是80C ο的⽔,另⼀边是20C ο的⽔,经过⼀段时间从热的⼀边向冷的⼀边传递了2000J 热量,求过程中系统的熵变.设系统与外界没有热量交换,且⽔⾜够多,传递热量后两部分的⽔温均可视为不变;忽略铜⽚熵变.解⽤可逆等温过程计算熵变 d =d d A B S S S +δδA B |Q ||Q |T T =-+ 112000(+)353293=?-116(J K).=5.5 31cm 的100C ο的⽔,在51.01310Pa ?的压强下加热变为31671cm 的同温度⽔蒸⽓,⽔的⽓化热为62.2510J kg ?.试求⽔变为⽔蒸⽓后熵的增量和内能的增量.解⽔在100C 时等温汽化,⽤可逆等温过程计算熵的增量 21δQ Q S T T== 3611022510603(J K )373..-== 根据热⼒学第⼀定律U Q A Q p V ?=-=-?()3656110225101013101617110..--=-??-? 320810(J).=?5.6 1mol 单原⼦理想⽓体经过两种不同的可逆过程从初态(,)p V 变到末态(2,2)p V .(1)等温膨胀到体积的两倍,然后等体升压达到末态;(2)等温压缩使压强加倍;然后等压膨胀到末态.画出两种过程的p V -图,并在两种过程中求熵的变化ΔS .解 p V -图如题解图5.6.(1)等温膨胀过程中1210δd V V Q p V S T T== 2d 2ln ln2V V V V R R R V V===? 因为12pV p V =,故12p p =.等体升压过程中313m 32m 11d δln T V ,V ,T C T T Q S C T T T ?===?? m 1232l n l n 3l n 222V ,p p C R R p p === 所以系统熵变124ln2S S S R ?=?+?=.题解图5.6(2)等温压缩过程中,因为2222pV p V pV ==,故22V V =.2230δd V V Q p V S T T== 2d 2ln ln2V V V V R R R V V ===-等压膨胀过程中323m 34m 22d δln T p,p,T C T T Q S C T T T ?===?? m 2252l n l n 5l n 222p,V V C R R V V === 所以系统熵变344ln2S S S R ?=?+?=.5.7 把1kg 0C ο的⽔与1kg 100C ο的⽔在绝热情况下混合,系统的熵变为多少?此过程是否可逆?这是否体现了熵增加原理?解将0C ο的⽔和100C ο的⽔在绝热情况下混合,0C ο的⽔吸收的热量等于100C ο的⽔放出的热量,于是可求出系统达到热平衡时的温度 12273373323(K)50C 22T T T ο++==== ⽤可逆过程计算1kg 的⽔由0C ο升温到50C ο的熵变,⽔的⽐热容34.1810c =?,则32331273δd 323141810ln 703273Q T S mc .T T ?====?? 再⽤可逆过程计算1kg 的⽔由100C ο降温到50C ο的熵变 32332373δd 323141810ln 602373Q T S mc .T T ?====-?? 所以系统熵变12101(J K)S S S ?=?+?=.由于系统的熵增加了,所以此过程是不可逆过程.因为系统为绝热系统,满⾜应⽤熵增加原理的条件,故上述结果体现了熵增加原理.5.8 把⼀定量100C ο的⽔蒸⽓通⼊装在绝热容器内的⽔⾥,可由⽔温的升⾼⽽测量⽔的⽓化热.此过程是可逆的吗?⽔蒸⽓的熵是否增加?这是否违反了熵增加原理?若把0.1kg 100C ο的⽔蒸⽓通⼊1k g 20C ο的⽔中,试求系统熵变.(⽔的⽓化热为62.2510J kg ?)解与热现象有关的⼀切实际宏观过程都是不可逆过程,所以此过程是不可逆过程.⽔蒸⽓放热,熵减少.但因为⽔蒸⽓不是孤⽴或绝热系统,不满⾜应⽤熵增加原理的条件,故⽔蒸⽓的熵减少并不违反熵增加原理.⽔蒸⽓液化和降温所放出的热量等于低温⽔吸收的热量,设⽔蒸⽓与低温⽔构成的绝热系统达到平衡时的温度为T ,则63301225100141810(373)141810(293)....T .T ??+-=-可求出系统平衡时的温度为349K 76C T ο==.⽤可逆等温过程计算100g ⽔蒸⽓液化为100C 的⽔的熵变 61110122510603373Q ..S T =-=-=- ⽤可逆过程计算0.1kg 100C 的⽔降温到76.2C ο的熵变 34932373δd 0141810Q T S ..T T== 234941810ln 28373.=?=- ⽤可逆过程计算1kg 20C ο的⽔升温到76C ο的熵变 34933293δd 141810Q T S .T T== 334941810ln 731293.=?= 所以系统熵变123100(J K)S S S S ?=?+?+?=.5.9 设每⼀块冰的质量为20g ,温度为0C ο,冰的熔解热为53.3410J kg ?.(1)求在绝热条件下,需加⼊多少块冰才能使1kg 的100C ο的⽔降温到40C ο?(2)求此过程中系统的熵变.(3)可以⽤熵增加原理判断此过程是否可逆的吗?⽔的熵是否增加?这是否违反了熵增加原理?解(1)设需n 块冰可使1kg 的100C ο的⽔降温到40C ο,冰块融化和升温所吸收的热量等于⽔降温放出的热量 533[0.02 3.34100.02 4.1810(400)]1 4.1810(10040)n ??+-=-即可求出4.1860250.02(334 4.1840)n ?==?+? (2)⽤可逆过程计算1kg 100C 的⽔降温到40C ο的熵变31331373δd 141810Q T S .TT ?==331341810ln733373.=??=- ⽤可逆等温过程计算25块冰融化为0C 的⽔的熵变5222500233410612273Q ..S T === ⽤可逆过程计算25块冰融化的⽔,由的0C 升温到40C ο的熵变31333273δd 0541810Q T S ..TT ?== 331320910ln 286273.=??= 所以系统的熵变122165(J K)S S S S ?=?+?+?=.(3)以1kg ⽔和加⼊的25块冰的整体为系统,则为绝热系统,可以⽤熵增加原理判断过程是否可逆.因此过程中系统的熵增加了,所以为不可逆过程.1kg 的⽔降温放热,熵减少,但这不违反熵增加原理.1kg 的⽔不是孤⽴或绝热系统,不满⾜熵增加原理适⽤条件.5.10 2mol 理想⽓体的初态体积为23210m -?,⽓体系统沿p V -图上300K 等温线作等温膨胀⾄末态,末态体积为23410m -?,求系统的熵变.有⼈说:“⽓体系统的熵增加了,由熵增加原理知此过程是不可逆过程.”此说法正确否?解可逆等温膨胀过程中221121δd d ln V V V V V Q p V V S R R T T V V νν?==== 402ln 2ln220R R == 此⼈说法不正确.⽓体等温膨胀过程与外界有热量交换,既不是孤⽴系统也不是绝热系统,不满⾜应⽤熵增加原理的条件.*5.11 什么是能量退化?能量退化与熵增加有什么关系?5.12 总结⼀下玻尔兹曼统计⽅法的⼤致步骤.5.13 ⽤⾃⼰的语⾔叙述热⼒学第⼆定律和熵的统计意义.*5.14 信息量的单位是如何定义的?什么是信息熵?信息量和信息熵间是什么关系? *5.15 阅读§5-5,找⼀个你感兴趣的问题,到⽹上查阅资料,写⼀个关于这个问题的报告.。
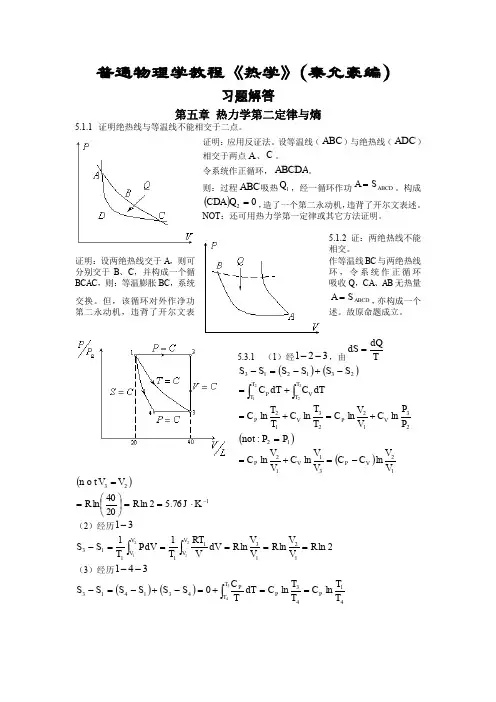
普通物理学教程《热学》(秦允豪编)习题解答第五章 热力学第二定律与熵 5.1.1 证明绝热线与等温线不能相交于二点。
证明:应用反证法。
设等温线(ABC )与绝热线(ADC )相交于两点A 、C 。
令系统作正循环,ABCDA 。
则:过程ABC 吸热1Q ,经一循环作功ABCD S A =。
构成()02=Q CDA ,造了一个第二永动机,违背了开尔文表述。
NOT :还可用热力学第一定律或其它方法证明。
5.1.2 证:两绝热线不能相交。
证明:设两绝热线交于A ,则可作等温线BC 与两绝热线分别交于B 、C ,并构成一个循环,令系统作正循环BCAC ,则:等温膨胀BC ,系统吸收Q ,CA 、AB 无热量ABCD S A =,亦构成一个交换。
但,该循环对外作净功第二永动机,违背了开尔文表述。
故原命题成立。
5.3.1 (1)经321--,由T dQdS =()()⎰⎰+=-+-=-3221231213T T V T T P dTC dT C S S S S S S23122312ln ln ln lnP P C V VC T T C T T C V P V P +=+=()12:P P not =()123112ln ln lnV V C C V V C V V C V P V P -=+=()23:V V n o t =176.52ln 2040ln -⋅==⎪⎭⎫⎝⎛=K J R R(2)经历31-2ln ln ln 111213111132121R V VR V V R dV V RT T PdV T S S V V V V =====-⎰⎰(3)经历341-- ()()4143431413ln ln 034T TC T T C dT T C S S S S S S P P T T P ==+=-+-=-⎰41-绝热 144111--=γγV T V T 11441-⎪⎪⎭⎫⎝⎛=γV V T Tγγ4411V P V P= γ14114⎪⎪⎭⎫ ⎝⎛=P P V V γγγγγγγγγ11211313114111441-----⎪⎪⎭⎫ ⎝⎛=⎪⎪⎭⎫ ⎝⎛=⎪⎪⎭⎫ ⎝⎛=⎪⎪⎭⎫⎝⎛=⎪⎪⎭⎫⎝⎛=V V V V P P P P V V T T∴2ln ln ln 1ln 121211213R V V R V V C V V C S S P P ==-=⎪⎪⎭⎫⎝⎛=--γγγγ (考虑RC P 1-=γγ)DIS :熵变化仅由初、末态决定,与过程无关。

第三章热力学第一定律3-5,有一闭口系统,从状态1经a变化到状态2,如图,又从状态2经b回到状态1;再从状态1经过c 变化到状态2。
在这个过程中,热量和功的某些值已知,如表,试确定未知量。
过程热量Q(kJ)膨胀功W(kJ)1-a-2 10 x12-b-1 -7 -41-c-2 x2 2解:闭口系统。
使用闭口系统能量方程(1)对1-a-2和2-b-1组成一个闭口循环,有⎰⎰=WQδδ即10+(-7)=x1+(-4)x1=7 kJ(2)对1-c-2和2-b-1也组成一个闭口循环x2+(-7)=2+(-4)x2=5 kJ(3)对过程2-b-1,根据WUQ+∆==---=-=∆)4(7WQU-3 kJ3-8 容积由隔板分成两部分,左边盛有压力为600kPa,温度为27℃的空气,右边为真空,容积为左边5倍。
将隔板抽出后,空气迅速膨胀充满整个容器。
试求容器内最终压力和温度。
设膨胀是在绝热下进行的。
解:热力系:左边的空气系统:整个容器为闭口系统过程特征:绝热,自由膨胀根据闭口系统能量方程WUQ+∆=绝热0 = Q自由膨胀W =0 因此ΔU=0对空气可以看作理想气体,其内能是温度的单值函数,得KT T T T mc v 300120)12(==⇒=-根据理想气体状态方程161211222p V V p V RT p ====100kPa3-10供暖用风机连同加热器,把温度为01=t ℃的冷空气加热到温度为2502=t ℃,然后送入建筑物的风道内,送风量为0.56kg/s ,风机轴上的输入功率为1kW ,设整个装置与外界绝热。
试计算:(1)风机出口处空气温度;(2)空气在加热器中的吸热量;(3)若加热器中有阻力,空气通过它时产生不可逆的摩擦扰动并带来压力降,以上计算结果是否正确? 解:开口稳态稳流系统(1)风机入口为0℃则出口为=⨯⨯==∆⇒=∆310006.156.01000Cp m Q T Q T Cp m1.78℃78.112=∆+=t t t ℃空气在加热器中的吸热量)78.1250(006.156.0-⨯⨯=∆=T Cp mQ =138.84kW (3)若加热有阻力,结果1仍正确;但在加热器中的吸热量减少。

《热力学第二定律》习题及答案选择题1.ΔG=0 的过程应满足的条件是(A) 等温等压且非体积功为零的可逆过程 (B) 等温等压且非体积功为零的过程 (C) 等温等容且非体积功为零的过程(D) 可逆绝热过程 答案:A2.在一定温度下,发生变化的孤立体系,其总熵(A )不变 (B)可能增大或减小(C)总是减小(D)总是增大答案:D 。
因孤立系发生的变化必为自发过程,根据熵增原理其熵必增加。
3.对任一过程,与反应途径无关的是(A) 体系的内能变化 (B) 体系对外作的功 (C) 体系得到的功 (D) 体系吸收的热 答案:A 。
只有内能为状态函数与途径无关,仅取决于始态和终态。
4.下列各式哪个表示了偏摩尔量: (A),,j i T p n U n ⎛⎫∂ ⎪∂⎝⎭ (B) ,,j i T V n H n ⎛⎫∂ ⎪∂⎝⎭ (C) ,,j i T V n A n ⎛⎫∂ ⎪∂⎝⎭ (D) ,,ji i T p n n μ⎛⎫∂ ⎪∂⎝⎭ 答案:A 。
首先根据偏摩尔量的定义,偏导数的下标应为恒温、恒压、恒组成。
只有A和D 符合此条件。
但D 中的i μ不是容量函数,故只有A 是偏摩尔量。
5.氮气进行绝热可逆膨胀ΔU=0 (B) ΔS=0 (C) ΔA =0 (D) ΔG=0答案:B 。
绝热系统的可逆过程熵变为零。
6.关于吉布斯函数G, 下面的说法中不正确的是(A)ΔG ≤W'在做非体积功的各种热力学过程中都成立(B)在等温等压且不做非体积功的条件下, 对于各种可能的变动, 系统在平衡态的吉氏函数最小(C)在等温等压且不做非体积功时, 吉氏函数增加的过程不可能发生(D)在等温等压下,一个系统的吉氏函数减少值大于非体积功的过程不可能发生。
答案:A 。
因只有在恒温恒压过程中ΔG ≤W'才成立。
7.关于热力学第二定律下列哪种说法是错误的(A)热不能自动从低温流向高温(B)不可能从单一热源吸热做功而无其它变化(C)第二类永动机是造不成的(D 热不可能全部转化为功答案:D 。
第一章基本概念与定义1.答:不一定。
稳定流动开口系统内质量也可以保持恒定2.答:这种说法是不对的。
工质在越过边界时,其热力学能也越过了边界。
但热力学能不是热量,只要系统和外界没有热量地交换就是绝热系。
3.答:只有在没有外界影响的条件下,工质的状态不随时间变化,这种状态称之为平衡状态。
稳定状态只要其工质的状态不随时间变化,就称之为稳定状态,不考虑是否在外界的影响下,这是他们的本质区别。
平衡状态并非稳定状态之必要条件。
物系内部各处的性质均匀一致的状态为均匀状态。
平衡状态不一定为均匀状态,均匀并非系统处于平衡状态之必要条件。
4.答:压力表的读数可能会改变,根据压力仪表所处的环境压力的改变而改变。
当地大气压不一定是环境大气压。
环境大气压是指压力仪表所处的环境的压力。
5.答:温度计随物体的冷热程度不同有显着的变化。
6.答:任何一种经验温标不能作为度量温度的标准。
由于经验温标依赖于测温物质的性质,当选用不同测温物质的温度计、采用不同的物理量作为温度的标志来测量温度时,除选定为基准点的温度,其他温度的测定值可能有微小的差异。
7.答:系统内部各部分之间的传热和位移或系统与外界之间的热量的交换与功的交换都是促使系统状态变化的原因。
8.答:(1)第一种情况如图1-1(a),不作功(2)第二种情况如图1-1(b),作功(3)第一种情况为不可逆过程不可以在p-v图上表示出来,第二种情况为可逆过程可以在p-v图上表示出来。
9.答:经历一个不可逆过程后系统可以恢复为原来状态。
系统和外界整个系统不能恢复原来状态。
?10.答:系统经历一可逆正向循环及其逆向可逆循环后,系统恢复到原来状态,外界没有变化;若存在不可逆因素,系统恢复到原状态,外界产生变化。
?11.答:不一定。
主要看输出功的主要作用是什么,排斥大气功是否有用。
第二章热力学第一定律1.答:将隔板抽去,根据热力学第一定律wuq+∆=其中,0==wq所以容器中空气的热力学能不变。
高中物理热力学第二定律课后习题答案及解析练习与应用1.汽车行驶时,要消耗汽油。
尽量详尽地说明:汽油燃烧时释放的化学能通过哪些途径最终转化成了周围环境的内能。
解析:化学能变成了汽缸内气体的内能,一部分内能转化为汽车的动能,另一部分散失到周围环境中成为环境的内能,汽车的动能通过摩擦转化为环境的内能;汽缸内气体的内能还有一部分通过汽车发电机转化为蓄电池内的化学能,使用蓄电池时,这部分化学能转化为电能,又通过车灯转化为光能,光照到地面空气,转化为环境的内能。
2.以下哪些现象能够发生、哪些不能发生?能够发生的现象是否违背热力学第二定律?(1)一杯热茶自然放置,茶会自动变得更热。
(2)蒸汽机把蒸汽的内能全部转化成机械能。
(3)桶中混浊的泥水在静置一段时间后,泥沙下沉,上面的水变清,泥、水自动分离。
(4)电冰箱通电后把箱内低温物体的热量传到箱外高温物体。
解析:(1)不会发生;热传递具有方向性,热量能自发的从高温物体传到低温物体,故一杯热茶自然放置,茶会自动变得凉,不会自动变得更热,因为违背热力学第二定律。
(2)不会发生;蒸汽机的能量损失不可避免,不可能把蒸汽的内能全部转化为机械能,违背了热力学第二定律,不能发生。
(3)可以发生;桶中混浊的泥水在静置一段时间后,泥沙下沉,上面的水变清,泥、水自动分离,其中系统的势能减少了,不违背热力学第二定律。
(4)可以发生;电冰箱通电后把箱内低温物体的热量传到箱外高温物体,此过程中消耗了电能,所以不违背热力学第二定律,能发生。
3.一间密闭的房间里放置了一台电冰箱,为了使房间降温,有人出了一个主意,建议把冰箱接通电源,打开冰箱门,让冰箱的“冷气”进入房间中,房间就变冷了。
这种方法可行吗?请说明道理。
解析:因为电冰箱的制冷机工作后,冰箱冷冻室内的蒸发器温度降低,吸收空气的热量,与此同时,冰箱内部的冷凝器温度升高,将热量传给空气,室内空气的热量只是被冰箱吸收后又被放出,所以室温不会降低,反而,电动机工作时,会将一部分电能转化为内能,故室内温度会有少许升高。