高三化学难题易错题集锦
- 格式:docx
- 大小:347.35 KB
- 文档页数:6


化学易错难题
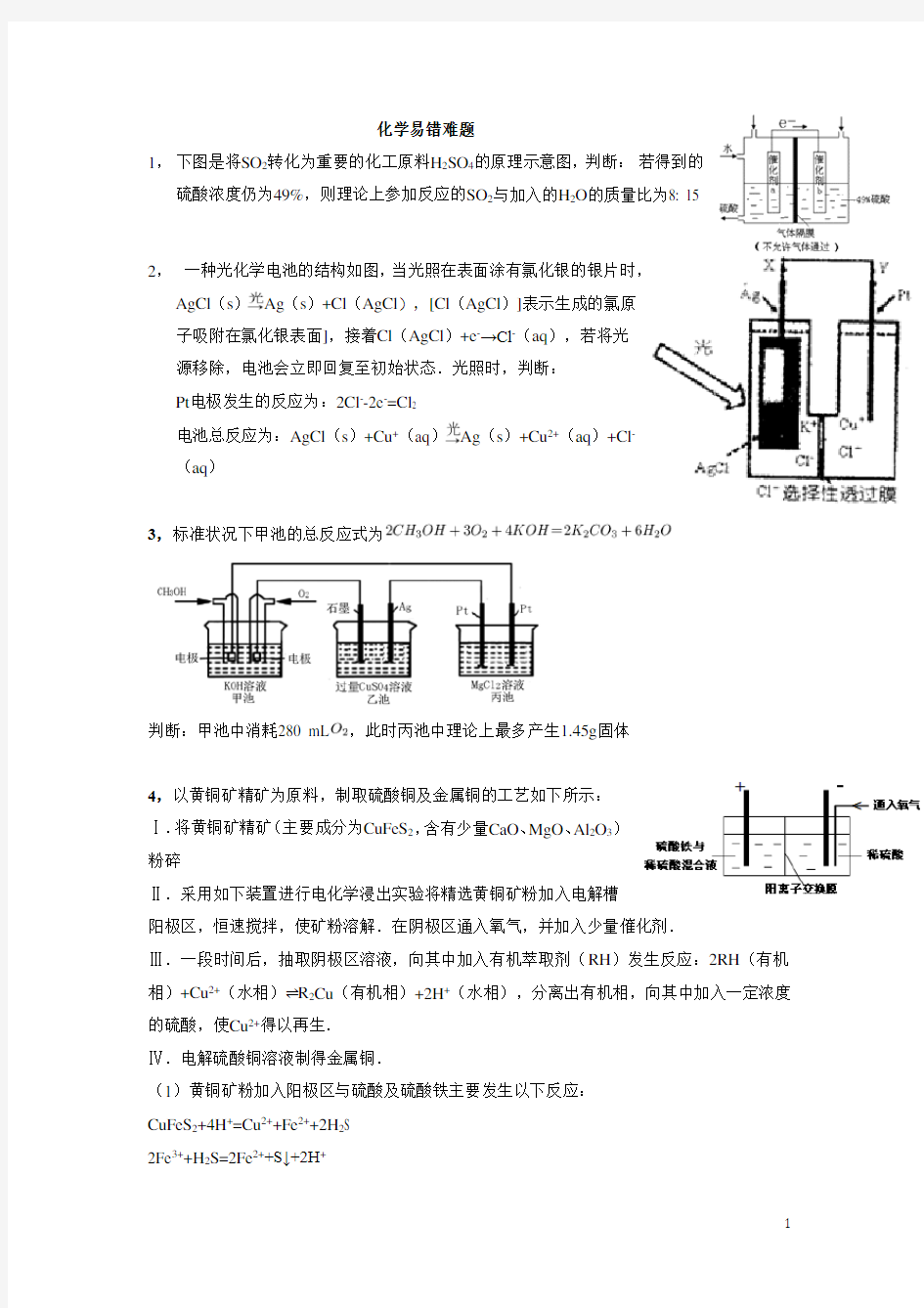
1,下图是将SO2转化为重要的化工原料H2SO4的原理示意图,判断:若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8: 15
2,一种光化学电池的结构如图,当光照在表面涂有氯化银的银片时,
AgCl(s)Ag(s)+Cl(AgCl),[Cl(AgCl)]表示生成的氯原
子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光
源移除,电池会立即回复至初始状态.光照时,判断:
Pt电极发生的反应为:2Cl--2e-=Cl2
电池总反应为:AgCl(s)+Cu+(aq)Ag(s)+Cu2+(aq)+Cl-
(aq)
3,标准状况下甲池的总反应式为
判断:甲池中消耗280 mL,此时丙池中理论上最多产生1.45g固体
4,以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)
粉碎
Ⅱ.采用如下装置进行电化学浸出实验将精选黄铜矿粉加入电解槽
阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)⇌R2Cu(有机相)+2H+(水相),分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是______.
5,一定条件下,下图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
该储氢装置的电流效率= (保留1位小数)
6,重铬酸铵[(NH4)2Cr2O7]是一种橘黄色晶体,实验室可由工业级铬酸钠(Na2CrO4)制取重铬酸铵。有关物质的溶解度如图所示。
实验步骤如下:
步骤1:将铬酸钠溶于适量的水,加入一定量浓硫酸酸化,使铬酸钠
转化为重铬酸钠。
步骤2:将上述溶液蒸发结晶,并趁热过滤。
步骤3:将步骤2得到的晶体再溶解,再蒸发结晶并趁热过滤。
步骤4:将步骤2、3得到的滤液冷却至40 ℃左右进行结晶,用水洗
涤,获得重铬酸钠晶体。
步骤5:将步骤4得到的重铬酸钠和氯化铵按物质的量之比1∶2 溶于
适量的水中,加热至105~110 ℃,让其充分反应。
(2)步骤2、3的主要目的是_______________________________________。
(3)步骤4在40 ℃左右结晶,其主要目的是________________________________。
7.Ksp(BaSO4)=1.07*10-10 Ksp(BaCO3)=2.58*10-9
现有0.2mol的BaSO4沉淀,每次用1L饱和NaCO3溶液,(浓度为1.79mol/ L)处理。若使BaSO4的SO42-全部转化到溶液中,需要反复处理次。[ BaSO4(s)+ CO32-(aq)=BaCO3(s)+ SO42-(aq)]
8,室温下,甲、乙两烧杯均盛有5mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是()。
D: 若分别与5mL pH=11的溶液反应,所得溶液的pH:甲≤乙
9,下图中的装置D是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图中的装置A、B、C也可起到相同效果的有________(填写编号)。
10,化学实验装置的正确连接是实验成败的关键,下图是中学化学中常见的实验装置.
甲同学用A、B组合来验证盐酸、碳酸、次氯酸的酸性强弱时,则盐酸应装入(填仪器名称)中,B装置中发生反应的离子方程式为.
11,将铝粉与Fe3O4粉末配制成铝热剂,分成三等份。①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3.下列说法正确的是()
A.V1=V3>V2B.V2>V1 =V3C.V1= V2>V3D.V1>V3>V2
12,用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少
量浓盐酸注入大试管内;
②关闭活塞1,盖上分液漏斗上口玻璃塞,浓盐酸和大试管内的高
锰酸钾粉末反应产生氯气;
③轻轻摇动瓶A,使氯气不断溶入水中.
用图乙装置能在较短时间内得到饱和氯水,除了在摇动过程中增
大了气体和水的接触面以外,另一个重要原因是______.分液漏斗中的盐酸应分数次加入试管内,若一次加入太多的盐酸,可能引起的后果是______.
13,实验室模拟合成氨和氨催化氧化的流程如下:
氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,
(“会”或“不会”)发生倒吸,原因
是:。
14,如图装置可用于收集气体并验证其某些化学性质,正确的是()
选项气体试剂现象结论
A NH3酚酞试液溶液变红色NH3的水溶液显碱性
B Cl2紫色石蕊试液溶液先变红后褪色Cl2有酸性和漂白性
C C2H2溴水溶液褪色C2H2分子中含碳碳双键
D X KI淀粉溶液溶液变蓝X可能是Cl2或NO2等
15, 由Na2O2、Na2CO3、NaHCO3、Na2O、NaCl中的某几种组成的混合物,向其中加入足量的盐酸,有气体放出。将气体通过足量的NaOH溶液,气体体积减少。将上述混合物在空气中加热,有气体放出且固体质量增加。下列判断正确的是()
A.混合物中一定不含Na2CO3、NaCl
B.混合物中一定有Na2O3、NaHCO3、Na2O
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O3、NaCl
16,硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(NaS2O3·5H2O)。I.[查阅资料]
(1)NaS2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。(2)向Na2CO3和Na2S混合液中通入SO2可制得NaS2O3,所得产品中常含有少量Na2SO3和Na2SO4。