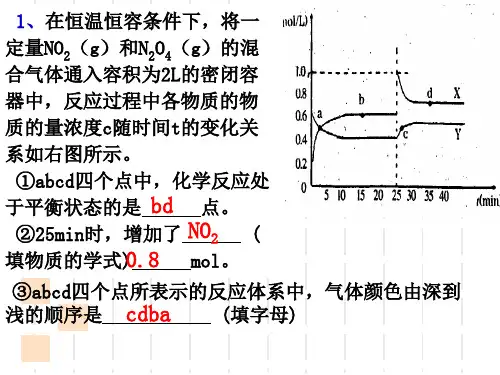
的程度? 增加氧气的浓度
2、可逆反应H2O(g)+C(s) CO(g)+H2(g) 在一定条件下达平衡状态,改变下列条件, 能否引起平衡移动?CO浓度有何变化? ①增大水蒸气浓度 ②加入更多的碳
③增加H2浓度 ① ③
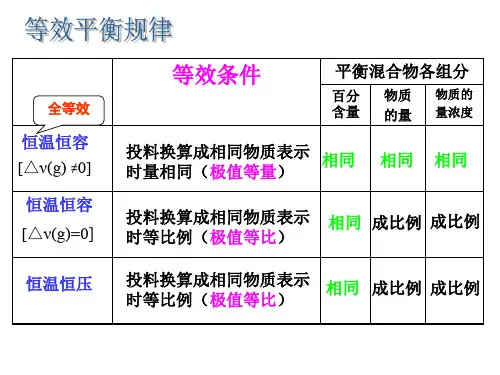
3、浓度对化学平衡移动的几个注意点
① 改变固态和纯液态物质的量并不影响V正、V逆的 大小,所以化学平衡不移动。
原因分析: •增加反应物的浓度, V正 > V逆,
平衡向正反应方向移动; 速率-时间关系图:
V
增
大
V,(正)
反
V(正)
应
V,(逆)
物
浓
V(逆)
度
0
t1
t
讨论:
当减小反应物的浓度时, 化学平衡将怎 样移动?并画出速率-时间关系图.
减V
小
反
V(正)
应
物
V,(逆)
浓
V(逆)
度
V,(正)
0
t1
t
一、浓度对化学平衡的影响:
速率-时间关系图:
V’正= V’逆
增大压强,正逆反应速 率均增大,但增大倍数 一样, V’正= V’逆,平衡 不移动。
0
t2
T(s)
练习
1.下列反应达到化学平衡时,增大压强,平衡是 否移动?向哪个方向移动?移动的根本原因是 什么?
① 2NO(g) + O2(g)
2NO2 (g)
② CaCO3(s) CaO(s) + CO2 (g)
课堂练习
❖ 已建立化学平衡的某可逆反应,当改变条件
使化学平衡向正反应方向移动时,下列有关
叙述正确的是
B
❖ ① 生成物的百分含量一定增加② 生成物的产