四种常见晶体资料
- 格式:ppt
- 大小:1.05 MB
- 文档页数:21

晶体的四种基本类型和特点晶体是由于原子、分子或离子排列有序而形成的固态物质。
根据晶体的结构特点,晶体可以分为四种基本类型:离子晶体、共价晶体、金属晶体和分子晶体。
1. 离子晶体离子晶体由正离子和负离子通过离子键结合而成。
正负离子之间的电荷吸引力使得离子晶体具有高熔点和脆性。
离子晶体的晶格结构稳定,形成高度有序的排列。
常见的离子晶体有氯化钠(NaCl)、氧化镁(MgO)等。
离子晶体在溶液中能够导电,但在固态下通常是绝缘体。
2. 共价晶体共价晶体由共价键连接的原子或分子组成。
共价键是由原子间的电子共享形成的,因此共价晶体具有很高的熔点和硬度。
共价晶体的晶格结构复杂多样,具有很高的化学稳定性。
典型的共价晶体包括金刚石(C)和硅(Si)。
共价晶体通常是绝缘体或半导体,由于共价键的稳定性,其导电性较弱。
3. 金属晶体金属晶体由金属原子通过金属键结合而成。
金属键是由金属原子间的电子云形成的,因此金属晶体具有良好的导电性和热传导性。
金属晶体的晶格结构常为紧密堆积或面心立方等紧密排列。
金属晶体的熔点通常较低,而且具有良好的延展性和韧性。
典型的金属晶体有铁(Fe)、铜(Cu)等。
4. 分子晶体分子晶体由分子通过弱相互作用力(如范德华力)结合而成。
分子晶体的晶格结构不规则,分子间的距离和角度较大。
由于分子间的相互作用力较弱,分子晶体通常具有较低的熔点和软硬度。
典型的分子晶体有水(H2O)、冰、石英(SiO2)等。
分子晶体在固态下通常是绝缘体,但某些分子晶体在溶液中能够导电。
总结起来,离子晶体由正负离子通过离子键结合,具有高熔点和脆性;共价晶体由共价键连接,具有高熔点和硬度;金属晶体由金属原子通过金属键结合,具有良好的导电性和热传导性;分子晶体由分子通过弱相互作用力结合,具有较低的熔点和软硬度。
这四种基本类型的晶体在结构、性质和应用上都有明显的差异。
研究晶体的类型和特点对于理解物质的性质和应用具有重要意义。

高二下化学四大晶体知识点化学是一门关于物质的研究,而晶体作为物质的一种特殊形态,在化学中具有重要的地位。
在高二下学期的化学课程中,学生们将会学习四大晶体知识点,分别是晶体的定义与特征、晶体的结构特征、晶体的晶格与晶核以及晶体的生长与影响因素。
下面将结合这四个知识点进行详细的阐述。
晶体的定义与特征晶体是指由具有周期性、有序排列的粒子构成的固体。
晶体的最显著特征是具有长程有序性,即原子、离子或分子的排列方式在整个晶体中有规律地重复出现。
此外,晶体还具有透明或半透明、具有特定的光学性质、结构紧密等特点。
晶体的结构特征晶体的结构特征主要包括晶体的晶胞、晶体的晶格以及晶体的晶体系。
晶胞是构成晶体的最小结构单位,通常由若干个晶体基元组成。
晶格是晶体中所有晶胞的有序排列,决定了晶体的外部形态和内部结构。
晶体系是晶体在空间中排列的方式,主要包括立方晶系、四方晶系、正交晶系、单斜晶系、三斜晶系和六方晶系。
晶体的晶格与晶核晶格是晶体中原子、离子或分子排列的有序结构,可以看做是无限重复的晶胞。
晶格通过晶胞间的平移操作而生成整个晶体。
晶核是晶体在固液相变中形成的最小晶体单位,具有完整的晶体结构。
晶核的形成涉及到过饱和度、温度和晶体性质等因素。
晶体的生长与影响因素晶体的生长是指晶核不断增大并形成完整晶体的过程。
晶体的生长受到溶液中溶质浓度、温度、溶液饱和度、溶质的分子大小和形状等因素的影响。
其中,过饱和度的增大、温度的升高以及溶液中杂质的存在都有助于晶体生长的发生。
综上所述,高二下化学的四大晶体知识点包括晶体的定义与特征、晶体的结构特征、晶体的晶格与晶核和晶体的生长与影响因素。
通过学习这些知识点,学生们能够对晶体有更深入的了解,为今后的学习打下坚实的基础。
希望同学们能够认真学习,掌握这些重要的化学知识点,提高自己的学习成绩,为将来的科学研究做好准备。

四大晶体知识总结一、分子晶体及其结构特点1. 概念: 分子间通过分子间作用力相结合形成的晶体。
2. 微粒间作用分子晶体中相邻的分子间以分子间作用力相互吸引。
4.(1)干冰①每个晶胞中有4个CO2分子, 12个原子。
②每个CO2分子周围等距离紧邻的CO2分子数为12个。
(2)冰①水分子之间的作用力有范德华力和氢键, 但主要是氢键。
②由于氢键的方向性, 使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
分子晶体的堆积方式1. 物理特性(1)分子晶体的熔、沸点较低, 密度较小, 硬度较小, 较易熔化和挥发。
(2)一般是绝缘体, 熔融状态也不导电。
(3)溶解性符合“相似相溶”规律。
2. 分子晶体熔、沸点高低的比较规律(1)分子晶体中分子间作用力越大, 物质熔、沸点越高, 反之越低。
(2)具有氢键的分子晶体, 熔、沸点反常高。
二、原子晶体及其结构特点1.概念相邻原子间以共价键相结合形成三维的共价键网状结构的晶体叫原子晶体, 又叫共价晶体。
2. 构成微粒及微粒间作用3. 常见原子晶体及物质类别(1)某些单质: 如硼(B)、硅(Si)、锗(Ge)、金刚石等。
(2)某些非金属化合物: 如碳化硅(SiC)、二氧化硅(SiO2)、氮化硼(BN)、氮化硅(Si3N4)等。
(3)极少数金属氧化物, 如刚玉(αAl2O3)等。
4. 两种典型原子晶体的组成与结构(1)金刚石金刚石晶体中, 每个碳原子均以4个共价键对称地与相邻的4个碳原子相结合, 形成C—C —C夹角为109°28′的正四面体结构(即金刚石中的碳采取sp3杂化轨道形成共价键), 整块金刚石晶体就是以共价键相连的空间网状结构。
其中最小的环是六元环, 每个碳原子参与形成12个六元环。
(2)二氧化硅二氧化硅晶体中, 每个硅原子均以4个共价键对称地与相邻的4个氧原子相结合, 每个氧原子与2个硅原子相结合, 向空间扩展, 形成空间网状结构。

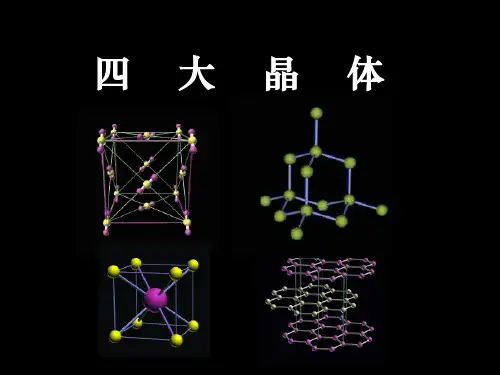



总结:四大晶体晶体类型离子晶体原子晶体分子晶体金属晶体概念离子间离子键原子间共价键分子间分子力金属离子和e金属键晶体质点阴、阳离子原子分子金属离子原子和e作用力离子键共价键分子间力金属键物理性质熔沸点较高很高很低一般高少数低硬度较硬很硬硬度小多数硬少数软溶解性易溶于水难溶任何溶剂相似相溶难溶导电性溶、熔可硅、石墨可部分水溶液可固、熔可实例盐MOH MO C Si SiO2SiC HX XO n HXO n金属或合金1.各种晶体中的化学键⑴离子晶体:一定有离子键,可能有共价键(极性键、非极性键、配位键)⑵分子晶体:一定没有离子键,可能有极性键、非极性键、配位键;也可能根本没有化学键。
⑶原子晶体:一定没有离子键,可能有极性键、非极性键。
⑷金属晶体:只有金属键2、物质熔沸点高低比较规律(1)晶体内微粒间作用力越大,熔沸点越高,只有分子晶体熔化时不破坏化学键。
(2)不同晶体(一般情况下):原子晶体>离子晶体>分子晶体熔点:上千度~几千度〉近千度~几百度〉多数零下最多几百度(3)相同条件下一般地说熔沸点:固态>液态>气态2、物质熔沸点高低比较规律(4)同种晶体离子晶体:比较离子键强弱,离子半径越小,电荷越多,熔沸点越高MgO〉MgCl2>NaCl〉KCl>KBr原子晶体:比较共价键强弱(看键能和键长)金刚石(C)> 水晶(SiO2) > SiC > Si分子晶体:比较分子间力(和分子内的共价键的强弱无关)1)组成和结构相似时,分子量越大熔沸点越高F2〈Cl2〈Br2〈I2;HCl〈HBr 〈HI;CF4〈CCl4 < CBr4 < CI4;N2〈O2 ;同系物熔沸点的比较2)同分异构体:支链越多熔沸点越低正戊烷>异戊烷〉新戊烷金属晶体:比较金属键,金属原子半径越小,价电子数越多,熔沸点越高。
熔沸点同族从上到下减小,同周期从左到右增大.Li>Na>K〉Rb>Cs ; Na〈Mg〈Al3、晶体类型的判断◆从物质的分类上判断:●离子晶体:强碱、大多数盐类、活泼金属氧化物;●分子晶体:大多数非金属单质(金刚石、石墨、晶体硅、晶体硼除外)及氧化物(SiO2除外),所有的酸及非金属氢化物,大多数有机物等。

化学中四种典型晶体的判断
晶体是由原子、分子或离子等有规则排列而成的固体物质,是化学中的重要概念之一。
在化学实验中,判断晶体的种类十分重要,下面介绍四种典型晶体的判断方法。
1. 硫酸铜晶体
硫酸铜晶体为蓝色斜方晶系,容易溶于水,且有强烈的蓝色。
判断硫酸铜晶体的方法是将少量硫酸铜溶于水中,加入一点氢氧化钠或氢氧化铵,若出现深蓝色沉淀,则为硫酸铜晶体。
2. 氯化钠晶体
氯化钠晶体为无色正方晶系,有一定的溶解度,且味道咸。
判断氯化钠晶体的方法是取一小部分样品,加入少量硫酸银,若出现白色沉淀,则为氯化钠晶体。
3. 硝酸银晶体
硝酸银晶体为白色菱形晶系,容易溶于水,且有毒。
判断硝酸银晶体的方法是将少量硝酸银溶于水中,加入一点氯化钠,若出现白色沉淀,则为硝酸银晶体。
4. 碘晶体
碘晶体为闪亮的黑色六方晶系,不溶于水,但可以溶于氯仿、二硫化碳等有机溶剂。
判断碘晶体的方法是将少量碘溶于氯仿中,加入一点氢氧化钠或氢氧化铵,若溶液变成蓝色,则为碘晶体。
通过以上四种典型晶体的判断方法,可以帮助化学实验者更准确、快速地判断出实验中所用晶体的种类。

胞状晶树枝晶等轴晶胞状晶树枝晶、胞状晶、树枝晶和等轴晶是四种常见的晶体形貌,它们分别具有不同的形态特征和生长机制。
首先,胞状晶是指晶体表面呈现细胞状的形态。
它的特点是晶体的表面有许多类似于细胞的结构,这些结构形状各异,不规则排列,形如多边形或菱形等。
胞状晶的生长机制主要是通过扩散、溶解和重结晶来实现的。
晶体在溶液中长大,扩散使溶质进入晶体内部,同时晶体表面也发生溶解和重结晶,形成新的结晶层,最终形成细胞状晶。
接下来,树枝晶是指晶体的形态呈现出分枝状或树枝状的形态。
树枝晶的特点是晶体的外形类似于树枝,有许多分枝和岔支,形状复杂多样。
树枝晶的生长机制主要是通过表面边界行进和物质扩散来实现的。
晶体在溶液中生长时,先形成主干,然后从主干表面生长出许多分枝,通过物质在溶液中的扩散来实现晶体的分枝生长。
接着,等轴晶是指晶体的形态呈现出较为均匀的球形或近似球形的形态。
等轴晶的特点是晶体的各个方向长度相近,没有明显的长轴和短轴。
等轴晶的生长机制主要是晶体在溶液中均匀生长,没有明显的生长方向。
因此,等轴晶一般在均匀溶液中生长,或是在被限制生长的环境中形成。
总体来说,胞状晶树枝晶、胞状晶、树枝晶和等轴晶是晶体形貌多样性的一种表现。
它们的形态特征和生长机制与晶体的物相、生长条件和晶体材料等密切相关。
对于胞状晶树枝晶,生长物相的成分和浓度、溶液的流动状态等对其形态有很大影响。
对于胞状晶和树枝晶,晶体的生长速率、表面活性剂的存在等因素也会对其形态产生影响。
而对于等轴晶,溶液的浓度、温度变化以及溶质与溶剂的相溶性等因素也会对其形态产生影响。
综上所述,胞状晶树枝晶、胞状晶、树枝晶和等轴晶是四种常见的晶体形貌。
它们具有不同的形态特征和生长机制,反映了晶体在不同条件下生长的多样性。
研究晶体形貌及其形成机制,对于理解晶体生长过程、调控晶体形态以及应用晶体材料等方面有着重要的意义。

四种晶体一.原子晶体1.定义:相邻的原子之间以共价键相结合而形成空间网状结构的晶体。
2.构成晶体的微粒:原子3.微粒间的相互作用:共价键①概念:原子间通过共用电子对所形成的相互作用。
②分类:极性共价键﹑非极性共价键③特征:有方向性﹑有饱和性④影响强度的因素:成键原子半径越小,键长越短,键能越大,共价键越稳定⑤对物质性质的影响:共价键的键能越大,分子稳定性越强4.物理性质:熔沸点高,难溶于水,硬度大,固态时不导电(熔点:金刚石﹥碳化硅﹥晶体硅)一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,熔沸点越高5.实例:某些非金属单质,如:B、Si、Ge 等;某些非金属化合物,如:SiC、BN、SiO2 二.金属晶体1.定义:通过金属键结合而形成的晶体2.构成晶体的微粒:金属阳离子和自由电子3.微粒间的相互作用:金属键4.物理性质:导热性、导电性、延展性,熔沸点较高,硬度较大一般来说,金属原子的价电子数越多,原子半径越小,金属晶体内部作用力越强,离子的熔沸点越高5.实例:金属、合金6.金属晶体的四种堆积模型简单立方:代表金属Po;配位数6;晶胞占有的原子数1体心立方(钾型):代表金属Na、K、Fe;配位数8;晶胞占有的原子数2面心立方(铜型):代表金属Cu、Ag、Au;配位数12;晶胞占有的原子数4六方最密堆积(镁型):代表金属Mg、Zn、Ti;配位数12;晶胞占有的原子数2 三.分子晶体1.定义:分子间以分子间作用力结合而成的晶体2.构成微粒:分子3.微粒间的相互作用力:①范德华力:特征:无方向性、无饱和性影响强度的因素:随着分子极性的增大而增大组成和结构相似的物质,相对分子质量越大,范德华力越大对物质性质的影响:影响物质的熔沸点、溶解度等物理性质组成和结构相似的物质,随着相对分子质量的增大,物质的熔沸点增大②氢键:分类:分子间氢键、分子内氢键特征:有方向性、有饱和性影响强度的因素:对A—H…B,A、B的电负性越大,B原子半径越小,键能越大对物质性质的影响:使物质的熔沸点升高,在水中的溶解度越大4.物理性质:熔沸点较低,硬度较小;“相似相溶”原理汽化或熔融时,克服分子间作用力不破坏化学键在固态或熔融状态下不导电5.实例:非金属氢化物、部分非金属单质、部分非金属氧化物、几乎所有的酸、绝大多数有机物四.离子晶体1.定义:离子间通过离子结合而形成的晶体2.构成微粒:阴离子和阳离子3.微粒间的相互作用:离子键4.物理性质:具有较高的熔沸点,难挥发,硬而脆,固态不导电,熔化或溶于水后能导电大多数易溶与极性溶剂(如水中),难溶于非极性溶剂(如汽油煤油)一般来说,阴阳离子所带的电荷数越多,离子半径越小,则离子键越强,离子晶体的熔沸点越高6.实例:强碱、活泼金属氧化物、绝大多数盐五.得到晶体的途径:熔融状态物质凝固气态物质冷却不经液态直接凝固(凝华)溶质从溶液中析出。
3四种重要晶体的结构特点1.氯化钠晶体(1)Na+、Cl-在晶体中按确定的比例和一定的规则排列,使整个离子晶体不显电性且能量最低。
离子晶体中无单个分子存在。
(2)离子的配位数为6。
(3)在每个结构单元(晶胞)中,处于不同位置的微粒在该单元中的份额也有所不同,一般规律是顶点上的微粒属于该单元的份额是1/8;棱上的微粒在该单元中所占的份额为1/4;面上的微粒在该单元中所占的份额为1/2;中心位置上的微粒完全属于该单元,即份额为1。
例如:氯离子数:1/8×8+1/2×6=4钠离子数:1/4×12+1=4因此,钠离子数与氯离子数之比为1∶1,氯化钠的化学式为NaCl。
2.金刚石晶体(1)碳原子间通过共价键相结合而形成空间网状结构的原子晶体,整个晶体中无单个分子。
(2)微观构型:正四面体,每个碳原子与4个碳原子成键,每个碳原子上的任意两个C—C键的夹角都是109°28′。
(3)最小的环:六元环。
(4)每个C原子参与形成六元环的总数:12个。
3.干冰晶体(1)干冰晶体中分子之间通过范德华力相结合,当熔化时,分子内的化学键并不断裂。
(2)每个二氧化碳分子周围与之相邻且等距的二氧化碳分子数为12。
(3)每个结构单元中含二氧化碳分子数为1/8×8+1/2×6=4。
4.石墨晶体(1)晶体结构:平面层状结构。
(2)最小的环:六元环。
(3)由于每个碳原子为三个六元环所共用,即每个六元环拥有的碳原子数为6×1/3=2。
(4)碳碳键数为二个六元环所共用,每个六元环拥有的碳碳键数为6×1/2=3。
键角为120°。
(5)该晶体介于原子晶体、分子晶体、金属晶体之间,因而具有各种晶体的部分特点。
如熔点高,硬度小,能导电。
【典例5】判断下列晶体类型:(1)SiI4:熔点120.5 ℃,沸点271.5 ℃,易水解。
属__________________________。
晶体的类型与性质知识规律总结晶体类型离子晶体分子晶体原子晶体金属晶体定义离子间通过离子键相结合而成的晶体分子间以分子间作用力相结合的晶体相邻原子间以共价键相结合而形成的空间网状结构的晶体金属阳离子和自由电子之间的较强作用形成的单质晶体构成粒子阴、阳离子分子原子金属离子、自由电子粒子间作用力离子间肯定有离子键,可能有原子间的共价键分子间:分子间作用力。
可能有分子内共价键(稀有气体例外)共价键金属离子和自由电子之间较强的相互作用代表物NaCl,NaOH,MgSO4干冰,I2,P4,H2O 金刚石,SiC,晶体硅,SiO2镁、铁、金、钠熔、沸点熔点、沸点较高熔点、沸点低熔点、沸点高熔点、沸点差异较大(金属晶体熔沸点一般较高,少部分低)导热性不良不良不良良好导电性固态不导电,熔化或溶于水导电固态和液态不导电,溶于水可能导电不导电。
有的能导电,如晶体硅,但金刚石不导电。
晶体、熔化时都导电硬度硬度较大硬度很小硬度很大硬度差异较大溶解性多数易溶于水等极性溶剂相似相溶难溶解难溶于水(钠、钙等与水反应)决定熔点、沸点高主要因素离子键强弱分子间作用力大小共价键强弱金属键强弱二、几种典型的晶体结构①、NaCl晶体1)在NaCl晶体的每个晶胞中,Na+占据的位置有 2 种。
顶点8个,面心6个2)Cl-占据的位置有 2 种。
棱上12个,体心1个3)在NaCl晶体中,每个Na+周围与之等距离且最近的Na+有 12 个;每个Cl-周围与之等距离且最近的Cl-有 12 个。
4)在NaCl晶体中每个Na+同时吸引着6个Cl-,每个Cl-同时也吸引着 6个Na+,向空间延伸,形成NaCl晶体。
5)每个晶胞平均占有 4 个Na+和 4 个Cl-。
1molNaCl能构成这样的晶胞个。
6) Na+与其等距紧邻的6个Cl-围成的空间构型为_____正八面体_________②、CsCl晶体1)每个Cs+同时吸引着 8 个Cl-,每个Cl-同时吸引着 8 个Cs+;2)在CsCl晶体中,每个Cs+周围与它等距离且最近的Cs+有6个,每个Cl-周围与它等距离且最近的Cl-有 6 个;3)一个CsCl晶胞有 1 个Cs+和 1 个Cl-组成;4)在CsCl晶体中,Cs+与Cl-的个数比为 1:1 。
四类晶体的结构和性质的比较
类型
项目
分子晶体原子晶体金属晶体离子晶体定义
构成晶体的粒子
粒子之间的作用力
作用力的强弱
作用力强弱的
判断方法
晶体熔化破坏的
作用力
熔点、沸点
硬度
导热和导电性
溶解性
延展性
机械加工性
典型代表物质(1)冰晶体
(2)干冰晶体
(1)金刚石晶体
(2)二氧化硅晶体
(1)钾型(体心立方
A2)
(2)铜型(面心立方
A1)
(3)镁型(六方最密
堆积A3)
(1)氯化钠晶体
(2)氯化铯晶体
(3)ZnS晶体
(1)金刚石晶体:
①金刚石晶体属于 晶体,其熔点 ,硬度 。
②金刚石晶体中每个碳原子与 个碳原子以 结合,形成 结构, 与碳原子最近的碳原子有 个。
③金刚石晶体中C -C 之间的键角均为 。
④最小碳环由 个碳组成,这些碳原子 同一平面内,最小的环内处于同一平面的碳原子最多有 个。
⑤每个碳原子参与 条C -C 键的形成,碳原子与C -C 键之比为 。
⑥
(2)二氧化硅晶体:
①每个硅原子与4个氧原子以共价键结合,形成正四面体结构。
②每个正四面体占有1个Si ,4个“
2
1
氧”,n (Si):n (O)=1:2。
③最小环上有12个原子,即:6个氧原子和6个硅原子。
四种晶体熔沸点高低排序晶体是物质的一种形态,具有规则的排列和周期性的结构,是固态物质的一种。
晶体的熔沸点是指晶体从固态转变为液态或气态时所需的温度,也是晶体的物理性质之一。
本文将介绍四种常见的晶体,按照它们的熔沸点从高到低进行排序。
1. 金刚石(熔点约为3550℃)金刚石是一种由碳原子构成的晶体,是自然界中最硬的物质之一。
它的晶体结构是由每个碳原子与四个相邻的碳原子形成四面体结构,形成了一种密集的、连续的晶体网络。
由于其晶体结构的紧密性,金刚石的熔沸点非常高,约为3550℃。
这也使得金刚石是一种非常耐高温的材料,可以被用于制造高温炉、高温热处理工具等。
2. 石英(熔点约为1713℃)石英是一种由硅氧原子构成的晶体,是自然界中最常见的矿物之一。
它的晶体结构是由每个硅原子与四个相邻的氧原子形成四面体结构,形成了一种紧密的、连续的晶体网络。
由于其晶体结构的紧密性,石英的熔沸点也非常高,约为1713℃。
石英在工业上有广泛的应用,可以用于制造玻璃、陶瓷、光学仪器等。
3. 盐(熔点约为801℃)盐是一种由氯化钠分子构成的晶体,是一种常见的食盐。
它的晶体结构是由每个钠离子与六个相邻的氯离子形成八面体结构,形成了一种密集的、连续的晶体网络。
由于其晶体结构的紧密性,盐的熔沸点也比较高,约为801℃。
盐可以用于烹饪、腌制、制造化学品等。
4. 冰(熔点约为0℃)冰是一种由水分子构成的晶体,是一种常见的物质。
它的晶体结构是由每个水分子与四个相邻的水分子形成六面体结构,形成了一种密集的、连续的晶体网络。
由于其晶体结构的紧密性,冰的熔沸点也比较高,约为0℃。
冰可以用于制冷、制造雪、制造冰雕等。
总结晶体的熔沸点是晶体的物理性质之一,它与晶体的结构密切相关。
不同的晶体具有不同的晶体结构和熔沸点,金刚石、石英、盐和冰是四种常见的晶体,它们的熔沸点从高到低依次排列为金刚石、石英、盐和冰。
这些晶体在工业、生活中都有广泛的应用。