2020高考化学原电池和电解池常考知识点总结(11页)
- 格式:docx
- 大小:73.71 KB
- 文档页数:11


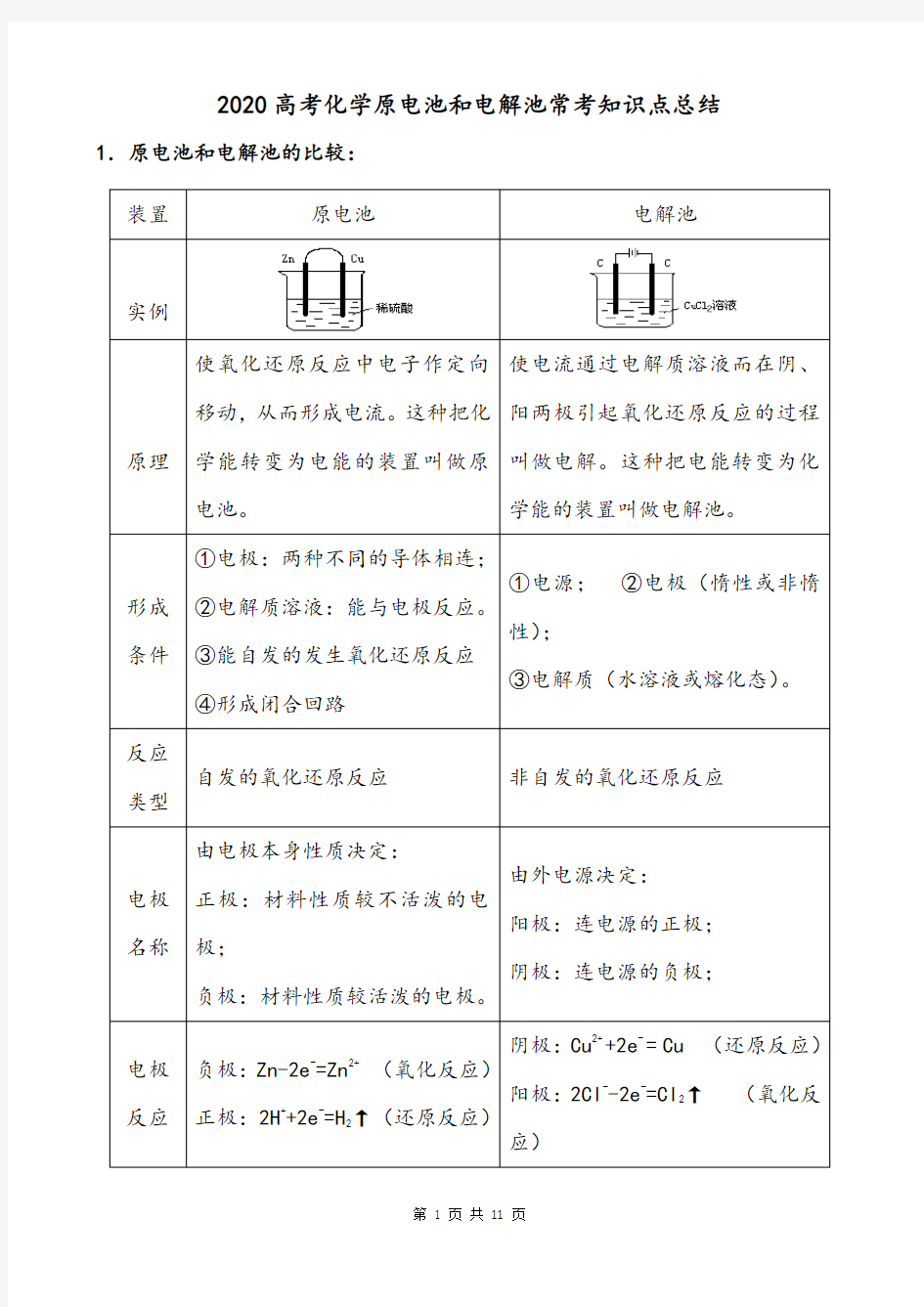
2020高考化学原电池和电解池常考知识点总结1.原电池和电解池的比较:
2原电池正负极的判断:
⑴根据电极材料判断:活泼性较强的金属为负极,活泼性较弱的或者非金属为正极。
⑵根据电子或者电流的流动方向:电子流向:负极→正极。电流方向:正极→负极。
⑶根据电极变化判断:氧化反应→负极;还原反应→正极。
⑷根据现象判断:电极溶解→负极;电极重量增加或者有气泡生成→正极。
⑸根据电解液内离子移动的方向判断:阴离子→移向负极;氧离子→移向正极。
3电极反应式的书写:
负极:⑴负极材料本身被氧化:
①如果负极金属生成的阳离子与电解液成分不反应,则为最简单的:M-n e-=M n+如:Zn-2 e-=Zn2+
②如果阳离子与电解液成分反应,则参与反应的部分要写入电极反应式中:
如铅蓄电池,Pb+SO42--2e-=PbSO4
⑵负极材料本身不反应:要将失电子的部分和电解液都写入电极反应式,
如燃料电池CH4-O2(C作电极)电解液为KOH:负极:CH4+10OH-8 e-=C032-+7H2O 正极:⑴当负极材料能自发的与电解液反应时,正极则是电解质溶液中的微粒的反应,
H2SO4电解质,如2H++2e=H2 CuSO4电解质: Cu2++2e= Cu
⑵当负极材料不与电解质溶液自发反应时,正极则是电解质中的O2反正还
原反应
①当电解液为中性或者碱性时,H2O比参加反应,且产物必为OH-,
如氢氧燃料电池(KOH电解质)O2+2H2O+4e=4OH-
②当电解液为酸性时,H+比参加反应,产物为H2O O2+4O2+4e=2H2O 4.化学腐蚀和电化腐蚀的区别
5.吸氧腐蚀和析氢腐蚀的区别
考点解说
6.金属的防护
⑴改变金属的内部组织结构。合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。如:不锈钢。⑵在金属表面覆盖保护层。常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。⑶电化学保护法
①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极
7。常见实用电池的种类和特点
⑴干电池(属于一次电池)
①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。酸性电解质:
②电极反应负极:Zn-2e-=Zn2+
正极:2NH4++2e-=2NH3+H2
NH3和H2被Zn2+、MnO2吸收: MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+
碱性电解质:(KOH电解质)
电极反应负极:Zn+2OH--2e-=Zn(OH)2
正极:2MnO2+2H2O+2e-=2MnOOH+ Zn(OH)2
Zn+ MnO2+2H2O-=2MnOOH+ Zn(OH)2
⑵铅蓄电池(属于二次电池、可充电电池)
①结构:铅板、填满PbO2的铅板、稀H2SO4。
②A.放电反应负极: Pb-2e-+ SO42- = PbSO4原电池正极:PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2O
B.充电反应阴极:PbSO4 +2e-= Pb+ SO42-电解池
阳极:PbSO4 -2e- + 2H2O = PbO2 +4H+ + SO42-
===
总式:Pb + PbO 2 + 2H2SO4放电
充电2PbSO4 + 2H2O
注意:放电和充电是完全相反的过程,放电作原电池,充电作电解池。电极名称看电子得失,电极反应式的书写要求与离子方程式一样,且加起来应与总反应式相同。
⑶锂电池
①结构:锂、石墨、固态碘作电解质。
②A电极反应负极: 2Li-2e- = 2Li+
正极: I2 +2e- = 2I-
总式:2Li + I2 = 2LiI
B MnO2 做正极时:
负极: 2Li-2e- = 2Li+
正极:MnO2+e- = MnO2 -
总Li +MnO2= Li MnO2
锂电池优点:体积小,无电解液渗漏,电压随放电时间缓慢下降,应用:心脏起搏器,手机电池,电脑电池。
⑷A.氢氧燃料电池
①结构:石墨、石墨、KOH溶液。
②电极反应负极: H2- 2e-+ 2OH- = 2H2O
正极: O2 + 4e- + 2H2O = 4OH-总式:2H2+O2=2H2O
(反应过程中没有火焰,不是放出光和热,而是产生电流)注意:还原剂在负极上反应,氧化剂在正极上反应。书写电极反应式时必须考虑介质参加反应(先常规后深入)。若相互反应的物质是溶液,则需要盐桥(内装KCl的琼脂,形成闭合回路)。
B.铝、空气燃料电池以铝—空气—海水电池为能源的新型海水标志灯已研制成功。这种灯以取之不尽的海水为电解质溶液,靠空气中的氧气使铝不断氧化而源源不断产生电流。只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。
电极反应:铝是负极 4Al-12e-== 4Al3+;
石墨是正极 3O2+6H2O+12e-==12OH-
8.电解池的阴阳极判断:
⑴由外电源决定:阳极:连电源的正极;阴极:连电源的负极;
⑵根据电极反应: 氧化反应→阳极;还原反应→阴极
⑶根据阴阳离子移动方向:阴离子移向→阳极;阳离子移向→阴极,
⑷根据电子几点流方向:电子流向: 电源负极→阴极;阳极→电源正极
电流方向: 电源正极→阳极;阴极→电源负极
9.电解时电极产物判断:
⑴阳极:如果电极为活泼电极,Ag以前的,则电极失电子,被氧化被溶解,Zn-2e-=Zn2+
如果电极为惰性电极,C、Pt、Au、Ti等,则溶液中阴离子失电子,4OH-- 4e-= 2H2O+ O2
阴离子放电顺序S2->I->Br->Cl->OH->含氧酸根>F-
⑵阴极:(.阴极材料(金属或石墨)总是受到保护)根据电解质中阳离子活动顺序判断,阳离子得电子顺序—金属活动顺序表的反表金属活泼性越强,则对应阳离子的放电能力越弱,既得电子能力越弱。
K+