第七章配合物的反应动力学.pptx
- 格式:pptx
- 大小:2.41 MB
- 文档页数:72

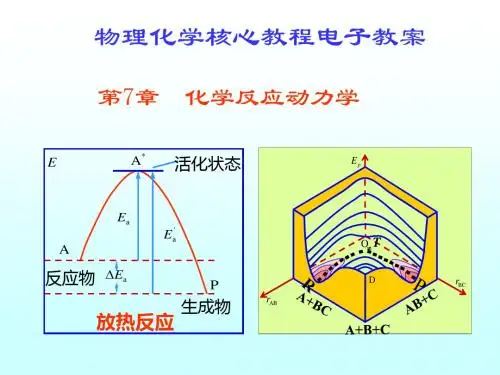
第七章配合物反应动力学部门: xxx时间: xxx整理范文,仅供参考,可下载自行编辑第七章配合物反应动力学研究范围:取代、氧化还原、异构化、加成与消除、配体上进行的反应第一节配合物的反应类型1、取代反应[Cu(H2O>6]2+ + NH3 [Cu(NH3>4(H2O>2]2+ +H2Ob5E2RGbCAP[Mo(CO>6] + bipy [Mo(CO>4bipy][Cr(H2O>6]3+ + Cl− [Cr(H2O>5Cl]2+ + H2O2、氧化还原反应[Os(bipy>3]2++ [Mo(CN>6]3−[Os(bipy>3]3+ +[Mo(CN>6]4−p1EanqFDPw3、异构化反应cis-[CoCl2(en>2]+ trans-[CoCl2(en>2]+[Co(-ONO>(NH3>5]2+ [Co(-NO2>(NH3>5]2+4、加成和消除反应[IrICl(CO>(PPh3>2] + H2 [IrIIIClH2(CO>(PPh3>2]DXDiTa9E3d[PtIICl2(NH3>2] + Cl2 [PtIVCl4(NH3>2]cis-[PtIVHCl2Me(PEt3>2] cis-[PtIICl2(PEt3>2] +CH4RTCrpUDGiT5、配体的反应第二节取代反应动力学定义:配离子中一个配体被另一个自由配体取代的反应。
例:L5M-X+Y L5M-Y+X一、取代的反应机理1、SN1和SN2机理<1)离解机理<SN1机理)慢a.L5M-X = L5M+X<配位数下降6 5)b.L5M+Y=L5M-Y速率方程:d[L5M-Y]/dt= k[L5M-X]速率与Y浓度无关,是对[L5M-X]的一级反应。
<2)缔合机理<SN2机理)慢a、L5M-X+Y = L5MXY<配位数升高6 7)b、L5MXY = L5M-Y + Xd[L5M-Y]/dt=k[L5M-X][Y]属于二级反应。


第七章配合物反应动力学研究范围:取代、氧化还原、异构化、加成与消除、配体上进行的反应第一节配合物的反应类型1、取代反应[Cu(H2O)6]2++ NH3 [Cu(NH3)4(H2O)2]2+ + H2O[Mo(CO)6] + bipy [Mo(CO)4bipy][Cr(H2O)6]3++ Cl−[Cr(H2O)5Cl]2+ + H2O2、氧化还原反应[Os(bipy)3]2++ [Mo(CN)6]3−[Os(bipy)3]3+ + [Mo(CN)6]4−3、异构化反应cis-[CoCl2(en)2]+trans-[CoCl2(en)2]+[Co(-ONO)(NH3)5]2+[Co(-NO2)(NH3)5]2+4、加成和消除反应[Ir I Cl(CO)(PPh3)2] + H2[Ir III ClH2(CO)(PPh3)2][Pt II Cl2(NH3)2] + Cl2[Pt IV Cl4(NH3)2]cis-[Pt IV HCl2Me(PEt3)2] cis-[Pt II Cl2(PEt3)2] + CH45、配体的反应ZnHCl-H2O [(NH3)3Pt-NO2]+[(NCrOOCrOOBrBr233第二节取代反应动力学定义:配离子中一个配体被另一个自由配体取代的反应。
例:L5M-X+Y L5M-Y+X一、取代的反应机理1、SN1和SN2机理(1)离解机理(SN1机理)慢a.L5M-X = L5M + X(配位数下降6 5)b.L5M + Y = L5M-Y速率方程:d[L5M-Y]/dt = k[L5M-X]速率与Y浓度无关,是对[L5M-X]的一级反应。
(2)缔合机理(SN2机理)慢a、L5M-X + Y = L5MXY(配位数升高6 7)b、L5MXY = L5M-Y + Xd[L5M-Y]/dt = k[L5M-X][Y]属于二级反应。
* SN1和SN2是两种极限情況。
二.活性与惰性配合物及理论解释1、活性与惰性配合物1)定义:配体可被快速取代的配合物,称为活性配合物;配体取代缓慢的配合物,称为惰性配合物划分标准:配合物与反应试剂(浓度均为0.1M)在25℃时反应,t1/2>1min,称为惰性配合物;t1/2<1min,称为活性配合物。