新人教版化学选修4高中电解池一
- 格式:doc
- 大小:102.00 KB
- 文档页数:9









【课题】人教版·高中化学·选修Ⅳ第四章电化学基础第三节电解池(第一课时)一、基本说明⒈教学内容所属模块:人教版·高中化学·选修Ⅳ⒉年级:高二⒊所用教材出版单位:人民教育出版社4所属的章节:第四章第三节5教学时间:45分钟二、教学设计【教材分析】电解属于电化学的知识范畴,是中学化学理论体系中不可缺少的一部分,同时电解与物理学科中的电学、能量的转换有密切的联系,是氧化还原反应、原电池、电离等知识的综合运用。
电解教学安排在氧化还原反应、离子方程式和原电池知识后教学,符合化学学科知识的逻辑体系和学生认知规律。
通过化学能和电能之间的相互转变,能够使学生对氧化还原反应的认识及化学反应中能量变化的认识更加深刻。
电解原理这一节内容包含了电解概念、电解池形成条件、电极反应式及电解方程式的书写等多个知识点,电解原理在工业生产、科学研究领域等方面应用很广泛,也是高考的重要考查点之一。
【学情分析】学生已经学习了化学反应中的物质变化和能量变化等理论知识,研究了化学能是如何转变成电能的,在此基础上,进一步研究电能转变为化学能是完全符合学生的认知规律的,电解原理是高中化学教材中的一个重要基本理论之一,也是学习过程中的一个难点。
在进行本课学习时,可以借鉴以前的方法,进一步运用所学的关于氧化还原反应、化学反应中的能量变化等理论知识,指导本章知识的学习,同时巩固和加深对这些知识的理解。
【设计思路】本课时采用的学生分组实验的探究方法,不仅激发了学生的学习兴趣和求知欲望,而且还唤起了学生的实验意识、思维意识、探究意识,培养了学生的动手能力、团结协作能力,充分体现了以“学生为主体,教师为主导”的教学思想。
在教学过程中,通过图片展示英国化学家戴维用电解的方法发现金属钾的故事,激发学生对本课教学内容的关注,通过回顾初中和高一了解的电解知识,激发探究电解质溶液导电原理的兴趣,从金属钠的工业制备分析了电解过程中发生了化学变化,再从产物着手去探究、去分析电解原理,让学生在合作学习的过程中自己分析得出相关概念和结论。
最后通过动手做氯化铜溶液导电实验,发现在导电的过程中出现的实现现象,让学生试着去自己分析和解释实验现象,以达到理解和巩固电解的原理的目的,也很好突破了本节课的教学重点。
同时为了尽可能多地让学生发现问题,在教学设计中采用了一个石墨电极、一个铜电极进行电解氯化铜溶液的实验,并且不规定电极的连接方式,这样由于电极连接方式的不同,使得实验探究过程中的现象变得更加的丰富多彩,激发了学生的探究思维。
【教学目的】知识与技能:①通过实验探究使学生了解电解的基本原理、电解池形成的基本条件及电解的一般规律,能正确判断电解池的阴极和阳极,能正确书写电极反应式和电解化学方程式;②培养和发展学生的自学能力、实验能力、观察能力、探究能力。
过程与方法:①通过实验,提高分析、探讨、对比、总结和语言表达能力;②体验问题解决的过程。
情感态度与价值观:①通过学生动手做实验,激发学生学习的兴趣;②培养学生探究和合作学习的精神。
【教学重点】电解原理,离子放电顺序【教学难点】电解原理,电解方程式的书写【教学策略】以“问题”为线索,挖掘学生的好奇心,激发学习兴趣,从而进行探究性实验,再结合教师的引导使学生进行启发式学习,最后通过学生自主学习而接受新知识;使学生充分感受到“能学―愿学―乐学―会学―志学”的新的教学思路,从而使学生的学习过程形成良性循环。
在教学中充分体现以学生为主体,在学生中开展小组合作学习,给他们提供更多的交流讨论的机会和空间。
本节课还利用多媒体教学辅助手段,从微观上解释电解原理,更有利于学生掌握和理解电解原理。
【课前准备】1、实验用品:石墨电极和铜电极各一个、导线若干、直流电源一个、U型管两支、氯化铜溶液一瓶、硫酸钠溶液一瓶、石蕊试液一瓶、淀粉KI试纸二张、蒸馏水一瓶、镊子一个2、学生分组:教学过程采用实验探究的方式,二人一组进行实验,但是讨论的时候可以安排4-6人为一个小组展开。
为了防止上课的时候出现混乱,在课前预先把全班学生分成10个左右的小组,并让学生在组内作好分工。
教学环节及时间教师活动学生活动设计意图【课题引入】2分钟【讲解】当意大利物理学家伏打发明了最原始的电池---伏打电池之后,许多科学家对电产生了浓厚的兴趣,电给世界带来了太多的不可思议,好奇心驱使着人们去进行各种尝试,想看看它还能否出现什么奇特的现象。
1807年,当英国化学家戴维将铂电极插入熔融的氢氧化钾并接通直流电源时,奇迹终于产生了,在阴极附近产生一种银白色的金属,随即形成紫色的火焰,这就是发现钾元素的主要过程,当时在社会上引起了轰动。
而现在,人类仍在用电解的方法生产许多东西。
【展示】电解工业的生产车间图片【设疑】这其中的奥妙是什么呢?电解时,物质的变化是如何发生的呢?这就是本节课我们要共同探讨的问题。
【倾听】【观看】化学史话引入,激发学生学习兴趣,营造探究学习情景。
以日常生活中的实例拉近生活与化学知识的距离。
【课题Ⅰ】电解池的概念4分钟【练习】在前面我们已经接触了一些有关电解问题,回顾初中和高中必修2所学知识,请同学们写出下列方程式。
1.电解水【学生书写】书写相关的方程式练习化学方程式的书写,加强学生基本化学技能训练2.工业上生产金属钠3.工业上生产金属铝【过渡】以上的过程都将电能转化为了化学能,那么这种装置叫电解池【板书】电解池一、电解池:将化学能转化为电能的装置【课题Ⅱ】电解池的构成4分钟【投影】电解水的装置图,由图讨论电解池的构成【讲解】电解池的构成:既然电解池是将电能转化为化学能的,所以在电解池装置中需要外加电源,选择直流电源。
在原电池中有正负极,而电解池中有阴阳极,还有需要电解质和组成闭合回路;电极材料可以是石墨、铂等惰性电极,也可以是金属铜、铁等活性电极。
【板书】1.构成:直流电源两极阳极--与电源正极相连阴极--与电源负极相连电解质溶液或者熔融态的电解质闭合回路【强调】关于两极的规定【练习】分析下图,哪些是原电池,哪些是电解池?【讨论】电解池的构成特点:外加电源--直流电源电解质电极材料【笔记】【思考回答】从最熟悉的电解图入手激发讨论热情,分析得出新知识通过新旧知识的比较和交融,理解电解池的构成【课题Ⅲ】电解原理9分钟【过渡】那么,电能如何才能转变成化学能呢?【板书】2、电解原理【展示】电解熔融氯化钠的示意图【设疑】1.熔融氯化钠中存在哪些微粒?2.在电流的作用下为什么会生成Na和Cl2呢?【讲解】在外加电源作用下,电子从电源负极流出,流向电解池阴极,可以推断在熔融氯化钠中带正电的Na+移向阴极,并【观看思考】【回答】Na+、Cl-通电前,Na+和Cl-在自由且无规则的运动;通电后,在电场的通过对电解熔融氯化钠的分析,让学生对掌握知识的有个循序渐进的过程,培养了学生自学和分析的能力。
电解 得到电子被还原成钠原子,覆盖在阴极上,那么带负电的Cl -移向阳极,并失去电子被氧化成氯原子,进而结合成Cl 2放出。
【板书】总反应: 2NaCl========2Na +Cl 2↑阴极: 2Na ++2e -=2Na (还原反应)阳极: 2Cl --2e -=Cl 2↑(氧化反应)【讲解】可见,在电极的作用下,自由运动的离子改作定向运动,即阴离子趋向阳极,阳离子趋向阴极,当这些离子达到电极时,就失去或者得到电子,发生了氧化还原反应,我们把这个过程称为放电。
而这种使电流通过电解质溶液而在阴、阳两极上引起氧化还原反应的过程叫电解。
【板书】电解:使电流通过电解质溶液而在阴、阳两极上引起氧化还原反应的过程 电解池或电解槽:把电能转变为化学能的装置。
【讲解】从以上分析,我们应该认识到:在电解池中,电子从电源的负极沿导线流入电解池的阴极,经过阴阳离子定向移动导电,再从电解池的阳极流出,并沿导线流回电源正极,电解质溶液或者熔融态导电过程就是电解质溶液或者熔融态电解过程。
【小结】电解池的原理 1.什么叫电解 2.什么是电解池3.区分两极,两极所发生的反应4.电解池中离子、电子的流向作用下,生成了Cl 2和金属钠,那么必须要求Cl -失去电子,发生氧化反应,生成Cl 2,而Na +必须得电子,发生还原反应,生成金属钠。
【笔记】 【倾听】【笔记】 【总结归纳讲述】使知识在学生头脑中得到升华,从而突出重点,把握关键、分散解决难点。
培养学生的化学严谨性和归纳总结的能力。
【课题Ⅳ】 实验探究 18分钟【过渡】因为条件限制电解熔融氯化钠的实验在教室里无法完成了,下面同学们可以根据教材实验4-2,动手做做电解氯化铜的实验。
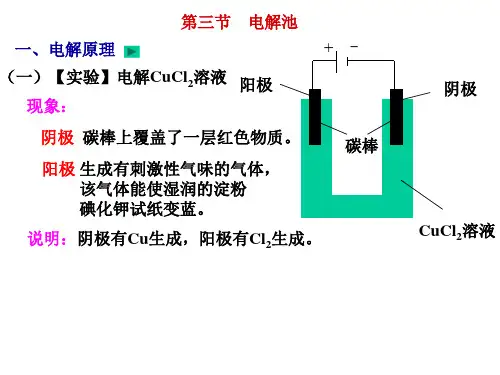
【实验探究】根据所给实验仪器和药品,分组探究电解氯化铜溶液。
【实验要求】仔细观察实验现象,注意实验时间【实验步骤】1.将氯化铜溶液装入U 形管内2.将两根碳棒分别插入U 形管内的溶液中,观察现象3.用导线将两根碳棒连接后,插入U 形管内的溶液中,观察现象【倾听】弄清楚实验目的和要求、实验步骤、观察的重点等【学生实验】通过自主探究,培养学生的观察能力、思维能力、实验能力,让学生感受探究成功的喜悦,激发学习化学的兴趣。
电解 4.将两根碳棒分别与直流电源的正极和负极连接,插入U 形管内的溶液中,观察现象,并检查电解后产物【实验注意】注意:1.要用镊子夹取KI-淀粉试纸湿润后检验Cl 2 (不能用手直接拿) 2.电压用6~12V 直流电源 【实验分析】1:氯化铜溶液中含有哪些微粒?2:在通电时这些微粒各向什么区移动? 3:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?【讨论】1.根据实验现象判断实验产物2. H + 和 OH -为什么没有参与电解?【实验结论】【板书】阳极:2Cl -+ 2e -→Cl 2↑氧化反应阴极:Cu 2++2e -→ Cu 还原反应 CuCl 2=========Cu +Cl 2↑ 【实验动画】电解原理【实验讨论】依据不同的电极讨论不同的实验方案 方案一、两电极均为碳棒方案二、两电极均为铜【汇报结果】实验现象阳极:有气泡,有刺激性气味,并能使 湿润的KI-淀 粉试纸变蓝(Cl 2) 阴极:碳棒上有一层红色的铜析出 【回答】 1.阳离子:Cu 2+ H +阴离子:Cl - OH - +、H +向阴极区移动; Cl -、OH -向阳极区移动 3.阴极区Cu 2+→Cu H +→H 2↑ 阳极区Cl-→Cl 2↑ OH -→O 2↑ 【回答】Cu 2.放电顺序,取决于氧化性、还原性的强弱。
【笔记】 【观看】【讨论】阳极:有气泡,有刺激性气味,并能使湿润的KI-淀粉试纸变蓝(Cl 2)--2Cl -放电阴极:碳棒上有一层红色的铜析出---- Cu 2+放电 阳极:铜棒溶解---金属铜放电 阴极:碳棒上有一规范学生操作,落实学生实验基本技能 培养实验基本技能及观察、分析能力;培养学生实验操作能力观察能力和与他人合作的能力通过动画显示,将原理直观化 实验讨论,激发了进一步思考的热情,同时在已有的知识上提升了学生对电解原理的理解方案三:阳极为铜,阴极为碳棒方案四:阳极为碳棒,阴极为铜[讲解]这里涉及放电顺序问题,究竟谁放电,由氧化性和还原性的强弱决定,这是下节课我们讨论的重点。