原子结构模型的演变 (2)
- 格式:ppt
- 大小:2.34 MB
- 文档页数:20


原子结构演变的5个阶段原子结构是材料科学重要的基础概念之一。
从19世纪末到20世纪初,科学家们开始探索原子的结构。
在不断的探索、研究和实验中,人们逐渐认识到了原子结构的复杂性和演变历程。
本文将介绍原子结构演变的5个阶段。
第一阶段:罗瑟福的阿尔法粒子散射实验1909年,英国科学家罗瑟福通过研究阿尔法粒子散射实验得出了原子模型。
这个模型认为原子由带正电的原子核和负电子组成,而电子分布在原子核之外。
这个模型为后来的原子核模型打下了基础。
第二阶段:卢瑟福-玻尔原子模型1913年,丹麦物理学家玻尔在研究氢原子光谱时提出了一个新的原子模型,被称为卢瑟福-玻尔原子模型。
这个模型认为原子是由带电质子和不带电的中性粒子组成的。
电子围绕原子核旋转,每条轨道对应不同的能量水平。
第三阶段:量子力学的发展随着量子力学的发展,原子的结构变得更加复杂。
量子力学认为原子的能量是量子化的,而不是连续分布的。
通过研究原子的波函数和能量状态,科学家们得出了原子的电子云结构,即一个原子中电子分布的概率密度分布。
这为化学分子和材料科学的研究奠定了基础。
第四阶段:原子核模型的发展在量子力学理论基础上,原子核模型得到发展,并确定了元素周期表。
原子核由带正电荷的质子和中性的中子组成。
质子数量不同的原子称为不同的元素。
不同的元素具有不同的化学性质和同位素。
第五阶段:超越原子的研究随着科学技术的发展,人们开始研究原子以外的更小、更基本的粒子。
通过加速器、探测器等尖端设备,科学家们研究了粒子物理学、核能等领域,揭示了一些重大问题,如弱相互作用、暗物质、暗能量等,为人类认识宇宙提供了新的契机。
总之,原子结构演变是一个在不断探索中不断发展的过程。
每个阶段都有其重要性,并且为后来的研究和探索奠定了基础。
我们应该把握历史机遇,用科学的方法深入研究原子结构,为未来的人类文明和科技进步做出贡献。

2021年福州市高级中学高二下学期期中考试化学试题试卷总分∶(50分+100分)完卷时间∶90 分钟可能用到的相对原子质量∶S-32 Ga-70 N-14 O-16第I卷模块水平测试(50分)一、选择题(每小题仅有一个选项符合题目要求每小题3 分,共39 分)1.原子结构模型的演变图中,(1)道尔顿实心球式原子模型,(2)为卢瑟福行星运转式原子模型,(3)为汤姆生葡萄干面包式原子模型,(4)为近代量子力学原子模型,(5)为玻尔轨道式原子模型。
其中符合历史演变顺序的一组排列是()A.(1)(3)(2)(5)(4)B.(1)(2)(3)(4)(5)C. (1)(3)(5)(4)(2)D. (1)(5)(3)(2)(4)2.下列说法中正确的是()A. 2p和3p 轨道形状均为哑铃形,能量也相等B. 磷元素基态原子的电子排布图为C. 铁元素基态原子的电子排布式为1s22s22p63s33p43d64s2D. Cu原子的简化电子排布式∶[Ar]3d104s1 ;外围电子排布式∶3d104s13.基态硫离子核外具有多种不同能量的电子( )A.18 种B.16 种C.5 种D.3种4.某元素的最外层电子数为2,外围电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( )A.电子排布式为∶1s22s22p63s23p63d34s2B.该元素为VC.该元素为∶A 族元素D.该元素位于d区5.有关晶体的下列说法中不正确的是()A.在NaCl晶体中,距Na+最近的Cl-形成正八面体B. 在NaCl晶体中,每个晶胞平均占有4个Na+C.金属导电是因为在外加电场作用下产生自由电子D. 铜品体为面心立方堆积,铜原子的配位数为126.下列分子的电子式书写正确的是量()A. 氨气∶B. 四氯化碳∶C. 氮气∶D. 二氧化碳∶7.下列物质的分子中既有σ键,又有π键的是( )∶HCl ∶H2O ∶N2 ∶H2O2∶C2H4∶C2H2A.∶∶∶B. ∶∶∶∶C. ∶∶∶D.∶∶∶8.下列说法正确的是(N A为阿伏加德罗常数)()A. 1mol P4含有P—P键的个数为4N AB.1 mol SiC中含有C—Si键的个数为2N AC.1 mol SiO2中含Si—O 键的个数为2N AD.含C为1 mol 的金刚石中含有C—C键的个数为2N A9.下列各组物质各自形成晶体,均属于分子晶体的化合物是()A. NH3、HD、C2H20B. PCl3、CO2、H2SO4C. SO2、BN、P2O5D. CCl4、Na2S、H2O210.下列变化需克服相同类型作用力的是()A. 碘和干冰的升华B.硅和C60的熔化C. 氯化氢和氯化钠的溶解D. 溴和汞的气化11. 下列有关晶体的说法正确的是()A. 分子晶体中分子间作用力越大,分子越稳定B. 原子晶体中共价键越强,晶体熔点越高C. 冰熔化时水分子中共价键发生断裂D. 氯化钠溶于水时离子键未被破坏12.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是()A.2Na2O2 + 2H2O === 4NaOH + O2↑B. MgN3 + 6H2O === 3Mg(OH)2↓+2NH3↑C. Cl2 + H2O === HCIO + HClD. NH4CI + NaOH === NaCl + NH3↑+H2O13.下列物质中不具有手性碳原子的是()A.乳酸∶ CH3-CH(OH)-COOHB.氨基乙酸∶ H2N-CH2-COOHC.丙醛糖∶ CH2OH-CH(OH)-CHOD. A-氨基丙酸∶ CH3-CH(NH2)-COOH二、非选择题(11分)32.(11分)一种离子晶体的晶胞如图,该品体可以看作阳离子A作面心立方最密堆积,阴离B填充其中。
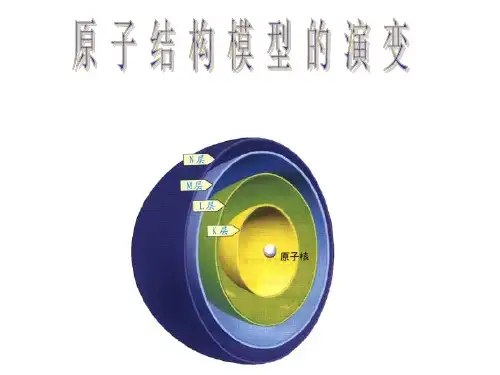
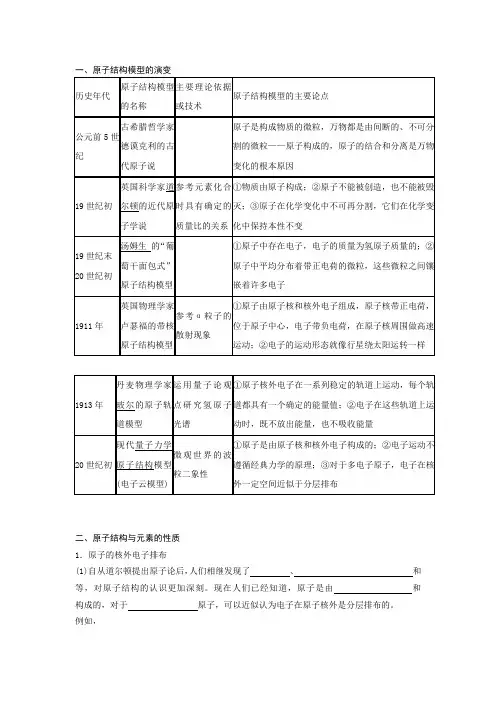
一、原子结构模型的演变历史年代原子结构模型的名称主要理论依据或技术原子结构模型的主要论点公元前5世纪古希腊哲学家德谟克利的古代原子说原子是构成物质的微粒,万物都是由间断的、不可分割的微粒——原子构成的,原子的结合和分离是万物变化的根本原因19世纪初英国科学家道尔顿的近代原子学说参考元素化合时具有确定的质量比的关系①物质由原子构成;②原子不能被创造,也不能被毁灭;③原子在化学变化中不可再分割,它们在化学变化中保持本性不变19世纪末20世纪初汤姆生的“葡萄干面包式”原子结构模型①原子中存在电子,电子的质量为氢原子质量的;②原子中平均分布着带正电荷的微粒,这些微粒之间镶嵌着许多电子1911年英国物理学家卢瑟福的带核原子结构模型参考α粒子的散射现象①原子由原子核和核外电子组成,原子核带正电荷,位于原子中心,电子带负电荷,在原子核周围做高速运动;②电子的运动形态就像行星绕太阳运转一样1913年丹麦物理学家玻尔的原子轨道模型运用量子论观点研究氢原子光谱①原子核外电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;②电子在这些轨道上运动时,既不放出能量,也不吸收能量20世纪初现代量子力学原子结构模型(电子云模型)微观世界的波粒二象性①原子是由原子核和核外电子构成的;②电子运动不遵循经典力学的原理;③对于多电子原子,电子在核外一定空间近似于分层排布二、原子结构与元素的性质1.原子的核外电子排布(1)自从道尔顿提出原子论后,人们相继发现了、和等,对原子结构的认识更加深刻。
现在人们已经知道,原子是由和构成的,对于原子,可以近似认为电子在原子核外是分层排布的。
例如,(2)核外电子排布的表示方法——结构示意图人们常用原子结构示意图表示原子的核外电子排布,如氧原子的结构示意图为,钠原子的结构示意图为。
2.元素的化学性质与原子核外电子排布的关系(1)稀有气体元素原子最外层电子数为8(氦为2),是稳定结构,不易得失电子,因此化学性质稳定,一般不跟其他物质发生化学反应。

原子结构发展与组成原子结构模型的演变如下:原子结构模型发展是指从1803年道尔顿提出的第一个原子结构模型开始,经过一代代科学家不断地发现和提出新的原子结构模型的过程。
人类对原子的认识史可以大致划分为5个阶段:(1)古代原子论。
(2)道尔顿原子论。
(3)汤姆森原子模型和卢瑟福原子模型。
(4)波尔原子模型。
(5)原子结构(核外电子运动)的量子力学模型。
一、原子的简介原子是构成化学元素的普通物质的最小单位;原子也是化学变化中最小的粒子及元素化学性质的最小单位。
二、原子的组成原子是由带正电荷的原子核和带负电荷的电子构成。
原子核所带的正电荷数与原子核外电子所带的负电子数相等,故原子呈电中性。
原子可以构成分子,也可以形成离子,也可以直接构成物质。
当质子数与电子数相同时,这原子就是电中性,称为中性原子;否则,就是带有正电荷或者负电荷的离子。
根据质子和中子数量的不同,原子的类型也不同:质子数决定了该原子属于哪种元素,而中子数则确定了该原子是此元素的哪种同位素。
原子的性质:一、衰变放射性每种元素都有一个或以上同位素有不稳定的原子核,从而能放射性衰变,在这过程中,原子核可释放出粒子或电磁辐射。
原子核半径大于强力的作用半径时就可能会放射性衰变,而强力的作用半径仅为几飞米。
二、磁矩基本微粒都有一个固有性质,就像在宏观物理中围绕质心旋转的物体都有角动量一样,在量子力学叫自旋。
但是严格来说,这些微粒仅仅是一些点,不能够旋转。
自旋的单位是约化普朗克常数,电子、质子和中子的自旋都是二分之一。
在原子里,电子围绕原子核运动,所以除了自旋,它们还有轨道角动量。
而对于原子核来说,轨道角动量是起源于自身的自旋。
三、能级原子中,电子的势能与它离原子核的距离成反比。
测量电子的势能,通常的测量将让该电子脱离原子所需要的能量,单位是电子伏特。
在量子力学模型中,电子只能占据一组以原子核为中心的状态,每一个状态就对应于一个能级。
最低的能级就被叫做基态,而更高的能级就被叫做激发态。


原子结构模型演变引言:原子是构成物质的基本单位,对于人类来说,了解原子结构的演变是科学发展的重要里程碑。
本文将从经典模型、波尔模型到量子力学模型,介绍原子结构模型的演变过程。
一、经典模型1. 托姆逊模型19世纪末,英国物理学家约瑟夫·约翰·托姆逊提出了托姆逊模型。
他认为原子是由带正电的球体中带负电的电子组成,这种模型可以解释电子在原子内的位置和运动。
然而,托姆逊模型无法解释原子的稳定性和光谱现象。
2. 鲁瑟福模型1909年,英国物理学家欧内斯特·鲁瑟福提出了鲁瑟福模型。
他的实验发现,原子中几乎所有的质量都集中在一个非常小的核心部分,而电子则围绕核心旋转。
这一模型解释了原子的稳定性和光谱现象,但无法解释电子在轨道上的运动方式。
二、波尔模型1. 波尔理论1913年,丹麦物理学家尼尔斯·波尔提出了波尔理论。
波尔根据鲁瑟福模型,结合了经典电磁理论和量子理论的思想,提出了电子只能在特定轨道上运动,且每个轨道对应一定能量。
这一模型解释了原子的光谱现象,并奠定了原子结构研究的基础。
2. 波尔模型的局限性尽管波尔模型在解释原子结构方面取得了重要成果,但它无法解释原子的精细结构和不同元素的光谱线。
此外,波尔模型也未能解释电子在轨道上的运动方式和原子中的电子云分布。
三、量子力学模型1. 波动力学1926年,奥地利物理学家埃尔温·薛定谔提出了波动力学理论。
该理论结合了波动性和粒子性的概念,通过波函数描述了电子在原子中的运动状态。
波动力学理论成功解释了原子的精细结构和光谱现象。
2. 玻恩-奥本海默近似1928年,德国物理学家玻恩和奥本海默提出了近似方法,称为玻恩-奥本海默近似。
该近似方法通过计算原子间的相互作用,预测了原子结合能和分子结构,为化学反应的研究提供了重要的理论基础。
3. 量子力学模型量子力学模型是目前最为完善的原子结构模型。
它通过数学方程描述了原子中电子的运动状态和能量。
原子结构模型演变历史一、引言原子是物质的最基本单位,研究原子结构模型的发展历程是物理学的重要组成部分。
本文将从经典原子结构模型、量子力学原子结构模型到现代原子结构模型三个阶段进行详细阐述,以展示原子结构模型的演变历史。
二、经典原子结构模型1. 道尔顿原子模型19世纪早期,英国化学家道尔顿提出了第一个经典原子结构模型。
他认为原子是不可分割的,是质点球体,且不同元素的原子具有不同的质量。
2. 汤姆逊原子模型1897年,汤姆逊发现了电子,提出了“面包状模型”,即认为原子是一个正电荷均匀分布的球体,电子均匀地分布在球体内。
3. 卢瑟福原子模型1909年,卢瑟福进行了一系列散射实验,发现了原子的核心,并提出了著名的卢瑟福原子模型。
该模型认为原子是由一个极小、带正电荷的核心和绕核心运动的电子构成,电子围绕核心运动,类似于行星围绕太阳运动。
三、量子力学原子结构模型1. 波尔原子模型1913年,丹麦物理学家波尔提出了量子力学的原子结构模型,也称为波尔原子模型。
他认为电子只能在特定的能级轨道上运动,每个轨道对应一定能量。
当电子跃迁到较低能级时,会放出光子。
2. 德布罗意波动力学模型1924年,法国物理学家德布罗意提出了物质粒子也具有波动性的假设,即德布罗意波动力学模型。
他认为电子的运动状态可以用波函数描述,波函数的平方表示电子在空间中的概率分布。
四、现代原子结构模型1. 薛定谔方程1926年,奥地利物理学家薛定谔提出了薛定谔方程,用于描述电子的波动性和粒子性。
这一方程成为量子力学的核心方程,被广泛应用于原子结构模型的研究。
2. 现代原子轨道模型根据薛定谔方程解得的波函数,可以得到电子的能级和轨道分布。
根据这些信息,科学家们发展出了现代原子轨道模型。
该模型认为电子沿着不同的轨道分布,每个轨道可以容纳一定数量的电子。
3. 量子力学云模型云模型是对电子位置的概率分布进行可视化的一种方法。
该模型认为电子不是精确地位于轨道上的某一点,而是存在于一定的空间区域,被称为电子云。
1—5—1原子结构模型的演变学习目标:了解构成物质的微粒;了解原子结构模型的演变;知道化合价的实质;学习重点:原子结构模型,化合价的实质学习难点:化合价的实质一.原子结构模型的演变1.构成物质的微粒2.原子结构模型的演变(1)道尔顿原子结构模型形状学说内容(2)汤姆生原子结构模型形状学说内容(3)卢瑟福原子结构模型形状学说内容(4)现代原子结构模型形状学说内容3.原子结构示意图4.1~18号元素原子结构示意图二.化合价1.定义2.化合价的实质(1)氧化镁形成过程(2)氯化钠形成过程(3)氧化铝形成过程结论:练习1.自从下列哪项发现或学说开始,化学才开始成为一门科学()A.阿伏加德罗提出原子——分子学说B.拉瓦锡确定空气的组成C.道尔顿提出近代原子学说D.汤姆逊发现电子2. 下列说法正确的是()A.原子是不可再分的粒子B.相对原子质量就是原子的实际质量C.分子是保持物质性质的最小粒子D.与元素化学性质关系密切的是原子的最外层电子数3.下列现象能证明分子在化学变化中可分的是()A. 100 mL水和100 mL酒精混合后总体积小于200 mLB.打开盛装浓盐酸瓶盖,浓盐酸逐渐减少C.气态氧在加压降温时变为淡蓝色的液态氧D.在1000℃时,甲烷可分解为石墨和氢气4.在1911年前后,物理学家卢瑟福把一束变速运动的α粒子(相对原子质量约为4的带2个单位正电荷的质子粒),射向一片极薄的金箔。
他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟能让大多数α粒子畅通无阻地通过,就像金箔不在那儿似的。
但也有极少数的α粒子发生偏转,或被笔直地弹回。
根据以上实验现象能得出关于金箔中Au原子结构的一些结论。
试写出其中的三点:(1)______________________________________________________________ (2)______________________________________________________________ (3)______________________________________________________________。