物质的分类化学知识点整理
- 格式:doc
- 大小:17.00 KB
- 文档页数:4

高三化学物质的分类知识点化学作为一门基础科学,对于我们的生活和工业生产都起着重要的作用。
而化学物质的分类是化学研究的基础,对于我们理解和应用化学知识非常重要。
本文将介绍高三化学中常见的物质分类知识点。
第一部分:常见物质分类1.无机物和有机物无机物是指不含碳元素或含碳元素但结构简单的化合物。
常见的无机物如水、氧气和氯化钠等。
有机物则是指含有碳元素并且结构复杂的化合物,其中包括有机酸、糖类和蛋白质等。
2.元素和化合物元素是指由相同类型的原子组成的纯物质。
元素可以进一步分为金属元素和非金属元素。
化合物是由两个或更多种不同元素组成的物质,例如水(H2O)和二氧化碳(CO2)等。
3.离子化合物和非离子化合物离子化合物是由正负电荷的离子组成的,例如氯化钠(NaCl)和硫酸铜(CuSO4)等。
非离子化合物则是由共价键连接的原子组成的,例如水和二氧化碳等。
第二部分:物质分类的依据1.化学成分物质的分类可以依据其化学成分来进行。
根据元素的不同组合和原子比例,物质可以分为一种元素、两种元素或多种元素的化合物。
2.物理性质物质的物理性质也可以作为进行分类的依据。
物理性质包括颜色、形状、密度和溶解性等。
例如,我们可以根据颜色将物质分为红色、蓝色或黄色等。
3.化学性质物质的化学性质也是进行分类的重要依据。
化学性质包括燃烧性、氧化性和酸碱性等。
通过对物质进行不同的化学反应和试剂的检测,可以确定其化学性质,进而进行分类。
第三部分:物质分类的应用1.高分子材料高分子材料是一类由大量重复单元组成的聚合物。
例如塑料、橡胶和纤维等。
这些材料的分类依据可以是化学结构、性质和用途等。
2.功能材料功能材料是指在特定条件下具有特殊性能和功能的材料。
例如磁性材料、光学材料和电子材料等。
这些材料的分类依据可以是其特定的功能和性质。
3.生物材料生物材料是指源于自然界的具有特殊生物活性和生物相容性的物质。
例如蛋白质、酶和细胞等。
这些材料的分类依据可以是其来源和应用领域。

物质的分类与性质知识点总结一、物质的分类1.按照物质的组成部分分类物质可以分为纯物质和混合物。
纯物质是由同一种元素或者化合物组成的物质,它们具有固定的化学组成和一定的化学性质。
混合物是由两种或两种以上的物质混合而成的物质,它们的化学组成和性质可以变化。
2.按照物质的形态分类物质可以分为固体、液体和气体。
固体具有固定的形状和体积,分子间相对稳定,有一定的结构和规则排列方式。
液体具有固定的体积,但没有固定的形状,在容器中自由流动。
气体具有没有固定形状和体积的特点,可以自由扩散。
3.按照物质的电导性分类物质可以分为导电物质和非导电物质。
导电物质能够传导电流,如金属、溶解了电解质的水。
非导电物质不能传导电流,如纯水、木材等。
4.按照物质的溶解性分类物质可以分为可溶性物质和不溶性物质。
可溶性物质可以在溶剂中充分溶解,如食盐、糖等。
不溶性物质不能在溶剂中溶解,如石油、石蜡等。
二、物质的性质1.物理性质物质的物理性质是指物质所特有的、不改变其化学组成的性质。
例如,颜色、形状、密度、熔点、沸点、导电性等。
通过物质的物理性质可以进行物质的鉴定和分类。
2.化学性质物质的化学性质是指物质与其他物质发生化学变化时所表现出的性质。
例如,可燃性、氧化性、还原性等。
物质的化学性质决定了它在化学反应中的行为和变化。
3.燃烧性质物质的燃烧性质是指物质与氧气或其他氧化剂接触时能够发生燃烧反应的性质。
例如,可燃物质如木材、纸张等在适当的条件下能够与空气中的氧气发生燃烧反应。
4.酸碱性质物质的酸碱性质是指物质在水溶液中的酸碱程度。
酸性物质具有酸性,如柠檬汁、硫酸等;碱性物质具有碱性,如氢氧化钠、氨水等;中性物质的酸碱程度接近于中性,如纯水。
5.氧化还原性质物质的氧化还原性质是指物质与其他物质发生氧化还原反应时所表现出的性质。
氧化反应是指物质失去电子或增加氧化态,还原反应是指物质获得电子或减少氧化态。
三、物质分类与性质的应用1.环境保护了解不同物质的分类与性质,有助于我们正确处理和利用各种物质,避免产生有害物质对环境造成污染。

初三化学知识点:物质的分类1500字物质是构成世界的基本单位,根据其物理性质、化学性质和组成方式,可以将物质分为不同的类别。
在化学中,通常根据其组成方式和化学性质分类物质。
以下是关于物质分类的一些知识点。
1. 纯物质和混合物:纯物质是由同一种物质组成的,具有确定的物理性质和化学性质。
例如,金属银、纯净水等都是纯物质。
混合物是由两种或多种不同的物质混合而成的,其成分可以是不固定的。
例如,空气、淡盐水都是混合物。
2. 元素和化合物:元素是由同一种原子组成的物质,不能通过化学方法分解为其他物质。
目前已知的元素共有118种,如氧气、铜、银等。
化合物是由两种或更多种元素以固定的比例结合而成的物质,可以通过化学方法分解为其组成元素。
例如,水(H2O)、盐(NaCl)等都是化合物。
3. 金属、非金属和半金属:金属是一类常见的物质,具有良好的导电性、热传导性和延展性。
例如,铁、铜、铝等都是金属。
非金属是指性质与金属相反的物质,通常具有较低的导电性和热传导性。
例如,碳、硫、氧等都是非金属。
半金属具有一些金属和非金属的性质。
例如,硅、锑等都是半金属。
4. 酸、碱和盐:酸是指具有酸性质的物质,能够与碱发生中和反应。
酸通常具有酸味、能够腐蚀物质和导电性等特点。
例如,硫酸(H2SO4)、盐酸(HCl)等都是酸。
碱是指能够与酸发生中和反应并产生盐和水的物质,通常具有苦味和腻感。
例如,氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)等都是碱。
盐是一类化合物,由阳离子和阴离子组成,通常是酸和碱反应后的产物。
例如,氯化钠(NaCl)、硫酸钠(Na2SO4)等都是盐。
5. 有机物和无机物:有机物是由碳元素与氢元素以及其他非金属元素组成的物质,通常具有复杂的结构和多种功能。
例如,葡萄糖、甲烷等都是有机物。
无机物是除了有机物以外的所有物质,包括无机酸、无机盐、无机气体等。
例如,氯气、氧气、盐酸等都是无机物。
总结起来,物质的分类有纯物质和混合物、元素和化合物、金属、非金属和半金属、酸、碱和盐以及有机物和无机物等。

高中化学第一章物质的分类知识点一、知识概述“物质的分类”①基本定义:物质的分类就是把多种多样的物质,根据它们的组成、性质等特点进行归类。
比如像给一群杂乱的东西按照某种规则分组。
就像把人按照性别分为男和女,或者按照职业分成不同的种类一样,我们可以把物质分成纯净物和混合物,纯净物里又能分成单质和化合物等好多类。
②重要程度:这可是高中化学的开篇重点呢。
就像打地基一样,这个搞不清楚后面很多知识就容易乱套。
它能帮助我们系统化地认识物质世界,让学到的知识更有条理。
③前置知识:初中化学里对简单物质的基本认识。
比如说得知道氧气、水这些常见物质的基本性质之类的。
④应用价值:在化学研究中,很方便我们去研究物质的性质。
比如研究盐类的性质,因为它们分类里就有相似性。
在日常生活中也有用,像区分食盐和白糖,它们一个是盐类(化学成分属于盐类)一个是糖类,知道分类就容易有区分的方法。
二、知识体系①知识图谱:这是化学知识体系里基础的一环,就像是树的根一样。
后续学到的各类物质反应等知识都是从这里发散出去的。
②关联知识:和元素的知识紧密关联,毕竟物质是由元素组成的。
比如单质就是由同种元素组成的纯净物。
还和化学方程式里的物质有关,得先清楚物质的分类,才能准确写出方程式。
③重难点分析:- 掌握难度:其实概念不算太难,但是细节比较多。
比如说混合物和纯净物的区分,一些看起来像纯净物实际是混合物的情况就比较容易混淆。
像溶液看起来透明均一好像是纯净物,实际上是混合物。
- 关键点:要抓住分类的依据,像根据物质组成元素种类来分单质和化合物等。
④考点分析:- 在考试中的重要性:相当重要。
各种大小考试都会涉及,基本是必考内容。
- 考查方式:选择题里鉴别物质分类选项对错,填空题里填写物质所属类别等。
三、详细讲解【理论概念类】①概念辨析:- 纯净物是由一种物质组成的。
比如水(H₂O),不管是实验室里制得的,还是自然界里的纯水,都是只有水分子这一种物质组成的。

物质的分类知识点总结一、物质的基本概念物质是构成万物的基本要素,是宇宙中自然存在的一切实体的总称,是占据一定空间,有一定质量的任何事物的总称,是构成一切物体的基本成分。
物质是由微观粒子组成的,包括原子、分子等微粒。
物质是具有一定质量、占据一定空间、具有可观察性和可度量性的,是人们认识和利用的客观存在。
物质性质是物质的固有属性,成为物质被认识的依据。
物质的三态:固、液、气。
物质的基本概念包括物质的组成、性质和分类。
二、物质的组成1.原子原子是构成一切物质的基本微粒,是化学元素的最小单位,化学反应中不会分解的微粒。
原子是由质子、中子和电子组成。
2.分子分子是原子按照一定比例结合而成的,分子的组成是由原子组成的。
分子在化学反应中会发生改变,化学反应中发生的都是分子的变化。
分子的构成有原子殊,分子中原子的种类与比例确定了分子的性质。
3.离子离子是由失去或者获得电子而具有电荷的粒子,可以是单个原子,也可以是分子,称为单一离子,或者多个原子或分子部分组成的有电荷的团体,称为复合离子。
离子在水溶液中自由移动,具有导电性和电化学反应性。
三、物质的性质1.物质的物理性质物质的物理性质是指不改变物质本质情况下,其所具有的固有性质,可以通过物理方法进行观察和度量。
物质的物理性质包括:颜色、气味、密度、熔点、沸点、导电性、磁性等。
2.物质的化学性质物质的化学性质是指物质在与其他物质发生化学反应时所表现出的性质。
物质的化学性质是通过化学反应和实验才能得以确认。
物质的化学性质包括:与其他物质发生反应、氧化还原性、酸碱性、水解性等。
3.物质的结构性质物质的结构性质是指物质内部微观结构和组成的性质。
物质的结构性质决定了物质的各种物理和化学性质。
物质的结构性质包括:原子和分子的结构、离子的组合方式等。
四、物质的分类1.物质的分类方法物质的分类可以通过不同的角度和属性来进行分类,包括化学性质、物理性质、组成结构等方面的分类。
物质的分类方法包括:按组成结构分类、按化学性质分类、按物理性质分类等。

初三化学知识点:物质的分类物质的分类〔1〕混合物和纯洁物混合物:组成中有两种或多种物质。
常见的混合物有:空气、海水、自来水、土壤、煤、石油、天然气、爆鸣气及各种溶液。
纯洁物:组成中只有一种物质。
①宏观上看有一种成分,微观上看只有一种分子;②纯洁物具有固定的组成和特有的化学性质,能用化学式表示;③纯洁物可以是一种元素组成的〔单质〕,也可以是多种元素组成的〔化合物〕。
〔2〕单质和化合物单质:只由一种元素组成的纯洁物。
可分为金属单质、非金属单质及稀有气体。
化合物:由两种或两种以上的元素组成的纯洁物。
〔3〕氧化物、酸、碱和盐氧化物:由两种元素组成的,其中有一种元素为氧元素的化合物。
氧化物可分为金属氧化物和非金属氧化物;还可分为酸性氧化物、碱性氧化物和两性氧化物;酸:在溶液中电离出的阳离子全部为氢离子的化合物。
酸可分为强酸和弱酸;一元酸与多元酸;含氧酸与无氧酸等。
碱:在溶液中电离出的阳离子全部是氢氧根离子的化合物。
碱可分为可溶性和难溶性碱。
盐:电离时电离出金属阳离子和酸根阴离子的化合物。
盐可分为正盐、酸式盐和碱式盐。
物质是什么物质为构成宇宙间一切物体的实物和场。
例如空气和水,食物和棉布,煤炭和石油,钢铁和铜、铝,以及人工合成的各种纤维、塑料等等,都是物质。
世界上所有的存在都是物质。
人体本身也是物质。
除实物之外,光、电磁场等也是物质,它们是以场的形式出现的物质。
物质的种类形态万千,物质的性质多种多样。
气体状态的物质,液体状态的物质或固体状态的物质;单质、化合物或混合物;金属和非金属;矿物与合金;无机物和有机物;天然存在的物质和人工合成的物质;无生命的物质与生命物质以及实体物质和场物质等等。
物质的种类虽多,但它们有其特性,那就是可以被观测或被理论预言,以及都具有质量和能量。
拥有不同化学式是不同的物质,拥有同一种化学式而构造不同也是不同的物质。

初中化学知识点总结(最全)初中化学知识点总结:1. 物质的分类:纯物质和混合物。
纯物质又可分为元素和化合物。
2. 元素:由同种原子组成的物质。
元素可分为金属元素和非金属元素。
金属元素通常具有良好的导电性和导热性,而非金属元素通常不具备这些性质。
3. 化合物:由不同元素按照一定比例结合而成的物质。
化合物可以通过化学反应分解成元素。
4. 原子和分子:原子是物质的基本组成单位,由电子、质子和中子构成。
分子是由两个或多个原子结合而成的物质。
5. 氧的存在:氧气是由两个氧原子结合而成的分子,以O2表示。
氧气在自然界中占据着重要的位置,是支持燃烧和生命存在的必需气体。
6. 元素周期表:是由元素按照原子序数排列而成的表格。
周期表有7个周期,元素根据原子序数增加,元素的性质按周期规律重复出现。
7. 化学反应:化学反应是物质发生变化的过程,通常伴随着产生新的物质和吸收释放能量。
8. 反应物和生成物:反应物是参与化学反应的起始物质,生成物是反应后形成的新物质。
9. 反应类型:常见的反应类型有合成反应、分解反应、置换反应和燃烧反应。
10. 酸和碱:酸和碱是常见的化学物质。
酸具有酸性,会使某些指示剂变红,酸在水中呈现酸性溶液。
碱具有碱性,会使某些指示剂变绿或蓝,碱在水中呈现碱性溶液。
11. pH值:是用来衡量溶液酸碱性强弱的指标,pH值越小表示溶液越酸,pH值越大表示溶液越碱,pH值为7表示中性溶液。
12. 盐:是由酸和碱中和反应形成的物质,也是一类常见的化学物质。
13. 酸碱中和反应:酸和碱反应生成盐和水的化学反应。
14. 溶液浓度:溶液中溶质的质量或体积与溶液总质量或体积之比。
15. 氧化和还原反应:氧化是指物质失去电子,还原是指物质获得电子,氧化还原反应是指物质之间转移电子的反应。
16. 电解质:在水溶液中能够导电的物质,分为强电解质和弱电解质。
17. 单质:一部分元素可以单独存在成为单质,如氢气、氧气、金属等。

化学物质的分类整理天空吸引你展翅翱翔,海洋召唤你扬帆启航,高山鼓励你奋勇攀登,平原等待你信马由缰……动身吧,愿你前程无量,努力备考,考入理想院校!下面是作者给大家带来的化学物质的分类整理,欢迎大家浏览参考,我们一起来看看吧! 常见化学物质的俗称归类1.硫酸盐类(1)皓矾:ZnSO4·7H2O(2)重晶石(钡餐):BaSO4(3)绿矾:FeSO4·7H2O(4)芒硝:Na2SO4·10H2O(5)明矾:KAl(SO4)2·12H2O(6)蓝矾(胆矾):CuSO4·5H2O(7)熟石膏:2CaSO4·H2O2.矿石类(1)电石:CaC2(2)磁铁矿石:Fe3O4(3)赤铁矿石:Fe2O3(4)石英:SiO2(5)刚玉(蓝宝石,红宝石):Al2O33.气体类(1)高炉煤气:CO、CO2等混合气体(2)水煤气:CO、H2(3)天然气(沼气):CH44.有机类(2)尿素:CO(NH2)2(3)氯仿:CHCl3(4)葡萄糖:C6H12O6(5)淀粉:(C6H10O5)n5.其他类(1)石灰乳:Ca(OH)2(2)铜绿:Cu2(OH)2CO3(3)王水:浓盐酸、浓HNO3(按体积比31混合)(4)小苏打:NaHCO3(5)纯碱、苏打:Na2CO3(6)大苏打:Na2S2O3·5H2O(7)生理盐水:0.9%的氯化钠溶液(8)漂白液:有效成分NaClO,非有效成分NaCl(9)漂白粉:有效成分Ca(ClO)2,非有效成分CaCl2(10)碱石灰:CaO、NaOH中考化学知识点汇总:常见物质的分类一、初中化学常见物质的分类1、单质:非惰性气体一样由两个原子组成:F2,O2,H2,Cl22、惰性气体:一样由一个原子组成:He,Ne,Ar,Kr,Xe3、化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI二、初中化学敞口置于空气中质量改变的(一)质量增加的 1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸; 2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;(二)质量减少的 1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水; 2、由于风化而减少的:碳酸钠晶体。

化学的分类知识点总结一、物质的分类物质是宇宙中存在的基本实体,根据其化学性质的不同,可以将物质分为单质和化合物两大类。
1. 单质单质是由同一种元素组成的物质,例如金属铁、非金属碳、气体氧等等。
单质是由同一种原子构成,因此具有特定的化学性质。
2. 化合物化合物是由两种或两种以上不同元素化合而成的物质,例如氧化铁、水、二氧化碳等等。
化合物的化学性质取决于其组成元素的种类和数量,会显现出新的性质。
二、根据状态的分类物质的存在状态可以分为固体、液体和气体三大类。
1. 固体固体是物质的一种状态,在固体状态下,原子或分子之间的相互作用力比较大,分子排列有序。
固体的形状和体积都稳定不变,例如金属、盐类、晶体等都是固体。
2. 液体液体是物质的一种状态,在液体状态下,分子间的相互作用力较弱,分子排列松散,能流动而不固定形状。
例如水、酒精、汽油等都是液体。
3. 气体气体是物质的一种状态,气体的分子之间几乎没有相互作用力,能够自由运动并填满容器。
例如空气、氢气、氧气等都是气体。
三、根据物质成分的分类根据物质的成分,可以将物质分为混合物、元素和化合物三大类。
1. 混合物混合物是由两种或两种以上的纯物质以任意比例混合而成的,其中每种纯物质仍保持着其原有的化学性质,混合物的成分可以发生变化。
例如空气是由氧气、氮气、二氧化碳等气体按一定比例混合而成。
2. 元素元素是由同一种原子构成的物质,不能通过化学方法分解成其他物质。
元素是构成一切物质的基本成分,例如氢元素、氧元素、铁元素等。
3. 化合物化合物是由两种或两种以上不同元素按一定的化学结构和化学键结合而成的物质。
化合物的化学成分和比例是固定的,通常可以通过化学方法分解成其他物质。
四、根据化学性质的分类根据物质的化学性质,可以将物质分为酸、碱、盐等不同类别。
1. 酸酸是一类具有酸性的化合物或溶液,它们能够与碱中和并产生盐和水。
酸具有酸味和腐蚀性,能够蚀坏金属,变红蓝色的石蕊试纸。

化学高一知识点物质分类化学是自然科学的一门重要学科,涉及到物质的性质、组成和变化。
在化学学习的初期,高一学生需要了解各种物质的分类,这对于后续的学习和实验是至关重要的。
本文将介绍化学高一知识点中的物质分类。
一、基础概念在学习物质分类之前,我们先了解一些基础概念。
1. 物质物质是组成一切实物的基本单位,包括固体、液体和气体。
2. 纯物质纯物质是由同一种物质组成的,具有一定的化学性质和物理性质。
3. 混合物混合物是由两种或两种以上的物质混合而成,每种物质保留自己的性质。
4. 纯净物质和杂质纯净物质是指纯物质中不含有杂质的物质。
而杂质是指混合物中除了主要成分以外的其他物质。
二、物质分类根据物质的组成和性质,我们可以将物质分为以下几类。
1. 单质单质是由同一种原子组成的的物质,具有一定的性质。
例如金属、非金属和惰性气体都是单质。
金属是一类具有典型金属性质的单质。
金属通常具有良好的延展性、导电性和热传导性。
常见的金属有铁、铜和铝。
非金属是金属以外的元素。
非金属通常具有不良的导电性和热传导性,大部分非金属在常温下呈固体或气体状态。
常见的非金属有氧气、磷和硫。
惰性气体又称稀有气体,它们是化学上非常稳定的元素,很少参与化学反应。
常见的惰性气体有氦、氩和氖。
2. 化合物化合物是由不同种类原子按照一定比例组合而成的物质,具有一定的性质。
例如水、二氧化碳和氨都是常见的化合物。
水是一种氢和氧按照2:1的比例组成的化合物,具有透明、无味和无色的性质。
水是生命中不可缺少的物质。
二氧化碳是由一份碳和两份氧组成的化合物,具有无色、无味、不可燃和不支燃的性质。
二氧化碳在自然界中普遍存在,是植物进行光合作用的产物。
氨是由一份氮和三份氢组成的化合物,具有刺激性气味和可燃的性质。
氨广泛用于农业领域,作为合成化肥的主要成分。
3. 混合物混合物是由两种或两种以上物质混合而成的物质,每种物质都保留自己的性质。
混合物可以是均匀混合物,也可以是非均匀混合物。

初中化学重难点知识点归纳整理重难点知识点归纳整理:一、物质的分类1.物质的分类:元素和化合物元素是由相同的原子组成,化合物是由不同元素组成的。
2.化合物的分类:离子化合物和共价化合物离子化合物是由正离子和负离子组成,共价化合物是由共价键连接的不同原子组成。
3.含氧化物的分类:碱性氧化物、中性氧化物和酸性氧化物碱性氧化物和金属氧化物反应得到碱,酸性氧化物和非金属氧化物反应得到酸,中性氧化物没有酸碱性质。
二、质量守恒定律1.质量守恒定律:封闭系统中,化学反应前后质量不变。
2.实验室称重:天平称重、量筒称重。
3.质量守恒定律应用:化学反应中物质的质量计算。
三、物质的组成1.原子:构成物质的基本微粒,由质子、中子和电子组成。
2.分子:由原子通过共价键连接而成。
3.离子的形成:正电荷和负电荷相吸引形成离子。
4.元素的符号:元素周期表中元素的符号和名称。
四、化学方程式和化学反应1.化学反应:物质之间发生的化学变化。
2.化学方程式:反应物和生成物的化学式符号组成的方程式。
3.原子的守恒和电荷的守恒:反应物和生成物中原子的种类和数量不变,反应中总正电荷和总负电荷不变。
五、相对分子质量和摩尔质量1.相对分子质量:分子的质量相对于碳-12的质量。
2.摩尔质量:一摩尔物质的质量。
六、化合价1.化合价:原子参与化学反应时的化合能力。
2.原子价:最稳定的化合价。
七、离子和离子键1.离子:带电荷的原子或分子。
2.阴离子和阳离子:带负电荷的离子称为阴离子,带正电荷的离子称为阳离子。
3.离子键:金属和非金属原子之间电子的转移形成的键。
八、氧化还原反应1.氧化还原反应:氧化剂和还原剂之间的电子转移反应。
2.氧化和还原的概念:氧化是失去电子,还原是获得电子。
九、常见气体的性质及制取1.氧气的性质:促使燃烧的气体。
2.氢气的性质:易燃烧的气体。
3.氮气的性质:空气中最主要的气体。
4.氢气和氧气的制取。
十、金属的性质1.金属的导电性:金属内具有自由电子,良好导电性。

高考化学知识点:物质的分类1500字物质的分类是化学学科中的重要内容之一。
它是根据物质的性质、组成、结构等方面的不同特征,将物质划分为不同的类别。
一、按物质的聚集状态分类根据物质的聚集状态,可以将物质分为固体、液体和气体三大类。
1. 固体:具有一定形状和体积的物质被称为固体。
固体的分子之间存在着比较密集的排列。
固体的特点是具有一定的形状和体积,呈现出坚固的结构和不可压缩性。
例如,金属、石头、木头等都是固体物质。
2. 液体:具有一定体积,但没有一定的形状,可以流动的物质被称为液体。
液体的分子间距离较固体大,分子之间的相互作用较弱。
液体具有一定的体积和可流动性的特点,但不具备固体的形状稳定性和可压缩性。
例如,水、酒精等都是液体物质。
3. 气体:具有一定体积和可压缩性,没有一定形状,能自由扩散和流动的物质被称为气体。
气体的分子之间的距离较大,分子间的相互作用相对较弱。
气体具有高度的可压缩性和自由扩散性,但没有一定的形状和体积。
例如,空气、氢气等都是气体物质。
二、按物质的组成分类根据物质的组成方式,可以将物质分为单质和化合物两大类。
1. 单质:由同一种元素组成的纯净物质称为单质。
单质的组成方式非常简单,只包含一个元素。
例如,金属元素、非金属元素等都是单质物质。
2. 化合物:由两种或两种以上元素组成的物质被称为化合物。
化合物的组成方式比较复杂,由不同种类的元素按照一定的比例组合而成,具有独特的化学性质。
例如,水(H2O)、二氧化碳(CO2)等都是化合物。
三、按物质的化学结构分类根据物质的化学结构特征,可以将物质分为有机物和无机物两大类。
1. 有机物:由碳元素与氢元素以及其他元素构成的化合物被称为有机物。
有机物的化学结构相对复杂,具有较为丰富的化学性质。
例如,脂肪、蛋白质、糖等都属于有机物。
2. 无机物:不含碳元素或者只含碳元素与少量其他元素构成的化合物被称为无机物。
无机物的化学结构相对简单,具有较为单一的化学性质。

高一化学物质的分类及转化知识点。
一、物质的分类物质是构成一切物体的基本单位,根据其组成和性质的不同,可以将物质分为纯物质和混合物。
1. 纯物质纯物质是由同种类型的分子或原子组成的物质,具有确定的化学组成和独特的性质。
根据纯物质的组成和性质,可以分为元素和化合物。
元素是由同种类型的原子组成的纯物质,无法通过化学方法分解成其他物质。
元素可以进一步分为金属元素、非金属元素和半金属元素等。
化合物是由两种或两种以上不同元素的原子通过化学键结合而成的纯物质。
化合物具有独特的化学性质,可以通过化学方法分解成其他物质。
2. 混合物混合物是由两种或两种以上不同纯物质按一定比例混合而成的物质。
混合物可以通过物理方法分离成组成它的纯物质。
根据混合物的形态和组成,可以分为气体混合物、液体混合物和固体混合物等。
二、物质的转化物质的转化是指物质在化学反应中发生原子、分子或离子的重组,形成新的物质的过程。
物质的转化可以分为化学变化和物理变化两种类型。
1. 化学变化化学变化是指物质在化学反应中发生原子、分子或离子的重组,形成新的物质的过程。
化学变化伴随着化学键的形成、断裂和能量的释放或吸收。
化学变化是永久性的,不可逆转的。
化学变化的特征包括:(1) 颜色的变化:反应前后物质的颜色发生明显变化。
(2) 气体的产生:反应中产生气体,如气泡、气味等。
(3) 沉淀的生成:反应中形成不溶于反应溶液的固体沉淀。
(4) 温度的变化:反应过程中放热或吸热,导致温度的升高或降低。
(5) 光的发射或吸收:反应中产生光的现象,如发光、发热等。
2. 物理变化物理变化是指物质在物理条件下发生形态或性质的改变,但其化学组成不发生变化的过程。
物理变化可以是可逆的,通过改变物理条件可以恢复原有的物质。
常见的物理变化包括:(1) 相变:物质由一个相态转变成另一个相态,如固体溶解成液体、固体升华成气体等。
(2) 研磨、切割等:物质的形态或大小发生改变,但其化学组成没有发生变化。
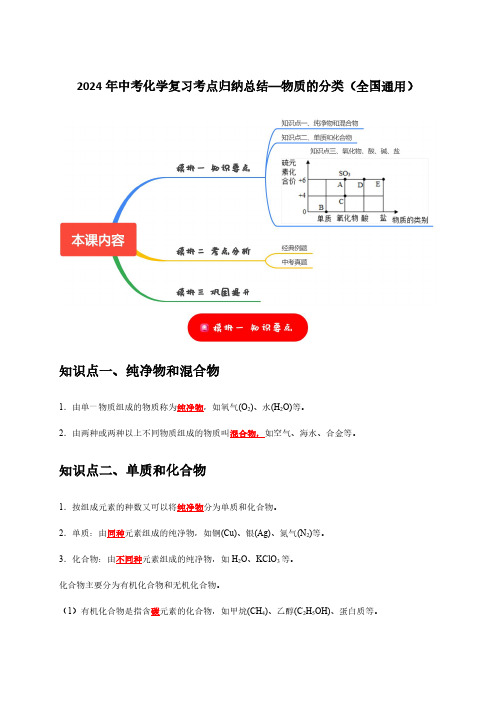
2024年中考化学复习考点归纳总结—物质的分类(全国通用)知识点一、纯净物和混合物1.由单一物质组成的物质称为纯净物,如氧气(O2)、水(H2O)等。
2.由两种或两种以上不同物质组成的物质叫混合物,如空气、海水、合金等。
知识点二、单质和化合物1.按组成元素的种数又可以将纯净物分为单质和化合物。
2.单质:由同种元素组成的纯净物,如铜(Cu)、银(Ag)、氮气(N2)等。
3.化合物:由不同种元素组成的纯净物,如H2O、KClO3等。
化合物主要分为有机化合物和无机化合物。
(1)有机化合物是指含碳元素的化合物,如甲烷(CH4)、乙醇(C2H5OH)、蛋白质等。
(2)无机化合物是指不含碳元素的化合物。
但有些含碳化合物也属于无机物,包括CO、CO2、H2CO3、Na2CO3(碳酸盐)和NaHCO3(碳酸氢盐)等。
【易错辨析】(1)区分混合物和纯净物时不看元素种类,看物质种类。
相同的元素可组成不同的物质,如H2O 和H2O2等。
(2)冰水混合物是纯净物而不是混合物。
知识点三、氧化物、酸、碱、盐1.氧化物:由两种元素组成,其中一种元素是氧元素的化合物,如CO2、H2O等。
2.酸:在水溶液中解离出的阳离子全部为H+的化合物,如HCl、H2SO4等。
3.碱:在水溶液中解离出的阴离子全部为OH-的化合物,如NaOH、Ca(OH)2、NH3·H2O等。
4.盐:由金属阳离子(或NH4+)与酸根阴离子构成的化合物,如NaCl、NaHCO3、K2MnO4等。
【易错辨析】(1)含有氧元素的化合物不一定是氧化物,如H2SO4是酸而不是氧化物。
(2)酸性物质不一定是酸,碱性物质不一定是碱。
考点一.从组成上识别氧化物1.(2023•永州)分类是学习和研究化学的常用方法。
下列物质属于氧化物的是()A.O3B.KMnO4C.CaO D.H2SO4【解答】解:A.O3是由氧元素组成的单质,不属于氧化物,故选项错误;B.KMnO4是由钾元素、锰元素和氧元素组成的化合物,由三种元素组成,所以不属于氧化物,故选项错误;C.CaO是由钙元素和氧元素组成的化合物,属于氧化物,故选项正确;D.H2SO4是由氢元素、硫元素和氧元素组成的化合物,由三种元素组成,所以不属于氧化物,故选项错误;故选:C。

高一物质的分类化学知识点一、自然界物质的分类自然界的物质可以分为无机物和有机物两大类。
无机物主要包括:金属、非金属、无机酸、无机碱、盐等。
有机物主要包括:烃、醇、酚、醛、酮、醚、羧酸、酯、醚、胺等。
二、无机物的分类1. 金属: 金属具有导电性、热导性、延展性、可塑性和光泽等性质。
根据它们的性质和与非金属的化合物形成的离子化合物,金属可以分为碱金属、碱土金属、过渡金属、镧系元素、锕系元素等。
2. 非金属: 非金属的物质通常是破碎的、脆的,没有电导性和光泽。
包括氢、卤素、氧族元素、氮族元素、硫族元素等。
3. 无机酸: 无机酸是由阴离子为酸根的酸。
常见的无机酸有盐酸、硫酸、硝酸等。
4. 无机碱: 无机碱是由阳离子为金属离子、阴离子为氢氧根离子的一类碱。
常见的无机碱有氢氧化钠、氢氧化铝、氢氧化钙等。
5. 盐: 盐是由阳离子为金属离子,阴离子为非金属离子的一种化合物。
常见的盐有氯化钠、硫酸铜、硫酸锌等。
三、有机物的分类有机物根据它们的结构可以分为不同的类别。
1. 烃: 烃是由碳和氢组成的化合物。
根据碳原子的连接方式,烃可分为链状烃、环状烃和支链烃。
常见的烃有甲烷、乙烷、丙烷等。
2. 醇: 醇是由羟基(-OH)取代碳原子上的氢原子得到的化合物。
根据羟基的数量,醇可分为一元醇、二元醇和多元醇。
常见的醇有乙醇、丙醇、甘油等。
3. 酚: 酚是由苯环上一个或多个羟基取代得到的化合物。
常见的酚有苯酚、萘酚等。
4. 醛: 醛是由羰基(C=O)连接碳和氢组成的化合物。
常见的醛有甲醛、乙醛等。
5. 酮: 酮是由羰基连接两个碳原子得到的化合物。
常见的酮有丙酮、己酮等。
6. 醚: 醚是由氧原子连接两个碳原子得到的化合物。
常见的醚有乙醚、二甲醚等。
7. 羧酸: 羧酸是由羧基(-COOH)取代碳原子上的氢原子得到的化合物。
常见的羧酸有乙酸、苯甲酸等。
8. 酯: 酯是由羧酸和醇反应生成的化合物。
常见的酯有乙酸乙酯、水果香精中的苹果酸酯等。

高中化学物质的分类知识点
高中化学中,物质的分类主要包括以下几个知识点:
1. 纯净物和混合物:纯净物是由同一种化学物质组成的物质,可以进一步分为元素和
化合物;混合物是由两种或两种以上的物质混合而成的,可以进一步分为均匀混合物
和非均匀混合物。
2. 元素和化合物:元素是由一种原子组成的物质,化合物是由两种或两种以上的元素
通过化学反应结合而成的物质。
3. 金属和非金属:金属具有良好的导电性、导热性和延展性等特点,而非金属则不具
备这些性质。
4. 四大物质状态:固体、液体、气体和等离子体。
固体具有固定的形状和体积,分子
间相互排列有序;液体具有一定的体积,但没有固定的形状;气体具有较低的密度和
可压缩性,没有固定的形状和体积;等离子体是由高温下电离的气体分子组成的物质。
5. 酸、碱和盐:酸具有酸性质,呈酸味,能和碱发生中和反应;碱具有碱性质,呈苦味,能和酸发生中和反应;盐是酸和碱经过中和反应形成的物质。
6. 氧化物和酸化物:氧化物是与氧元素直接结合的化合物,通常具有碱性;酸化物是
与非金属元素形成的化合物,通常具有酸性。
7. 有机化合物和无机化合物:有机化合物是以碳元素为基础的化合物,通常具有较复
杂的结构;无机化合物是非有机化合物,通常具有较简单的结构。
以上是高中化学物质分类的主要知识点,我们在学习化学的时候需要掌握这些概念,
并能够进行相应的分类和辨认。

初高中化学知识点大全化学是一门研究物质组成、结构、性质以及其变化规律的自然科学。
在初高中阶段学习化学的过程中,掌握一些基本的化学知识点是非常重要的。
本文将为大家汇总整理初高中化学知识点大全,帮助大家系统地复习和回顾相关内容。
一、物质的分类1. 物质的三态:固态、液态、气态;2. 物质的分类:元素、化合物和混合物;3. 化学式和化合价:化学式、离子式、分子式和化合价的概念;4. 元素的分类:金属、非金属元素和过渡金属元素。
二、原子结构1. 原子结构:原子的组成(质子、中子和电子)及构造(云层模型、量子力学模型);2. 原子序数和质量数:原子序数表示原子核中质子的数目,质量数表示核中质子和中子总数;3. 元素周期表:元素周期表的结构、周期性规律(周期性表趋势、同一族元素的性质)。
三、化学键和化合物1. 化学键:共价键、离子键、金属键和氢键的概念及特点;2. 化合物的名称和式写法:二元化合物、氧化物和酸碱盐的命名规则;3. 化合物的性质:酸碱性、氧化还原性等化合物的性质。
四、化学反应1. 化学方程式:化学反应的表示方法、平衡反应式和氧化还原反应式;2. 化学反应类型:酸碱中和、氧化还原、水解、置换等不同类型的化学反应。
五、溶液和离子反应1. 溶液的分类:饱和溶液、过饱和溶液、不饱和溶液;2. 离子反应:离子方程式的书写、双替反应和析出反应的概念;3. 氧化还原反应和电化学:氧化还原反应中的电子转移和电化学电池的原理。
六、酸碱化学1. 酸碱的定义:布朗斯特里法和劳里亚定义下的酸碱概念;2. 酸碱指示剂:PH值和酸碱指示剂的作用及种类;3. 中和反应和盐类:酸碱反应的中和、盐的制备和性质。
七、有机化学1. 有机化合物的命名规则:烷烃、烯烃、炔烃、醇、醛、酮、羧酸等的命名规则;2. 有机反应类型:加成反应、消除反应、置换反应、氧化反应等常见有机反应类型;3. 生物分子和聚合物:碳水化合物、脂肪类、蛋白质、核酸等生物分子的结构和作用。
物质的分类化学知识点整理
1.混合物:是由两种或两种以上的物质混合而成(或由不同种物质组成) 例如,空气,溶液(盐酸、澄清的石灰水、碘酒、矿泉水)矿物(煤、石油、天然气、铁矿石、石灰石),合金(生铁、钢)
注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。
纯净物、混合物与组成元素的种类无关。
即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净或混合物。
2.纯净物:由一种物质组成的。
例如:水、水银、蓝矾(CuSO4 ・5H2 O)都是纯净物
冰与水混合是纯净物。
名称中有“某化某”“某酸某”的都是纯净物,是化合物。
3.单质:由同种(或一种)元素组成的纯净物。
例如:铁氧气(液氧)、氢气、水银。
4.化合物:由不同种(两种或两种以上)元素组成的纯净物。
名称中有“某化某”“某酸某”的是化合物。
5.有机物(有机化合物):含碳元素外的化合物(除CO、CO2 和含碳酸根化合物外)
无机物:不含碳元素的'化合物以及CO、CO2 和含碳酸根的化合物
6. 氧化物:由两种元素组成,其中一种是氧元素的化合物。
a. 酸性氧化物:跟碱反应生成盐和水的氧化物CO2 ,SO2 ,SO3
b. 大部分非金属氧化物都是酸性氧化物,跟水反应生成同价的含氧酸。
CO2 + H2O= H2CO3 SO2 + H2O= H2SO3 SO3 + H2O= H2SO4
b.碱性氧化物:跟酸反应生成盐和水的氧化物。
CaO Na2 O MgO Fe2 O3 CuO
大部分金属氧化物都是碱性氧化物, BaO K2 O CaO Na2 O溶于水立即跟水反应生成相应的碱,其他碱性氧化物不溶于水,跟水不反应。
CaO+H2O=Ca(OH)2 BaO+H2O=Ca(OH)2 Na2O+H2O=2NaOH K2O+H2O=2KOH
c.注意:CO和H2 O既不是酸性氧化物也不是碱性氧化物,是不成盐氧化物。
7.酸:电离时生成的阳离子全部是氢离子的化合物。
酸溶液的PH值小于7
酸的名称中最后一个字是“酸”,通常化学式的第一种元素是“H”,酸由氢和酸根离子组成紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色
根据酸的组成,通常有以下两种分类方法:酸的电离方程式:酸=nH++酸根离子n-
a.根据酸分子电离所能生成的氢离子的个数分为:一元酸(HCl、
HNO3 )、
酸二元酸(H2 SO4 、H2 S、H2 CO3 )和三元酸(H3 PO4 )
b.根据酸分子里有无氧原子分为:含氧酸(H2 SO4 ,HNO3 ,H3 PO4 名称为:某酸)无氧酸(HCl, H2 S名称为:氢某酸)
鉴定酸(鉴定H+)的方法有:
①加紫色石蕊试液变红色的是酸溶液;
②加活泼金属Mg、Fe、Zn等有氢气放出
8碱:电离时生成的阴离子全部是氢氧根离子的化合物。
碱通常由金属离子和氢氧根离子构成。
溶碱有五种:钾钙钠钡氨(KOH,Ca(OH)2 ,NaOH Ba(OH)2 ,氨水)它们的溶液无色。
有颜色的碱(不溶于水):红褐色的氢氧化铁(Fe(OH)3 ↓ )、蓝色的氢氧化铜(Cu(OH)↓)
其他固体碱是白色。
碱的名称通常有“氢氧化某”,化学式的最后面是“OH”
可溶性碱的溶液PH值大于7,紫色石蕊试液遇溶碱变蓝色,无色酚酞试液遇溶碱变红鉴定可溶性碱溶液(鉴定OH-)
方法一:加紫色石蕊试液变蓝色,加无色酚酞试液变红色是碱.
方法二:加铁盐溶液有红褐色沉淀生成;加铜盐溶液有蓝色沉淀的是碱。
9.盐:电离时生成金属离子和酸根离子的化合物。
第一种分类方法:
a.正盐(酸碱完全中和的产物,没有可电离的氢离子或氢氧根离子),例如 NaCl、Na2 S ,KNO3
无氧酸正盐叫“某化某”Na2 S_______ MgCl2__________FeS__________
含氧酸盐叫“某酸某”KNO3_________
BaSO4______________Na2CO3______
b.酸式盐(多元酸里的氢部分被金属取代,H夹在中间)
NaHCO3____________ 、 Ca(HCO3 )2_____________、NaH2 PO4
_____________
常见的酸式盐的酸根有:HCO3-、HSO4-、H2PO4-、HPO42-
c.碱式盐(化学式的中间有“OH”):Cu2 (OH)2 CO3
第二种分类方法
按盐中相同部分的离子称为某类盐:含碳酸根离子的盐称为碳酸盐、含硫酸根离子的盐称为
硫酸盐、含硝酸根离子的盐称为硝酸盐、含铁离子的盐称为铁盐,等等。
10.酸碱指示剂(石蕊试液、无色酚酞)和PH值:
酸溶液的PH值小于7(如盐酸、稀硫酸、硝酸),酸性越强PH值越小,酸性越弱PH值越大。
水、中性的硫酸盐、硝酸盐和盐酸盐溶液不能使指示剂变色,PH值等于7。
不能使指示剂变色;可溶的碱溶液PH值大于7。
碱性越强PH值越大,碱性越弱PH越小
13.酸碱盐溶解性口诀:钾钠硝铵溶溶碱有五种:钡钾钙钠氨不溶氯化物AgCl 不溶硫酸盐BaSO4 碳酸盐只溶钾钠铵
口诀的含义:含有钾、钠、硝酸根、铵根的物质都溶于水
溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水
含Cl的化合物只有AgCl不溶于水,其他都溶于水;含SO42-的化合物只有BaSO4 不溶于水,其他都溶于水。
含CO32-的物质只有含K+ Na+NH4+溶于水,其他都不溶于水
11.沉淀物中AgCl和BaSO4 不溶于稀硝酸,Fe(OH)3是红褐色沉淀,
Cu(OH)2是蓝色沉淀
其他沉淀是白色(包括Fe(OH)2)有以下常见的沉淀:Mg(OH)2
Al(OH)3 CaCO3 BaCO3 Ag2 CO3
推断题中,往沉淀物加稀硝酸:若讲沉淀不溶解,则沉淀中一定有AgCl 或BaSO4 ;若讲沉淀全部溶解,则沉淀中一定没有AgCl或BaSO4 ;若讲沉淀部分溶解,则沉淀中一定有AgCl或BaSO4 中的一种,且还有另一种可溶于稀硝酸的沉淀。