最新通过GLP认证机构名单
- 格式:xlsx
- 大小:14.93 KB
- 文档页数:30

动物实验室的NMPA GLP证书是指药物非临床研究质量管理规范(Good Laboratory Practice,简称GLP)认证证书。
这个证书是由中国国家药品监督管理局(National Medical Products Administration,简称NMPA)颁发的,证明实验室在药物非临床安全性评价研究中遵守了GLP规范。
GLP规范是一套国际公认的实验室质量管理体系标准,旨在确保实验数据的质量、可靠性和完整性。
获得NMPA GLP证书的实验室意味着其具备了进行药物安全性评价等非临床研究的资格和能力。
此外,对于通过GLP认证的药物非临床安全性评价研究机构,NMPA会发放新版的药物GLP 认证证书,该证书的有效期通常为5年。
这表明实验室在认证有效期内需要维持符合GLP 标准的管理和操作流程,以确保其研究质量得到持续的保证。
总的来说,GLP认证对于实验室来说是一个重要的质量保证,它不仅有助于提升实验室的国际认可度,还能够增强其在国内药品注册审批过程中的竞争力。
因此,许多实验室都会积极追求获得这一认证,以展示其科研水平和管理能力。

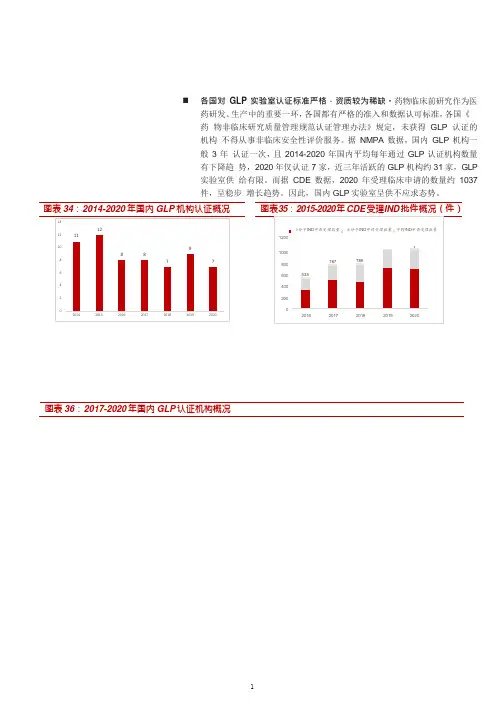
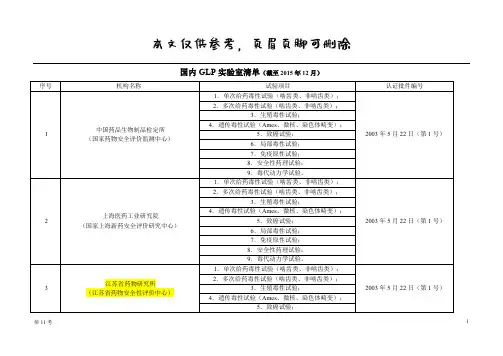
我国GLP现状中国继2005 年首次作为临时观察员参加第19 届OECD/GLP 工作组会议后,于2008 年作为临时观察员第二次组团参加该工作组会议。
中国代表团向大会报告了近年来中国在GLP 监控领域的工作进展,并表示中国将积极申请成为OECD/GLP “非成员数据互认协议”签署方。
由于我国不是OECD 成员国,目前尚未建立工业化学品GLP 监控体系,也没有加入OECD/GLP 工作组或加入其非成员数据互认协议,目前我们国家还没有哪一种GLP 认证是被国际认可的,数据还不能够得到国际承认,我国处于提交加入OECD -GLP 体系的申请阶段。
化学品监管涉及农业部、国家环保总局、卫生部和国家食品药品监管局等部门,并需以国家名义递交申请方可有效。
目前相关部门正在积极协调,希望尽早向OECD 提交申请书,进一步推进我国实现包括药物安全评价资料在内的化学品资料国互认的进程。
农药、兽药GLP我国是农药生产、使用和出口大国,促进我国农药GLP 管理体系和农药GLP 实验室的建设,是农药管理和形势发展的需要。
我国农药GLP 工作,但近几年在GPL 体系建立、尤其是GLP 国际互认方面开展了一些卓有成效的工作。
先后制定与GLP 有关的法律、法规和标准:NY/T 718 -2003《农药毒理学安全性评价良好实验室规范》NY/T 1386 -2007 农药理化分析良好实验室规范准则。
2003 年颁布实施《农药毒理学安全性评价良好实验室规范》,2006 年11 月农业部公告第739 号《农药良好实验室考核管理办法》;2008 年6 月农业部发布《关于开展农药良好实验室规范符合性考核工作的通知》;2008 年8 月农业部办公厅发布《关于印发《农药良好实验室考核专家管理办法》和《农药良好实验室规范符合性考核评价表》的通知》农办农[2008]129 号。
虽然农业部也参照OECD 的GLP 准则,相继制定和出台了GLP 的规章和技术标准,2008 年6 月也发布通知,但尚未有机构通过检查认定。

赛赋医药安评中⼼:打造⼀站式医药CRO平台,获得GLP资质9项认证动脉⽹近⽇获悉,国科赛赋河北医药技术有限公司(赛赋医药安评中⼼)获得了国家药品监督管理局(NMPA)颁发的药物⾮临床研究质量规范(GLP)9项全项药物安全性评价试验资质证书。
赛赋医药本次获得GLP资质认证,标志着该公司的⼀站式医药CRO服务平台进⼀步健全。
2003年6⽉4⽇,我国正式发布了GLP规范,第⼀次对全国药物临床前安全评价实验室进⾏了试点检查,检查试验项⽬包括在实验室条件下,⽤实验系统进⾏的各种毒性试验,例如单次给药的毒性试验、反复给药的毒性试验、⽣殖毒性试验、遗传毒性试验、致癌试验、局部毒性试验、免疫原性试验、依赖性试验、毒代动⼒学试验及与评价药物安全性有关的其它试验。
药物临床前安全评价作为新药研发中最重要的⼀环,通过GLP认证的实验室才有资格进⾏药物的各种毒性试验,GLP实验室也成为医药CRO企业间拉开差距的竞争点之⼀。
截⾄⽬前,我国约有近70家实验室通过了GLP认证,但约⼀半的GLP实验室只获得了7项及7项以内的试验资质批件。
再加之GLP实验室对设备仪器、场地、⼈员等的要求⾮常⾼,由此带来的运营开⽀⼗分庞⼤,普通企业难以承受,所以我国⼤多数GLP实验室都具有很强的政府背景,如中检所、军科院或上海药物所的安评中⼼等。
赛赋医药安评中⼼作为⼀个⾮政府背景的第三⽅GLP实验室,并且能够获得9项安评项⽬的试验资质批件,其背后的实⼒有⽬共睹。
此次获得GLP资质的国科赛赋河北医药技术有限公司是赛赋医药集团专注进⾏药物临床前安全性评价的全资⼦公司,也是赛赋医药集团打造的⼀站式服务平台的核⼼组成部分之⼀。
该中⼼依托于中国科学院药物创新研究院、国家北京新药评价中⼼等国家级药物研发单位,于2017年成⽴,2018年7⽉试运⾏,按照国际最先进的分区控制理念,建设了近万平⽶的功能实验室及实验动物饲养设施。
赛赋医药安评中⼼主要从事GLP条件下的药物(⽣物技术药物、化学药物和中药)、医疗器械的⾮临床安全性评价研究,以及遵从GLP的药理、药效和药代研究。



glp实验室的认证依据
GLP实验室的认证依据主要包括以下方面:
1. 国际GLP准则:认证依据主要是国际上普遍接受的GLP准则,如OECD(经济合作与发展组织)制定的《实验室实施通用质量管理与GLP要求》等。
2. 国家或地区GLP准则:根据国家或地区的法律法规和管理标准制定的GLP准则,如中国GLP准则,德国GLP法规等。
3. 实验室管理体系文件:包括实验室质量管理体系文件、SOP(标准操作规程)、操作指南、实验记录等,这些文件应符合GLP准则的要求。
4. 实验设施和设备:实验室必须具备适宜的实验设施和设备,包括实验室建筑、仪器设备、测量仪器等,以满足GLP准则对实验环境的要求。
5. 人员素质和培训:实验室的人员应具备相应的学术背景和专业知识,并接受过GLP培训,以保证实验的可靠性和合规性。
6. 样品管理:实验室的样品管理应符合GLP准则的要求,包括样品接收、储存、保管和处理等环节。
7. 数据管理和质量控制:实验室应建立完善的数据管理制度,确保实验数据的可追溯性、真实性和完整性,并进行相应的质量控制活动。
8. 审核和审计:实验室应定期进行内部审核和外部审计,以评估实验室是否符合GLP准则的要求。
认证机构根据以上认证依据对实验室进行审核和认证,确保实验室能够按照GLP准则进行实验,并提供符合质量要求的实验数据。

中国NMPA、MARA和美国FDA、EPA以及OECD GLP规范的差异比对■ 王 勇 张文婕(益诺思生物技术海门有限公司)摘 要:本文对中国药品监督管理局(NMPA)、中国农业农村部(MARA)、美国食品药品监督管理局(FDA)、美国环境保护署(EPA)、经济合作与发展组织(OECD)所颁布的GLP质量管理规范进行了差异比对和分析,以便相关从业人员更好地理解不同GLP规范下的异同点,准确应用GLP规范。
关键词:GLP,差异,NMPA,MARA,FDA,EPA,OECDDOI编码:10.3969/j.issn.1002-5944.2021.05.031Comparison of the Differences between NMPA, MARA, FDA, EPA andOECD GLP PrinciplesWANG Yong ZHANG Wen-jie(InnoStar Bio-Tech Haimen Site)Abstract: This paper compares and analyzes the differences between China NMPA (National Medical Products Administration), MARA (Ministry of Agriculture and Rural Affairs), US FDA (Food and Drug Administration), US EPA (Environmental Protection Agency) and OECD (Organization for Economic Co-operation and Development) GLP Principles, to help relevant practitioners to better understand and accurately apply different GLPs.Keywords: GLP, differences, NMPA, MARA, FDA, EPA, OECD标准比对1 引 言自上世纪70年代GLP规范颁布以来,各个国家或组织纷纷建立了适用于本国或本区域发展需要的GLP规范。
国家GLP认证机构(安全评价检测机构)1 中国药品生物制品检定所(国家药物安全评价监测中心)1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);3.生殖毒性试验;4.遗传毒性试验(Ames、微核、染色体畸变);5.致癌试验;6.局部毒性试验;7.免疫原性试验;8.安全性药理试验;9.毒代动力学试验。
2003年5月22日(第1号)2 上海医药工业研究院(国家上海新药安全评价研究中心)1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);3.生殖毒性试验;4.遗传毒性试验(Ames、微核、染色体畸变);5.致癌试验;6.局部毒性试验;7.免疫原性试验;8.安全性药理试验;9.毒代动力学试验。
2003年5月22日(第1号)3 江苏省药物研究所(江苏省药物安全性评价中心)1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);3.生殖毒性试验;4.遗传毒性试验(Ames、微核、染色体畸变);5.致癌试验;6. 局部毒性试验;7.免疫原性试验;8.安全性药理试验。
2003年5月22日(第1号)4 沈阳化工研究院安全评价中心(国家沈阳新药安全评价研究中心)1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);3.生殖毒性试验;4.遗传毒性试验;5.致癌试验;6.局部毒性试验;7.免疫原性试验;8.安全性药理试验;9.毒代动力学试验。
2003年5月22日(第1号)5 四川省天然药物研究所(安全性评价中心)1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);4.遗传毒性试验;5.致癌试验;6. 局部毒性试验;7.免疫原性试验;8.安全性药理试验。
2004年3月18日(第2号)6 中国科学院上海药物研究所(药物安全评价研究中心)1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);3.生殖毒性试验;4.遗传毒性试验(Ames、微核、染色体畸变);5.致癌试验;6.局部毒性试验;7.免疫原性试验;8.安全性药理试验;9.毒代动力学试验。
GLP知识汇总GLP的定义GLP是英文Good Laboratory Practice 的缩写,中文直译为优良实验室规范。
GLP是就实验室实验研究从计划、实验、监督、记录到实验报告等一系列管理而制定的法规性文件,涉及到实验室工作的所有方面。
它主要是针对医药、农药、食品添加剂、化妆品、兽药等进行的安全性评价实验而制定的规范。
制定GLP的主要目的是严格控制化学品安全性评价试验的各个环节,即严格控制可能影响实验结果准确性的各种主客观因素,降低试验误差,确保实验结果的真实性。
GLP在国内外发展情况概述狭义的GLP是对药品的进行临床前安全评价试验的质量管理和保证体系。
自从美国F DA在1978年公布GLP法规,规定不符合GLP标准的实验室所提供的实验数据将不被F DA所受理以来,GLP已经逐渐成为国际上从事新药安全性研究的实验室共同遵循的规范。
我国的GLP开始较晚,1991年才开始酝酿制定GLP规范,1994年开始执行《药品非临床研究质量管理规定(试行)》,标志着GLP在中国开始起步。
而2003年6月SFDA正式颁布GLP规范,则意味着我国的GLP建设走上了正轨。
至今我国已经有14家机构通过了SFDA的GLP认证。
我国GLP实验室的现状GLP实验室对设备仪器、场地、人员等的要求都非常高,由此带来庞大的运营开支,在目前情况下,这种庞大的开始是个人或一般企业所难以承受的。
因此,我国目前的GLP 实验室,大部分具有很强的政府背景,如中检所、军科院或上海药物所的安评中心等,这种情况也是由我国目前的国情所决定的。
由于各级政府的大力支持,以及与各国的药政当局以及研究机构的大力协作,近年来我国的GLP工作取得了巨大的进展,一些基础较好的实验室,如中检所GLP中心,其硬件和软件建设已经达到了国际水平。
随着我国对GLP规范的进一步加强,以及加入ICH工作的开展,我国的GLP实验室建设必将获得更大的进步。
我国安全评价市场的现状以及GLP实验室的生存状态显然,对GLP实验室这样一个投资和维持费用高昂的机构而言,始终依靠国家的输血,是不现实也不经济的。
GLP(Good Laboratory Practice)是指良好实验室规范,是一种组织和管理实验室活动的规范和方法,旨在确保实验室数据的科学性、可靠性和可重复性。
GLP认证是对实验室的质量体系进行认证,确认实验室遵循了GLP要求并且实验室进行了完整的内部质量控制。
GLP认证是对实验室质量管理体系的检查和评估。
通过认证,可以证明实验室在全面贯彻GLP原则方面具有较高的水平,能够持续稳定地提供高品质的实验室服务和测试结果。
GLP 认证包括实验室的设施和设备、实验人员的资质和素质、实验样品的管理、实验方法的规范、数据的记录和报告、实验数据的存储和管理等方面。
GLP认证对各种类型的实验室都是适用的,包括化学、生物、制药、食品、环境等领域的实验室。
通过GLP认证,实验室可以建立严格的管理体系,保证实验室数据的精确性和可信度,提高实验室的声誉和公信力,同时满足客户和监管机构对实验室质量管理的要求。
需要注意的是,GLP认证是实验室质量管理的一种方法,而非产品质量认证或个人的认证。
GLP认证并不直接证明实验结果的准确性和可靠性,但它可以提供信心,保证实验室中
的所有过程、需要的管理、影响了质量的因素得到了全面的、系统的、有规范性的控制,这有助于提高实验室数据的科学性和可信度。
glp认证解读-回复初步理解,"glp认证"指的是"Good Laboratory Practice"(良好实验室规范)认证。
良好实验室规范是一种国际公认的实验室质量管理体系,主要确保实验室在科学研究和测试中遵循一系列指导原则和标准。
本文将分步解析glp认证的内涵、流程和作用。
第一步:基本概念与原则1.1 定义:glp认证是一种确保实验室遵循良好实验室规范的认证机制。
1.2 原则:1.2.1 可追溯性:实验室的每个过程和操作都应有明确的文档记录,以确保结果的可追溯性。
1.2.2 质量控制:实验室应建立和维护适当的质量控制措施,以确保测试结果的准确性和可靠性。
1.2.3 培训和教育:实验室应提供必要的培训和教育,确保实验人员具备必要的技能和知识。
1.2.4 仪器和设备:实验室应使用经过校准和维护的仪器设备,以保证实验结果的准确性。
1.2.5 文件管理:实验室应建立恰当的文件管理系统,确保记录和报告的准确性和完整性。
第二步:认证流程2.1 审核申请:实验室首先向认证机构提交申请,包括组织机构信息、实验室设施和仪器设备清单、质量管理计划等。
2.2 认证准备:实验室进行内部评估,以确定是否符合glp认证标准。
若不符合,需要进行改进和调整。
2.3 外部审核:认证机构派遣专业审核团队对实验室进行现场审核,包括检查设备、记录和操作程序等。
2.4 报告和建议:审核团队提交审核报告,并给出改善建议和意见。
2.5 认证决定:认证机构基于审核报告和实验室的改善措施,决定是否颁发glp认证证书。
第三步:作用与价值3.1 维护科学研究的可靠性:glp认证确保实验室在科学研究中遵循标准和程序,提高研究结果的可靠性和准确性。
3.2 促进国际合作与交流:glp认证是国际公认的质量管理体系,使得实验室能够在国际合作和交流中获得更多机会与认可。
3.3 提升实验室竞争力:glp认证是实验室质量管理的重要证明,能够提升实验室的竞争力,获得更多合作伙伴与资金支持。