高三化学物质的量浓度
- 格式:pdf
- 大小:1.50 MB
- 文档页数:13

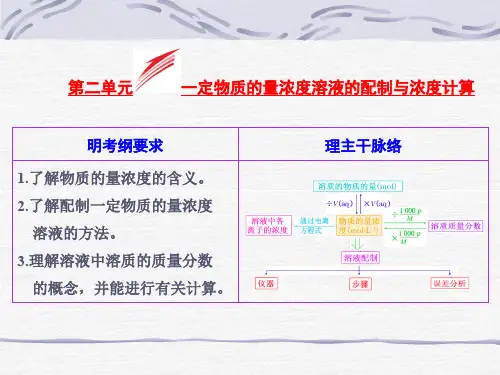
专题2. 物质的量的浓度考纲解读:1.理解物质的量浓度的概念;3.掌握一定物质的量浓度溶液的配制方法以及配制误差的分析;2.掌握有关溶液浓度的有关计算,如溶液中溶质的质量分数、溶解度和物质的量的浓度计算及相互换算;4.高考的热点是物质的量浓度的概念及其计算,一定物质的量浓度的溶液的配制方法。
1.物质的量浓度。
浓度是指一定温度、压强下,一定量溶液中所含溶质的量的多少。
常见的浓度有溶液中溶质的质量分数,溶液中溶质的体积分数,以及物质的量浓度。
物质的量浓度是以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量。
符号用c B表示,(2)表达式:c B = n B/V,单位常用mol/L或mol/m3,注意:①单位体积为溶液的体积,不是溶剂的体积。
②溶质必须用物质的量来表示。
计算公式为概念中的单位体积一般指1升,溶质B指溶液中的溶质,可以指单质或化合物,如c(Cl2)=0.1mol/L,c(NaCl)=2.5mol/L;也可以指离子或其它特定组合,如c(Fe2+)=0.5mol/L, c(SO42-)=0.01mol/L等。
③在一定物质的量浓度的溶液中取出任意体积的溶液,其浓度不变,但所含溶质的量或质量因体积的不同而不同。
④a.完全相的两种溶液相混合后的总体积等于原来两溶液的体积之和; b.不同浓度的两种溶液或不同溶质的两种溶液混合后的总体积一般不等于原溶液体积之和;c.往溶液中加入固体或通入气体后发生反应或溶解后所得液体体积也不等于原来液体的体积。
⑤以带结晶水的物质做溶质,在确定溶质的物质的量时,用结晶水合物的质量除以结晶水合物的摩尔质量即可。
⑥当氨气、氯气等溶于水后成分复杂,求浓度时仍以溶解前的NH3、Cl2等作溶质,而溶液的体积必须依据溶液质量和密度计算例题精讲例1. 实验室需80ml 1mol/L 的NaOH溶液,若用固体NaOH 配制,则应称取NaOH 的质量为()A.3.2gB. 4.0gC. 4.8gD.19.2g例2.下列叙述正确的是( )A.含1mol 溶质的任何溶液,物质的量浓度一定相等B.配置1mol·L-1的NaCl溶液1L,其方法是将58.5g NaCl溶于1L水中C.将40gNaOH溶于1L水中,所得溶液的物质的量浓度为1mol·L-1D.K+为2mol的1LK2SO4溶液的浓度为1mol·L-1例3. 把aL硫酸铵与硝酸铵的混合液分为两等份,一份用b mol 烧碱刚好把氨全部赶出,另一份与BaCl2溶液完全反应恰好消耗c mol BaCl2,则原溶液中硝酸根离子的物质的量浓度(mol·L-1)是:A. b-2c/aB. 2b-2c/aC.2b-c /aD.2b-4c /a例4.设体积的单位为L。


2021届高三化学一轮复习——溶液的浓度及相关计算知识梳理1.溶液组成的两种表示方法(1)物质的量浓度[名师点拨]①物质的量浓度中的体积是指溶液的体积,而不是指溶剂的体积,不能用水的体积代替,如溶液混合,也不是两份溶液体积和。
②对于某浓度的溶液,取出任意体积的溶液,其浓度、密度、质量分数不变,但所含溶质的物质的量、质量则因体积不同而改变。
③溶质的浓度和离子的浓度不一定相同,要注意根据化学式具体分析计算。
例如:1 mol·L-1CaCl2溶液中Cl-的物质的量浓度不是1 mol·L-1,而是2__mol·L-1。
(2)质量分数①概念:用溶质的质量与溶液的质量的比值来表示溶液组成的物理量,一般用百分数表示。
②表达式:饱和溶液(溶质的溶解度用S表示)w=SS+100×100%2.有关物质的量浓度计算的两大类型(1)溶液中溶质的质量分数与物质的量浓度的换算。
计算公式:c=1 000ρwM(c为溶质的物质的量浓度,单位:mol·L-1,ρ为溶液密度,单位g·cm-3,w为溶质的质量分数,M为溶质的摩尔质量,单位g·mol-1)。
[名师点拨]两种溶液浓度换算关系推导以n 为核心⎩⎨⎧质量分数溶液n =ρ×V ×w M 物质的量浓度溶液n =c ×V,故ρ×w ×V M =c ×V 如ρ单位为g·L -1,c =ρw M ,如ρ单位为g·cm -3,c =ρw ×1 000M(2)溶液稀释、同种溶质的溶液混合的计算。
①溶液稀释:a .溶质的质量在稀释前后保持不变,即m 1w 1=m 2w 2。
b .溶质的物质的量在稀释前后保持不变,即c 1V 1=c 2V 2。
c .溶液质量守恒,m (稀)=m (浓)+m (水)(体积一般不守恒)。
②溶液混合:a .混合前后溶质的物质的量保持不变,即:c 1V 1+c 2V 2=c 混V 混(稀溶液混合时,常认为V 混=V 1+V 2进行粗略计算)。

物质的量浓度【考纲要求】1、 理解物质的量浓度。
2、 能用物质的量浓度等概念进行简单的计算。
3、 了解一定物质的量浓度溶液的配制及误差分析。
考点一:物质的量浓度(1)概念:以单位体积溶液里所含溶质B 的 来表示溶液组成的物理量。
符号 ,单位 ,数学表达式:【例题1】在t ℃时,a g 某化合物饱和溶液的体积为b mL ,将其蒸干后得到c g 摩尔质量为d g/mol 的不含结晶水的固体物质。
求:此化合物在t ℃时,饱和溶液中溶质的物质的量浓度。
【例题2】将标准状况下的a L HCl 气体溶于1000 g 水中,得到的盐酸密度为b g/cm 3,则该盐酸的物质的量浓度是多少?【例题3】在标准状况下,1体积的水中溶解700体积NH 3,所得溶液密度为0.9 g/mL ,则该溶液的物质的量浓度和质量分数各是多少?【知识巩固】将物质的量均为a mol 的钠和铝一同投入mg 足量水中,所得溶液的密度为ρg ·cm -3,则此溶液的物质的量浓度为( )A .m a a +501000ρmol ·L -1B .m a a +46ρmol ·L -1C .m a a +461000ρmol ·L -1D . m a a +451000ρmol ·L -1考点二:物质的量浓度、溶解度和质量分数的互换1. 与质量分数(w%)之间的换算关系式: ρ为溶液的密度(g/mL ),ω为溶质的质量分数。
2. 与溶解度(s)之间的换算关系式: ρ为溶液的密度(g/mL ),S 为一定温度下的溶解度(g )。
【例题4】标准状况下VL 氨气溶解在1L 水中(水的密度近似为1g/ml ),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L ,则下列关系中不正确...的是 A.()()1722400/22.422.4p V V =++ B. ()17/1000W c ρ=C. ()17/1722400W V V =+D.C=1000V ρ/(17V+22400)【例题5】 已知某盐酸溶液中HCl 的质量分数为36.5%,溶液的密度为1.19 g/mL ,求此溶液的物质的量浓度?【巩固训练】在25℃时,a g 硫酸铜晶体(CuSO 4.5H 2O )溶于bg 水中,恰好形成 v ml 饱和溶液,下列计算结果正确 的是 ( )A .该饱和溶液中硫酸铜的物质的量浓度为c=640a/v mol/lB .该饱和溶液中硫酸铜的质量分数为w%=16a/25(a+b)%C .25℃时硫酸铜的溶解度为S=1600a/(9a+25b)gD .该饱和硫酸铜溶液的密度为p=160/(a+b)g/ml考点三:不同浓度的物质的混合计算问题【例题6】已知25%氨水的密度为ρ 1 g.cm -3,5%氨水的密度为ρ 2 g·cm -3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是( )A. 等于15%B.大于15%C.小于15%D.无法估算【讨论】如果将氨水改成硫酸,答案应该为【结论】【习题巩固】3a%的硫酸与a%的硫酸等体积混合,若混合物的密度为dg/ml ,则混合物的物质的量浓度为( )A 、大于20ad/98B 、 20ad/98C 、小于20ad/98D 、 不确定考点四:一定物质的量浓度溶液的配制a .仪器 用固体配制需 ; 用液体配制需 ;b .步骤c .误差分析(1)看溶质的量的变化。

1.物质的量浓度(1)概念物质的量浓度表示 里所含溶质B 的物质的量,也称为 ,符号为c B 。
(2)表达式:c B =n B V ,变形: n B =c B ·V ;V =n Bc B。
(3)常用单位: 或mol·m -3,有时也用mmol·L -1。
(4)特点:对于某浓度的溶液,取出任意体积的溶液,其浓度、密度、质量分数均不变,但所含溶质的 、物质的量因体积不同而改变。
2.溶质的质量分数【易错】1.正确判断溶液的溶质并计算其物质的量(1)与水发生反应生成新的物质,如Na 、Na 2O 、Na 2O 2――→水NaOH ;SO 3――→水H 2SO 4;NO 2――→水HNO 3。
(2)特殊物质:如NH 3溶于水后溶质为 ,但计算浓度时仍以 作为溶质。
(3)含结晶水的物质:CuSO 4·5H 2O ―→CuSO 4;Na 2CO 3·10H 2O ―→Na 2CO 3。
01 了解物质的量浓度的概念。
2.准确计算溶液的体积c =nV 中的V 是 的体积,不是 的体积,也不是溶质和溶剂的体积之和,不能用 代替溶液的体积,应根据V =mρ计算。
.1.1 mol·L -1的NaCl溶液是指此溶液中含有1 mol Na +( )2.从100 mL 5 mol·L -1 H 2SO 4溶液中取出了10 mL ,所得硫酸的物质的量浓度为0.5 mol·L -1( )3.将62 g Na 2O 溶于水中,配成1 L 溶液,所得溶质的物质的量浓度为1 mol·L -1( )4.0.5 mol·L -1的稀硫酸中,c (H +)为1.0 mol·L -1( )5.将25 g CuSO 4·5H 2O 晶体溶于75 g 水中所得溶质的质量分数为25%( )6.用100 mL 水吸收0.1 mol HCl 气体所得溶液的物质的量浓度恰好是1 mol·L -1( )7.1 L 水中溶解5.85 g NaCl 所形成的溶液的物质的量浓度是0.1 mol·L -1( )一、物质的量浓度与质量分数的计算1.将标准状况下的a L 氯化氢气体溶于100 g 水中,得到的盐酸的密度为b g ·mL -1,则该盐酸的物质的量浓度(mol ·L -1)是( )A.a22.4 B.ab 22 400 C. 1 000ab2 240+36.5a D.ab 22 400+36.5a2.将25 g CuSO 4·5H 2O 晶体溶于75 g 水中,配成溶液,所得溶液的溶质质量分数为________。



第二讲 物质的量浓度1、掌握物质的量浓度的基本概念、含义及相关的计算与换算。
2、掌握一定物质的量浓度溶液配制的步骤、方法、注意事项。
3、能够对配制一定物质的量浓度溶液的过程进行误差分析。
一、物质的量浓度1、定义:以1L 溶液里所含溶质B 的物质的量来表示溶液的浓度叫做物质的量浓度。
符号为:c B ;单位为: mol ﹒L -12、表达式:c B =n V(n 为溶质B 的物质的量,单位为mol ;V 为溶液的体积,单位为L)3、难点提示(1)理解物质的量浓度的物理意义和相关的量。
物质的量浓度是表示溶液组成的物理量,衡量标准是单位体积溶液里所含溶质的物质的量的多少。
这里的溶质可以是单质、化合物,也可以是离子或其他的特定组合,单位是mol ;体积指溶液的体积而不是溶剂的体积,单位是L ;因此,物质的量浓度的单位是mol·L -1。
(2)明确溶液中溶质的化学成分。
求物质的量浓度时,对一些特殊情况下溶液的溶质要掌握清楚,如NH 3溶于水得NH 3·H 2O ,但我们习惯上认为氨水的溶质为NH 3;SO 3溶于水后所得溶液的溶质为H 2SO 4;Na 、Na 2O 、Na 2O 2溶于水后所得溶液的溶质为NaOH ;CuSO 4·5H 2O 溶于水后所得溶液溶质为CuSO4(3)在计算物质的量浓度时,要注意概念中的体积是溶液的体积,而不是溶剂的体积,如将1 mol NaCl 、标准状况下22.4 L HCl 溶于1 L 水形成的溶液浓度都不是1 mol·L -1,因为最终溶液体积不是1 L 。
(4)溶液浓度与体积多少无关,即同一溶液,无论取出多大体积,其各种浓度(物质的量浓度、溶质的质量分数)均不发生变化。
4、溶质的质量分数质量分数指溶液中溶质的质量分数是溶质质量与溶液质量之比。
计算公式:ω=m(溶质)m(溶液)×100% 5、溶解度在一定的温度和压力下,在100g 溶剂中所能溶解溶质最大的克数。


备战2023年高考化学【一轮·夯实基础】复习精讲精练第2讲 物质的量浓度【复习目标】 1.了解溶液的含义。
2.了解溶解度、饱和溶液的概念。
3.了解物质的量浓度(c )。
【知识精讲】 1.物质的量浓度(1)概念:表示单位体积的溶液里所含溶质B 的物质的量。
(2)单位:mol·L-1或mol/L 。
(3)表达式:c B =n BV ;(4)注意事项①V 是溶液的体积,不是溶剂的体积,也不是溶质与溶剂的体积之和。
①n 必须是溶质B 的物质的量。
【例题1】下列目的能达到的是( )A .将58.5 g NaCl 溶于1 L 水中可得1 mol·L -1的NaCl 溶液B .从1 L 1 mol·L-1的NaCl 溶液中取出10 mL ,其浓度仍是1 mol·L -1C .中和100 mL 1 mol·L -1的H 2SO 4溶液生成正盐,需NaOH 4 gD .将78 g Na 2O 2溶于水,配成1 L 溶液可得到浓度为1 mol·L -1溶液2.溶质的质量分数(1)概念:以溶液里溶质质量m (B)与溶液质量的比值表示溶液组成的物理量,一般用百分数表示,也可用小数表示。
(2)表达式:w(B)=m(B)m(aq)×100%。
①求物质的量浓度时,对一些特殊情况下溶液的溶质要掌握清楚,如NH3溶于水得NH3·H2O,但我们习惯上认为氨水的溶质为NH3;SO3溶于水后所得溶液的溶质为H2SO4;Na、Na2O、Na2O2溶于水后所得溶液的溶质为NaOH;CuSO4·5H2O溶于水后所得溶液溶质为CuSO4等。
①溶液浓度与体积多少无关,即同一溶液,无论取出多大体积,其各种浓度(物质的量浓度、溶质的质量分数、离子浓度)均不发生变化。
3.物质的量浓度和溶质质量分数的比较【例题2】在环保、化工行业有一种溶液浓度的表示方法:质量—体积浓度,用单位体积溶液中所含的溶质质量来表示,单位g·m-3或g·L-1。
最新整理高三化学教学高中化学重要知识点:物质的量浓度高中化学重要知识点:物质的量浓度定义:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度符号:cB单位:mol/L(mol·L-1)计算公式:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)物质的量浓度与溶液质量分数、密度的关系:c=1000ρω/M稀释定理:稀释前后溶液中溶质的物质的量不变c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)稀释前后溶液中溶质的质量不变ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)物质的量浓度与质量分数(质量百分比浓度)的比较:浓度计算的注意事项:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)(1)V指溶液体积而不是溶剂的体积;(2)取出任意体积的1mol/L溶液,其浓度都是1mol/L。
但所含溶质的量则因体积不同而不同;(3)“溶质”是溶液中的溶质,可以是化合物,也可以是离子或气体特定组合,特别的,像NH3、Cl2等物质溶于水后成分复杂,但求算浓度时,仍以溶解前的NH3、Cl2为溶质,如氨水在计算中使用摩尔质量时,用17g/mol。
溶液中溶质的质量分数与溶质的物质的量浓度的换算:溶液中溶质的质量可以用溶质的质量分数表示:m(溶质)=ρ(g·cm-3)·V(L)·w%(1cm3=1mL)溶液中溶质的质量可以用物质的量浓度来表示:m(溶质)=c(mol/L)·V(L)·M(g·mol-1)由于同一溶液中溶质的质量相等,溶液的体积也相等,但注意:1L=1000mL,所以,上述两式可以联系起来:ρ(g·cm-3)·1000V(mL)·w%=c(mol/L)·V(L)·M(g·mol-1)化简得:1000ρw%=cM。
高考计算热点-物质的量浓度相关计算物质的量浓度是化学基本概念之一,是化学重要思维的组成部份,历来是命题重点,包含物质的量浓度的概念。
溶液的浓度是化学计算中涉及面最广的内容。
试题包括:1、溶液物质的量浓度、溶液的体积、溶质物质的量,溶液质量之间的换算;2、物质的量浓度、溶质的质量分数和溶解度之间的换算;3、溶液稀释后,溶质质量分数或物质的量浓度大小计算或大小判断;4、两种溶液混合(包括发生反应和不发生反应)后,溶液浓度的计算;5、气体溶于水后,溶液浓度的计算;6、其他综合运算。
试题以选择题为主,是高考试题中考查学生计算能力的必考题。
此类题涉及的概念较多(如物质的量、质理、摩尔质量、气体的摩尔体积等),知识范围广,内容灵活多变,解题过程中不少同学感到无所适从。
现对该类试题进行归类例析:一、物质的量浓度计算的依据----“定义式”物质的量浓度的定义的数学表达式为c=n/V,其中n为溶质的物质的量(mol),V为溶液的体积(L),c的单位为mol/L。
由此可知,欲求c。
应先分别求出n及V。
在近几年高考试题中,物质的量浓度计算都是与其它考点结合考查,或做为其中的一步,如例3中第4步。
例1、(2001年全国,25)标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol·L -1、密度为0.915 g·cm-3的氨水。
试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的相对分子质量以17.0,水的密度以1.00 g·cm-3计)解析:1.00 L该氨水中含氨的质量为12.0 mol×17.0 g·mol-1;其体积在标准状况下为:12.0 mol×22.4 L·mol-1;1.00 L该氨水中含水的质量为:1.10 L×915 g·L-1-12.0 mol×17.0 g·mol-1答案:1体积水吸收378体积的氨气可制得上述氨水。
2020届高三化学一轮复习 物质的量浓度及相关计算(学案及训练) 知识梳理1.物质的量浓度(1)概念:表示单位体积溶液中所含溶质B 的物质的量。
(2)表达式:c B =n B V。
(3)单位:mol·L -1(或mol/L)。
(4)注意事项:①c B =n B V中的V 是溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和。
②从一定物质的量浓度溶液中取出任意体积的溶液,其浓度相同,所含溶质的物质的量不同。
2.溶质的质量分数3正确判断溶液的溶质并计算其物质的量(1)与水发生反应生成新的物质,如Na 、Na 2O 、Na 2O 2――→水NaOH ;SO 3――→水H 2SO 4;NO 2――→水HNO 3。
(2)特殊物质:如NH 3溶于水后溶质为NH 3·H 2O ,但计算浓度时仍以NH 3作为溶质。
(3)含结晶水的物质:CuSO 4·5H 2O ―→CuSO 4;Na 2CO 3·10H 2O ―→Na 2CO 3。
4.准确计算溶液的体积不能用水的体积代替溶液的体积,尤其是固体、气体溶于水,一般根据溶液的密度进行计算:V =m (气体或固体)+m (溶剂)ρ×10-3L(ρ以g·cm -3为单位)。
5.注意溶质的浓度与溶液中某离子浓度的关系溶质的浓度和离子浓度可能不同,要注意根据化学式具体分析。
如1mol·L -1Al 2(SO 4)3溶液中c (SO 2-4)=3mol·L -1,c (Al 3+)等于2mol·L -1(考虑Al 3+水解时,则其浓度小于2mol·L -1)。
6.溶液稀释定律(守恒观点)(1)溶质的质量在稀释前后保持不变,即m 1w 1=m 2w 2。
(2)溶质的物质的量在稀释前后保持不变,即c 1V 1=c 2V 2。
(3)溶液质量守恒,m (稀)=m (浓)+m (水)(体积一般不守恒)。
高三一轮复习化学第一部分 基本概念专题1——物质的量及物质的量浓度计算一、物质的量1.物质的量物质的量是国际单位中七个基本物理量之一,用来计量原子、分子或离子等微观粒子的多少。
基准:以0.012kg 12C 中所含的碳原子数为基准,即阿伏加德罗常数。
【注】a.用物质的量来表示微粒时,要用化学式注明微粒的种类或其特定组合; 如1mol 水(不正确)和1molH 2O (正确)b.物质的量只适用于微观粒子,不适用于宏观物质。
如1mol 麦粒、1mol 电荷、1mol 元素的描述都是错误的。
2.阿伏加德罗常数阿伏加德罗常数是一个可以用实验测出的准确值,目前只测出6.0221367×1023mol -1,在应用中用6.02×1023 mol -1作为它的最大近似值用于计算。
阿伏加德罗常数是一个非常大的数,只适用于表示微观粒子。
公式:n =AN N【注】应用时要注意:a.特殊物质的摩尔质量及微粒数目:如D 2O 、18O 2、H 37Cl 等。
b.某些特定组合物质分子中的原子个数:如稀有气体为单原子分子,O 3为三原子分子,白磷(P 4)为四原子分子。
c.某些物质中的化学键数目:如白磷(31g 白磷含1.5molP -P 键)、金刚石(12g 金刚石含2mol C -C 键)、晶体硅及晶体SiO 2(60g 二氧化硅晶体含4molSi -O 键)等。
d.某些特殊反应中的电子转移数目:如Na 2O 2与H 2O 、CO 2的反应(1mol Na 2O 2转移1mol 电子;Cl 2与H 2O 、NaOH 的反应(1mol Cl 2转移1mol 电子。
若1mol Cl 2作氧化剂,则转移2mol 电子);Cu 与硫的反应(1mol Cu 反应转移1mol 电子或1mol S 反应转移2mol 电子)等。
e.电解质溶液中因微粒的电离或水解造成微粒数目的变化:如强电解质HCl 、HNO 3等因完全电离,不存在电解质分子;弱电解质CH 3COOH 、HClO 等因部分电离,而使溶液中CH 3COOH 、HClO 浓度减小;Fe 3+、Al 3+、CO 32–、CH 3COO –等因发生水解使该种粒子数目减少;Fe 3+、Al 3+、CO 32–等因发生水解反应而使溶液中阳离子或阴离子总数增多等。