第七章-芳环上亲电和亲核取代反应反应
- 格式:ppt
- 大小:1.53 MB
- 文档页数:42
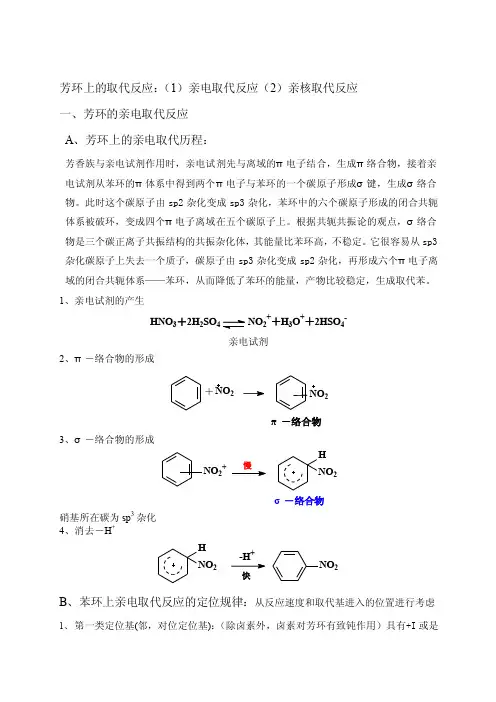
芳环上的取代反应:(1)亲电取代反应(2)亲核取代反应 一、芳环的亲电取代反应 A 、芳环上的亲电取代历程:芳香族与亲电试剂作用时,亲电试剂先与离域的π电子结合,生成π络合物,接着亲电试剂从苯环的π体系中得到两个π电子与苯环的一个碳原子形成σ键,生成σ络合物。
此时这个碳原子由sp2杂化变成sp3杂化,苯环中的六个碳原子形成的闭合共轭体系被破环,变成四个π电子离域在五个碳原子上。
根据共轭共振论的观点,σ络合物是三个碳正离子共振结构的共振杂化体,其能量比苯环高,不稳定。
它很容易从sp3杂化碳原子上失去一个质子,碳原子由sp3杂化变成sp2杂化,再形成六个π电子离域的闭合共轭体系——苯环,从而降低了苯环的能量,产物比较稳定,生成取代苯。
1、亲电试剂的产生HNO 3+2H 2SO4NO 2++H 3O ++2HSO 4-亲电试剂2、π-络合物的形成+NO 2π-络合物23、σ-络合物的形成NO 2+HNO2σ-络合物硝基所在碳为sp 3杂化 4、消去-H ++NO 2H NO 2快B 、苯环上亲电取代反应的定位规律:从反应速度和取代基进入的位置进行考虑1、 第一类定位基(邻,对位定位基):(除卤素外,卤素对芳环有致钝作用)具有+I 或是+C 效应,其作用是增大芳环的电子云密度。
致活基NH 2NHR2OHORNHCROPhR致钝基F Cl BrI2、 第二类定位基(间位定位基):具有-I 或-C 效应,使芳环上的电子云密度降低,均为致钝基NO 2NR 3COOHCOORSO 3HCNCHOCROCCl 3C 、影响亲电取代的因素:(1)芳环上取代基对于E +进入芳环位置的影响第一类定位基-邻对位定位基第二类定位基-间位定位基共振式越多, 正电荷分散程度越大,芳正离子越稳定。
(2) 动力学控制与热力学控制: α位取代-动力学控制产物; β位取代-热力学控制产物。
(3) 邻位和对位定向比:a 亲电试剂的活性越高,选择性越低。


有机化学中的芳香亲核取代与芳香亲电取代芳香亲核取代和芳香亲电取代是有机化学中的两个重要反应类型。
这两种反应是有机芳香化合物中的氢原子被置换为另一种原子或基团的过程。
本文将详细介绍芳香亲核取代和芳香亲电取代的原理、机理和应用。
一、芳香亲核取代芳香亲核取代反应是指芳香化合物中的氢原子被一个亲核试剂取代的过程。
亲核试剂可能是氢氧根离子、卤素离子、芳基负离子等。
这种反应一般需要在碱性条件下进行。
芳香亲核取代反应的机理是由共轭碳氢键的特殊性质决定的。
芳香环中的π电子可以共享给亲核试剂,而由于环上的π电子非常稳定,取代反应的活性较低,因此需要在碱性条件下进行。
常见的芳香亲核取代反应有苯酚的溴化反应、苯的硝化反应等。
苯酚的溴化反应以环境中的溴离子为亲核试剂,生成溴苯和溴化氢。
苯的硝化反应以硝酸为亲核试剂,生成硝基苯和水。
这些反应在有机合成中具有重要意义,可以用于合成药物、香料等化合物。
二、芳香亲电取代芳香亲电取代反应是指芳香化合物中的氢原子被一个亲电试剂取代的过程。
亲电试剂可能是正离子、电子不足的分子等。
这种反应一般需要在酸性条件下进行。
芳香亲电取代反应的原理是由共轭芳香体系的特殊稳定性决定的。
共轭芳香体系能够吸引亲电试剂的正电荷,使其参与反应。
芳香环上的π电子提供了稳定性和活性中心,使得亲电试剂能够与芳香化合物反应。
常见的芳香亲电取代反应有苯的硝化反应、苯的磺化反应等。
苯的硝化反应以浓硝酸为亲电试剂,在酸性条件下发生取代反应,生成硝基苯和水。
苯的磺化反应以浓硫酸为亲电试剂,生成苯磺酸和水。
这些反应在有机合成中也具有重要意义,可以用于合成各种化合物。
三、芳香亲核取代与芳香亲电取代的比较芳香亲核取代和芳香亲电取代在机理和反应条件上有明显的区别。
芳香亲核取代需要在碱性条件下进行,而芳香亲电取代需要在酸性条件下进行。
此外,芳香亲核取代的亲核试剂通常是负离子,而芳香亲电取代的亲电试剂通常是正离子或电子不足的分子。
两种反应类型在有机合成中有着不同的应用。

有机化学基础知识亲核取代反应和亲电取代反应有机化学是研究含有碳元素的化合物的科学,其中涉及了许多的反应类型和机理。
亲核取代反应和亲电取代反应是其中两种重要的反应类型,它们在有机合成中具有广泛的应用。
本文将详细介绍亲核取代反应和亲电取代反应的基本概念、机理和应用。
一、亲核取代反应亲核取代反应是指一个亲核试剂与一个电子亏损的化合物之间的反应,亲核试剂中的亲核物质与电子亏损的原子或官能团发生亲电子进攻,形成新的化学键。
亲核取代反应的机理一般分为两步骤:亲核物质的亲电子进攻和原有官能团的离去。
在亲核取代反应中,亲核试剂可以是阴离子(如氢氧根离子、溴根离子等)或中性分子(如水、醇等)。
而被取代的官能团通常是卤代烃、羰基化合物等。
亲电子进攻的位置取决于取代基的取向效应、立体效应等因素。
亲核取代反应有许多经典的例子,如Sn2反应、醇的酸性取代反应、酯的加水分解等。
Sn2反应是最典型的亲核取代反应之一,其中亲核试剂(通常为阴离子)直接在反应过渡态中与受保护的碳原子发生亲电子进攻。
亲核取代反应在有机合成中具有重要的应用价值。
它们可以用于制备具有特定官能团的化合物、构建碳碳或碳氧化合物的键等。
二、亲电取代反应亲电取代反应是指一个亲电试剂与一个电子富余的化合物之间的反应,亲电试剂中的亲电子物种与电子富余的原子或官能团发生亲电子进攻。
亲电取代反应通常可分为两个阶段:亲电子进攻和亲电子离去。
在亲电取代反应中,亲电试剂可以是正离子(如卤素离子、硫酸酯离子等)或中性分子(如酮、卤代烃等)。
而被取代的官能团通常是亲合电子能力较强的原子或官能团,如羟基、氨基等。
亲电取代反应有很多经典的例子,如卤代烃的取代反应、羟基的酸性取代反应等。
卤代烃的取代反应中,亲电试剂中的亲电子物种会与卤代烃中的卤素原子发生亲电子进攻,从而取代卤素。
亲电取代反应在有机合成中也有广泛的应用。
它们可以用于制备具有特定官能团的化合物、构建碳碳或碳氧化合物的键等。




有机化学基础知识点整理亲电取代反应和亲核取代反应的区别有机化学是化学学科中的一个重要分支,主要研究有机化合物的结构、性质以及它们之间的反应。
在有机化学中,亲电取代反应和亲核取代反应是两种常见且重要的反应类型。
本文将对这两种反应进行详细介绍,并总结它们的区别。
一、亲电取代反应亲电取代反应是一种亲电子试剂(电子亲和力较强)与有机物发生反应,产生亲电子试剂的正离子和有机物的亲电子中间体,最后产生新的有机产物的反应。
亲电取代反应通常涉及到电子丰富的亲电子试剂(如卤代烃和醇类)与缺电子的有机物之间的反应。
亲电取代反应的特点是:1. 亲电子试剂攻击有机物中的亲电子中间体,将其替换为一个新的官能团。
2. 反应速率受限于亲电子试剂的浓度和反应物之间的亲合度。
3. 反应发生在一个步骤中,生成一个过渡态。
亲电取代反应的例子包括:1. 氯代烃和醇的取代反应:氯代烃与醇反应生成醚。
2. 酯键的加成取代反应:酯与亲电子试剂(如卤代烃)反应生成取代酯。
二、亲核取代反应亲核取代反应是一种亲核试剂(电子给予力较强)与有机物发生反应,产生亲核试剂的负离子和有机物的亲核中间体,最后产生新的有机产物的反应。
亲核取代反应通常涉及到电子缺乏的有机物与亲核试剂(如羟基离子和氨基离子)之间的反应。
亲核取代反应的特点是:1. 亲核试剂攻击有机物中的亲核中间体,将其替换为一个新的官能团。
2. 反应速率受限于亲核试剂的浓度和反应物之间的亲合度。
3. 反应发生在两个步骤中,首先生成一个过渡态,然后生成最终产物。
亲核取代反应的例子包括:1. 羟基离子与卤代烃的取代反应:羟基离子(OH-)攻击卤代烃中的卤素原子,生成醇。
2. 氨基离子与酰卤的取代反应:氨基离子(NH2-)攻击酰卤中的酰基,生成酰胺。
三、亲电取代反应和亲核取代反应的区别亲电取代反应和亲核取代反应在机理和试剂选择上有明显的区别:1. 亲电取代反应中,试剂是亲电子试剂,而亲核取代反应中,试剂是亲核试剂。

有机化学基础知识点整理芳香亲电取代和芳香亲核取代反应有机化学基础知识点整理芳香亲电取代和芳香亲核取代反应在有机化学中,芳香亲电取代和芳香亲核取代反应是两种重要的反应类型。
它们涉及到芳香化合物的化学反应,对于理解和应用有机化学知识具有重要意义。
本文将对芳香亲电取代和芳香亲核取代反应进行整理和讲解。
一、芳香亲电取代反应芳香亲电取代反应是指在芳香环上发生的亲电取代反应。
亲电取代反应是指一个亲电试剂(通常是正离子或部分正离子)与芳香化合物发生反应,取代一个芳基上的原子或基团。
这种反应的机理通常经历亲电试剂的攻击,形成的中间体再经历解离、重排等步骤最终生成产物。
常见的芳香亲电取代反应有取代基的烷基化、酰基化、酰基氨基化、酰基氧代化等。
其中,取代基的烷基化反应是最为基础和典型的芳香亲电取代反应。
以氯代甲烷为例,氯离子是一个强亲电试剂,它可以与苯发生取代反应,生成氯代苯。
芳香亲电取代反应的速率受到电子密度、位阻效应和取代基效应等因素的影响。
电子密度越大,反应速率越快;位阻效应越大,反应速率越慢;取代基的性质也会影响反应速率。
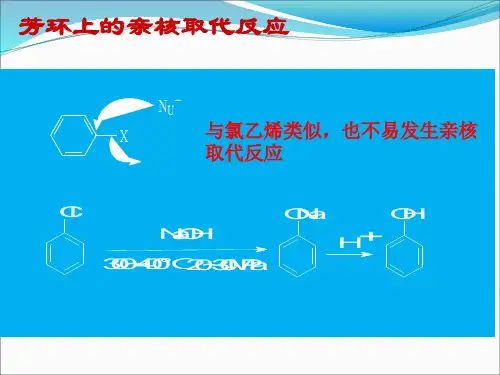
二、芳香亲核取代反应芳香亲核取代反应是指在芳香环上发生的亲核取代反应。
亲核取代反应是指一个亲核试剂与芳香化合物发生反应,取代一个芳基上的离去基。
亲核试剂通常是以亲核离子形式存在,如氢氧根离子、氨根离子等。
芳香亲核取代反应的机理通常经历亲核试剂的进攻、解离、重排等步骤最终生成产物。
常见的芳香亲核取代反应有碱水解、碱醇解、碱胺解等,以氢氧根离子为例,它可以与苯发生取代反应,生成苯酚。
与芳香亲电取代反应相比,芳香亲核取代反应的速率受到反应性的影响更大。
反应性越高,反应速率越快;另外,电子密度、位阻效应和取代基效应等因素也会影响反应速率。
三、芳香亲电取代和芳香亲核取代反应的应用芳香亲电取代和芳香亲核取代反应在有机合成中有着广泛的应用。
根据有机化学的原理和方法,可以利用这两种反应来合成不同的有机化合物。

有机化学基础知识点整理亲电芳香取代和亲核芳香取代反应有机化学基础知识点整理:亲电芳香取代和亲核芳香取代反应亲电芳香取代和亲核芳香取代反应是有机化学中常见的反应类型,它们都与芳香族化合物的反应有关。
本文将对亲电芳香取代和亲核芳香取代的基本概念、反应条件、机理和应用进行整理和探讨。
1. 亲电芳香取代亲电芳香取代反应是指在芳香环上引入一个新的官能团(通常是通过一个亲电试剂)的反应过程。
该反应发生的条件包括有合适的亲电试剂、溶剂和温度,以及适当的反应过程。
亲电试剂可以是卤素化合物、羰基化合物、硝酸酯等。
反应机理通常包括电子亲和性试剂的亲电攻击、芳香环上电子密度的变化和氢的碱性。
2. 亲电芳香取代的应用2.1 酰基化反应酰基化反应是一种常见的亲电芳香取代反应,常用的试剂为酰氯。
该反应在有机合成中广泛应用,用于引入酰基团。
2.2 硝化反应硝化反应是指芳香烃在硝化混酸的条件下引入硝基基团。
硝基芳香化合物广泛应用于药物合成、爆炸物制备和染料合成等领域。
3. 亲核芳香取代亲核芳香取代反应是指在芳香环上引入一个新的官能团(通常是通过一个亲核试剂)的反应过程。
与亲电芳香取代不同,亲核芳香取代的反应机理涉及到亲核试剂的亲核攻击和芳香环上电子密度的变化。
常见的亲核试剂有醇、氨基化合物等。
4. 亲核芳香取代的应用4.1 氢化反应氢化反应是指通过亲核试剂在芳香环上引入氢原子,形成饱和环的反应。
该反应广泛应用于工业催化反应和药物合成等领域。
4.2 氨基化反应氨基化反应是指在芳香环上引入氨基基团的反应。
该反应在药物合成和聚合物合成等领域具有重要应用。
综上所述,亲电芳香取代和亲核芳香取代是有机化学中重要的反应类型。
它们的应用广泛,对于有机合成和药物合成等领域具有重要意义。
深入理解亲电芳香取代和亲核芳香取代的基本概念、反应条件和机理,对于提高有机化学研究的水平和进一步拓宽应用领域具有重要作用。
(本文仅为示例,实际内容请根据具体要求和知识点进行撰写)。
亲电取代和亲核取代反应亲电取代和亲核取代反应是有机化学中常见的两种重要反应类型。
它们在合成有机化合物和药物中起着重要作用。
本文将分别介绍亲电取代和亲核取代反应的基本概念、机理和应用。
一、亲电取代反应1. 概念:亲电取代反应是指通过亲电试剂攻击有机化合物的反应。
亲电试剂通常是电子亏损的离子或分子,例如卤素、卤代烷、强酸等。
亲电取代反应的特点是反应物中的亲电子基团被亲电试剂取代。
2. 机理:亲电取代反应的机理通常分为两步:亲电试剂与反应物形成中间体,然后中间体发生重排或消除反应,最终生成产物。
其中中间体的形成是通过亲电试剂攻击反应物中较活泼的亲电子基团实现的。
3. 应用:亲电取代反应广泛应用于有机合成中,例如合成醇、醚、酮、酯等有机化合物。
常见的亲电取代反应有卤代烷与亲核试剂的取代反应、酮与亲电试剂的取代反应等。
二、亲核取代反应1. 概念:亲核取代反应是指通过亲核试剂攻击有机化合物的反应。
亲核试剂通常是富电子的离子或分子,例如氢离子、氢氧根离子、氨基离子等。
亲核取代反应的特点是反应物中的亲核子基团被亲核试剂取代。
2. 机理:亲核取代反应的机理通常分为两步:亲核试剂与反应物形成中间体,然后中间体发生重排或消除反应,最终生成产物。
其中中间体的形成是通过亲核试剂攻击反应物中较活泼的亲电子基团实现的。
3. 应用:亲核取代反应广泛应用于有机合成中,例如合成醇、醚、酮、酯等有机化合物。
常见的亲核取代反应有醇与酸的酯化反应、酮与亲核试剂的取代反应等。
总结:亲电取代和亲核取代反应是有机化学中重要的反应类型。
亲电取代反应是通过亲电试剂攻击有机化合物,取代亲电子基团的反应;亲核取代反应是通过亲核试剂攻击有机化合物,取代亲核子基团的反应。
这两种反应在有机合成中具有广泛的应用价值,能够合成多样化的有机化合物和药物。
因此,对于有机化学的学习和研究来说,了解亲电取代和亲核取代反应的机理和应用是非常重要的。
有机化学基础知识点整理亲电和亲核取代反应亲电和亲核取代反应是有机化学中常见的两类反应类型。
在这篇文章中,我们将对亲电和亲核取代反应的基础知识进行整理和总结。
一、亲电取代反应亲电取代反应是指亲电子试剂与有机化合物中的亲核位点发生反应,形成新的化学键的过程。
亲电试剂通常具有正电荷或δ+电荷,它们能够与孤对电子或具有δ-电荷的亲核位点进行反应。
亲电取代反应主要涉及到以下几个重要的概念和知识点:1. 亲电试剂:亲电试剂可以是带正电荷的离子,也可以是带正电荷的分子。
常见的亲电试剂包括卤素化合物、酸、羧基化合物等。
亲电试剂的选择决定了反应的类型和机理。
2. 亲核位点:有机化合物中富含电子的原子或官能团被称为亲核位点,通常是孤对电子、π电子或负电荷较为集中的原子或官能团。
亲电试剂会与亲核位点发生反应,从而形成新的化学键。
3. 电子云的重排:亲电试剂与有机化合物的反应通常伴随着电子云的重排。
电子云的重排可以改变化合物的立体构型和键的位置,从而影响反应的产物。
4. 规则:亲电取代反应遵循一系列的规则和机理,例如亲电试剂的攻击方式、反应的立体化学控制等。
学习和理解这些规则对于掌握亲电取代反应至关重要。
二、亲核取代反应亲核取代反应是指亲核试剂与有机化合物中的亲电位点发生反应,形成新的化学键的过程。
亲核试剂通常具有负电荷或δ-电荷,它们能够与带正电荷或δ+电荷的亲电位点进行反应。
亲核取代反应也涉及到以下几个重要的概念和知识点:1. 亲核试剂:亲核试剂是富含电子的离子或分子,通常具有孤对电子或负电荷。
常见的亲核试剂包括氢氧根离子、醇、胺等。
亲核试剂的选择和性质决定了反应类型和机理。
2. 亲电位点:有机化合物中带正电荷或δ+电荷的原子或官能团被称为亲电位点,通常是阳离子或具有正电荷的原子或官能团。
亲核试剂会与亲电位点发生反应,形成新的键。
3. 反应机理:亲核取代反应可以通过不同的机理进行,如相邻基团迁移、加成-消除反应等。
第七章芳香亲核取代反应12芳香亲核取代反应芳香亲核取代反应机理3芳香亲核取代反应(S N 2Ar)离去基团邻对位含有强吸电子取代基芳香化合物的亲核取代反应反应机理: (S N 2Ar)1)常见S N 2Ar 反应致活基团N 2+> +NR 3>NO>NO 2>CF 3>COR>CN>CO 2H>SO 3->Cl>Br>I>CO 2->Ph 2)常见的亲核试剂H -, HS -, RO -, -CN, -SCN, -OH, -CH 2R, -CHXR, NR 3, M-CH 2R 3)芳环上可被亲核试剂取代的基团F>NO 2>Cl, Br, I>-N 2+>OSO 2R>+NR 3>OAr>OR, SR, SAr>SO 2R>NR 24芳香亲核取代反应对位含有硝基芳环上的亲核取代反应反应机理: (S N 2Ar)芳环上可被亲核试剂取代的基团的活性F > Cl, Br, I由于亲核加成是速控步, L 的吸电子能力越强, 与其相连的碳原子电正性越大,对反应越有利.从反应机理看, 芳环的邻对位有吸电子取代基可以稳定中间体环己二烯负离子,对反应有利.5芳香亲核取代反应芳环上的亲核取代反应(S N 2Ar )L + Nu :-Nu + L :-Cl10% NaOH 360o C pressure H 2O +OHCl 135-160 o C H 2O +OHO 2N O 2N NaOH, H 2O Cl 100 o CH 2O +OH O 2N O 2N Na 2CO 3, H 2O NO 2NO 2Cl H 2O +OH O 2N O 2NH 2O NO 2NO 2NO 2NO 2RT硝基的影响吸电子的诱导效应吸电子的共轭效应S N 2Ar 反应硝基为邻对位致活基团6芳香亲核取代反应芳香硝基化合物的芳香亲核取代反应Cl 是好的离去基团, 不好的活化基团.硝基是好的离去基团, 也是好的活化基团Cl 位于2个硝基的邻对位, 易离去.NO 2NO 2OHNO 2NH 2NO 25% NaOHNH 3ClNO 2OMeNO 2NHNH 2NO 2H 2NNH 2NO 2NO 2NO 2MeONa MeOH7芳香亲核取代反应芳香硝基化合物的芳香亲核取代反应实例:NMe 2HNO 2NMe 2KOHONOH + Me 2NHONFO 2N OMe 93%O 2N MeONa MeOH 25o C O 2NOEt NO 2O 2N X +NO 2PhNH 2180o CO 2N NHPh + EtOH NO 2O 2NN NO 2HN + HXX= Cl, BrX= NO 2X= OC 6H 4OMe-489芳香亲核取代反应(S N 1Ar 机理)芳香重氮盐参与的芳香亲核取代反应(无铜催化无强碱)(S N 1Ar)重氮盐热不稳定,0 o C 分解较慢, 温度升高酸性增大均可以加速分解反应.同位素标记证明第一步反应可逆.X -的亲核性不能比:Nu -的强,才有利于形成Ar-Nu ;否则会有利于生成Ar-X.X -可以为HSO 4-,BF 4-,BCl 4-,BBr 4-,Cl -,Br -,I 3-等.10芳香亲核取代反应(S N 1Ar)芳香重氮盐参与的芳香亲核取代反应(无铜催化无强碱)(S N 1Ar)芳环上取代基对反应的影响: (主要看速控步)1)吸电子取代基不利于苯正离子稳定, 对反应不利; 2)给电子取代基有利于苯正离子稳定, 对反应有利;相对速度: p -NO 2< m -Cl < H < p -Mev 1/240 1/24 1 4.53) 邻对位有易形成共轭效应的给电子取代基时, 增加了C-N 键的双键性质, 不利于氮气离去, 因此对反应不利.N N Cl -+RH 2O, 29oCR+ N 2+ Cl -+11芳香亲核取代反应(S N 1Ar)芳香重氮盐的水解(S N 1Ar 机理)HSO 4-的亲核性比H 2O 弱, 只得到酚; 若用HCl, HNO 3代替H 2SO 4还会生成副产物PhCl, PhONO 2.12芳香亲核取代反应(S N 1Ar)Schiemann 反应(制备ArF)13芳香亲核取代反应(S N 1Ar)Schiemann-Olah 反应(制备ArCl, ArBr, ArI)Olah 将该反应推广到制备ArCl 和ArBr1415芳香亲核取代反应(苯炔中间体)苯炔与芳香亲核取代反应机理一.苯炔的结构sp 2-sp 2重叠很弱二.以苯炔为中间体的芳香亲核取代反应离去基团邻对位无强吸电子取代基,但邻位有氢芳香化合物在强碱条件下的亲核取代。