2018高考化学《 水溶液中的离子平衡图像分析》
- 格式:pptx
- 大小:1.28 MB
- 文档页数:14
2018年高考化学真题分类汇编专题8水溶液中的离子平衡(选修4)I—弱电解质的电离1. [2018天津卷-3]下列叙述正确的是A. 某温度下,一元弱酸HA的K a越小,则NaA的K h(水解常数)越小B. 铁管镀锌层局部破损后,铁管仍不易生锈C. 反应活化能越高,该反应越易进行D. 不能用红外光谱区分C2H5OH和CHOCH J【答案】B【解析】A.根据越弱越水解”的原理,HA的K a越小,代表HA越弱,所以A-的水解越强,应该是NaA 的心(水解常数)越大。
选项A错误。
B.铁管镀锌层局部破损后,易形成锌铁原电池,因为锌比铁活泼,所以锌为负极,对正极铁起到了保护作用,延缓了铁管的腐蚀。
选B正确。
C.反应的活化能越高,反应越难进行。
选项C错误。
D.红外光谱是用来检测有机物中的官能团或特定结构的,C2H5OH和CH S OCH S的官能团明显有较大差异,所以可以用红外光谱区分,选项D错误。
【考点】水解平衡常数与电离平衡常数的关系、金属的防护、活化能、红外光谱与化学键。
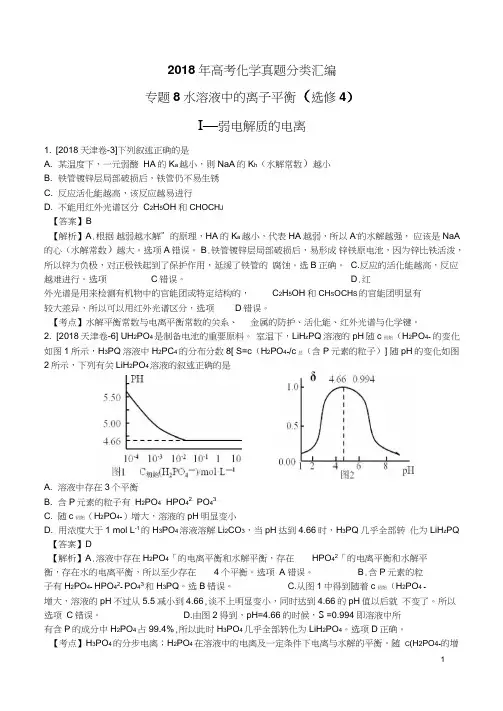
2. [2018天津卷-6] UH2PO4是制备电池的重要原料。
室温下,LiH z PQ溶液的pH随c初始(H2PO4- 的变化如图1所示,H3PQ溶液中H2PC4-的分布分数8[ S=c(H2PO4-/c总(含P元素的粒子)] 随pH的变化如图2所示,下列有关LiH2PO4溶液的叙述正确的是A. 溶液中存在3个平衡B. 含P元素的粒子有H2PO4-HPO42-PO43-C. 随c初始(H2PO4-)增大,溶液的pH明显变小D. 用浓度大于1 mol L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PQ几乎全部转化为LiH z PQ 【答案】D【解析】A.溶液中存在H2PO4「的电离平衡和水解平衡,存在HPO42「的电离平衡和水解平衡,存在水的电离平衡,所以至少存在4个平衡。
选项A错误。
B.含P元素的粒子有H2PO4- HPO42- PO43和H3PQ。








水溶液中的离子平衡图像分析最终版word版本水溶液中的离子平衡图像分析一、考纲解读1、了解电解质、强电解质、弱电解质的概念。
2、了解水的电离、离子积常数。
3、了解溶液pH 的定义,了解测定溶液pH 的方法,能进行pH 的简单计算。
4、了解强酸强碱中和滴定的原理。
5、了解弱电解质在水溶液中的电离平衡。
6、了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
7、了解难溶电解质的沉淀溶解平衡及沉淀转化的本质。
了解溶度积的含义及其表达式,能进行相关的计算。
二、教学过程 1.与对数有关的曲线图【例1】【2015新课标Ⅰ卷理综化学】浓度均为0.10 mol·L -1、体积均为V 0的MOH 和ROH 溶液,分别加水稀释至体积V ,pH 随lg VV 0的变化如图所示,下列叙述错误的是()A .MOH 的碱性强于ROH 的碱性B .ROH 的电离程度:b 点大于a 点C .若两溶液无限稀释,则它们的c (OH -)相等D .当lg V V 0=2时,若两溶液同时升高温度,则c(M +)c(R +)增大【变式题】【2016年广一模】在浓度均为0.1 mol/L 、体积均为V 0的HX 、HY ,分别加水稀释至体积V ,pH 随lg 0V V 的变化关系如右图所示。
下列叙述正确的是()A .HX 、HY 都是弱酸,且HX 的酸性比HY 的弱B .常温下,由水电离出的+(H )(OH )c cg:a <b C .相同温度下,电离常数K (HX):a >bD .lg 0V V =3时,若同时微热两种液体(不考虑HX 、HY 和H 2O 的挥发),则-+(X )(Y )c c 减小思考:____________________________________________________________________ ____【例2】【2013年高考江苏卷】(双选题)一定温度下,三种碳酸盐MCO 3(M :Mg 2+、Ca 2+、Mn 2+)的沉淀溶解平衡曲线如下图所示。

水溶液中的离子平衡高考真题讲解1.(2018·江苏高考)根据下列图示所得出的结论不正确的是()A.图甲是CO(g)+H2O(g)===CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小C.图丙是室温下用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1某一元酸HX的滴定曲线,说明HX是一元强酸D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO2-4)的关系曲线,说明溶液中c(SO2-4)越大c(Ba2+)越小答案 C解析根据图甲,升高温度,lg K减小,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,该反应的ΔH<0,A正确,根据图乙,随着时间的推移,c(H2O2)变化趋于平缓,说明随着反应的进行H2O2分解速率逐渐减小,B 正确;根据图丙,没有滴入NaOH溶液时,0.1000 mol·L-1HX溶液的pH>1,HX 为一元弱酸,C错误;根据图丁可见横坐标越小,纵坐标越大,-lg c(SO2-4)越小,-lg c(Ba2+)越大,说明c(SO2-4)越大,c(Ba2+)越小,D正确。
2.(2018·天津高考)LiH2PO4是制备电池的重要原料。
室温下,LiH2PO4溶液的pH随c初始(H2PO-4)的变化如图1所示,H3PO4溶液中H2PO-4的分布分数δ随pH],下列有关LiH2PO4溶液的叙述正的变化如图2所示[δ=c(H2PO-4)c总(含P元素的粒子)确的是()A.溶液中存在3个平衡B.含P元素的粒子有H2PO-4、HPO2-4、PO3-4C.随c初始(H2PO-4)增大,溶液的pH明显变小D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4答案 D解析溶液中存在H2PO-4的电离平衡和水解平衡,存在HPO2-4的电离平衡,存在水的电离平衡等,所以至少存在4个平衡,A错误。

专题11 水溶液中的离子平衡1.【2018新课标3卷】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl)C.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到aD.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动【答案】C【解析】C.滴定的过程是用硝酸银滴定氯离子,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将50mL 0.05mol/L的Cl-溶液改为50mL 0.04mol/L的Cl-溶液,此时溶液中的氯离子的物质的量是原来的0.8倍,所以滴定终点需要加入的硝酸银的量也是原来的0.8倍,因此应该由c点的25mL变为25×0.8=20mL,而a 点对应的是15mL,选项C错误。
D.卤化银从氟化银到碘化银的溶解度应该逐渐减小,所以K SP(AgCl)应该大于K SP(AgBr),将50mL 0.05mol/L 的Cl-溶液改为50mL 0.05mol/L的Br-溶液,这是将溶液中的氯离子换为等物质的量的溴离子,因为银离子和氯离子或溴离子都是1:1沉淀的,所以滴定终点的横坐标不变,但是因为溴化银更难溶,所以终点时,溴离子的浓度应该比终点时氯离子的浓度更小,所以有可能由a点变为b点。
选项D正确。
考点定位:考查沉淀溶解平衡以及图像分析等【试题点评】本题应该从题目所给的图入手,寻找特定数据判断题目中的沉淀滴定的具体过程。
注意:横坐标是加入的硝酸银溶液的体积,纵坐标是氯离子浓度的负对数。
本题虽然选择了一个学生不太熟悉的滴定过程——沉淀滴定,但是其内在原理实际和酸碱中和滴定是一样的。