高三有机化学一轮复习知识点归纳
- 格式:docx
- 大小:66.26 KB
- 文档页数:19

化学全国卷高考化学一轮复习的知识点汇总随着高考的临近,今年的化学全国卷也即将到来。
想要在这场考试中取得优异的成绩,必须要对化学知识点进行全面复习。
本文将对高考化学一轮复习的知识点进行汇总,以助于考生们更好地备考。
1. 元素周期表元素周期表是化学中最基本也是最重要的知识之一,同时也是一些复杂知识的理论基础。
考生需要掌握元素周期表中元素的周期、族、原子序数和基本参数,以及基本元素的化学性质等知识点。
2. 化学键和物质分类化学键是指通过电子共享或转移使各种原子组成不同化合物的化学作用。
考生需要掌握离子键、共价键和金属键等各种化学键的原理和特点。
此外还需要对化合物进行分类,掌握酸、碱、盐等物质的化学性质。
3. 离子方程式和化学平衡离子方程式和化学平衡是高中化学中的两个重要知识点。
离子方程式是指化学反应方程式中的离子和原子的简单体现,通过对离子方程式的掌握可以解决化学反应中离子生成和消失问题。
而化学平衡则是指一个化学反应达到平衡时,反应物和产物浓度之间达到了定量比例。
考生需要掌握化学反应式的平衡计算、平衡常数和焓变的计算等知识点。
4. 化学反应动力学化学反应动力学研究的是反应速率和反应过程的影响因素,是高中化学中的一个难点。
考生需要掌握反应速率的定义、计算公式和影响因素等知识点,同时还需要掌握化学反应动力学的实验方法和条件。
5. 酸碱平衡和电化学酸碱平衡和电化学是高中化学的又一个难点。
考生需要掌握酸碱指示剂和PH值的含义、酸碱中和反应的原理和计算方法等知识点。
同时还需要掌握电化学的基本原理和半电池电位等知识点,能够了解电池的工作原理和电解质溶液的电解等内容。
6. 化学实验基础化学实验是高中化学学习中不可缺少的一部分。
考生需要掌握有机和无机化学实验的基础知识和技能,掌握基本实验设备和实验方法,更好地理解化学问题和化学反应的原理。
以上就是高考化学一轮复习的知识点汇总。
考生需要根据自身情况,有计划地进行学习和复习,掌握化学知识和技能,做好备考准备。



高考化学一轮复习有机化学知识点汇总化学知识在我们的日常生活中处处可见。
一起来看看高考化学一轮复习有机化学知识点汇总吧~1.羟基官能团可能发生反应类型:取代、消去、酯化、氧化、缩聚、中和反应正确,取代(醇、酚、羧酸);消去(醇);酯化(醇、羧酸);氧化(醇、酚);缩聚(醇、酚、羧酸);中和反应(羧酸、酚)2.最简式为CH2O的有机物:甲酸甲酯、麦芽糖、纤维素错误,麦芽糖和纤维素都不符合3.分子式为C5H12O2的二元醇,主链碳原子有3个的结构有2种正确4.常温下,pH=11的溶液中水电离产生的c(H+)是纯水电离产生的c(H+)的10^4倍错误,应该是10^(-4)5.甲烷与氯气在紫外线照射下的反应产物有4种错误,加上HCl一共5种6.醇类在一定条件下均能氧化生成醛,醛类在一定条件下均能氧化生成羧酸错误,醇类在一定条件下不一定能氧化生成醛,但醛类在一定条件下均能氧化生成羧酸7.CH4O与C3H8O在浓硫酸作用下脱水,最多可得到7种有机产物正确,6种醚一种烯8.分子组成为C5H10的烯烃,其可能结构有5种正确9.分子式为C8H14O2,且结构中含有六元碳环的酯类物质共有7种正确10.等质量甲烷、乙烯、乙炔充分燃烧时,所耗用的氧气的量由多到少正确,同质量的烃类,H的比例越大燃烧耗氧越多11.棉花和人造丝的主要成分都是纤维素正确,棉花、人造丝、人造棉、玻璃纸都是纤维素12.聚四氟乙烯的化学稳定性较好,其单体是不饱和烃,性质比较活泼错误,单体是四氟乙烯,不饱和13.酯的水解产物只可能是酸和醇;四苯甲烷的一硝基取代物有3种错误,酯的水解产物也可能是酸和酚14.甲酸脱水可得CO,CO在一定条件下与NaOH反应得HCOONa,故CO是甲酸的酸酐错误,甲酸的酸酐为:(HCO)2O15.应用取代、加成、还原、氧化等反应类型均可能在有机物分子中引入羟基正确,取代(卤代烃),加成(烯烃),还原(醛基),氧化(醛基到酸也是引入-OH)16.由天然橡胶单体(2-甲基-1,3-丁二烯)与等物质的量溴单质加成反应,有三种可能生成物正确,1,21,43,4三种加成方法17.苯中混有己烯,可在加入适量溴水后分液除去错误,苯和1,2-二溴乙烷可以互溶18.由2-丙醇与溴化钠、硫酸混合加热,可制得丙烯错误,会得到2-溴丙烷19.混在溴乙烷中的乙醇可加入适量氢溴酸除去正确,取代后分液20.应用干馏方法可将煤焦油中的苯等芳香族化合物分离出来错误,应当是分馏21.甘氨酸与谷氨酸、苯与萘、丙烯酸与油酸、葡萄糖与麦芽糖皆不互为同系物错误,丙烯酸与油酸为同系物22.裂化汽油、裂解气、活性炭、粗氨水、石炭酸、CCl4、焦炉气等都能使溴水褪色正确,裂化汽油、裂解气、焦炉气(加成)活性炭(吸附)、粗氨水(碱反应)、石炭酸(取代)、CCl4(萃取)23.苯酚既能与烧碱反应,也能与硝酸反应正确24.常温下,乙醇、乙二醇、丙三醇、苯酚都能以任意比例与水互溶错误,苯酚常温难溶于水25.利用硝酸发生硝化反应的性质,可制得硝基苯、硝化甘油、硝酸纤维错误,硝化甘油和硝酸纤维是用酯化反应制得的26.分子式C8H16O2的有机物X,水解生成两种不含支链的直链产物,则符合题意的X有7种正确,酸+醇的碳数等于酯的碳数27.1,2-二氯乙烷、1,1-二氯丙烷、一氯苯在NaOH醇溶液中加热分别生成乙炔、丙炔、苯炔错误,没有苯炔这种东西28.甲醛加聚生成聚甲醛,乙二醇消去生成环氧乙醚,甲基丙烯酸甲酯缩聚生成有机玻璃错误,乙二醇取代生成环氧乙醚,甲基丙烯酸甲酯加聚生成有机玻璃29.甲醛、乙醛、甲酸、甲酸酯、甲酸盐、葡萄糖、果糖、麦芽糖、蔗糖都能发生银镜反应错误,蔗糖不是还原性糖,不发生银镜反应30.乙炔、聚乙炔、乙烯、聚乙烯、甲苯、乙醛、甲酸、乙酸都能使KMnO4(H+)(aq)褪色错误,聚乙烯、乙酸不能使酸性高锰酸钾溶液褪色高考化学一轮复习有机化学知识点大家复习得怎么样了,2019年高考化学常见的易混知识点需要大家重点复习~。

高考化学一轮复习知识点精华汇总学好化学可以使我们正确并深入的认识我们身边的事物,提高我们的生活品质。
下面是作者为大家整理的有关高考化学一轮复习知识点汇总,期望对你们有帮助!高考化学一轮复习知识点汇总1.水在氧化还原反应中的作用(1)、水作氧化剂水与钠、其它碱金属、镁等金属反应生成氢气和相应碱:水与铁在高温下反应生成氢气和铁的氧化物(四氧化三铁):水与碳在高温下反应生成“水煤气”:铝与强碱溶液反应:(2)、水做还原剂水与F2的反应:(3)、水既做氧化剂又做还原剂水电解:(4)、水既不作氧化剂也不作还原剂水与氯气反应生成次氯酸和盐酸水与过氧化钠反应生成氢氧化钠和氧气水与二氧化氮反应生成硝酸和一氧化氮2.水参与的非氧化还原反应:(1)、水合、水化:水与二氧化硫、三氧化硫、二氧化碳、五氧化二磷等酸性氧化物化合成酸。
(能与二氧化硅化合吗?)水与氧化钠、氧化钙等碱性氧化物化合成碱。
(氧化铝、氧化铁等与水化合吗?)氨的水合、无水硫酸铜水合(变色,可检验液态有机物中是否含水)、浓硫酸吸水、工业酒精用生石灰吸水然后蒸馏以制无水酒精、乙烯水化成乙醇(2)、水解:卤代烃水解、乙酸乙酯水解、油脂水解(酸性水解或皂化反应)、水与碳化物——电石反应制乙炔、盐类的水解、氮化物水解、糖类的水解、氢化物——氢化钠水解3.名称中带“水”的物质(一)、与氢的同位素或氧的价态有关的“水”。
蒸馏水—H2O重水—D2O超重水—T2O双氧水—H2O2(二)、水溶液氨水—(含分子:NH3,H2O,NH3·H2O,含离子:NH4+,OH-,H+)氯水—(含分子:Cl2,H2O,HClO,含离子:H+,Cl-,ClO-,OH-)卤水—常指海水晒盐后的母液或粗盐潮解所得溶液,含NaCl、MgCl2、NaBr等王水—浓硝酸和浓盐酸的混合物(1∶3)生理盐水—0.9%的NaCl溶液(三)、其它水银—Hg水晶--SiO2水煤气—CO、H2的混合气、水玻璃—Na2SiO3溶液高考化学复习25个精华知识点1、基本反应类型化合反应:多变一分解反应:一变多置换反应:一单换一单复分解反应:互换离子2、常见元素的化合价(正价)一价钾钠氢与银,二价钙镁钡与锌,三价金属元素铝;一五七变价氯,二四五氮,硫四六,三五有磷,二四碳;一二铜,二三铁,二四六七锰特别。
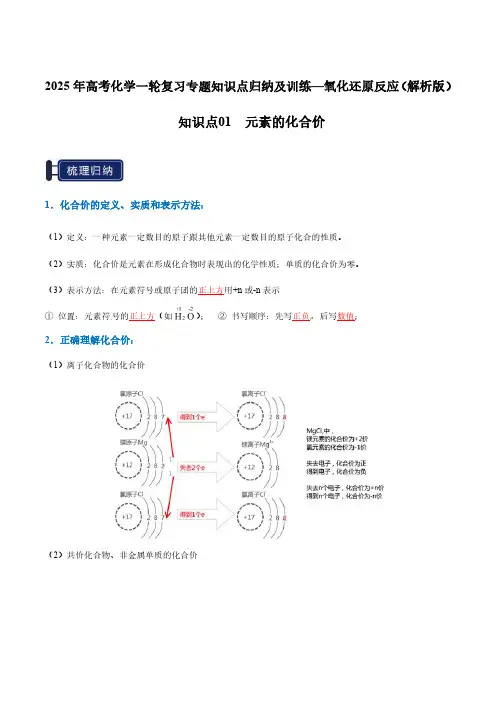
2025年高考化学一轮复习专题知识点归纳及训练—氧化还原反应(解析版)知识点01元素的化合价1.化合价的定义、实质和表示方法:(1)定义:一种元素一定数目的原子跟其他元素一定数目的原子化合的性质。
(2)实质:化合价是元素在形成化合物时表现出的化学性质;单质的化合价为零。
(3)表示方法:在元素符号或原子团的正上方用+n或-n表示①位置:元素符号的正上方(如);②书写顺序:先写正负,后写数值;2.正确理解化合价:(1)离子化合物的化合价(2)共价化合物、非金属单质的化合价3.化合价的数值及正负判定4.元素化合价的规律(1)化合价原则:①化合物中,正负化合价的代数和=0②离子中,正负化合价的代数和=电荷③在化合物里,氢通常显+1价,氧通常显-2价;④金属元素通常显正价,非金属元素通常显负价,但在非金属氧化物里,氧显负价,另一非金属元素显正价;⑤单质中元素的化合价规定为零;⑥许多元素具有可变化合价,如:硫、碳等;⑦“根”的化合价一定不为零。
(2)常用等量关系①主族元素最高正价=主族序数=原子的最外层电子数②主族元素的最高正价+|最低负价|=8或2③最高正化合价与其最低负化合价代数和a.等于0的短周期元素:H、C、Sib.等于2的短周期元素:N、Pc.等于4的短周期元素:Sd.等于6的短周期元素:Cl(3)化合价的范围:+1≤最高价≤+7,-4≤最低价≤-15.化合价的特殊点(1)F元素没有正化合价,金属元素没有负化合价(2)O元素有正化合价,但是没有其所在族的最高正化合价(3)硼元素只有+3价(4)氢元素的化合价①金属氢化物中,氢显-1价,如NaH、NaAlH4、②非金属氢化物中,氢一般显+1价,如NH3、CH4、B2H6(5)氧元素的化合价①普通的含氧微粒中,氧显-2价②含O22―或―O―O―的微粒中,氧显-1价③在S2O82―()中,过氧键中的两个O显-1价,其余的O显-2价。
④在CrO5中,两个过氧键中的4个O显-1价,其余的O显-2价。

高中有机化学整理烃烃:仅含C、H两种元素的有机物叫做烃。
甲烷烷烃一、构造特点和通式:1、构造特点:全部以C—C,和C—H结合的饱和链烃,烷烃。
2、通式:C n H2n+2 (满足此通式的必然为烷烃)3、同系物和同分异构体:同系物:构造相似,组成上相差一个或假设干个CH2的有机物,互称为同系物;同分异体:分子式一样,构造不同的物质互称为同分异构体。
二、物理性质:随碳原子数目的增加,烷烃由g→l→s;随碳原子数目的增加,烷烃的熔点、沸点逐渐升高。
〔碳原子一样的烷烃,支链多的熔、沸点低。
〕三、化学性质:1、氧化反响:〔1〕燃烧:CH4+2O2CO2+2H2O〔2〕烷烃不能使酸性KMnO4溶液褪色。
2、取代反响:(反响不可控制)CH4 + Cl2CH3Cl+HCl CH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HCl CHCl3+Cl2CCl4+HClCH3CH3+Cl2CH3CH2Cl+HCl〔可生成6种取代物〕3、高温分解:CH4C+2H2 2CH4C2H4+2H2乙烯烯烃一、构造特点和通式:1、构造特点:只含一个C=C,其余全部以C—C,和C—H结合的链烃叫烯烃。
2、通式:C n H2n (满足此通式的还可能为环烷烃)二、物理性质:随碳原子数目的增加,烯烃由g→l→s;随碳原子数目的增加,烯烃的熔点、沸点逐渐升高。
三、化学性质:1、氧化反响:〔1〕燃烧:C2H4+3O22CO2+2H2O〔2〕烯烃能使酸性KMnO4溶液褪色。
乙烯与KMnO4溶液作用生成CO22、加成反响:CH2=CH2 +HBr CH3CH2Br CH2=CH2 +H2O CH3CH2OH CH2=CH2 +H2催化剂CH3CH3△3、加聚反响:nCH2=CH2 n四、乙烯的实验室制法:CH3CH2OH浓硫酸CH2=CH2↑+H2O170℃注意:1、浓H2SO4催化剂、脱水剂的作用;2、参加碎瓷片防止暴沸;3、温度计的水银球应置于液面以下;4、应迅速升温到170℃,防止较多的副反响发生;5、除去乙烯中的杂质,最好用NaOH溶液。

高三化学第一轮复习:有机化学(一)—有机基本概念和分子空间构型【本讲主要内容】有机化学(一)——有机基本概念和分子空间构型【知识掌握】【知识点精析】一. 基本概念1. 有机物:绝大多数含碳的化合物(CO、CO2,碳酸、碳酸盐等属于无机物)。
有机物组成元素包括C、H、O、S、N、P、卤素等。
注意:①有机物种类很多,数量高达几千万种,绝大多数为共价化合物②从性质上说,多数难溶于水、易溶于有机溶剂、熔点较低、易燃易分解、不易导电③有机物种类多的原因:一方面是碳原子成键的多样性,另一方面是有大量的同分异构体。
2. 烃、烃的衍生物:仅有C、H两种元素组成的有机物称为碳氢化合物,又称烃。
烃的衍生物:从结构上讲,可看作是烃分子中的氢原子被其他原子或原子团取代后生成的一系列物质,烃的衍生物种类很多。
3. 同系物和同分异构体:同系物的特点:(1)结构相似、有相同的通式(2)分子组成相差CH2或CH2的整倍数(3)有相似的化学性质。
同分异构体:化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象,具有同分异构现象的化合物互称为同分异构体。
注意:(1)同分异构体的书写——主链由长变短,支链由整到散,位置由中到边。
(2)命名:①先主链(最长碳链),称其烷(或烯、炔等)②编号位(最小定位),定支链③取代基,写在前,标位置,短线连④不同基,简到繁,相同基,合并算。
4. 根和基的比较22该类烃结合氢原子以达最大程度,又称为饱和链烃。
6. 不饱和烃、烯烃、炔烃:烯烃:分子中含C=C官能团的一类链烃,若不特别说明,指的是分子中含有一个C=C,通式为CnH2n(n≥2)。
二烯烃指的是分子中含有两个C=C。
炔烃:分子中含C≡C官能团的一类链烃,若不特别说明,指的是分子中含有一个C≡C,通式为CnH2n-2(n≥2)。
不饱和烃:分子中含有C=C或C≡C这样不饱和碳的烃。
7. 环烃、链烃:环烃:分子中碳原子连接有环的烃。
环烷烃的通式是CnH2n(n≥3)。

(2011年1月)高三化学第一轮复习总结资料(知识归纳)一、物质的组成、性质和分类 (3)1、物质的分类 (3)2、物质的组成 (4)3、物质的变化 (4)4、酸、碱、盐的概念及分类 (4)5、常见的既能与酸又能与碱反应的物质 (6)二、化学用语 (6)1、元素符号的意义: (6)2、离子符号和价标符号: (6)3、化合价的含义、规律、应用 (6)4、电子式 (7)5、原子(离子)结构示意图(或称原子、离子结构简图) (7)6、分子式、结构式、结构简式 (7)7、中学阶段常用的方程式 (7)三、化学中常用计量 (8)1、相对原子质量的涵义及相关的说法 (8)2、物质的量:——国际单位制的基本物理量 (8)3、化学反应与能量 (9)4、金属活动性顺序在化学反应中的应用 (9)四、溶液 (12)1、学习目标: (12)2、四种分散系的比较 (12)3、溶液的组成及形成过程 (12)4、温度对溶解度的影响及溶解度曲线 (13)五、金属概论 (13)1、金属在周期表中的位置和原子结构 (13)2、金属的性质 (13)3、金属冶炼 (13)4、金属的锈蚀及防护 (13)六、非金属概论 (15)一、物质的组成、性质和分类1、物质的分类2、物质的组成— 分子是保持物质化学性质的一种粒子 原子—— 是化学变化中的最小粒子 — 带有电荷的原子(或原子团) —— 原子团各原子以共价键相结合,不易分开 元素—— 具有相同核电荷数(即质子数)的同一类原子的总称 同位素—— 具有相同质子数和不同中子数的不同原子的互称 同素异形体—— 同种元素组成的不同种单质 同分异构体—— 同分子式、同化学组成、不同结构的有机物 同系物—— 结构相似、组成上相差一个或若干个“—CH 2”原子团的物质的互称。
3、物质的变化 物理变化:化学变化(反应):本质—— 旧化学键破坏,新的化学键形成化合、分解、置换、复分解反应基本反应类型: 氧化还原反应、非氧化还原反应 放热反应、吸热反应4、酸、碱、盐的概念及分类⑴酸:在溶液中电离时阳离子全部是H +的化合物2SiO 3非氧化性酸:稀H 2SO 4、盐酸、H 3PO 4 一元酸:HCl 、HNO 3、CH 3COOH宏观(成份) 微观(粒子)二元酸:H 2SO 4、HOOC —COOH (乙二酸,又称草酸) 多元酸:H 3PO 4 §酸的特殊性质难挥发性酸:H 2SO 4、H 3PO 4 易挥发性酸:HCl 、HNO 3、H 2S易分解的酸:HClO 、H 2SO 3、H 2CO 3、HNO 3 还原性酸:H 2S 、浓HCl 、HBr 、HI 、H 2SO 3 §下列弱酸不能使指示剂变色、H 2SiO 3、高级脂肪酸、HClO (漂白)§酸的通性(以CH 3COOH 为例)a 、 遇石蕊试液变红b 、 Cu(OH)2+2CH 3COOH =(CH 3COO)2Cu +2H 2Oc 、 CuO +2CH 3COOH =(CH 3COO)2Cu +H 2Od 、Zn +2CH 3COOH =(CH 3COO)2Zn +H 2↑e 、 NaHCO 3+CH 3COOH =CH 3COONa +H 2O +CO 2↑☆硝酸例外,不论是稀硝酸还是浓硝酸,金属是否活泼,硝酸与金属一般不放出氢气。

高考化学一轮复习知识点总结Ⅰ、基本概念与基础理论:一、阿伏加德罗定律1.内容:在同温同压下,同体积的气体含有相同的分子数。
即“三同”定“一同”。
2.推论(1)同温同压下,V1/V2=n1/n2 同温同压下,M1/M2=ρ1/ρ2注意:①阿伏加德罗定律也适用于不反应的混合气体。
②使用气态方程PV=nRT有助于理解上述推论。
3、阿伏加德罗常这类题的解法:①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa、25℃时等。
②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。
③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及希有气体He、Ne等为单原子组成和胶体粒子,Cl2、N2、O2、H2为双原子分子等。
晶体结构:P4、金刚石、石墨、二氧化硅等结构。
二、离子共存1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。

高三化学有机化学知识点梳理有机化学是高中化学的重要组成部分,对于高三学生来说,系统地梳理有机化学知识点对于备考至关重要。
以下是对高三化学有机化学知识点的详细梳理。
一、有机化合物的分类1、按照碳骨架分类链状化合物:如乙烷、乙烯等。
环状化合物:又分为脂环化合物(如环己烷)和芳香族化合物(如苯)。
2、按照官能团分类烃:只含碳和氢两种元素,包括烷烃、烯烃、炔烃和芳香烃。
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物,如卤代烃、醇、酚、醛、酮、羧酸、酯等。
二、烃1、烷烃通式:CₙH₂ₙ₊₂(n≥1)。
物理性质:随着碳原子数的增加,烷烃的熔沸点逐渐升高,密度逐渐增大。
常温下,C₁₋₄的烷烃为气态,C₅₋₁₆的烷烃为液态,C₁₇及以上的烷烃为固态。
化学性质:稳定性较高,通常不与强酸、强碱、强氧化剂反应。
能发生取代反应,如甲烷与氯气在光照条件下发生取代反应。
2、烯烃通式:CₙH₂ₙ(n≥2)。
物理性质:与烷烃类似,但其熔沸点和密度一般比相同碳原子数的烷烃稍高。
化学性质:易发生加成反应,如乙烯与溴水发生加成反应使溴水褪色;能被酸性高锰酸钾溶液氧化而使其褪色;还能发生加聚反应生成高分子化合物。
3、炔烃通式:CₙH₂ₙ₋₂(n≥2)。
化学性质:与烯烃类似,能发生加成、氧化和加聚反应。
4、芳香烃苯:平面正六边形结构,分子中 6 个碳原子和 6 个氢原子共平面。
具有特殊的稳定性,不易发生加成反应,易发生取代反应,如苯与液溴在催化剂作用下发生取代反应。
三、烃的衍生物1、卤代烃物理性质:通常不溶于水,可溶于有机溶剂,多数为液体或固体。
化学性质:在强碱水溶液中发生水解反应生成醇,在强碱的醇溶液中加热发生消去反应生成烯烃。
2、醇通式:R—OH(R 为烃基)。
物理性质:低级醇(如甲醇、乙醇)能与水以任意比例互溶,随着碳原子数的增加,醇在水中的溶解度逐渐减小。
化学性质:能与金属钠反应放出氢气;能发生消去反应生成烯烃(如乙醇在浓硫酸、170℃条件下发生消去反应);能发生催化氧化反应(如乙醇在铜或银作催化剂、加热条件下被氧化为乙醛);能与羧酸发生酯化反应。
高中化学一轮复习重点知识点笔记(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如演讲稿、总结报告、合同协议、方案大全、工作计划、学习计划、条据书信、致辞讲话、教学资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of classic sample essays, such as speech drafts, summary reports, contract agreements, project plans, work plans, study plans, letter letters, speeches, teaching materials, essays, other sample essays, etc. Want to know the format and writing of different sample essays, so stay tuned!高中化学一轮复习重点知识点笔记学习,就像一位客人,你只有热情地去迎接它,它才会传授给你知识,给予你美好的人生。
专题一官能团与有机物类别、性质的关系【考纲解读】:有机化学是高中化学的主干知识,是高考化学中必考内容之一,学习有机化学就是学习官能团,考纲中对官能团的要求是:掌握官能团的名称和结构,了解官能团在化合物中的作用,掌握个主要官能团的性质和主要化学反应,并能结合同系物的概念加以应用。
【知识网络】1(1)有机物:。
(2)有机物种类繁多的原因:。
(3)同系物。
(4)烃:。
2、官能团 (1)定义: (2)常见官能团:官能团与有机物性质的关系RCOOH3、三羟基对比4.四种有机分子的空间结构5、重要有机物的物理性质归纳(1)溶解性:有机物均能溶于有机溶剂.能溶于水的有机物为:低级的醇、醛、酸;微溶于水:①苯酚②苯甲酸③C2H5-O-C2H5注意:水溶性规律。
有机物是否溶于水与组成该有机物的原子团(包括官能团)有密切关系。
在有机物分子常见的官能团中,—OH 、—CHO 、—COC —、—COOH 、—SO 3H 等,皆为亲水基,—R 、—NO 2、—X 、—COOR —等皆为憎水基。
一般来讲,有机物分子中当亲水基占主导地位时,该有机物溶于水;当憎水基占主导地位时,则难溶于水。
由此可推知: ①烃类均难溶于水,因其分子内不含极性基团。
②含有—OH 、—CHO 、及—COOH 的各类有机物(如醇、醛、酮、羧酸),其烃基部分碳原子数小于等于3时可溶于水。
③当活泼金属原子取代有机物分子中的氢原子后所得的产物可溶于水。
如CH 3CH 2ONa 、CH 3COONa 、C 6H 5ONa 等。
(2)密度:比水轻的:①烃(含苯及其同系物、矿物油)②酯(含油脂)③一氯烷烃 比水重:①溴苯②溴乙烷③四氯化碳液态④硝基苯⑤苯酚 (3)有毒的物质:苯、硝基苯、甲醇、甲醛(4)常温下呈气态:①分子中含碳原子数小于或等于4的烃(新戊烷除外)②CH 3Cl ③HCHO(5)有特殊气味或香味:①苯②甲苯③CH 3COOC 2H 5④CH 3CH 2OH6、几类重要的有机物(1)糖类:又叫碳水化合物,一般符合C n (H 2O)m 的通式,但是符合该通式的不一定就属于糖类,不符合该通式的也可以属于糖类。
高考化学一轮复习知识难点汇总高考化学是高中化学王国里最重要的一个分支,也是每个学生都必须学习和考试的科目之一。
一轮复习是高考之前的重要一环,也是快速梳理重难点,弥补知识漏洞的必要环节。
下面将为大家汇总高考化学一轮复习中知识难点。
1. 化学平衡化学平衡是高考化学中最为重要的知识点之一。
学生需要掌握化学平衡的基本定律、影响化学平衡的因素、平衡常数、化学反应速率与平衡之间的关系等。
这些知识点的深入理解对于课堂考试和高考都有重要意义。
2. 元素周期表元素周期表是高考化学中一个广为人知的知识点,是了解化学元素、元素性质、电子排布、化学键及其性质,及元素周期性及其规律性的必备知识点之一。
需要注意的是,学生需掌握周期表组成、周期及元素基本性质等知识,并能熟练绘制出周期表的结构原理。
3. 缩写式和化学式化合物的缩写式和化学式是高考化学中的常见知识点。
学生需掌握各种离子和分子的常用名称、元素符号和离子式、分子式等,以及关于简单化合物和化学方程式的通用规则。
高考化学中关于化学式的应用尤为重要,学生需要能够正确解题和判断。
4. 化学反应与反应速率化学反应及其速率是高考化学中学习较为复杂的知识点。
学生需掌握化学反应的类型、条件和物料变化等内容,同时明确化学反应速率的含义和控制方法,以及周知与非周知反应的区别等。
5. 化学动力学化学动力学是高考化学中的一个普遍存在的难点。
学生需要掌握化学反应中反应物浓度、表面积、温度及碰撞效率等因素对反应速率影响的基本概念和公式。
同时,学生还需要了解反应的热学过程、热催化等其他知识点。
6. 电化学电化学在化学中是一个非常基础的领域,高考中也是一个常见的知识点。
学生需要了解电解质溶液、电极电动势、电位差、电流的流动情况、电解过程的热效应等。
学生需要深入理解电化学的基本概念,并掌握相关公式和制定明确策略。
7. 化学平衡与电化学化学平衡与电化学是化学中的两个基本领域,高考中都是重要的考点。
学生需要掌握化学平衡和电化学之间的关系,以及如何在电解质溶液中准确地进行化学平衡计量和电化学反应分析等。
知识清单30 营养物质 有机合成与推断知识点01 油脂1.油脂的组成和结构(1)组成:油脂是由高级脂肪酸与甘油形成的酯,属于酯类物质 (2)结构①单甘油酯:R =R '=R ''②混甘油酯:R 、R '、R ''不完全相同 ③天然油脂都是多种混甘油酯的混合物。
(3)常见的高级脂肪酸 2.分类 3.物理性质 4.化学性质(1)水解反应①酸性水解:制备甘油和高级脂肪酸②碱性水解(皂化反应):制备甘油和肥皂(2)加成反应--不饱和油脂的特性①溴水:液态油能够使溴水褪色(鉴别植物油和动物油)。
②氢化反应:液态油与氢气的加成反应,又叫油脂的硬化。
这样制得的油脂叫人造脂肪,又叫硬化油。
+3H2。
5.油脂的应用6.油脂和矿物油的比较A.油脂氢化的目的是提高油脂的熔点和稳定性B.油脂是高级脂肪酸和甘油所生成的酯C.油脂在酸性条件下的水解反应也叫皂化反应D.油和脂肪属于同系物【答案】AB【解析】油脂氢化可以提高油脂的饱和程度,增强稳定性和提高熔点;高级脂肪酸甘油酯在碱性条件下的水解反应叫做皂化反应;油是不饱和高级脂肪酸甘油酯,脂肪是饱和高级脂肪酸甘油酯,不可能是同系物,故A、B正确。
【典例02】糖类、油脂和蛋白质是食物中的主要营养物质,对人类的生命、生活和生产都有及其重大的意义。
(一)某油脂常温下呈液态,其中一种成分的结构简式为。
(1)天然油脂是 (填“纯净物”或“混合物”);该油脂能否使溴水褪色? (填“能”或“不能”);为了促进该油脂的水解,可以采取的最有效的措施是 (填字母,下同)。
A .加浓硫酸并加热B .加稀硫酸并加热C .加热D .加入NaOH 溶液并加热 (2)1mol 该油脂要完全水解,需要消耗NaOH 的物质的量为 mol 。
(二)大米、小麦是富含淀粉的农作物。
现按以下路径对农作物米麦进行转化利用:已知E 是一种具有香味的液体,酸性条件下重铬酸钾(227K Cr O )的还原产物是3Cr +。
专题一官能团与有机物类别、性质的关系【考纲解读】:有机化学是高中化学的主干知识,是高考化学中必考内容之一,学习有机化学就是学习官能团,考纲中对官能团的要求是:掌握官能团的名称和结构,了解官能团在化合物中的作用,掌握个主要官能团的性质和主要化学反应,并能结合同系物的概念加以应用。
知识点:1、有机物的概念:(1)有机物:。
(2)有机物种类繁多的原因:。
(3)同系物。
(4)烃:。
2、官能团(1)定义:(2)常见官能团:官能团与有机物性质的关系酚-OH以苯酚为例1.弱酸性:(1)与活泼金属反应放H2(2)与NaOH:(酸性:H2CO3>酚-OH)2.取代反应:能与卤素。
3.与FeCl3的显色反应:4、强还原性,可以被氧化。
5、可以和氢气加成。
-X以溴乙烷为例1取代反应: NaOH的水溶液得醇2消去反应:NaOH的醇溶液-CHO以乙醛为例1.加成反应:2.氧化反应:(1)能燃烧(2)催化氧化:(3)被新制Cu(OH)2、银氨溶液氧化。
3、三羟基对比羟基种类代表物Na NaOH NaHCO 3 Na 2CO 3-OH 活泼性酸性醇羟基 C 2H 5OH √ × × × 增 强中性酚羟基 C 6H 5OH√ √ ×√<H 2CO 3 羧羟基CH 3COOH√√√ √>H 2CO 34.四种有机分子的空间结构 5、重要有机物的物理性质归纳(1)溶解性: 有机物均能溶于有机溶剂.能溶于水的有机物为:低级的醇、醛、酸; 微溶于水:①苯酚 ②苯甲酸 ③C 2H 5-O-C 2H 5注意:水溶性规律。
有机物是否溶于水与组成该有机物的原子团(包括官能团)有密切关系。
在有机物分子常见的官能团中,—OH 、—CHO 、—COC —、—COOH 、—SO 3H 等,皆为亲水基,—R 、—NO 2、—X 、—COOR —等皆为憎水基。
一般来讲,有机物分子中当亲水基占主导地位时,该有机物溶于水;当憎水基占主导地位时,则难溶于水。
由此可推知:①烃类均难溶于水,因其分子内不含极性基团。
②含有—OH 、—CHO 、及—COOH 的各类有机物(如醇、醛、酮、羧酸),其烃基部分碳原子数小于等于3时可溶于水。
③当活泼金属原子取代有机物分子中的氢原子后所得的产物可溶于水。
如CH 3CH 2ONa 、CH 3COONa 、C 6H 5ONa 等。
(2)密度:比水轻的:①烃(含苯及其同系物、矿物油) ②酯(含油脂) ③一氯烷烃 比水重: ①溴苯 ②溴乙烷 ③四氯化碳液态 ④硝基苯 ⑤苯酚(3)有毒的物质:苯、硝基苯、甲醇、甲醛(4)常温下呈气态: ①分子中含碳原子数小于或等于4的烃(新戊烷除外) ②CH 3Cl ③HCHO(5)有特殊气味或香味:①苯 ②甲苯 ③CH 3COOC 2H 5 ④CH 3CH 2OH 6、几类重要的有机物(1)糖类:又叫碳水化合物,一般符合C n (H 2O)m 的通式,但是符合该通式的不一定就属于糖类,不符合该通式的也可以属于糖类。
葡萄糖:CH 2OH(CHOH)4CHO 既含醛基,又含多个羟基。
故葡萄糖既有醛的通性,又有多元醇的通性 :单糖(C 6H 12O 6)(1)氧化反应:能发生银镜反应和与新制Cu(OH)2反应,也能在体内完全氧化(2)醛基发生与H 2发生加成反应 (3)酯化反应 (4)分解制乙醇果 糖:结构、性质不要求,但葡萄糖与果糖互为同分异构体。
(C 6H 12O 6)糖 蔗 糖:(1)非还原性糖,即不含醛基 (2)水解得到一葡一果 类 二糖 (C 12H 22O 11):蔗糖和麦芽糖互为同分异构体。
麦芽糖:(1)还原性糖,即含有醛基 (2)水解得到两分子葡萄糖。
淀 粉:(1)非还原性糖 (2)水解最终得到葡萄糖(3)遇I 2变蓝色 多糖 (C 6H 10O 5)n 淀粉、纤维素的通式都为(C 6H 10O 5)n ,但两者并非同分异构体 纤维素:含有几千个单糖单元,每个单糖单元含有三个醛基。
(1)非还原性糖 (2)水解最终得到葡萄糖,但水解比淀粉困难。
(3)酯化(2).氨基酸和蛋白质 (1)两性两性←氨基酸 蛋白质 (2)盐析(可逆) (含-COOH 、 (3)变性(不可逆) -NH 2) 含肽键 (4)颜色反应(5)灼烧有烧焦羽毛气味 (6)水解得氨基酸-H O (缩+H 2O (水典型例题:例1:某期刊封面上有如下一个分子的球棍模型图。
图中“棍”代表单键或双键或三健。
不同颜色的球代表不同元素的原子,该模型图可代表一种()A.卤代羧酸B.酯C.氨基酸D.醇钠例2:下图表示蛋白质分子结构的一部分,图中A、B、C、D标出分子中不同的键,当蛋白质发生水解反应时,断裂的键是()例3:(08海南卷)在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2的化合物是()例4:(08北京崇文)12.珍爱生命,远离毒品。
以下是四种毒品的结构简式,下列有关说法正确的是A.K粉的分子式为C13H16ClNOB.这四种毒品都属于芳香烃C.1mol大麻最多可与含4mol Br2的浓溴水发生反应D.摇头丸不可能发生加成反应例5、(08北京丰台)17.我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。
某种兴奋剂的结构简式如右图所示,有关该物质的说法正确的是A.该化合物的分子式为C16H18O3B.该分子中的所有碳原子一定在同一平面上C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物D.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol、7mol专题二同分异构体和同系物【考纲要求】1、了解同分异构现象普遍存在的本质原因。
2、掌握同分异构和同系物的概念,会辨认同系物和列举同分异构体。
考点一、同系物: 知识点:1、定义:2、同系物的判断规律 典型例题:例1:下列各物质互为同系物的是( )OH CH 2OH和A.B .CH 3CH 2OH 和CH 3OCH 3C .CH 3一CH=CH 2和CH 3 CH 2 CH 3D .CH 3CH 2OH 和CH 3OH 例2、下列各组物质中,一定互为同系物的是( )A 、分子式为CH 2O 2和C 3H 6O 2的物质B 、分子式为CH 2O 和结构简式为CH 3CHO 的物质C 、分子式为CH 4O 和C 2H 6O 的物质D 、苯酚和苯甲醇(C 6H 5CH 2OH ) 强化训练:1、下列物质是苯的同系物的是 ( )2、下列各组中物质一定互为同系物的是 ( )A.C 3H 4与C 5H 8B.C 3H 6与C 5H 10C.C 3H 8与C 5H 12D.C 3H 7Cl 与C 5H 10Cl 2 3、下列各组物质中,互为同系物的是 ( ) A .CH 3CH 2CH 2CH 3和 CH 3CH =CHCH 3 B .甲苯和苯乙烯C .CH ≡CCH 2CH 3和CH 2=CHCH 2CH 3D .CH 2=CHCH 3和CH 2=CHCH 2CH 34、下列各组物质间,互为同系物的是 ( ) A .CH 3CH 2CH 2Cl 、CH 3Cl B .CH 2Cl 2、CH 3Cl C .CH 3C 6H 4Cl 、C 6H 5Cl D .CH 2=CHCH 2Cl 、CHCl=CHCH 35、下列叙述正确的是 ( )A 、同系物具有相同的性质B 、同系物的结构相似,所以物理性质也相似C 、同系物互为同分异构体D 、同系物具有相似的结构,化学性质也相似 6、下列各物质中, 互为同系物的一组是 ( )①C 2H 5COOH ②C 6H 5—COOH ③硬脂酸 ④油酸 ⑤丙烯酸 ⑥CH 3CH 2CHOA .①③B .③⑤C .④⑥D .⑤⑥ 考点二 、同分异构体的种类 知识点:1、同分异构体的概念。
2、同分异构体的类型: (1)碳架异构:例1:(1)熟练地写出分子式为C 4H 10、C 5H 12、C 6H 14、C 7H 16的所有同分异构体的结构简式:(2)熟练写出符合—C 3H 7、—C 4H 9的所有同分异口构。
(2)位置异构:指官能团在链的不同位置上形成的异构现象。
如:1-氯丙烷,2-氯丙烷常见的官能团有:卤原子、碳碳双键、碳碳叁键、羟基、氨基、硝基等。
例2:推断下列物质的异构体的数目思考:C 4H 10的二氯代物与八氯代物的种类有何关系? 例3:书写满足下列条件的同分异构体的结构简式: ①分子式为C 5H 10,能使溴水反应褪色同分异构体的结构简式 ②分子式为C 5H 12O 的醇类且能氧化成醛同分异构体的结构简式 ③写出符合C 5H 10O 属于醛的同分异构体的结构简式 ④写出符合C 5H 10O 2属于羧酸的同分异构体的结构简式 ⑤写出符合C 4H 8O 2属于酯的同分异构体的结构简式 (3)类别异构:官能团的类别不同引起的异构现象。
例4:邻甲基苯甲酸有多种同分异构体,其中属于酯类且结构中含有苯环的同分异构体有()A、6种B、5种C、4种 D、3种例5、实验室将化学式为C8H16O2的酯水解,得到A和B两种物质, A氧化可转变为B, 符合上述性质的酯的结构种类有A.2种 B.1 种 C.4种 D.3种例6:(08海南卷)分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有()A.3种B.4种C.5种D.6种例7、乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。
乙酸苯甲酯可以用下面的设计方案合成。
(1)写出A人的结构简式:A ,C:。
(2)D有很多同分异构体,含有酯基和一取代苯结构的同分异构体有五个,其中三个的结构简式是请写出另外两个同分异构体的结构简式:和。
专题三有机反应类型考点一、有机反应基本类型有机反应的几种基本类型是:取代反应、加成反应、消去反应、聚合反应等,此外还有氧化反应、还原反应、裂化反应等。
其中酯化反应、酯的水解反应、硝化反应、磺化反应等都是取代反应的一些子类型。
1.同一反应的类型,从不同的角度看可有不同的名称,如: (1) 卤代,硝化,磺化,酯化等均属于取代反应(2)卤代烃,酯,多肽和蛋白质的水解反应属于取代反应,二糖,多糖的水解反应一般认为不属于取代反应(3)油脂在碱性条件下的水解反应叫皂化反应,也是取代反应(4)醇与醇,羧酸与羧酸,氨基酸与氨基酸等分子间的脱水反应属于取代反应 有关反应类型的关系可图示为: 2.把握官能团的反应特征掌握碳碳不饱和键、-OH 、-CHO 、-COOH 、-COOR 、C 6H 5-的特征反应,弄清官能团之间相互影响如-COOH 、-COO-中的C=O 不与H 2加成。
3.掌握一些反应物间量的关系①烃基或苯环上的H 被Br 2取代时,不要误认为1个Br 2取代2个 H 原子。