[2010届一轮复习]《物质结构与性质》全册教案
- 格式:doc
- 大小:4.59 MB
- 文档页数:24

2009届高三化学一轮复习教案:物质结构与性质全册
第四讲原子结构与性质.
一.认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.
1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.
电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.
原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.
例1.下列关于氢原子电子云图的说法正确的是
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对运动无规律性的描述
例2.下列有关认识正确的是
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n -1
D.各能层含有的电子数为2n2
2.(构造原理)
了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布.
(1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.
(2).原子核外电子排布原理.
①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.
②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.
③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.

试卷第1页,共19页 高考化学一轮专题复习:物质结构与性质
1.(2022·湖南·石门县第一中学二模)铜及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)在元素周期表的分区中,铜属于_______区,与铜处于同一周期且最外层电子数相同的元素的基态原子共有_______种。
(2)下列现代分析手段中,可用于检验水中痕量铜元素的是_______(填标号)。
A.X射线衍射 B.原子光谱 C.质谱 D.红外光谱
(3)在CO分子中,C与O之间形成_______个σ键、_______个π键,在这些化学键中,O原子共提供了_______个电子,过渡金属与O形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物xNi(CO)中,x=_______。
(4)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为_______,1mol该有机配体与Cu(Ⅱ)形成的配位键为_______mol。
(5)铜催化烯烃硝化反应时会产生NO2。键角:NO2_______NO2(填“<”或“=”或“>”),其原因是_______。
(6)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为_______,其中Cu元素以Cu+和Cu2+存在,则_______(填“Ⅱ”或“Ⅱ”)为Cu2+。
2.(2022·河南·焦作市第一中学模拟预测)BP晶体超硬、耐磨,是耐高温飞行器的红外增透的理想材料,其合成途径之一为33300BBr+PHBP+3HBr℃。 试卷第2页,共19页 请回答下列问题:
(1)基态溴原子的核外电子排布式为[Ar]_______;基态磷原子中自旋方向相反的电子数目相差_______个。

1
高考题型专项突破 元素“位—构—性”的综合推断
(2022·湖南高考)科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是( )
A.原子半径:X>Y>Z
B.非金属性:Y>X>W
C.Z的单质具有较强的还原性
D.原子序数为82的元素与W位于同一主族
[解题思路分析] 由共价化合物的结构可知,X、W形成4个共价键,Y形成2个共价键,Z形成1个共价键,X、Y、Z、W是原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和,则X为C元素、Y为O元素、Z为F元素、W为Si元素。氟的单质具有很强的氧化性,故C错误。
[答案] C
(2022·广东高考)甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是( )
A.原子半径:丁>戊>乙
B.非金属性:戊>丁>丙
2
C.甲的氢化物遇氯化氢一定有白烟产生
D.丙的最高价氧化物对应的水化物一定能与强碱反应
[解题思路分析] 甲~戊是短周期元素,戊的最高价氧化物对应的水化物为强酸,则可能是硫酸或高氯酸,若是高氯酸,则戊为Cl,甲为N、乙为F、丙为P、丁为S;若是硫酸,则戊为S,甲为C、乙为O、丙为Si、丁为P。甲的氢化物可能为氨气,也可能为甲烷;若是甲烷,则遇氯化氢不反应,没有白烟生成,故C错误。
[答案] C
(2021·海南高考改编)短周期主族元素X、Y、Z、W的原子序数依次增大,XY-离子与Y2分子均含有14个电子;习惯上把电解饱和ZW水溶液的工业生产称为氯碱工业。下列判断正确的是( )
A.原子半径:W>Z
B.最高价氧化物对应的水化物的酸性:Y
C.化合物ZXY的水溶液呈酸性
D.(XY)2分子中既有σ键又有π键
[解题思路分析] 由“短周期主族元素X、Y、Z、W的原子序数依次增大”,“XY-离子与Y2分子均含有14个电子”知,X为C、Y为N;由“习惯上把电解饱和ZW水溶液的工业生产称为氯碱工业”,推出Z、W分别为Na、Cl。

第 1 页 共 20 页 化学高考第一轮复习教案
(经典版)
编制人:__________________
审核人:__________________
审批人:__________________
编制单位:__________________
编制时间:____年____月____日
序言
下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!
并且,本店铺为大家提供各种类型的经典范文,如工作总结、述职报告、策划方案、演讲致辞、合同协议、条据文书、教案资料、好词好句、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!
Download tips: This document is carefully compiled by this editor. I
hope that after you download it, it can help you solve practical problems.
The document can be customized and modified after downloading, please adjust
and use it according to actual needs, thank you!
Moreover, our store provides various types of classic sample essays for
everyone, such as work summaries, job reports, planning plans, speeches,
contract agreements, doctrinal documents, lesson plans, good words and
sentences, complete essays, and other sample essays. If you want to learn

1第十单元综合练习
[建议用时:40分钟]
一、选择题(每小题只有1个选项符合题意)
1.下列各项叙述中,正确的是()
A.所有原子任一能层的s轨道都是球形,但球的半径大小不同
B.镁原子由1s22s22p63s2
→1s22s22p63p2时,原子释放能量,由基态转化成激
发态
C.
24Cr原子的电子排布式是
1s22s22p63s23p63d44s2
D.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
答案A
2.(2022·南京、盐城高三一模)科学家发现金星大气中存在PH
3,据此推断金
星大气层或存在生命。利用下列反应可制备PH
3:P
4+3KOH(浓)+
3H
2O=====△
3KH
2PO
2+PH
3↑。下列说法正确的是()
A.PH
3为非极性分子
B.中子数为10的氧原子可表示为108O
C.H
2O分子空间结构为V形
D.1个P
4分子中含有4个σ键
答案C
3.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,
其反应如下:HCHO+O
2―――→催化剂
CO
2+H
2O。下列有关说法正确的是()
A.反应物和生成物都是非极性分子
2B.0.5molHCHO含有1molσ键
C.HCHO、CO
2分子的中心原子的杂化类型相同
D.HCHO能溶解在H
2O中
答案D
4.在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图所示。
下列说法错误的是()
A.该配离子与水分子形成氢键的原子只有N和O
B.该配离子中铜离子的配位数是4
C.基态Cu原子的价层电子排布式是3d104s1
D.该配离子中非金属元素的电负性大小顺序为O>N>C>H
答案A
解析根据其结构可知,该配离子中的N和O可与水分子中的H形成氢键,
而水分子中的O也可与该配离子中的H形成氢键,因此该配离子与水分子形成氢
键的原子除N和O外,还有H,A错误。
5.下列有关NO-
2、NO-
3和NH
3的说法正确的是()
A.NO-
3的键角大于NH
3的键角
B.NO-
2的空间结构为直线形
C.NH

- 1 - / 191·····谢阅。。。。。 高中化学人教版必修一 全册 教案
高中化学必修一教案
课题: 引言 授课班级
课
时 1
教
学
目
的 知识
与技能 了解化学与工农业生产及日常生活的密切关系
过程与
方法 了解化学科学的理论基础与研究方法
情感
态度
价值观 1、通过化学在工农业及生活中的应用,激发同学们对化学科学的学习兴趣,使同学们热爱化学这们学科。
2、通过师生互动,增加师生感情、
重
点 化学的新认识
难 高中化学的知识特点以及学习方法 - 2 - / 191·····谢阅。。。。。 点
知识结构与板书设计 引 言
一、再说化学:
化学就是研究物质的组成、结构、性质、变化规律以及合成的自然科学。
二、学习内容
三、学习特点:
我的几点要求
教学过程
教学步骤、内容 教学方法
放一组现代化学与人类生活关系的图片
[导入]化学是一门充满神奇色彩的科学,从现在开始,我和同学们一道来探索化学的奥秘
[讲]化学研究的领域不仅局限于传统意义上的化学反应,一些现代生物领域及物理领域都需要我们化学家参与研究,如刚才看到的几组图片,可以说无论从生活还是将来的任何工作都离不开化学。化学是一门实用性很强的科学
[板书]一、再说化学:
[展示并总结]
1、化学是一门应用性很强的科学
(1) 解开许多物质结构之迷,在工厂大规模生产化工[学生活动]阅读教材引言内容
学生讨论,教师总结
学生的怨言:面宽,琐碎,难学,易忘。针对学生- 3 - / 191·····谢阅。。。。。 产品,如人工牛胰岛素
(2) 合成并开发诸多自然界中并不存在的新物质和新材料
(3) 为解决困扰现代社会的环境问题、能源问题和资源问题提供更多的有效途径
(4) 利用化学高效综合应用自然资源和保护环境,使国民经济能良性、可持续发展、为子孙后代造福,使人类生活得更美好。
2、化学与社会发展以及人们生活质量的提高有密切的关系

第1页(共28页) 第一章 原子结构与性质
【高考新动向】
考点梳理
1.了解原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某种性质。
3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
【考纲全景透析】
一.原子结构
1.能级与能层
能 层(n) 一 二 三 四 五 六 七
符 号 K L N O P Q
能 级(l) 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s „ „„
最 多
电 子 数 2 2 6 2 6 10 2 6 10 14 2 „ „„
2 8 18 32 „„ 2n2
2.原子轨道 第2页(共28页)
3.原子核外电子排布规律
⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。
说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。
(2)能量最低原理
现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。换言1s 2s 3s 4s 5s 6s 7s
2p 3p 4p 5p 6p 7p
3d 4d 5d 6d 7d
4f 5f 6f 7f
起点 第3页(共28页) 之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。

人教版高中化学高考第一轮复习专题12《物质结构和性质》测试卷(解析版)
1 / 9 人教版高中化学高考第一轮复习专题12《物质结构与性质》测试卷
一、单选题(共15小题)
1.只有阳离子而没有阴离子的晶体是( )
A. 金属晶体
B. 原子晶体
C. 离子晶体
D. 分子晶体
2.下列有关电子云和原子轨道的说法正确的是( )
A. 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B. s轨道呈球形,处在该轨道上的电子只能在球壳内运动
C. p轨道呈纺锤形,随着电子层的增加,p能级原子轨道也在增多
D. 与s轨道相同,p轨道的平均半径随电子层的增大而增大
3.在乙烯分子中有5个σ键和1个π键,它们分别是( )
A. sp2杂化轨道形成σ键,未杂化的2p轨道形成π键
B. sp2杂化轨道形成π键,未杂化的2p轨道形成σ键
C. C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键
D. C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键
4.下列关于σ键和π键的理解不正确的是( )
A. σ键能单独形成,而π键一定不能单独形成
B. σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C. HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的
D. 气体单质中一定存在σ键,可能存在π键
5.用过量的硝酸银溶液处理含有0.01 mol氯化铬(CrCl3·6H2O)的水溶液,生成0.02 mol AgCl沉淀,此氯化铬最可能是( )
A. [Cr(H2O)6]Cl3
B. [Cr(H2O)5Cl]Cl2·H2O
C. [Cr(H2O)4Cl2]Cl·2H2O
D. [Cr(H2O)3Cl3]·3H2O

第26讲 原子结构 核外电子排布规律
[复习目标] 1.掌握原子结构中微粒数目的关系。2.了解原子核外电子的运动状态、能级分布和排布原理。3.能正确书写1~36号元素原子核外电子排布式、价电子排布式和轨道表示式。
考点一 原子结构、核素、同位素
1.原子结构
(1)构成微粒及作用
(2)微粒间的数量关系
①阳离子的核外电子数=质子数-所带电荷数。
②阴离子的核外电子数=质子数+所带电荷数。
(3)微粒符号周围数字代表的信息
2.元素、核素、同位素
(1)元素、核素、同位素的概念及相互关系
(2)同位素的特征
①同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
(3)氢元素的三种核素
11H:名称为氕,不含中子;
21H:用字母D表示,名称为氘或重氢;
31H:用字母T表示,名称为氚或超重氢。
(4)几种重要核素的用途
核素 235 92U 14 6C 21H 31H 18 8O
用途 核燃料 用于考古断代 制氢弹 示踪原子
1.一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子( )
2.所有原子核内一定都有中子( )
3.质量数就是元素的相对原子质量( )
4.质子数相同的微粒一定属于同一种元素( )
5.核外电子数相同的微粒,其质子数一定相同( )
6.核聚变如21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学变化( ) 7.氢的三种核素形成的单质有6种,它们物理性质有所不同,但化学性质几乎完全相同( )
答案 1.√ 2.× 3.× 4.× 5.× 6.×
7.√
一、微粒中“粒子数”的确定
1.月球上的每百吨32He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以42He的形式存在。已知一个 12C原子的质量为a g,一个32He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是( )
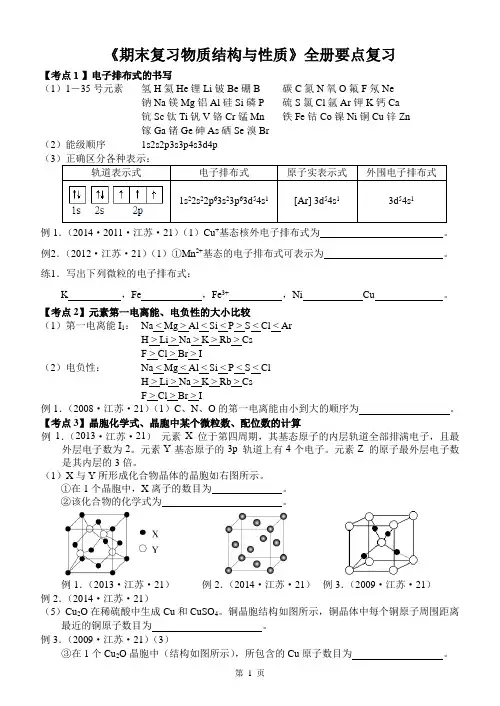
第 1 页 《期末复习物质结构与性质》全册要点复习
【考点1】电子排布式的书写
(1)1-35号元素 氢H氦He锂Li铍Be硼B 碳C氮N氧O氟F氖Ne
钠Na镁Mg铝Al硅Si磷P 硫S氯Cl氩Ar钾K钙Ca
钪Sc钛Ti钒V铬Cr锰Mn 铁Fe钴Co镍Ni铜Cu锌Zn
镓Ga锗Ge砷As硒Se溴Br
(2)能级顺序 1s2s2p3s3p4s3d4p
(3)正确区分各种表示:
轨道表示式 电子排布式 原子实表示式 外围电子排布式
1s22s22p63s23p63d54s1 [Ar] 3d54s1 3d54s1
例1.(2014·2011·江苏·21)(1)Cu+基态核外电子排布式为
。
例2.(2012·江苏·21)(1)①Mn2+基态的电子排布式可表示为
。
练1.写出下列微粒的电子排布式:
K
,Fe
,Fe3+
,Ni
Cu
。
【考点2】元素第一电离能、电负性的大小比较
(1)第一电离能I1: Na < Mg > Al < Si < P > S < Cl < Ar
H > Li > Na > K > Rb > Cs
F > Cl > Br > I
(2)电负性: Na < Mg < Al < Si < P < S < Cl
H > Li > Na > K > Rb > Cs
F > Cl > Br > I
例1.(2008·江苏·21)(1)C、N、O的第一电离能由小到大的顺序为
。
【考点3】晶胞化学式、晶胞中某个微粒数、配位数的计算
例1.(2013·江苏·21) 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如右图所示。

试卷第1页,共10页 高考化学一轮专题复习----物质结构与性质专题训练
1.回答下列问题:
(1)符号“x3p”没有给出的信息是___________。
A.能层
B.能级
C.电子云在空间的伸展方向
D.电子的自旋方向
(2)将2F通入稀NaOH溶液中可生成2OF。2OF中氧原子的杂化方式为___________。
(3)43TiBH是一种储氢材料,可由4TiCl和4LiBH反应制得。基态3+Ti的电子占据的最高能层符号为___________,该能层具有的原子轨道数为___________,-4BH的立体结构是___________。
(4)目前发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。氯化铍在气态时存在2BeCl分子(a)和二聚分子22BeCl(b),a属于___________(填“离子”或“共价”)化合物;b中Be原子的杂化方式相同。且所有原子都在同一平面上,则b的结构式为___________(标出配位键)。
(5)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般0d或10d排布无颜色,19d~d排布有颜色。如2+26CoHO显粉红色。据此判断:2+26MnHO___________(填“无”或“有”)颜色。
(6)过渡金属易与CO形成羰基配合物,如配合物4Ni(CO),常温下为液态,易溶于4CCl、苯等有机溶剂。
①4Ni(CO)固态时属于___________分子(填极性或非极性);
①4Ni(CO)中Ni与CO的___________原子形成配位键;
①4Ni(CO)分子中π键与σ键个数比为___________。
2.请回答下列问题:
(1)(CH3)3NH+和AlCl4可形成离子液体。离子液体由阴、阳离子构成,熔点低于100①,其挥发性一般比有机溶剂_______(填“大”或“小” ),可用作 _______(填代号)
1 第十一单元 物质结构与性质
A卷 新题基础练
一、选择题:本题共14个小题,每小题4分,共56分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关化学键的说法正确的是
A.任何离子和原子之间都可能存在化学键
B.只有直接相邻的原子或离子之间才存在相互作用
C.离子键是指阴、阳离子之间的相互吸引力
D.分子和分子之间不存在化学键
2.(2021·辽宁·大连八中)下列化学用语使用正确的是
A.Cu价层电子的轨道表达式为
B.空间填充模型可以表示甲烷分子,也可以表示四氯化碳分子
C.用电子式表示水的形成过程:→
D.2Fe的结构示意图:
3.(2021·辽宁实验中学)下列说法正确的是
A.原子轨道与电子云都是用来形象描述电子运动状态的
B.电子的运动状态可从能层、能级、轨道3个方面进行描述
C.气体单质中,一定有σ键,可能有π键
D.1个乙烯分子中含有4个σ键,1个π键
4.(2021·辽宁沈阳·)以下现象与原子核外电子的跃迁有关的是
①节日焰火②棱镜分光③激光④LED灯光⑤凹透镜聚光⑥钢铁生锈
A.③⑥ B.①③④ C.①③④⑤ D.①②③⑤⑥
5.(2021·全国·)如图是物质的微观结构示意图,请认真观察两图,判断下列说法正确的是
2
A.两种物质在一定条件下都会自动形成有规则几何外形的晶体
B.I形成的固体物理性质有各向异性
C.II形成的固体一定有固定的熔点
D.二者的X射线衍射图谱是相同的
6.(2021·全国·)下列有关电子排布式或排布图的结论错误的是
选项 电子排布式 结论
A 1s2 2s2 2p2x2p0y2p0z 违背洪特规则
B 1s2s2p63s2 3p63d3 书写正确
C N的电子排布图:
违背泡利原理
D 1s22s2 2p6 3s2 3p63d54s1 书写正确
7.(2021·辽宁·辽河油田第一高级中学)已知A、B、C、D、E是原子序数依次增大的前四周期元素,其元素性质成原子结构如表:
第2课时 分子的空间构型与分子性质
1.知道手性分子的概念,会判断手性碳原子。
2.了解等电子原理。
3.了解分子的手性以及手性分子在生产、生活和医疗中的应用。
4.了解分子的极性以及分子的极性与共价键的极性、分子的空间结构之间的关系。(重点)
分
子
的
对 称 性
[基础·初探]
教材整理1 对称分子
1.概念
依据对称轴的旋转或借助对称面的反映能够复原的分子。
2.性质
具有对称性。
3.与分子性质的关系
分子的极性、旋光性及化学性质都与分子的对称性有关。
(1)CH4分子是面对称。(√)
(2)NH3和H2O分子是面对称。(×)
(3)CH3—CH3分子是轴对称。(√)
(4)分子的对称性对物质的化学性质有一定影响。(√)
教材整理2 手性分子
1.手性
一种分子和它在镜中的像,就如同人的左手和右手,相似而不完全相同,即它们不能重叠。
2.手性分子 具有手性的分子。一个手性分子和它的镜像分子构成一对异构体,分别用D和L标记。
3.手性碳原子
四个不同的原子或原子团连接的碳原子。
4.应用
(1)手性分子缩合制蛋白质和核酸。
(2)分析药物有效成分异构体的活性和毒副作用。
(3)药物的不对称合成。
分子中含几个手性碳原子。
【提示】 2个。
[核心·突破]
1.对称轴:以通过两个碳原子的连线为轴线旋转120°或240°时,分子完全恢复原状,我们称这条连线为对称轴。
2.对称面:如甲烷分子,通过与碳原子相连的两个氢原子所构成的平面,分子被分割成相同的两部分,我们称这个平面为对称面。
3.碳原子形成双键或叁键时不是手性碳原子,手性碳原子和非手性碳原子可以通过化学反应相互转化。
4.含有手性碳原子的分子是手性分子。
[题组·冲关]
1.下列分子为手性分子的是( )
A.CH2Cl2 B.
C. D.CH3CH2COOCH2CH3
【解析】 B项乳酸分子的中间碳原子连—CH3、—H、—OH、—COOH四种不同的原子和原子团,为手性分子。 【答案】 B
教育资料基础课时1 原子结构与性质
1.[2015·课标Ⅰ,37(1)]碳及其化合物广泛存在于自然界中。回答下列问题:
处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。在基态14C原子中,核外存在________对自旋相反的电子。
解析电子在原子核外出现的频率密度分布通常用电子云来形象化描述。146C的电子排布
图为,所以其基态原子中核外存在2对自旋相反的电子。答案电子云2 2.[2015·福建理综31(1)(3)①](1)CH4和CO2所含的三种元素电负性从小到大的顺序为
___________________________________________________________。(2)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
基态Ni原子的电子排布式为________,该元素位于元素周期表的第________族。答案(1)H、C、O (2)[Ar]3d84s2Ⅷ
3.[2015·江苏化学,31A(1)]Cr3+基态核外电子排布式为________;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
答案1s22s22p63s23p63d3(或[Ar]3d3) O
4.(2015·上海化学,26)Mg原子核外电子排布式为________;Ca原子最外层电子的能量________Mg原子最外层电子的能量。(选填“低于”、“高于”或“等于”)。
答案1s22s22p63s2(或[Ne]3s2) 高于5.[2015·安徽理综,25(3)节选]原子半径:Al________Si,电负性:N________O(用“>”
或“<”填空)。答案><
6.[2014·新课标全国卷Ⅰ,37(2)]基态Fe原子有________个未成对电子。Fe3+的电子排布式为________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。
单元检测十四 物质结构与性质
一、选择题(本题包括15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.下列各项叙述正确的是( )
A.N、P、As的电负性随原子序数的增大而增大
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:
2.下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的15的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
3.下列关于元素第一电离能的说法不正确的是( )
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
C.最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D.对于同一元素而言,原子的电离能I1<I2<I3<…
4.对于短周期元素形成的各分子,下表所述的对应关系错误的是( )
选项 A B C D
分子式 CH4 NH3 CO2 SCl2
VSEPR模型名称 正四面体形 四面体形 直线形 四面体形
分子的空间结构名称 正四面体形 平面三角形 直线形 V形
5.已知各种硝基苯酚的性质如下表:
名称 结构式 25 ℃,水中溶解度/g 熔点/℃ 沸点/℃ 邻硝基苯酚
0.2 45 100
间硝基苯酚
1.4 96 194
对硝基苯酚
1.7 114 295
下列关于各种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另两种硝基苯酚
2023届高考化学一轮专题训练——物质结构与性质
1.(2022·安徽师范大学附属中学模拟预测)钴的化合物在工业生产、生命科技等行业有重要应用。
(1)基态钴原子的价电子排布式为____,Co的第四电离能比Fe的第四电离能要小得多,原因是____。Co与Ca属于同一周期,且最外层电子数相同,但金属Co的熔点、沸点均比金属Ca的高,原因是____。
(2)以无水乙醇作溶剂,Co(NO3)2可与某多齿配体结合形成具有催化活性的配合物,其结构简式如图所示。
①该多齿配体中所含元素(除氢以外)第一电离能由大到小的顺序为____(填元素符号)。
②下列化合物与上述配合物中C和N原子的杂化类型均相同的是____(填标号)。
A. B. C. D.
(3)[Co(NO3)4]2-中Co2+的配位数为4,1mol该配离子中含σ键数目为____NA,配体中与钴进行配位的原子是____,原因是____。
(4)稀土钴系(Sm—Co)永磁合金的六方晶胞结构如图所示(晶体结构可看成如图(a)、(b)两种原子层交替堆积排列而成图(c))。已知同一原子层的Sm—Sm的最近距离为apm,不同原子层间的Sm—Sm最近距离为bpm。
①Sm—Co永磁合金的化学式为____。
②已知阿伏加德罗常数的值为NA,则该合金的密度ρ为____g·cm-3。(只要求列出计算式)
2.(2022·山东潍坊·模拟预测)硼单质及其化合物在生产生活中应用广泛。
(1)离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物,被认为是21世纪理想的绿色溶剂。氯代1丁基3甲基咪唑离子液([bmim]Cl)可以与44NHBF发生离子交换反应合成离子液体4[bmim]BF,如下图所示:
①第二周期中第一电离能介于B与N之间的元素为___________(写元素符号);44NHBF中N原子的杂化方式为___________,-4BF的立体构型为___________。
() 集各地最新资料精华 按“教材目录、知识体系”编排
集全国化学资料精华,按“四套教材(旧人教版、新课标人教版、苏教版、鲁科版)目录、知识体系”编排。资源丰富,更新及时。欢迎上传下载。 第1页 【化学】2010届一轮复习:《物质结构与性质》全册教案
(新人教版选修3)
第一章 原子结构与性质
第二章 分子结构与性质
第三章
晶体结构与性质
一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.
1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.
电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.
原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.
例1.下列关于氢原子电子云图的说法正确的是(B)
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对运动无规律性的描述
例2.下列有关认识正确的是(A)
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n -1
D.各能层含有的电子数为2n2
2.(构造原理)
了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布.
(1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.
(2).原子核外电子排布原理. () 集各地最新资料精华 按“教材目录、知识体系”编排
集全国化学资料精华,按“四套教材(旧人教版、新课标人教版、苏教版、鲁科版)目录、知识体系”编排。资源丰富,更新及时。欢迎上传下载。 第2页 ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.
②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.
③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.
洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.
(3).掌握能级交错图和1-36号元素的核外电子排布式.
①根据构造原理,基态原子核外电子的排布遵循图⑪箭头所示的顺序。
②根据构造原理,可以将各能级按能量的差异分成能级组如图⑫所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。
例3.表示一个原子在第三电子层上有10个电子可以写成(C)
A.310 B.3d10 C.3s23p63d2 D. 3s23p64s2
例4.下列电子排布中,原子处于激发状态的是(BC)
A.1s22s22p5 B. 1s22s22p43s2
C. 1s22s22p63s23p63d44s2 D. 1s22s22p63s23p63d34s2
例5.下列关于价电子构型为3s23p4的粒子描述正确的是(B)
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其电子排布图为:
1s 2s 2p 3s 3p
例6.按所示格式填写下表有序号的表格:
原子序数 电子排布式 价层电子排布 周期 族
17 ① ② ③ ④
⑤ 1s22s22p6 ⑥ ⑦ ⑧
⑨ ⑩ 3d54s1 ⑾ ⅥB
答案 ①.1s22s22p63s23p5 ②.3s23p5 ③.3 ④.ⅦA ⑤.10 ⑥.2s22p6 () 集各地最新资料精华 按“教材目录、知识体系”编排
集全国化学资料精华,按“四套教材(旧人教版、新课标人教版、苏教版、鲁科版)目录、知识体系”编排。资源丰富,更新及时。欢迎上传下载。 第3页 ⑦.2 ⑧.0 ⑨.24 ⑩.1s22s22p63s23p63d54s1
⑾.4
例7.(1).砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于__________
周期 族;最高价氧化物的化学式为 ,砷酸钠的化学式是 .
(2).已知下列元素在周期表中的位置,写出它们最外层电子构型和元素符号:
①.第4周期ⅣB族 ;
②.第5周期ⅦA族 .
答案 (1).4 ⅤA As2O5 Na3AsO4
(2).①.3d24s2 Ti ②.5S25p5 I
3.元素电离能和元素电负性
第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。
(1).原子核外电子排布的周期性.
随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化.
(2).元素第一电离能的周期性变化.
随着原子序数的递增,元素的第一电离能呈周期性变化:
★同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小;
★同主族从上到下,第一电离能有逐渐减小的趋势.
说明:
①同周期元素,从左往右第一电离能呈增大趋势。电子亚层结构为全满、半满时较相邻元素要大即第 ⅡA 族、第 ⅤA 族元素的第一电离能分别大于同周期相邻元素。Be、N、Mg、P
②.元素第一电离能的运用:
a.电离能是原子核外电子分层排布的实验验证.
b.用来比较元素的金属性的强弱. I1越小,金属性越强,表征原子失电子能力强弱.
() 集各地最新资料精华 按“教材目录、知识体系”编排
集全国化学资料精华,按“四套教材(旧人教版、新课标人教版、苏教版、鲁科版)目录、知识体系”编排。资源丰富,更新及时。欢迎上传下载。 第4页 (3).元素电负性的周期性变化.
元素的电负性:元素的原子在分子中吸引电子对的能力叫做该元素的电负性。
随着原子序数的递增,元素的电负性呈周期性变化:同周期从左到右,主族元素电负性逐渐增大;同一主族从上到下,元素电负性呈现减小的趋势.
电负性的运用:
a.确定元素类型(一般>1.8,非金属元素;<1.8,金属元素).
b.确定化学键类型(两元素电负性差值>1.7,离子键;<1.7,共价键).
c.判断元素价态正负(电负性大的为负价,小的为正价).
d.电负性是判断金属性和非金属性强弱的重要参数(表征原子得电子能力强弱).
例8.下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是(A)
A.K、Na、Li B.N、O、C C.Cl、S、P D.Al、Mg、Na
例9.已知X、Y元素同周期,且电负性X>Y,下列说法错误..的是(C)
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
例10.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)„„下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据.
元素 I1/eV I2/eV I3/eV
甲 5.7 47.4 71.8
乙 7.7 15.1 80.3
丙 13.0 23.9 40.0
丁 15.7 27.6 40.7
下列说法正确的是(AC)
A.甲的金属性比乙强 B.乙的化合价为+1价
C.丙一定为非金属元素 D.丁一定是金属元素
例11.在下面的电子结构中,第一电离能最小的原子可能是 (C)
A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np6
例12.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.下图是部分元素原子的第一电离能I1随原子序数变化的曲线图. () 集各地最新资料精华 按“教材目录、知识体系”编排
集全国化学资料精华,按“四套教材(旧人教版、新课标人教版、苏教版、鲁科版)目录、知识体系”编排。资源丰富,更新及时。欢迎上传下载。 第5页
请回答以下问题:
(1).认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像.
(2).从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3).上图中5号元素在周期表中的位置是________________________________________;
(4).上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:__________________________________.
答案 (1).见上图(右) (2).从上到下依次减小
(3).第三周期,ⅤA族
(4).因同主族上一周期的元素的氢化物分子间存在氢键
例13.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
元素符号 Li Be B C O F Na Al Si P S
Cl
x 值 0.98 1.57 2.04 2.55 3.44 3.98 0.93 1.61 1.90 2.19 2.58
3.16
⑪.通过分析 x 值变化规律,确定N、Mg的 x 值范围:
<x (N)< , <x (Mg)< .
⑫.推测x值与原子半径的关系是 ;根据短周期元素的x值变化特点,体现了元素性质的 变化规律.
⑬.某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称).