11全国高中化学竞赛试题及评分标准4
- 格式:doc
- 大小:856.00 KB
- 文档页数:11

2011年湖北省高中化学竞赛初赛试题考试限时:150分钟试卷满分:150分(1)允许使用非编程计算器及直尺等文具。
迟到半小时不得进场,开始考试后1小时内不得离场。
(2)考号、姓名、年级和所属学校等必须写在首页左侧指定的位置,否则作废卷论处。
(3)时间到,把试卷对折整齐,背面朝上放在桌面上,立即离开考场。
第I卷(选择题,共70分)一、(本题包括14小题,每小题5分,共70分。
每小题可能有1或2个选项符合题意,若有2个正确选项,只选1个且正确给2分,多选、错选都给0分。
请将答案填写在第I卷答题表中)第Ⅰ卷答题表1.第63届联大通过决议,将2011年定为“国际化学年”(International Year of Chemistry),以纪念化学学科所取得的成就以及对人类文明的贡献。
联合国教科文组织及国际纯粹与应用化学联合会(IUPAC)负责主导这一年的纪念活动。
国际化学年的主题是()A.“化学,改变世界的创新”B.“化学,我们的生活、我们的未来”C.“化学,改变今天的世界,创造未来的生活”D.“化学照耀世界”2. 直接测定同素异形体相互转化的反应热是很困难的。
盖斯定律指出:“不管化学过程是一步完成还是分几步完成,其总过程的热效应是相同的”。
已知:P4(固、白磷)+5O2(g)=P4O10(s)(每摩尔白磷按照上述方程式完全燃烧放出2983.2kJ 热)P(固、红磷)+5/4O2(g)=1/4P4O10(s)(每摩尔红磷按照上述方程式完全燃烧放出738.5kJ热)那么,1mol白磷转变成相应物质量的红磷时,应是()A. 放出29.2kJ热量B. 吸收29.2kJ热量C. 放出2244.7kJ热量D. 吸收2244.7kJ热量3. 下列关于下图中结构的叙述,正确的是()A. 此图结构是依ABCABC……的重复顺序堆积B. 此图结构属于面心立方排列C. 此图结构属于六方最密堆积D. X与Y原子可属于相同的层4. 下列各反应中,不生成醇类产物的有哪些()A. 2-甲基-2-溴丙烷与水反应B. 在酸性条件下2-戊烯与水的作用C. 丙醛与土伦试剂反应D. 利用镍金属催化丁酮与氢气的反应5.运用元素周期律分析下面的推断,其中错误的是( )A.铍(Be)的氧化物的水化物可能具有两性B.砹(At)为有色固体,HAt不稳定,AgAt感光性很强,不溶于水,可溶于稀硝酸C.硫酸锶(SrSO4)是难溶于水的白色固体D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体6. 化学式为C7H7Br的芳香族化合物,共有几种异构物()A. 3种B. 4种C. 5种D. 6种7.4种化合物:①CH3—CH2—CH2—COOH,②CH3—CH2—CHOH—COOH ,③CH3—CHOH—CH2—COOH ,④CH3—CH2—CO—COOH ,酸性由强至弱的顺序是()A.①>②>③>④B.④>③>②>①C.④>②>③>①D.②>③>④>①8.1-甲基环己烯与溴化氢发生加成反应的主产物是()A.溴甲基环己烷B.1-甲基-1-溴环己烷C.1-甲基-2-溴环己烷D.1-甲基-3-溴环己烷9.分子式为C6H12的同分异构体中,能与溴化氢加成生成2-溴-4-甲基戊烷的环烷烃是()A.环己烷B.甲基环戊烷C.1,2-二甲基环丁烷D.1,3-二甲基环丁烷10. 制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油,②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并密封冷却,④加入少量铁屑,⑤加入少量CCl4,⑥向FeSO4溶液中滴入足量氨水,⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。

中国化学会 全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2COO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H 或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2- (1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
1-3 Na 2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na 2[Fe(CN)5(NO)]是鉴定S 2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
Fe(II) 答II 或+2也可 (2分)[Fe(CN)5(NO)]2-+S 2- = [Fe(CN)5(NOS)]4- 配合物电荷错误不得分 (1分)1-4 CaSO 4 • 2H 2O 微溶于水,但在HNO 3 ( 1 mol L -1)、HClO 4 ( 1 mol L -1)中可溶。

中国化学会第24届全国高中学生化学竞赛(省级赛区)评分通则1.凡要求计算或推导的, 必须示出计算或推导过程。
没有计算或推导过程, 即使结果正确也不得分。
2.有效数字错误, 扣0.5分, 但每一大题只扣1次。
3.单位不写或表达错误, 扣0.5分, 但每一大题只扣1次。
4.只要求1个答案、而给出多个答案,其中有错误的, 不得分。
5.方程式(不是反应式!)不配平不得分。
6.用铅笔解答(包括作图)无效。
7.使用涂改液涂改的解答无效。
8.不包括在标准答案的0.5分的题, 可由省、市、自治区评分组讨论决定是否给分。
9.答案中红色字为标准答案, 而蓝字体(加下划线)为注释语不属于答案。
气体常数R=8.31447 J K-1 mol-1 法拉第常数F=96485 C mol-1 阿佛加德罗常数N A=6.022142×1023 mol-1F F F FFI[(C 6H 5)IF 5] sp 3d 3(1分) 其他答案不得分。
sp 3d (1分) 其他答案不得分。
sp 3(1分) 其他答案不得分。
(3分)1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体, 其中之一可用如下简式表示。
请依样画出其他所有八面体构型的异构体。
OOCl BrN NClBr NOON ClBr ONN ON BrClOO N N BrClOON OBrClN NO OBrCl NN OO BrClON N OBrClON N N BrClN OO NBrClNO O每式1分。
正确画出5个几何异构体, 未画对映体但指明都有对映异构体, 各得1.5分。
(10分)每式1分。
正确画出5个几何异构体,未画对映体但指明都有对映异构体,各得1.5分。
(10分)第2题 (5 分) 最近我国有人报道, 将0.1 mol L 1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里, 将蛋壳开口朝上, 部分浸入盛有0.1 mol L 1的氯化铜溶液的烧杯中, 在静置一周的过程中, 蛋壳外表面逐渐出现金属铜, 同时烧杯2-1设此装置中发生的是铜离子和硫离子直接相遇的反应, 已知φӨ(Cu2+/Cu)和φӨ(S/S2)分别为0.345 V和(0.476 V, nFEӨ=RTlnK, EӨ表示反应的标准电动势, n为该反应得失电子数。

2011年福建省高中学生化学竞赛预赛试题答案及评分标准第1题(11分) 1-1 (5分)黄丹粉Pb 3O 4 或者 2PbO ·PbO 2 (1分)检验:将松花蛋粉碎,加入稀HNO 3搅拌充分反应(也可加入浓HCl 加热充分反应),用稀碱调节pH 值到弱酸性,静置取上层清液,离心分离后,取出2滴清液,加入1滴稀HAc 酸化,加入0.1mol ·L -1 K 2CrO 4溶液,如有黄色沉淀,则示有铅。
(4分)【评分要点:加酸(稀HNO 3或浓HCl ) 1分, 调节pH 值 0.5分;稀HAc 酸化 0.5分,K 2CrO 4溶液 1分,黄色沉淀 1分 】 1-2 (6分)Pb 不易溶于稀HCl 、稀H 2SO 4 (1分) 因为反应的产物是微溶的PbCl 2和难溶的PbSO 4,阻止了反应的进行。
(2分) Pb 可溶热浓H 2SO 4、浓HCl 中。
(1分)Pb + 3 H 2SO 4(浓) == Pb(HSO 4)2+ SO 2↑+ 2 H 2O (1分)Pb + 4 HCl(浓) === H 2[PbCl 4] + H 2↑ (1分)第2题(8分) 2-1 (2分)第二种方法制得的NO 纯。
(1分) 因为先将NaNO 2酸化,可能发生下列反应:2 NO 2+2 H +NO + NO 2 + H 2O , 使 NO 中混有 NO 2 。
(1分)2-2 (2分)FeSO 4 + NO = [ Fe(NO)]SO 4 (2分) 2-3 (4分)N 处于第二周期,缺乏合适的空轨道接受水中氧的孤对电子,不能形成五配位的中间态。
因此,水分子负端攻击的是配位卤素原子,Cl 原子有空的d 轨道接受水分子中氧的孤对电子生成配位键,而F 原子则不能。
(2分)△△另一方面由于NF 3中F 的电负性特别大,N 上的孤对电子给予性弱于NCl 3,NCl 3中N 上的孤对电子可与H 2O 中的H 生成氢键。
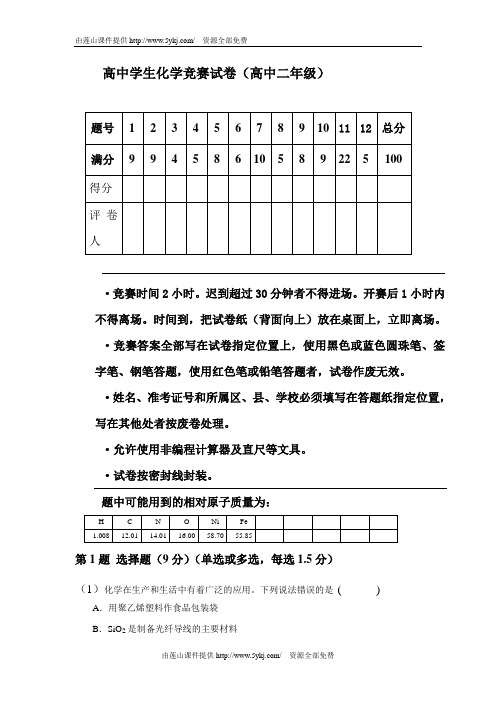
高中学生化学竞赛试卷(高中二年级)题号 1 2 3 4 5 6 7 8 9 10 11 12 总分满分9 9 4 5 8 6 10 5 8 9 22 5 100得分评卷人·竞赛时间2小时。
迟到超过30分钟者不得进场。
开赛后1小时内不得离场。
时间到,把试卷纸(背面向上)放在桌面上,立即离场。
·竞赛答案全部写在试卷指定位置上,使用黑色或蓝色圆珠笔、签字笔、钢笔答题,使用红色笔或铅笔答题者,试卷作废无效。
·姓名、准考证号和所属区、县、学校必须填写在答题纸指定位置,写在其他处者按废卷处理。
·允许使用非编程计算器及直尺等文具。
·试卷按密封线封装。
题中可能用到的相对原子质量为:H C N O Ni Fe1.008 12.01 14.01 16.00 58.70 55.85第1题选择题(9分)(单选或多选,每选1.5分)(1)化学在生产和生活中有着广泛的应用。
下列说法错误的是( ) A.用聚乙烯塑料作食品包装袋B.SiO2是制备光纤导线的主要材料C.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以延长货架期D.民间用明矾作净水剂除去水中的悬浮物(2)下列离子方程式正确的是( ) A.向NH4HSO4溶液中滴加少量的Ba(OH)2溶液Ba2++2OH-+NH4++H+== BaSO4↓+NH3·H2O+H2O B.向漂白粉溶液中通入过量的SO2气体ClO-+SO2+H2O== HSO3-+HClOC.向偏铝酸钠溶液中通入CO2气体AlO2-+CO2+2H2O== Al(OH)3↓+HCO3-D.海水中的Fe2+在铁细菌的催化下被氧化成Fe2O34Fe2++8OH-+CO2==2Fe2O3+HCHO+3H2O(3)已知:N2(g)+3H2(g)2NH3(g) △H = -92.4 kJ·mol-1,在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:容器实验1 实验2实验3反应物投入量始态1mol N2、3molH22mol NH34mol NH3NH3的平衡浓度/mol·L-1c l c2c3反应的能量变化放出a kJ 吸收b kJ 吸收c kJ体系压强( Pa) p1p2p 3反应物转化率α1α2α3下列说法正确的是()A.2 c l > c3B.a + b = 92.4C.2 p2 < p3D.(α1 + α3)< 1(4)下列溶液中微粒的物质的量浓度关系正确的是( ) A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)B.25℃时,pH =4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(CHCOO-)+c(H+)<c(Na+)+c(OH-)D.0.1 mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:3 (CO32-)+3 (HCO3-)+3 (H2CO3)=2 (Na+)(5)现有3.5t质量分数为70%的硫酸和2.5t含杂质20%的烧碱(杂质不参加反应),足量的铝屑。

全国化学高中竞赛初赛试题与答案注意:本文提供的全部试题及答案系虚构,仅供参考,如有雷同,纯属巧合。
一、选择题(每题4分,共40分)1. 下面哪种化合物能够导电?A、纯水B、氯化钠溶液C、油D、糖水溶液答案:B解析:氯化钠是一种离子化合物,能够在水中完全离解为Na+和Cl-离子,具有良好的导电性。
2. 以下哪种因素不影响化学反应速率?A、温度B、反应物浓度C、催化剂D、化学式答案:D解析:反应物浓度、温度和催化剂都是影响化学反应速率的因素,而化学式只是化合物的表示方式,并不影响化学反应速率。
3. 下列哪种物质能与酸做反应,生成氢气?A、铁B、氢氧化钠C、氯化钠D、氧气答案:A解析:铁可以和酸做反应,生成氢气。
例如,铁和盐酸的反应式为Fe + 2HCl → FeCl2 + H2。
4. 下列哪种物质是一种卤素?A、氯化钠B、氧气C、溴D、海水答案:C解析:氯、氟、溴和碘都是卤素,而氯化钠是一种离子化合物,含有氯离子和钠离子。
氧气是一种气体,不是卤素。
5. 下列哪种化学反应不是氧化还原反应?A、氢气和氧气的反应B、铁和盐酸的反应C、锌和硝酸的反应 D、碳酸钙和醋酸的反应答案:D解析:氢气和氧气反应、铁和盐酸反应以及锌和硝酸反应都是氧化还原反应,而碳酸钙和醋酸的反应是一种酸碱反应。
6. 下列哪种物质是一种单质?A、氢氧化钠B、氯化钠C、金属铁D、碳酸钙答案:C解析:单质是指由同一种元素组成的化合物,金属铁是一种单质。
氢氧化钠、氯化钠和碳酸钙都是化合物。
7. 下列哪种元素不属于金属?A、铁B、铜C、氧D、锌答案:C解析:氧是一个非金属元素,铁、铜和锌都是金属元素。
8. 下列哪种物质是一种弱酸?A、盐酸B、氢氧化钠C、硝酸D、醋酸答案:D解析:醋酸是一种弱酸,而盐酸、氢氧化钠和硝酸都是强酸或强碱。
9. 下列哪种物质不是一种盐?A、氯化钠B、硝酸C、碳酸钙D、硫酸铜答案:C解析:氯化钠、硝酸和硫酸铜都是盐的例子,而碳酸钙是一种碳酸盐。
评分通则1.凡要求计算或推导的,必须示出计算或推导过程。
没有计算或推导过程,即使结果正确也不得分。
2.有效数字错误,扣0.5分,但每一大题只扣1次。
3.单位不写或表达错误,扣0.5分,但每一大题只扣1次。
4.只要求1个答案、而给出多个答案,其中有错误的,不得分。
5.方程式(不是反应式!)不配平不得分。
6.用铅笔解答(包括作图)无效。
7.使用涂改液涂改的解答无效。
8.不包括在标准答案的0.5分的题,可由省、市、自治区评分组讨论决定是否给分。
9.答案中红色字为标准答案,而蓝字体(加下划线)为注释语不属于答案。
气体常数R =8.31447 J K -1 mol -1 法拉第常数F =96485 C mol -1 阿佛加德罗常数N A =6.022142×1023 mol -1第1题 (15分)1-1 2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。
117号元素是用249Bk 轰击48Ca 靶合成的,总共得到6个117号元素的原子,其中1个原子经p 次α衰变得到270Db 后发生裂变;5个原子则经q 次α衰变得到281Rg 后发生裂变。
用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角每式1分,画箭头也得 1分。
两式合并为 23n +Uns 5+Uns =Bk 6+Ca 629397294117249974820也得满分。
(2分)(3分)1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如第2题(5 分)最近我国有人报道,将0.1 mol L-1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol L-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。
2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu2+/Cu)和φӨ(S/S2-)分别为0.345 V和-0.476 V,nFEӨ=RT ln K,EӨ表示反应的标准电动势,n为该反应得失电子数。
高中化学竞赛试题及答案一、选择题(每题2分,共40分)1. 以下哪种元素的原子序数为11?A. 碳(C)B. 钠(Na)C. 镁(Mg)D. 铝(Al)2. 以下哪个化合物的化学式为HCl?A. 氢氧化钠B. 氯化氢C. 硫酸D. 碳酸3. 根据元素周期律,原子半径从左到右在周期表中逐渐减小。
以下哪个元素的原子半径最大?A. 氢(H)B. 锂(Li)C. 钠(Na)D. 钾(K)4. 以下哪个反应是氧化还原反应?A. 2H2O → 2H2 + O2B. CaO + H2O → Ca(OH)2C. 2NaOH + H2SO4 → Na2SO4 + 2H2OD. CH4 + 2O2 → CO2 + 2H2O5. 以下哪个化合物是共价化合物?A. NaClB. MgOC. H2OD. Fe3O46. 以下哪种物质是强碱?A. 氢氧化钠(NaOH)B. 碳酸氢钠(NaHCO3)C. 氢氧化铵(NH4OH)D. 硼酸(H3BO3)7. 以下哪个反应是酸碱中和反应?A. 2HCl + Zn → ZnCl2 + H2B. 2H2O + 2e- → H2 + 2OH-C. H2SO4 + 2NaOH → Na2SO4 + 2H2OD. 2H2S + 3O2 → 2SO2 + 2H2O8. 以下哪种物质是酸?A. 碳酸钙(CaCO3)B. 硫酸(H2SO4)C. 氢氧化钠(NaOH)D. 硝酸铵(NH4NO3)9. 以下哪个化合物是离子化合物?A. 氢气(H2)B. 氧气(O2)C. 氯化钠(NaCl)D. 二氧化碳(CO2)10. 以下哪种元素的原子最外层电子数为8?A. 氦(He)B. 氧(O)C. 氟(F)D. 氖(Ne)答案:1. B2. B3. D4. D5. C6. A7. C8. B9. C10. D二、填空题(每空1分,共30分)11. 元素周期表中,第______周期的元素被称为过渡金属元素。
答案:412. 根据化学键的类型,水(H2O)分子中的化学键是______键。
评分通则1.凡要求计算的,须给出计算过程。
无计算过程,即使结果正确也不得分。
2.有效数字错误,扣0.5分,但每一大题只扣1次。
3.单位不写或表达错误,扣0.5分,但每一大题只扣1次。
4. 只要求1个答案、而给出多个答案, 其中有错误的,不得分。
5. 方程式不配平不得分。
6. 用铅笔解答的部分(包括作图)无效。
7. 禁用涂改液和修正带。
否则,整个答卷无效。
8. 不包括在标准答案的0.5分的题,可由省、市、自治区评判组集体讨论决定是否给分。
9. 参赛者信息须写于试卷首页左侧指定位置,写于其他位置者按废卷论处。
第1题(15分)1-1 2011年是国际化学年,是居里夫人获得诺贝尔化学奖100周年。
居里夫人发现的两种化学元素的元素符号和中文名称分别是 Ra ,镭 和 Po , 钋 。
0.5分×4=2分 1-2 向TiOSO 4水溶液中加入锌粒,反应后溶液变为紫色。
在清液中滴加适量的CuCl 2水溶液,产生白色沉淀。
生成白色沉淀的离子方程式是Ti 3++Cu 2++Cl -+ H 2O =TiO 2+ + CuCl ↓ +2H +;1分 继续滴加CuCl 2水溶液,白色沉淀消失,其离子方程式是 CuCl + Cl - =CuCl 2- 。
1分第一个离子方程式中,CuCl ↓ 未加箭头不扣分第二个离子方程式, 写成 CuCl + 2Cl - = CuCl 32-, 不扣分在第一个离子方程式中写Ti 3+(aq )等也可1-3 20世纪60年代维也纳大学V. Gutmann 研究小组报道, 三原子分子A 可由SF 4和NH 3反应合成;A 被AgF 2氧化得到沸点为27o C 的三元化合物B 。
A 和B 分子中的中心原子与同种端位原子的核间距几乎相等;B 分子有一根三重轴和3个镜面。
画出A 和B 的结构式(明确示出单键和重键,不在纸面上的键用楔形键表示,非键合电子不必标出)。
2分×2=4分A 图画成直线形不得分写成正确的共振式也得分1-4 画出Al 2(n-C 4H 9)4H 2和Mg[Al(CH 3)4]2的结构简式。
中国化学会 全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2COO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H 或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2- (1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
1-3 Na 2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na 2[Fe(CN)5(NO)]是鉴定S 2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
Fe(II) 答II 或+2也可 (2分)[Fe(CN)5(NO)]2-+S 2- = [Fe(CN)5(NOS)]4- 配合物电荷错误不得分 (1分)1-4 CaSO 4 • 2H 2O 微溶于水,但在HNO 3 ( 1 mol L -1)、HClO 4 ( 1 mol L -1)中可溶。
写出能够解释CaSO 4在酸中溶解的反应方程式。
CaSO 4 + H + = Ca 2+ + HSO 4- (1分)写成 2CaSO 4 + 2HNO 3 = Ca(NO 3)2 + Ca(HSO 4)2 也得分。
高氯酸同。
答案若生成H 2SO 4 不得分。
1-5 取质量相等的2份PbSO 4 (难溶物)粉末,分别加入HNO 3 ( 3 mol L -1) 和HClO 4 ( 3 molL -1),充分混合,PbSO 4在HNO 3 能全溶,而在HClO 4中不能全溶。
简要解释PbSO 4在HNO 3中溶解的原因。
Pb 2+与NO 3-形成络离子(配离子或配合物)。
(1分)写方程式也可,如PbSO 4 + H + + NO 3- = HSO 4- + Pb(NO 3)+。
若将络离子(配离子或配合物)写成Pb(NO 3)2或Pb(NO 3)3-也得分,但方程式须配平。
1-6 X 和Y 在周期表中相邻。
CaCO 3与X 的单质高温反应,生成化合物B 和一种气态氧化物;B 与Y 的单质反应生成化合物C 和X 的单质;B 水解生成D ;C 水解生成E ,E 水解生成尿素。
确定B 、C 、D 、E 、X 和Y 。
B: CaC 2 C: CaCN 2 D: C 2H 2 或Ca(OH) 2 E: NH 2CN [C(NH)2也可]X: C Y: N(各0.5分,共3分)第2题 (5分) 化合物X 是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300万吨的氯酸钠是生产X 的原料,92%用于生产X —在酸性水溶液中用盐酸、二氧化硫或草酸还原。
此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产X 。
X 有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应。
2-1 写出X 的分子式和共轭π键(m n π)。
ClO 2 53π (各1分,共2分)2-2 分别写出上述用草酸还原和用氯气氧化生产X 的反应方程式。
2ClO 3- + H 2C 2O 4 + 2H + = 2ClO 2 + 2CO 2 + 2H 2O (1分)或 2NaClO 3 + H 2C 2O 4 + H 2SO 4 = 2ClO 2 + 2CO 2 + Na 2SO 4 + 2H 2O2NaClO 2 + Cl 2 = 2ClO 2 + 2NaCl (1分)NaClO 2是固体,写成ClO 2-,不得分。
2-3 写出上述X 歧化反应的化学方程式。
2ClO 2 + 2NaOH = NaClO 2 + NaClO 3 + H 2O (1分)或 2ClO 2 + 2OH - = ClO 2- + ClO 3- + H 2O第3题 (4分) 甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下: CH 3CH 2O(g) + H 2(g) m r H ∆= 84.2 kJ mol -1 (1) 向体系中通入空气,通过以下反应提供反应(1) 所需热量:H 2(g) + ½O 2(g) H 2O(g) mr H ∆=–241.8 kJ mol -1 (2) 要使反应温度维持在700˚C ,计算进料中甲醇与空气的摩尔数之比。
已知空气中氧气的体积分数为0.20。
要使反应维持在一定温度持续进行,应保证反应(2)放出的热量恰好被反应(1) 全部利用,则:甲醇与氧气的摩尔比为:n (CH 3OH) : n (O 2) = (2 ⨯ 241.8) / 84.2 = 5.74 (2分)甲醇与空气的摩尔比为:n (CH 3OH) : n (空气) = 5.74 / 5 = 1.1 (2分)答成1.15或1.148得1.5分。
答(写)成1 : 0.87也得2分。
考虑到实际情况,将上式的等号写成小于或小于等于,得2分。
算式合理,结果错误,只得1分。
只有结果没有计算过程不得分。
第4题 (10分) (CN)2被称为拟卤素,它的阴离子CN - 作为配体形成的配合物有重要用途。
4-1 HgCl 2 和Hg(CN)2反应可制得 (CN)2, 写出反应方程式。
HgCl 2 + Hg(CN)2 = Hg 2Cl 2 + (CN)2 (1分)4-2 画出CN -、(CN)2的路易斯结构式。
C N -[] C C (各1分,共2分)短线画成电子对同样得分;不画孤对电子不得分。
4-3 写出(CN)2 (g) 在O 2 (g) 中燃烧的反应方程式。
(CN)2(g) + 2O 2(g) = 2CO 2(g) + N 2(g) (1分)不标物态也可。
4-4 298 K 下,(CN)2 (g) 的标准摩尔燃烧热为 -1095 kJ mol -1,C 2H 2 (g) 的标准摩尔燃烧热为 -1300 kJ mol -1,C 2H 2 (g) 的标准摩尔生成焓为227 kJ mol -1,H 2O (l) 的标准摩尔生成焓为 -286 kJ mol -1,计算 (CN)2 (g) 的标准摩尔生成焓。
(CN)2(g) + 2O 2(g) = 2CO 2(g) + N 2(g)2Δf H m (CO 2) -Δf H m [(CN)2] = -1095 kJ mol -12Δf H m (CO 2) = -1095 kJ mol -1 +Δf H m [(CN)2]C 2H 2(g) + 2.5O 2(g) = 2CO 2(g) + H 2O(l)2Δf H m (CO 2) +Δf H m (H 2O) - Δf H m (C 2H 2) = -1300 kJ mol -12Δf H m (CO 2) = -1300 kJ mol -1 + 286kJ mol -1 + 227 kJ mol -1Δf H m [(CN)2] = 1095 kJ mol -1 - 1300 kJ mol -1 + 286kJ mol -1 + 227 kJ mol -1= 308 kJ mol -1 (2分)计算过程正确计算结果错误只得1分。
没有计算过程不得分。
Δf H m [(CN)2] = 1095 - 1300 + 286 + 227 = 308(kJ mol -1)也可以。
但不加括号只得1.5分。
4-5 (CN)2在300~500 o C 形成具有一维双链结构的聚合物,画出该聚合物的结构。
CCN Nn 或 C C N C C N N C C N N N (2分) 画成 N N N N N N 也得2分。
但画成N N N N N N 只得1分。
4-6 电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN -,写出化学方程式(漂白粉用ClO -表示)。
2CN - + 5ClO - + H 2O = 2HCO 3- + N 2 + 5Cl - (2分)产物中写成CO 32-, 只要配平,也得2分。
第5题 (5分) 1963年在格陵兰Ika 峡湾发现一种水合碳酸钙矿物ikaite 。
它形成于冷的海水中,温度达到8o C 即分解为方解石和水。
1994年的文献指出:该矿物晶体中的Ca 2+ 离子被氧原子包围,其中2个氧原子来自同一个碳酸根离子,其余6个氧原子来自6个水分子。
它的单斜晶胞的参数为:a = 887 pm, b = 823 pm, c = 1102 pm, β = 110.2°,密度d = 1.83 g cm -3,Z = 4。
5-1 通过计算得出这种晶体的化学式。
ikaite 晶胞体积:V = abc sin β = (8.87 ⨯ 8.23 ⨯ 11.02 ⨯ 10-24 cm 3) ⨯ sin110.2° = 7.55 ⨯ 10-22 cm 3 (0.5分)设晶胞中含有n 个水分子,晶胞的质量:m = 4 ⨯ (100 + 18 n ) / N A (g) (0.5分)晶体密度:d = m /V = 4 ⨯ (100 + 18 n ) / ( 6.02 ⨯ 1023 ⨯ 7.55 ⨯ 10-22)(g cm -3)= 1.83 g cm -3100 + 18 n = 208 n = 6 (0.5分)该晶体的化学式为 CaCO 3 ⋅ 6H 2O (0.5分)算出6个水分子,未写化学式,得1.5分。
5-2 研究了这种晶体在加压下受热膨胀体积增大的情形,并与冰及钙离子配位数也是8的二水合石膏晶体(gypsum)作了对比,结果如下图所示(纵坐标为相对体积):为什么选取冰和二水合石膏作对比?实验结果说明什么?Ikaite 在冷水中形成,而且含有大量结晶水,分解温度又接近冰的熔点,可能与冰的结构有相似性,故选取冰作参比物; (0.5分)石膏是带结晶水的钙的含氧酸盐,而且钙的配位数也是8,可能与ikaite 结构相似,故选取石膏作参比物。