氯气、氯化氢的性质与制法比较PPT教学课件
- 格式:ppt
- 大小:284.00 KB
- 文档页数:18



室制法》课件•氯气概述•实验室制取氯气原理及装置•氯气的收集与净化•氯气的检验与尾气处理•实验误差分析与改进建议•知识拓展与思考题氯气概述氯气是一种黄绿色、有刺激性气味的气体。
密度比空气大,可溶于水。
熔沸点较低,常温常压下为气态。
010204氯气是一种活泼的非金属单质,具有强氧化性。
能与多种金属直接化合生成氯化物,如与钠反应生成氯化钠。
能与多种非金属直接化合,如与氢气在光照或点燃条件下反应生成氯化氢。
能与水反应生成盐酸和次氯酸,次氯酸具有漂白性。
03氯气的用途与危害用途氯气可用于合成多种氯化物,如氯化钠、氯化钾等,是化学工业的重要原料。
此外,氯气还可用于自来水的消毒、农药的生产等。
危害氯气是一种有毒气体,对人体有害。
吸入氯气后,轻者可能引起呼吸道刺激症状,重者可能出现肺水肿、窒息等严重后果。
因此,在使用氯气时应严格遵守安全操作规程,防止泄漏和污染。
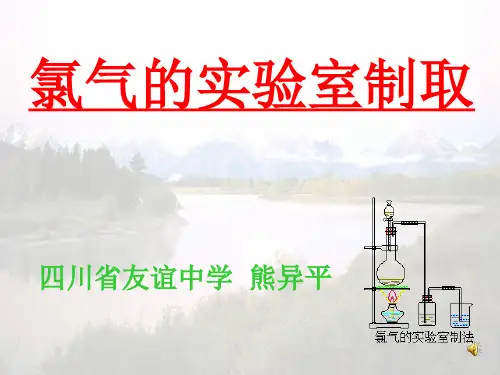
实验室制取氯气原理及装置制取原理氧化还原反应实验室制取氯气通常采用浓盐酸与强氧化剂(如二氧化锰)在加热条件下进行氧化还原反应,生成氯气、水和氯化物。
反应方程式MnO₂+4HCl(浓)=MnCl₂+Cl₂↑+2H₂O,这是一个典型的氧化还原反应,二氧化锰是氧化剂,浓盐酸是还原剂。
由圆底烧瓶、分液漏斗、酒精灯等组成,用于盛放反应物和进行加热。
发生装置收集装置尾气处理装置采用向上排空气法或排饱和食盐水法收集氯气,收集前需对气体进行干燥处理。
由于氯气有毒,需用氢氧化钠溶液进行尾气处理,防止污染环境。
030201装置组成准备工作开始反应收集气体尾气处理操作步骤01020304检查装置气密性,向圆底烧瓶中加入二氧化锰,向分液漏斗中加入浓盐酸。
打开分液漏斗活塞,将浓盐酸滴入圆底烧瓶中,同时点燃酒精灯加热。
当气体生成后,通过导管将气体引入收集装置中,进行收集。
收集完毕后,关闭分液漏斗活塞和酒精灯,将尾气通入氢氧化钠溶液中处理。
氯气的收集与净化氯气的密度比空气大,可用向上排空气法收集。






氯气和氯化氢〔一〕氯气1、氯原子构造及氯分子构造〔1〕氯原子核内有17个质子,核外有17个电子,其原子构造示意图为:。
可知氯原子最外电子层上有7个电子,且原子半径较小,在化学反响中易得到1个电子。
因此氯原子是很活泼的原子,氯元素是活泼的非金属元素。
〔2〕氯分子构造由于氯原子最外层为7个电子,通常状况下两个氯原子共用一对电子形成共价分子Cl 2。
又由于两个氯原子对电子对有一样的吸引力,所以在氯分子中共用电子对在两个氯原子正中间。
2、氯气的性质〔1〕氯气的物理性质①通常状况下是黄绿色有刺激性气味的气体,氯气有毒。
②易液化,氯气在×105 Pa 、-℃时变成液氯。
③氯气的密度比空气的密度大。
④能溶于水,常温时1体积水约能溶解2体积氯气。
〔2〕氯气的化学性质①氯气与金属的反响2Na+Cl 2===点燃2NaCl 〔白烟〕 Cu+Cl 2===点燃CuCl 2〔棕黄色烟〕2Fe+3Cl 2===点燃2FeCl 3 〔棕褐色烟〕氯气还能跟K 、Ca 、Mg 、Al 、Zn 等金属反响。
注意,氯气把Cu 、Fe 氧化到高价态。
②氯气与非金属的反响H 2+Cl 2===点燃2HCl〔纯洁的H 2在Cl 2中安静地燃烧,产生苍白色火焰,并有白雾生成。
〕H 2+Cl 2===点燃2HCl 〔H 2与Cl 2的混合气光照时爆炸,并产生白雾。
〕2P+3Cl 2===点燃2PCl 3〔液体〕PCl 3+Cl 2 == PCl 5〔固体〕2P+5Cl 2===点燃2PCl 5〔固体〕磷在氯气中燃烧时,会产生白色烟雾。
由一些金属、非金属在氯气中燃烧的实验,可知燃烧不一定有氧气参加。
一切发光、发热的剧烈的化学反响,都可以叫做燃烧。
③氯气与水的反响氯气溶于水得到黄绿色溶液——氯水。
在氯水中有一少局部Cl 2与水反响,大局部以Cl 2分子存在,所以氯水中的主要溶质是Cl 2。
Cl 2+H 2O == HCl+HClO新制的氯水中存在Cl 2、H 2O 、HClO 、H +、Cl -、ClO -、OH -等微粒。