第十一章 配位化合物和配位平衡(第一部分)
- 格式:pdf
- 大小:4.28 MB
- 文档页数:57







第十一章配位化合物11.1 基本概念 (1)11.2 化学键理论 (6)11.3 晶体场理论 (11)11.4 螯合物 (18)11.5 配位平衡 (19)11.1 基本概念11.1.1 配位化合物的基本概念前言配位化合物是一类由中心金属原子(离子)和配位体组成的化合物。
第一个配合物是1704年普鲁士人在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸钠在铁锅中强烈煮沸而得到的,即KFe[Fe(CN)6]。
配合物的形成对元素和配位体都产生很大的影响,以及配合物的独特性质,使人们对配位化学的研究更深入、广泛,它不仅是现代无机化学学科的中心课题,而且对分析化学、生物化学、催化动力学、电化学、量子化学等方面的研究都有重要的意义。
1.配位化合物的定义配合物是由中心原子(或离子)和配位体(阴离子或分子)以配位键的形式结合而成的复杂离子或分子,通常称这种复杂离子或分子为配位单元。
凡是含有配位单元的化合物都称配合物。
如:[Co(NH3)6]3+、[HgI4]2-、Ni(CO)4等复杂离子或分子,其中都含配位键,所以它们都是配位单元。
由它们组成的相应化合物则为配合物。
如:[Co(NH3)6]Cl3、k2[HgI4]、Ni(CO)411.1.2 组成2.配位化合物的组成图11-01表11-01 常见的配体表11.1.3 命名3.配位化合物的命名对于整个配合物的命名,与一般无机化合物的命名原则相同,如配合物外界酸根为简单离子,命名为某化某;如配合物外界酸根为复杂阴离子,命名为某酸某;如配合物外界为OH-,则命名为氢氧化某。
但配合物因为存在较为复杂的内界,其命名要比一般无机化合物复杂。
内界的命名顺序为:例如:11.1.4 配合物的类型4.配位化合物的类型(1).简单配位化合物简单配位化合物是指由单基配位体与中心离子配位而成的配合物。
这类配合物通常配位体较多,在溶液中逐级离解成一系列配位数不同的配离子。
例如:这种现象叫逐级离解现象。



第十一章配位化合物配位化合物简称配合物,也称络合物,是一类复杂的化合物,它的存在和应用都很广泛,生物体内的金属元素多以配合物的形式存在。
例如植物中的叶绿素是镁的配合物,植物的光合作用靠它来完成。
又如动物血液中的血红蛋白是铁的配合物,在血液中起着输送氧气的作用;动物体内的各种酶几乎都是以金属配合物形式存在的。
当今配合物广泛地渗透到分析化学、生物化学等领域。
发展成为一门独立的学科──配位化学。
本章将对配合物的基本概念、组成、性质等作一初步介绍。
§11-1 配合物的基本概念一、配合物及其组成配位化合物是一类复杂的化合物,含有复杂的配位单元。
配位单元是由中心离子(或原子)与一定数目的分子或离子以配合键结合而成的。
例如在硫酸铜溶液中加入氨水,开始时有蓝色Cu2(OH)2SO4沉淀生成,当继续加氨水过量时,蓝色沉淀溶解变成深蓝色溶液。
总反应为:CuSO4 + 4NH3ƒ[Cu(NH3)4]SO4 (深蓝色)此时在溶液中,除SO42-和[Cu(NH3)4]2+外,几乎检查不出Cu2+的存在。
再如,在HgCl2溶液中加入KI,开始形成桔黄色HgI2沉淀,继续加KI过量时,沉淀消失,变成无色的溶液。
HgCl2 + 2KI ƒHgI2↓+ 2KCl HgI2 + 2KI ƒK2[HgI4]象[Cu(NH3)4]SO4和K2[HgI4]这类较复杂的化合物就是配合物。
配合物的定义可归纳为:由一个中心离子(或原子)和几个配体(阴离子或分子)以配位键相结合形成复杂离子(或分子),通常称这种复杂离子为配离子。
由配离子组成的化合物叫配合物。
在实际工作中一般把配离子也称配合物。
经研究表明,在[Cu(NH3)4]SO4中,Cu2+占据中心位置,称中心离子(或形成体);中心离子Cu2+的周围,以配位键结合着4个NH3分子,称为配体;中心离子与配体构成配合物的内界(配离子),通常把内界写在方括号内;SO 42-被称为外界,内界与外界之间是离子键,在水中全部离解。
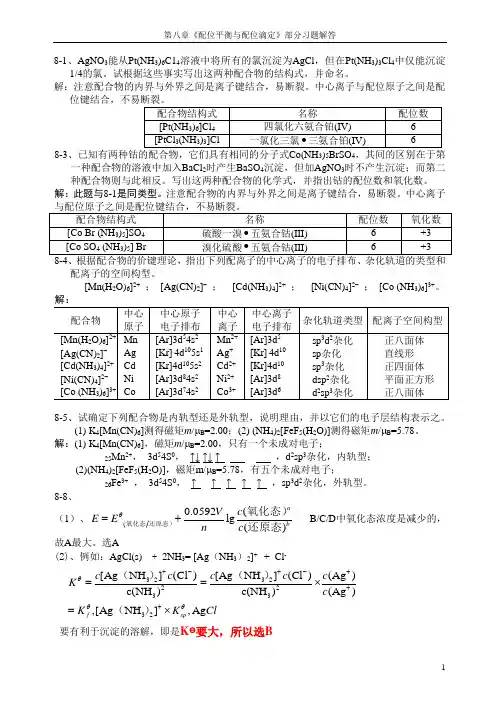
第八章《配位平衡与配位滴定》部分习题解答18-1、AgNO 3能从Pt(NH 3)6C14溶液中将所有的氯沉淀为AgCl ,但在Pt(NH 3)3Cl 4中仅能沉淀1/4的氯。
试根据这些事实写出这两种配合物的结构式,并命名。
解:注意配合物的内界与外界之间是离子键结合,易断裂。
中心离子与配位原子之间是配8-3354一种配合物的溶液中加入BaCl 2时产生BaSO 4沉淀,但加AgNO 3时不产生沉淀;而第二种配合物则与此相反。
写出这两种配合物的化学式,并指出钴的配位数和氧化数。
解:此题与8-1是同类型。
注意配合物的内界与外界之间是离子键结合,易断裂。
中心离子配离子的空间构型。
[Mn(H 2O)6]2+ ; [Ag(CN)2]- ; [Cd(NH 3)4]2+ ; [Ni(CN)4]2- ; [Co (NH 3)6]3+。
8-5、试确定下列配合物是内轨型还是外轨型,说明理由,并以它们的电子层结构表示之。
(1) K 4[Mn(CN)6]测得磁矩m /μB =2.00;(2) (NH 4)2[FeF 5(H 2O)]测得磁矩m /μB =5.78。
解:(1) K 4[Mn(CN)6],磁矩m /μB =2.00,只有一个未成对电子;25Mn 2+, 3d 54S 0, ↑↓ ↑↓ ↑ ,d 2sp 3杂化,内轨型;(2)(NH 4)2[FeF 5(H 2O)],磁矩m/μB =5.78,有五个未成对电子;26Fe 3+ , 3d 54S 0, ↑ ↑ ↑ ↑ ↑ ,sp 3d 2杂化,外轨型。
8-8、(1)、(0.0592(lg ()a b V c E E n c θ=+氧化态还原态)氧化态)还原态 B/C/D 中氧化态浓度是减少的,故A 最大。
选A(2)、例如:AgCl(s) + 2NH 3= [Ag (NH 3)2]+ + Cl -3232223332[Ag NH ](Cl )[Ag NH ](Cl )(Ag )c(NH )c(NH )(Ag ),[Ag NH ],Ag f sp c c c c c K c K K Clθθθ+-+-+++==⨯=⨯()()() 要有利于沉淀的溶解,即是K 要大,所以选B无机及分析化学学习指导2 8-9、H 2O ;过氧化氢(HO —OH);H 2N —CH 2CH 2一NH 2;联氨H 2N —NH 2;解:有效的螯合剂为H 2N —CH 2CH 2一NH 2有效的螯合剂是一个配体中含两个及以上的配位原子,而且配位原子间要相隔2~3个其它原子,故只有H 2N —CH 2CH 2一NH 2满足。