海水的化学组成
- 格式:pdf
- 大小:835.42 KB
- 文档页数:16

海水组成恒定定律海水是地球上最广泛分布的天然水体,其组成及特性对地球生态系统具有重要影响。
海水的化学组成是多方面环境过程的结果,同时也受到多种因素的影响。
然而,在许多情况下,海水的化学组成可以遵循一种恒定的定律,即海水各组分的含量比例基本保持稳定。
海水中的主要元素海水主要由水以及各种盐类组成,其中主要元素包括氯(Cl)、钠(Na)、镁(Mg)、硫(S)、钙(Ca)、钾(K)等。
除此之外,海水中还含有微量元素如锌、铁、锰、铬等。
这些元素的含量可以通过化学分析确定,研究表明它们之间存在一定的比例关系。
恒定定律的原理在海水的化学组成中,氯离子是最多的,其次是钠离子。
这两种离子的比例在不同海域中相对固定,被称为“地球海水中的氯-钠比例”,通常为1.16:1。
这种比例的恒定性表明海水的化学组成在某种程度上是受到控制的。
形成定律的机制海水中各种盐类元素来源于陆地、岩石的侵蚀,由河流输送至海洋。
而地球上各地的陆地和岩石成分不同,导致不同海域的海水盐度也有所差异。
然而,氯、钠元素主要来自地壳中的矿物,其相对含量相对较稳定,因此构成了海水中的固定比例。
应用与意义海水组成恒定定律的发现对于研究海洋和地球环境具有重要意义。
利用这一定律,可以推断不同海域之间的水体交换情况,分析海水中的盐度变化对生态系统的影响,甚至指导海水淡化工艺的发展。
同时,海水组成恒定定律也为地质学、地球化学等领域的研究提供了重要参考。
总之,海水组成恒定定律揭示了海水中各元素之间的稳定比例关系,为我们理解海洋环境提供了重要线索,也为环境科学的发展提供了新的思路和方法。
只有充分理解和利用这一定律,我们才能更好地保护海洋生态系统,实现人类与自然的和谐共生。

海水成分包括什么
海水是地球表面广泛存在的一种自然水体,其成分复杂多样。
海水中所含的成分可以分为无机盐类和有机物质两大类,其中无机盐类主要是氯化物、硫酸盐、碳酸盐和溴化物等,而有机物质则包括藻类、浮游生物、腐殖质等。
无机盐类
氯化物
氯化物是海水中最主要的无机盐之一,占海水总盐量的主要成分。
它主要以氯化钠的形式存在,占据海水总盐量的约占70%,同时也包含少量的氯化镁和氯化钙。
硫酸盐
硫酸盐是另一个重要的无机盐类成分,包括硫酸钠和硫酸镁等,其含量在海水中并不算很高,但它对海水的酸碱度和离子平衡有一定影响。
碳酸盐
碳酸盐是海水中含有的另一个重要无机盐类成分,包括碳酸氢盐、碳酸钙等,它对海水的酸碱度和溶解氧的平衡具有重要作用。
溴化物
溴化物是海水中含量较少的无机盐类成分,但在某些特定场合下,也会对海水的生物体系产生一定的影响。
有机物质
藻类
海水中富含各种藻类生物,它们是海洋生态系统中的重要组成部分,包括浮游藻、赤潮藻等,它们对海水中的氧气产生和有机物质的分解循环起着重要作用。
浮游生物
海水中还包含大量的浮游生物,如浮游动物和浮游植物等,它们是海洋生态系统中的底层生物链,起到了食物链的重要角色。
腐殖质
腐殖质是由有机物质的降解产物形成的复杂有机物质,它在海水中的含量相对
较低,但对海水的颜色、透明度等也有一定影响。
综上所述,海水的成分极为复杂,其中既包括无机盐类,也包括各种有机物质,这些成分共同构成了海水的独特性质和丰富的生态系统,是地球上不可或缺的重要自然资源之一。


海水的主要成分化学式
海水是地球上最常见的液体之一,它主要是由各种无机物质组成的。
海水中包
含许多元素和化合物,这些成分对海洋生物和地球生态系统都起着至关重要的作用。
我们来看一下海水的主要成分及其化学式。
主要成分
氯化钠(NaCl)
氯化钠是海水中含量最丰富的物质之一,其化学式为NaCl。
它是普通食盐的主要成分,也是海水中呈现咸味的原因。
氯化镁(MgCl2)
氯化镁是海水中的另一个主要成分,其化学式为MgCl2。
氯化镁在海水中起着
调节细胞内外渗透压的作用,对海洋生物的生存和生长至关重要。
硫酸钠(Na2SO4)
硫酸钠是海水中的一种重要盐类,化学式为Na2SO4。
它可以在海水中与其他
盐类形成沉淀,影响海水的PH值和离子平衡。
硫酸镁(MgSO4)
硫酸镁也是海水中的主要成分之一,其化学式为MgSO4。
硫酸镁在海水中的含量较高,对海洋生物的代谢和生长有重要影响。
其他成分
除了以上主要成分外,海水中还包含微量元素如钾、钙、氟等,以及各种有机
物质和浮游生物。
这些成分共同构成了海水的复杂组成,维持着海洋生态系统的平衡和稳定。
综上所述,海水中的主要成分化学式包括氯化钠、氯化镁、硫酸钠、硫酸镁等,它们共同构成了海水的特有化学特性,对地球生态系统和人类生活都具有重要意义。
对海水成分的研究将有助于更好地理解海洋环境的变化和保护海洋资源的重要性。

海水组成元素
海水是地球表面最广泛的水体,其组成元素主要包括氯化钠、镁、硫酸根离子、钠、镁、钾、钙等。
这些元素在海水中的含量可以影响海水的性质和适用性。
以下是一些最主要组成元素的介绍:
•氯化钠:氯化钠是海水中含量最丰富的元素,约占海水总质量的86%。
它赋予海水咸味,并在水体之间维持渗透压的平衡。
•镁:镁是海水中的第二丰富元素,约占海水总量的1.3%。
它在海水中扮演着重要的生物学和地质学作用。
•硫酸根离子:硫酸根离子是海水中的重要阴离子之一,其浓度约为海水总量的约0.2%。
它参与了海水的酸碱平衡和循环。
•钠:钠是海水中的主要阳离子之一,占海水总量的约30%。
它对维持海水的电解质平衡和渗透压起着关键作用。
•钾:海水中的钾浓度较低,约占海水总量的约0.04%。
它在维持生物体内细胞的正常功能和代谢中扮演着重要作用。
•钙:海水中的钙含量较低,约占海水总量的约0.04%。
它对海洋生物的生长和骨骼形成至关重要。
除了这些主要元素外,海水中还含有微量元素如锌、铜、铁等,它们虽然存在
量较少,但对海洋生态系统的稳定和生物体的生长仍然起着重要作用。
总的来说,海水组成元素的存在丰富多样,它们相互之间的平衡和相互作用决
定了海水的性质和特点。
通过了解海水中的组成元素,我们可以更好地理解海洋环境的复杂性,为保护和利用海洋资源提供科学依据。

海水成分包括无机盐和有机物
海水是地球上最广泛的天然水体,其成分复杂多样。
海水中的主要成分包括无机盐和有机物。
这两类物质构成了海水独特的化学组成,为海洋生物的生存提供了必要的条件。
无机盐
无机盐是海水中最主要的成分之一。
主要的无机盐包括氯化钠(NaCl)、硫酸镁(MgSO₄)、硫酸钙(CaSO₄)、碳酸钠(Na₂CO₃)等。
这些无机盐是从陆地上岩石的风化和海床的火山喷发中流入海洋中的。
其中,氯化钠是海水中含量最丰富的盐类,占据了海水总盐量的大部分。
有机物
有机物是海水中的另一类重要成分。
有机物包括蛋白质、脂肪、碳水化合物等有机化合物。
这些有机物来源于海洋生物的代谢活动、植物残骸的分解以及陆地上的污染物输入等因素。
有机物为海洋生物提供了能量和营养物质,同时也参与了海水的化学循环过程。
海水成分的影响
海水中的无机盐和有机物对海洋生物和海洋环境具有重要的影响。
无机盐的含量影响着海水的密度、结晶度和电导率等性质,对海水的物理化学过程产生影响。
有机物则在海洋食物链中扮演着重要的角色,是海洋生态系统的重要组成部分。
总的来说,海水中的无机盐和有机物相互作用,共同构成了复杂的海洋化学系统。
了解海水的成分对于认识海洋环境、保护海洋资源具有重要意义。
希望人类能够更加关注海洋环境,共同保护我们美丽的蓝色地球。

海水的主要成分及其特点是什么
海水是地球表面覆盖70%的水体,其中包含了丰富的成分,了解海水的主要成分及其特点可以帮助我们更好地理解海洋生态系统和地球的水循环。
1. 主要成分
海水的主要成分包括水分子和溶解在其中的无机盐、气体以及微量元素。
其中,水分子占据海水的绝大部分,约占体积的96.5%。
无机盐主要包括氯化钠、硫酸盐、碳酸盐等,占据了海水的溶解物质中的大部分。
气体主要是氮气、氧气和二氧化碳,微量元素则包括铁、锰、铜等。
2. 特点
•高盐度:海水的平均盐度约为35‰,高于淡水。
这是因为海水中溶解了大量的盐类物质,使得海水呈现咸味。
•高密度:海水的密度通常比淡水高,大约为1.025g/cm³。
这是由于海水中的盐类物质增加了水体的质量,使得海水比淡水更加密集。
•含氧量高:相比淡水,海水中溶解氧气含量更高,这对海洋生物的生存和繁衍起着至关重要的作用。
•含微量元素:海水不仅含有常见的盐类和气体,还包含各种微量元素,这些微量元素是维持海洋生态系统平衡的重要因素。
•pH值稳定:海水的pH值通常维持在约8.1左右,呈碱性,这是由于海水中的碳酸盐溶解平衡的结果。
综上所述,海水作为地球上最重要的水体之一,拥有独特的成分和特点。
深入
了解海水的成分及其特点有助于我们更好地保护海洋环境,维护地球生态平衡。
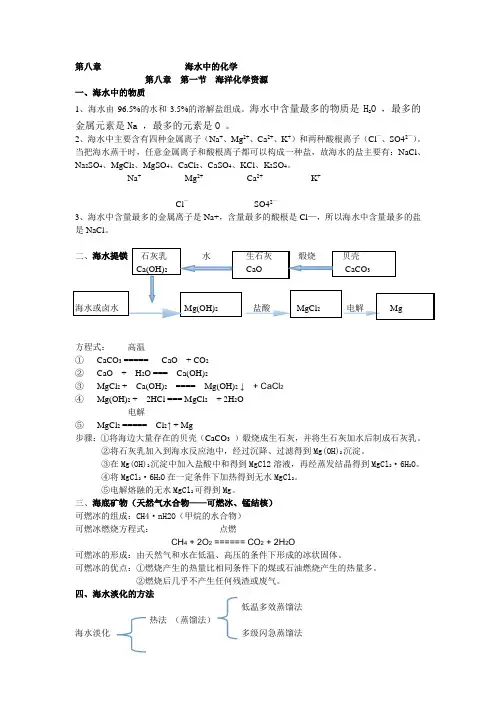
第八章海水中的化学第八章第一节海洋化学资源一、海水中的物质1、海水由96.5%的水和3.5%的溶解盐组成。
海水中含量最多的物质是H2O ,最多的金属元素是Na ,最多的元素是O 。
2、海水中主要含有四种金属离子(Na+、Mg2+、Ca2+、K+)和两种酸根离子(Cl—、SO42—)。
当把海水蒸干时,任意金属离子和酸根离子都可以构成一种盐,故海水的盐主要有:NaCl、Na2SO4、MgCl2、MgSO4、CaCl2、CaSO4、KCl、K2SO4。
Na+Mg2+Ca2+K+Cl—SO42—3、海水中含量最多的金属离子是Na+,含量最多的酸根是Cl—,所以海水中含量最多的盐是NaCl。
二、海水提镁石灰乳水生石灰煅烧贝壳Ca(OH)2CaO CaCO3海水或卤水Mg(OH)2盐酸MgCl2电解Mg方程式:高温①CaCO3 ===== CaO + CO2②CaO + H2O === Ca(OH)2③MgCl2 + Ca(OH)2==== Mg(OH)2↓+ CaCl2④Mg(OH)2 + 2HCl === MgCl2+ 2H2O电解⑤MgCl2 ===== Cl2↑ + Mg步骤:①将海边大量存在的贝壳(CaCO3)煅烧成生石灰,并将生石灰加水后制成石灰乳。
②将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀。
③在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O。
④将MgCl2·6H2O在一定条件下加热得到无水MgCl2。
⑤电解熔融的无水MgCl2可得到Mg。
三、海底矿物(天然气水合物——可燃冰、锰结核)可燃冰的组成:CH4·nH2O(甲烷的水合物)可燃冰燃烧方程式:点燃CH4 + 2O2 ====== CO2 + 2H2O可燃冰的形成:由天然气和水在低温、高压的条件下形成的冰状固体。
可燃冰的优点:①燃烧产生的热量比相同条件下的煤或石油燃烧产生的热量多。

海水的化学组成
海水是地球上最丰富的水体资源之一,其化学组成复杂多样。
海水主要由水和溶解在其中的各种物质组成,下面将详细介绍海水的化学组成。
主要成分
1.水:海水的主要成分是水,占据了海水总重量的绝大部分,约为
96.5%。
2.盐类:盐类是海水中的重要组成部分,主要包括氯化钠、硫酸镁、
硫酸钠、硫酸钙等。
这些盐类在海水中以离子的形式存在。
3.溶解气体:海水中还含有各种气体,如氧气、氮气、二氧化碳等。
这些气体的含量会受到温度、深度等因素的影响。
主要离子
1.氯离子(Cl-):是海水中最主要的阴离子,占据了海水中离子总浓度
的绝大部分。
2.钠离子(Na+):与氯离子在海水中呈现最主要的正负配对,氯离子和
钠离子的浓度比例基本稳定。
3.镁离子(Mg2+)、钙离子(Ca2+):海水中还含有少量的镁离子和钙离
子,但它们对海水的理化性质有一定影响。
其他物质
1.硅酸盐:海水中含有少量的硅酸盐,这些物质对海洋生态系统尤为
重要。
2.微量元素:海水中还含有各种微量元素,如锰、铁、铜等,这些元
素虽然含量较少,但在海洋生态系统中扮演着重要的角色。
总的来说,海水的化学组成是一个相对稳定且复杂的体系,其中水和盐类是海水的主要组成部分,各种离子和溶解物质共同构成了海水独特的化学特性。
以上是对海水化学组成的简要介绍,希望能对你有所帮助。

海水成分主要是什么元素组成
海洋覆盖地球表面约70%,海水是地球上最丰富的水源之一,那么海水中主要是由哪些元素组成的呢?
1. 氯(Cl)
氯是海水中含量最多的元素之一,占据海水总盐量的大部分。
在海水中,氯离子氯化物(Cl-)的浓度非常高,是海水中主要的阴离子。
2. 钠(Na)
钠是海水中第二大含量的元素,主要以钠离子(Na+)的形式存在。
氯离子和钠离子的结合构成了氯化钠,即我们通常所说的盐。
3. 硫(S)
硫在海水中的浓度并不高,但却起着重要的作用。
硫以硫酸盐(SO4^2-)或硫化物(H2S)等形式存在于海水中。
4. 镁(Mg)
镁是海水中第四大含量的元素,主要以镁离子(Mg^2+)的形式存在。
海水中的镁对于海洋生物的生长和调节水平具有重要意义。
5. 钙(Ca)
钙是海水中的第五大元素,以钙离子(Ca^2+)的形式存在。
钙在海水中起着维持海水碱度和海洋生物骨骼形成等重要作用。
6. 钾(K)
钾在海水中的含量较低,但仍然是海水中的重要元素。
钾以钾离子(K+)的形式存在,参与了海洋生物的生长和代谢过程。
7. 硅(Si)
硅是海水中的关键元素之一,主要以硅酸盐(SiO4^4-)的形式存在。
硅在海水中对于海洋生物的骨骼形成和生物多样性起着重要作用。
以上便是海水主要的元素组成,各种元素以不同的形式存在于海水中,共同构成了丰富多样的海洋生态系统。
对于地球生态系统和生命的演化,海水中的元素组成起着至关重要的作用。

海水的主要组成成分
海水是地球上广泛存在的一种天然水体,它是由多种溶解在其中的无机盐和有
机物质组成的。
尽管海水中含有多种元素和化合物,但主要的成分却是氯化钠和水。
氯化钠
氯化钠是海水中含量最多的无机盐,占据了海水总盐份的大部分。
氯化钠的化
学式为NaCl,通常我们所说的食盐就是由氯化钠组成的。
海水中的氯化钠除了味
咸之外,还在水体的电导率、密度、溶解性等方面起重要作用。
水
水是海水中另一个最主要的成分。
水占据了海水的绝大部分,几乎所有的物质
都是以水的形式存在于海水中。
水在海洋生物的生存和海水的化学性质中扮演着至关重要的角色。
其他无机盐
除了氯化钠外,海水中还含有多种其他无机盐,如硫酸镁、硫酸钙、硫酸钾、
硫酸钠等。
这些无机盐的含量虽然不及氯化钠,但在维持海洋生物的生存和调节海水化学平衡方面同样至关重要。
有机物质
海水中的有机物质包括藻类、蛋白质、碳水化合物等,它们虽然含量较低,但
对海洋生态系统的平衡和物质循环具有重要影响。
综上所述,海水的主要组成成分是氯化钠和水,而其他无机盐和有机物质虽然
含量较少,却也在维持海洋生态系统的平衡和海水化学性质的稳定上起到至关重要的作用。
只有当这些成分保持合适的比例和浓度时,海水才能维持它独特的生态环境和化学特性。
海水所含主要化学元素海水是地球上最广泛的自然资源之一,它包含许多不同种类的化学元素。
这些化学元素对于海洋生态系统的稳定和生物体的生存至关重要。
海水中的主要化学元素包括钠、氯、镁、硫等。
下面将详细介绍海水中的主要化学元素及其重要性。
钠(Na)钠是海水中含量最丰富的元素之一,占据了海水总溶解物质的约30%。
钠是维持生命所必需的元素之一,它对于细胞内外的渗透压平衡和神经脉冲传导至关重要。
海水中的钠主要以Na+的形式存在,它是细胞内外的离子平衡的重要组成部分。
氯(Cl)氯是另一个海水中含量很高的元素,占据了海水总溶解物质的约55%。
氯离子(Cl-)是维持酸碱平衡和水分平衡的重要离子,也参与了细胞内外的离子平衡。
氯离子在细胞内外的分布对于细胞的功能和稳定起着至关重要的作用。
镁(Mg)镁是海水中含量较高的金属元素之一,约占据了海水总溶解物质的约3.7%。
镁离子(Mg2+)在海水中起着多种重要的生理作用,包括细胞的代谢和酶活性的调节。
镁还参与了蛋白质合成和DNA修复等生物体内重要的生化过程。
硫(S)硫是海水中的主要元素之一,以硫酸根离子(SO42-)的形式存在。
硫是蛋白质和核酸等生命分子的主要构成元素之一,也是一些氨基酸和辅酶的组成成分。
硫在海洋生态系统中也起着重要的生态作用,例如硫细菌利用硫代谢过程维持了海洋生态系统的平衡。
综上所述,海水中的主要化学元素包括钠、氯、镁和硫等,它们在维持生命和生态系统的平衡中起着不可或缺的作用。
了解海水中的主要化学元素的含量和作用有助于我们更好地理解海洋生态系统的复杂性,为保护海洋生态环境和开展海洋资源的合理利用提供科学依据。
海水的化学式海水的化学式是H2O,即二氧化氢(Hydrogen Dioxide)。
海水是由水分子组成的溶液,它含有丰富的元素和化合物,其中最重要的组成部分是水分子。
水分子由两个氢原子和一个氧原子组成,这三个原子之间以共价键相互联系,形成一个分子。
水分子的化学式是H2O,它代表着氢原子两个,氧原子一个。
在水分子中,氢原子在水分子中承担着两个电子,而氧原子则承担六个电子,从而形成一个氢氧分子,也就是海水的基本组成部分。
海水中还含有大量的其他元素和化合物,如氯离子、硫酸根、硫酸盐、硅酸根和碳酸根等。
它们的化学式分别为Cl-、SO42-、Na2SO4、SiO32-、CO3 2-等。
大多数元素和化合物的浓度都很低,但它们在海水中占有重要的地位,可以影响海水的性质和特性。
海水的化学成分是十分复杂的,它不仅含有水分子,而且还含有丰富的元素和化合物,例如氯离子、硫酸根、硫酸盐、硅酸根和碳酸根等,它们的化学式分别为Cl-、SO42-、Na2SO4、SiO32-、CO3 2-等。
海水的化学组成是非常复杂的,它的组成元素及其化合物的种类和浓度会随着海洋的不同部位而有所不同。
海水具有重要的生物学功能,它提供了大量的生物物质,如氧、氮、磷等,以及提供海洋生物必需的微量元素,如钙、镁、钠、铜、锌等,它们对海洋生物的生长发育具有重要作用,使海洋生物能够正常生长发育。
海水具有十分特殊的化学性质,它的pH值通常在7.5到8.5之间,非常稳定,而且其酸碱平衡也很稳定,可以消除环境的变化。
此外,海水中还含有大量的盐分,这些盐分可以抵消海水中的离子,使海水保持非常稳定的pH值和酸碱平衡。
总之,海水的化学式是H2O,是由两个氢原子和一个氧原子组成的氢氧分子,它不仅含有水分子,而且还含有大量的元素和化合物,这些元素和化合物组成了海水独特而又复杂的结构,使海水具有重要的生物学功能和稳定的化学性质,使之成为一个自然界中最重要的液体。
海水的组成部分
海水是地球表面最常见的液态物质,它由多种化学物质组成。
海水中主要包括以下组成部分:
盐类物质
海水中含有大量的盐类物质,其中最主要的是氯化钠(NaCl)。
氯化钠占据了海水中大部分的盐类物质,约占总盐量的85%。
此外,海水中还含有硫酸盐、碳酸盐、溴化物、氟化物等各种盐类物质。
溶解气体
海水中也溶解了多种气体,其中最主要的是氧气和二氧化碳。
氧气是海洋生物生存所必需的气体,而二氧化碳则在海水中与水进行化学反应,形成碳酸根离子,维持海水的酸碱平衡。
有机物质
海水中含有丰富的有机物质,包括藻类分泌的物质、浮游生物的遗骸和粪便、海洋动植物的分泌物等。
这些有机物质为海洋生物提供养分,并参与了海洋生物的生产和分解过程。
矿物质
海水中还含有多种矿物质,如钠、氯、镁、钙、钾等元素。
这些元素对海水的化学性质和海洋生物的生长发育都起到了重要作用。
综上所述,海水是一个复杂的体系,其中包含了多种不同的化学物质和元素,这些组成部分相互作用,维持了海洋生态系统的平衡和稳定性。
对于人类而言,海水也是一个重要的资源,我们需要将其保护好,以保障地球的生态平衡和人类的可持续发展。
海水的主要成分及氯化镁的作用
海水是地球上最丰富的水体,其中包含着各种元素和化合物。
海水的主要成分
包括水分子、氯化钠、硫酸镁、硫酸钙、氯化镁等。
本文将会重点介绍海水中的主要成分以及氯化镁在海水中的作用。
海水的主要成分
1.水分子:海水中最主要的成分是水分子,约占海水总质量的96.5%。
2.氯化钠:也就是我们常说的盐分,占海水总质量的约
3.5%。
氯化钠
是使海水呈咸味的主要成分之一。
3.硫酸镁:海水中含有大量的硫酸镁,它是海水中的第二大盐类成分。
4.硫酸钙:硫酸钙也是海水中重要的盐类成分之一,对海洋生物的生
长发育起着重要作用。
5.氯化镁:氯化镁是海水中的重要成分之一,它对维持海水的盐度和
渗透压起着至关重要的作用。
氯化镁在海水中的作用
氯化镁是海水中的重要盐类成分,它在海水中有着多种重要作用:
1.维持海水的盐度:氯化镁是维持海水盐度的重要组成部分,保持了
海水的味道和浓度。
2.调节海水的渗透压:氯化镁能够调节海水中的渗透压,维持海水和
海洋生物体内的渗透平衡,保证了海洋生物的正常生理活动。
3.影响海水的化学性质:氯化镁还会影响海水的化学性质,参与海水
的酸碱平衡和离子平衡,保持海水的稳定性。
总的来说,海水中的氯化镁是非常重要的,它不仅维持了海水的化学平衡,还
对海洋生物起着关键性的作用。
通过了解海水的主要成分和氯化镁的作用,我们可以更加深入地了解海水的特点,以及海洋生物与海水之间的关系。
海洋是地球上最重要的生态系统之一,保护海洋资源,维护海洋生态平衡是我们共同的责任。
海水主要成份化学式
海水是地球上最为广泛的天然水体之一,其主要成分包括多种无机化合物和溶
解气体。
本文将介绍海水中的主要成分化学式及其含量。
海水中的主要成分及化学式
1.氯化钠(NaCl):氯化钠是海水中含量最丰富的化合物,占据海水
总溶解物质的约85%左右。
2.硫酸镁(MgSO4):硫酸镁是海水中第二丰富的溶解物质,占据海
水总溶解物质的约3.7%。
3.硫酸钙(CaSO4):硫酸钙是海水中的重要成分之一,占据海水总溶
解物质的约1.2%。
4.氯化钾(KCl):氯化钾是海水中的一种重要无机盐,占据海水总溶
解物质的约1.1%。
5.碳酸钠(Na2CO3):碳酸钠在海水中含量较低,占据海水总溶解物
质的约0.1%。
海水中其他重要成分
除了上述提到的主要成分外,海水中还包含了微量元素和其他有机物质,例如:•硫酸钾(K2SO4):硫酸钾是海水中的微量成分之一,其含量较低,但对海洋生态系统有重要影响。
•碳酸钙(CaCO3):碳酸钙是海水中的重要有机物质,对珊瑚礁的形成和生长起着关键作用。
•氯化镁(MgCl2):氯化镁是海水中的微量成分之一,对海水的盐度和离子平衡起着重要作用。
•溴化物(Br-):溴化物是海水中的微量元素之一,虽然含量较低,但在海洋生态系统中扮演着不可或缺的角色。
结语
海水中的化学成分是一项极其重要的研究课题,对于地球科学、海洋生态学等
领域具有重要意义。
通过深入了解海水中的主要成分及其化学式,我们可以更好地理解海水的性质和功能,进一步探索海洋资源的利用和保护方法。
希望本文对您有所帮助,谢谢阅读!。
第1节 引言第二章 海水的化学组成第2节 海洋的形成一、宇宙的形成距今约140亿年前,一个比针尖还小的点发生大爆 炸,宇宙从此诞生(伽莫夫,1948)。
物质粒子摆 脱了能量的束缚,开始自发地排列起来形成现在的 宇宙。
二、太阳的形成距近约50亿年前,一快由气体和尘埃组成的巨大 烟云在万有引力的重压下崩塌瓦解。
由于原子核发 生熔化,使得云团中心处的温度变得非常高,密度 也很大,太阳由此形成。
1三、地球的形成太阳的引力开始对星云的其余部分产生吸引,随着 太阳的逐渐增大,引力越来越强,直到除了零星碎 片和部分气体,因为距离遥远和游移速度极快而保 持孤立外,其余都被控制,各布其位。
最后,这些 粒子和气体凝聚在一起,各星球包括地球就形成了 地球形成初期,是一个炽热的火球,温度高达 5000°C,同时不断地经受数百万颗陨石的冲击。
三、地球的形成地球燃烧了100万年后才逐渐冷却,质量较大的 铁、镍等金属物质在地心处沉积下来,形成一个灼 热的、直径3000多公里的地核。
质量较轻的矿物 质则不断上升,形成厚约3000多公里的地壳。
地球形成的时间:距今46亿年 地球形成时间的证据:古老的矿物结晶体—锆石, 测定年代为44亿年前。
地球形成初期是一个炽热的火球四、月亮的形成年轻的地球与一个火星大小的、高速运动的星体发生 碰撞,冲击力将地球表层掀掉一大块。
这块被剥离的 熔岩状星体外壳溅落到太空中,绕着地球的轨道飞行。
10亿年后才被地球引力揉成一个小星球,即为月球。
证据:在月球上发现地球的星体残片以及其他来自 地球的物质。
五、海洋的形成地球形成初期,火山活动持续不断,底下熔融的 岩浆从地表爆发出来,释放出CO2、N2、CH4、 H2和水蒸汽,此为地球的脱气作用。
约40亿年前,大气层中以水蒸气、CO2为主,随 着地球的继续冷却,聚集在大气中的水蒸气转化 为一场持续几百万年的滂沱大雨,加上带有冰的 彗星不断地落在地球上。
水蒸气的冷凝及冰的融 化形成液态水,水累积在低洼地带,形成海洋。
海洋形成时间:38亿年前。
2地球的演化历史第3节 海水的化学组成1、水的特殊性质及其意义 海水中含量最多的元素是氢和氧(水)(1)异常高的冰点与沸点,导致其高的热容量:水所具有的 高热容量对于维持地球的气候与生命具有重要意义。
夏天的时 候,热被储存在海洋中,而到冬天的时候再将其辐射回大气, 由此使地球的气候较为舒适。
这也是为何沿海地区夏天没有内 陆地区来得热,而冬天没有内陆地区来得冷的原因。
(2)异常的密度变化: 对于中纬度地区水中生物的生存 具有重要意义。
当冬季接近的时 候,表层水变冷,密度的增加导 致这些水往深层下沉。
此过程不 断连续进行直至水温降低至4°C 以下,在更低温度的时候,进一 步的冷却使水的密度降低,此时 下沉停止了。
如果气温达到 0°C,冰首先在表层形成,并成 为下覆水体与大气冷却的屏障, 延缓深层水的结冰。
因此,结冰 是从表层往下进行的。
这也就保 护了水中鱼类等生物免于被冻死。
水密度随温度的变化水分子具有异常高的熔点和沸点3(3)水是极好的溶剂(4)水中盐分的增加导致冰点的降低 以及达到最大密度的温度降低NaCl在水中的溶解冰点与最大密度温度与盐度的关系(5)水中盐分的增加导致渗透压增加 水中的高离子浓度使海水较纯水具有高的渗透 压。
渗透压的差异会导致水分子跨越半透膜从低盐 区域向高盐区域扩散,当两边盐浓度相同时,水的 净扩散就停止了。
最典型的天然半透膜就是细胞 膜,许多海洋生物细胞内体液的盐含量与海水是接 近的,这就是他们几乎不用耗费多的能量来维持体 内与海水之间的盐浓度平衡。
哺乳动物血液中的盐 浓度与海水也是接近的(3.5% wt/v),这并不奇 怪,因为生物看来是在海洋中演化起来的。
第3节 海水的化学组成一、原始海水的化学组成自地球上海洋形成起,就进行着蒸发—冷凝构成的 水循环。
水对其接触的岩石进行风化,岩石变成了 碎屑,元素溶于水中,由此形成了海水。
海水中的大多数阳离子组分由此而来。
通过海洋中 发生的各种过程,海水生成沉淀物和成岩作用等。
原始海水组成可视为由0.3 M HCl溶液与岩石接触, 溶解Ca、Mg、K、Na、Fe、Al等元素,中和后,Fe、 Al等以氢氧化物沉淀,把无机物和有机物沉积到海底430亿年前海水化学组成与现代海水的比较年代 30亿年前海水 现代海水 Mg2+ 13~24 10.7 Ca2+ Na+ K+ 17 3.0二、海水化学组成的变迁海水化学组成至少在几亿年内基本恒定,证据包括: 贝壳的Sr/Ca比看,26亿年前海水的主要元 素和Sr/Ca比与现代海水相近; 寒武纪的沉积物看,可能 20 亿年前海水中主要 化学组分浓度与现代相近。
(%) 23~29 30~47 3.2 83.130亿年前的海水,其K浓度比现代海水来得高,而Na浓度比现代海水来得 低。
原因在于:玄武岩与HCl作用生成黏土矿物,它们与海水发生Na+和 K+、H+的交换反应,结果是不仅使海水的pH8,而且K+被黏土矿物吸 附,而水中Na+浓度升高。
30亿年前的海水,其Mg、Ca浓度比现代海水来得高。
原因在于:海水变 成中性后,大气CO2进入海水并开始有CaCO3沉淀形成,Mg同时也发生 共沉淀,结果海水中的Mg、Ca浓度逐渐降低。
海水中的许多阴离子,如F、Cl、Br、I、S、As等,它们在海水中的含量远 比从岩石溶出的要多,可能是火山、海底热液等输入的缘故。
三、现代海水的化学组成1、元素存在形态海洋物质: (1)颗粒物质:由海洋生物碎屑等形成的颗粒有机 物和各种矿物所构成的颗粒无机物; (2)胶体物质:多糖、蛋白质等构成的胶体有机物 和Fe、Al等无机胶体; (3)气体:保守性气体(N2、Ar、Xe)和非保守气 体(O2、CO2); (4)真正溶解物质:溶解于海水中的无机离子和分子 以及小分子量的有机分子。
海洋物质的粒径区分标准类别 颗粒物质 胶体 溶解物质 颗粒粒径(μm) ≥0.1 0.001~0.1 ≤0.001实际工作中,一般以孔径为0.4 μm的滤膜过滤海 水,被滤膜截留的称为颗粒物,通过滤膜的称为溶解 物质,其中包含了胶体物质(操作性定义)。
5各种物质粒径大小及对应的分离方法2、海水的元素组成(1)常量元素:大于0.05 mmol/kg,有11种 阳离子:Na+、K+、Ca2+、Mg2+、Sr2+ 阴离子:Cl-、SO42-、Br-、HCO3-(CO32-)、F-(Si例外) 分子:HBO3 以上占海水总盐分的99%。
(2)微量元素:0.05~50 μmol/kg (3)痕量元素:0.05~50 nmol/kg和<50 pmol/kg (4)营养盐:N、P、Si(主要营养盐)、Mn、Fe、Cu、Zn (微量营养盐)等,它们与海洋生物生长密切相关 (5)溶解气体:O2、CO2、N2、惰性气体等。
(6)有机物质海水化学组成(以浓度高低排序)类别 常量离子 微量离子 气体 营养盐 痕量金属 溶解有机物质 胶体 颗粒物质 例子 Cl-、Na+、Mg2+、SO42-、Ca2+、K+ HCO3-、Br-、Sr2+、FN2、O2、Ar、CO2、N2O、(CH3)2S、 H2S、H2、CH4 NO3-、NO2-、NH4+、PO43-、H4SiO4 Ni、Li、Fe、Mn、Zn、Pb、Cu、 Co、U、Hg 氨基酸、腐殖酸 多糖、蛋白质 沙、黏土、海洋生物 浓度范围 mM μM nM~mM μM <0.05 μM ng/L ~ mg/L ≤mg/L μg/L ~ mg/L3、海水主要成分(常量元素)组成的恒定性1779年,Bergman最早对海水进行化学分析; 1819年,Marcet首次指出:海盐的化学组成基本 恒定; 1965年,Forchhammer测定世界海洋表层水Cl-、 SO42-、Mg2+、Ca2+、K+、Na+的浓度,发现元素 之间的比值仅存在很小变化; 1884年,Dittmar分析了“挑战者”号采集的样品, 结果与Forchhammer的相当吻合,但深水中的 Ca2+浓度比表层水高约0.3%; 1965年,Culkin综合此前的数据,进一步证明海 水常量元素组成相对恒定的观点。
6Marcet-Dittmar恒比规律 海水的大部分常量元素,其含量比值基本上是不变的离子 ClNa+ SO42Mg2+ Ca2+ K+ HCO3BrSr2+ B F含量(g/kg,S=35) 19.344 10.773 2.712 1.294 0.412 0.399 0.142 0.0674 0.0079 0.00445 0.00128 与氯度比值 (g/kg/Cl‰) 0.556 0.1400 0.0668 0.02125 0.02060 非保守 0.00348 0.00041 0.00023 6.67×10-5不管盐度从一个地方到另一个地方如何变化,开阔 大洋水中的常量元素的比值几乎是恒定的。
三大洋表层水主要阳离子与氯度的比值0.55 Na/Cl 0.35 K/Cl Mg/Cl Ca/Cl 0.15-0.05AtlanticPacificIndian开阔大洋表层水与深层水主要阳离子与氯度的比值0.6 0.5 0.4 0.3 0.2 0.1 0 Na/Cl K/Cl Mg/Cl Ca/Cl Surface Deep海水中常量元素恒定的原因水体在海洋中的移动速率快于加入或迁出元素 的化学过程的速率,因为加入或迁出水不会改 变海洋中盐的总量,仅仅是离子浓度和盐度的 改变。
7恒比规律的引论:① 相对于海水混合速率,常量组分由河流输入海洋 的速率是慢的,这也称为保守行为,但河口区与 近岸污染严重海域例外; ② 常量组分对海域生物过程、地球化学过程不敏 感,仅受控于物理过程。
例外的情况包括:生物 过程对Ca2+、Sr2+的影响;结冰和融冰对Na+、 SO42-的影响;海底热液的影响等。
③ 恒比规律不适用于微量或痕量组分。
④ 恒比规律没有历史继承性,并非指海水之过去和 未来都有相似的规律。
⑤ 恒比规律表明常量组分具有保守性质,并不是说 这些组分未经任何化学等反应,仅仅是因为它们 的浓度大到足以掩盖这些过程的效应。
4、海水常量组分组成非恒定性的影响因素(1)河口区:河水输入对区域恒比规律有一定影响Seawater 海水River Water 河水Na+ Ca2+Ca K+2+Mg2+ 2-Mg2+SO4 Na+ SiO2K+SO4 Cl-2-ClHCO3-(2)缺氧海盆:细菌的还原作用,使SO42-被还原为 H2S,进而可通过形成FeS2、ZnS、CuS等沉淀将硫 迁出水体,由此导致海水中的SO42-/Cl-非常低,偏离 恒比规律。