第八章-地球化学系统中的氧化还原反应
- 格式:doc
- 大小:460.50 KB
- 文档页数:16



氧化還原反應
氧化还原反应是化学中一种常见的反应类型,也是化学反应中最重要的一种。
在氧化还原反应中,通常涉及物质的电子转移过程,其中一种物质失去电子被氧化,另一种物质获得电子被还原。
这种电子的转移过程会导致物质的化学性质发生变化,产生新的物质。
氧化还原反应可以发生在各种化学物质之间,包括金属、非金属、离子等。
一个典型的氧化还原反应就是金属与非金属之间的反应。
例如,铁与氧气的反应就是一个氧化还原反应。
在这个反应中,铁的原子失去了电子,被氧气氧化成了铁氧化物,同时氧气获得了电子被还原成了氧化物。
氧化还原反应在我们日常生活中也有很多应用。
例如,电池就是利用氧化还原反应来产生电能的。
在电池中,正极发生氧化反应,负极发生还原反应,通过电子在外部电路中流动,产生电流,从而驱动设备工作。
另外,氧化还原反应还广泛应用于金属冶炼、废水处理、化学合成等领域。
在氧化还原反应中,氧化剂和还原剂是起着重要作用的两种物质。
氧化剂是一种能够接受电子的物质,因此在反应中氧化剂会被还原;而还原剂则是一种能够给予电子的物质,因此在反应中还原剂会被氧化。
氧化还原反应中,氧化剂和还原剂之间的电子转移是通过氧化还原反应的进行。
氧化还原反应是化学反应中一种非常重要的反应类型,它不仅在化学工业中有着广泛的应用,也在我们的日常生活中扮演着重要角色。
通过深入了解氧化还原反应的原理和机制,我们可以更好地理解化学反应的本质,为我们的学习和工作带来更多的启发和帮助。
希望通过本文的介绍,读者们能对氧化还原反应有更深入的了解。

氧化还原反应1. 氧化还原反应的概念氧化还原反应是化学反应中最常见的一种类型。
在氧化还原反应中,某些物质失去电子,被氧化为较高的化合价态,同时其他物质得到电子,被还原为较低的化合价态。
这些电子的转移导致了物质的氧化和还原。
氧化还原反应也可以称为电子转移反应。
2. 氧化还原反应的特征氧化还原反应有以下几个特征:•电子转移:在氧化还原反应中,电子从一个物质转移到另一个物质。
这个过程涉及到自氧化还原反应的两个半反应,一个是氧化半反应,一个是还原半反应。
•氧化与还原:氧化还原反应中,发生氧化的物质失去电子,还原的物质得到电子。
这个过程中,氧化剂接受电子,被还原,而还原剂失去电子,被氧化。
•氧化态与还原态:氧化还原反应中,氧化剂的氧化态减小,还原剂的还原态增大。
3. 氧化还原反应的常见类型3.1 燃烧反应燃烧反应属于氧化还原反应的一种特殊类型。
在燃烧反应中,燃料物质与氧气反应,产生二氧化碳、水等产物,释放出能量。
在这个过程中,燃料物质失去电子,被氧化,氧气得到电子,被还原。
3.2 金属与酸反应金属与酸反应也属于氧化还原反应。
在金属与酸反应中,金属失去电子,被氧化,同时酸接受电子,被还原。
这个反应会产生金属盐和氢气。
3.3 元素的氧化与还原许多元素可以氧化或还原,这也是氧化还原反应的一种常见类型。
例如,氧的氧化态为-2,但在氯气中,氧可以被氧化为氯气中的+2态。
同时,氯气可以还原氧,使其氧化态下降。
3.4 单质与化合物的反应氧化还原反应中,单质与化合物的反应也是常见的类型。
在这种反应中,单质可以被氧化为化合物,化合物也可以被还原成单质。
4. 氧化还原反应的重要性氧化还原反应在生活和工业中都有重要的应用。
以下是一些例子:•铁的氧化还原反应导致了铁的生锈,这是日常生活中经常遇到的一个问题。
•电池中的化学反应就是氧化还原反应。
电池的作用是将化学能转化为电能。
•氧化还原反应在许多工业过程中起着关键作用,例如金属的提取和水的电解。
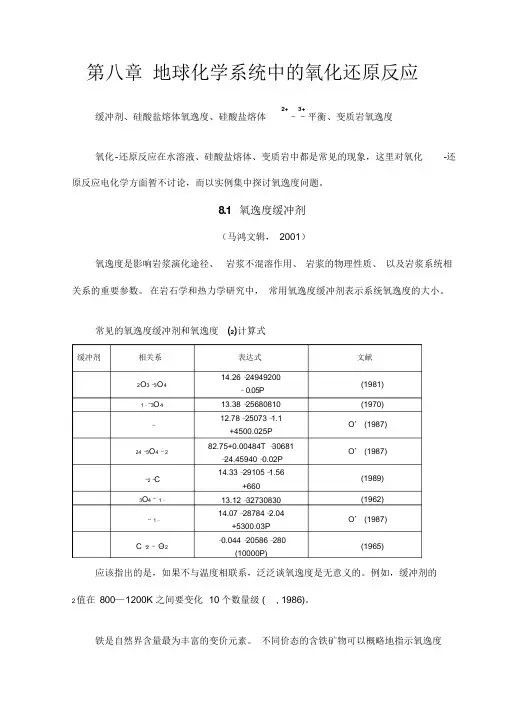
缓冲剂 相关系表达式 文献 2O 3–3O 414.26 –24949200–0.05P 13.38 –25680810 12.78–25073–1.1 +4500.025P 82.75+0.00484T –30681–24.45940 –0.02P 14.33–29105–1.56+660 13.12 –32730830 14.07–28784–2.04+5300.03P –0.044 –20586–280(10000P)(1981) 1––3O 4(1970) –O ’ (1987) 24–3O 4–2O ’ (1987)–2–C (1989) 3O 4–1–(1962) –1– O ’ (1987)C –2 ––O 2(1965)第八章 地球化学系统中的氧化还原反应缓冲剂、硅酸盐熔体氧逸度、硅酸盐熔体2+3+––平衡、变质岩氧逸度氧化-还原反应在水溶液、硅酸盐熔体、变质岩中都是常见的现象,这里对氧化 -还原反应电化学方面暂不讨论,而以实例集中探讨氧逸度问题。
8.1 氧逸度缓冲剂(马鸿文辑, 2001)氧逸度是影响岩浆演化途径、 岩浆不混溶作用、 岩浆的物理性质、 以及岩浆系统相关系的重要参数。
在岩石学和热力学研究中, 常用氧逸度缓冲剂表示系统氧逸度的大小。
常见的氧逸度缓冲剂和氧逸度 (2)计算式应该指出的是,如果不与温度相联系,泛泛谈氧逸度是无意义的。
例如,缓冲剂的2 值在 800—1200K 之间要变化 10 个数量级 ( , 1986)。
铁是自然界含量最为丰富的变价元素。
不同价态的含铁矿物可以概略地指示氧逸度222 222 2的相对大小。
由自然铁 ()→方铁矿( 2+)→磁铁矿( 23+)→赤铁矿( 3+),反映了其结晶时的氧逸度依次增高。
在火山岩中,铁镁矿物和氧逸度之间的平衡主要决定于熔体和斑晶相矿物的总成分。
在相似的温度下, 随氧逸度由低到高, 铁镁矿物一般将依次出现橄榄石、 斜方辉石、角闪石和黑云母。

地球化学探索地球内部的化学反应与作用地球作为我们生存的家园,其内部的化学反应与作用对于地球的演化、地质过程以及自然资源的分布起着至关重要的作用。
地球化学作为一门研究地球内部化学成分和过程的学科,为我们揭示了地球内部的奥秘,本文将介绍地球化学在探索地球内部的化学反应与作用方面的重要成果。
一、地球内部的化学成分地球的内部可以分为地壳、地幔和地核三个层次,不同层次的物质组成不同,其中化学元素的分布情况直接决定了地球内部的化学反应与作用。
地球化学家通过对地壳和岩石的取样研究,确定了地壳的主要化学成分,如氧、硅、铝等元素的含量,这对于理解地壳的形成和演化过程至关重要。
同时,地球化学家通过地震波观测以及对火山岩石和钻孔样品的研究,揭示了地幔的化学成分。
地幔主要由铁、镁、铝等元素组成,这些元素的含量和分布对于地幔的物理状态以及热对流作用有着重要的影响。
地球化学揭示出地幔中的化学反应与作用是地球内部热力学平衡的重要因素。
地核是地球内部的最深部分,由铁和镍等重元素组成。
对地核的研究可以帮助我们了解地球内部的高温高压环境以及地球磁场的起源和演化。
地球化学揭示了地核中的放射性元素衰变是地内部持续释放的重要能量,这种能量对地球热力学和地球动力学的研究有着重要的意义。
二、地球内部的化学反应地球内部的化学反应是地球演化和地壳形成的基础。
其中最重要的反应之一是岩石和矿石的熔融。
地球化学家通过实验模拟和地质观测发现,在地幔和地壳的高温高压环境下,岩石和矿石可以发生熔融,形成岩浆和矿脉等地质现象。
这些熔融反应不仅决定了地球表面的构造和地貌,还是形成矿产资源的重要过程。
此外,地球内部的化学反应还包括水的溶解和氧化还原反应等。
地球的水圈是地球系统中至关重要的一部分,水的存在和循环与地球内部的化学反应密切相关。
地球化学家的研究表明,地下水通过与岩石相互作用可以发生溶解反应,改变岩石的化学组成并影响地下水的质量。
此外,地球内部的氧化还原反应也是关键的化学过程,相关研究对于了解地下矿产资源的形成和分布具有重要意义。


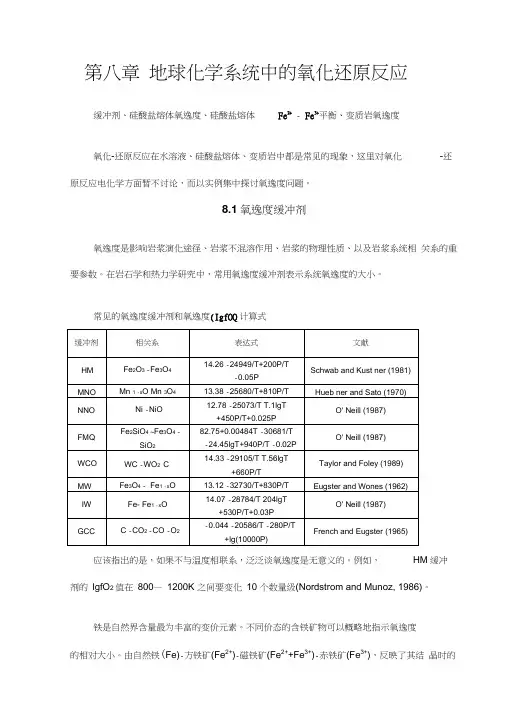
第八章地球化学系统中的氧化还原反应缓冲剂、硅酸盐熔体氧逸度、硅酸盐熔体Fe2+- Fe3+平衡、变质岩氧逸度氧化-还原反应在水溶液、硅酸盐熔体、变质岩中都是常见的现象,这里对氧化-还原反应电化学方面暂不讨论,而以实例集中探讨氧逸度问题。
8.1氧逸度缓冲剂氧逸度是影响岩浆演化途径、岩浆不混溶作用、岩浆的物理性质、以及岩浆系统相关系的重要参数。
在岩石学和热力学研究中,常用氧逸度缓冲剂表示系统氧逸度的大小。
常见的氧逸度缓冲剂和氧逸度(IgfOQ计算式应该指出的是,如果不与温度相联系,泛泛谈氧逸度是无意义的。
例如,HM缓冲剂的lgfO2 值在800—1200K 之间要变化10 个数量级(Nordstrom and Munoz, 1986)。
铁是自然界含量最为丰富的变价元素。
不同价态的含铁矿物可以概略地指示氧逸度的相对大小。
由自然铁(Fe)-方铁矿(Fe2+)-磁铁矿(Fe2++Fe3+)-赤铁矿(Fe3+),反映了其结晶时的氧逸度依次增高。
在火山岩中,铁镁矿物和氧逸度之间的平衡主要决定于熔体和斑晶相矿物的总成分。
在相似的温度下,随氧逸度由低到高,铁镁矿物一般将依次出现橄榄石、斜方辉石、角闪石和黑云母。
为讨论问题的方便,人们常用相对于FMQ缓冲剂的氧逸度dgf ozb MQ)来表示岩浆系统氧逸度的大小,定义为△lgf°2(FMQ) = lgf o2-lgf°2(FMQ)。
某些火成岩△ lgf°2(FMQ)值如为:接近液相线的各种基性熔岩和大多数亏损型地幔尖晶石二辉橄榄石(mg# = 0.90)的△lgf o2(FMQ)= ±2.0,含铁橄榄石斑晶的流纹岩的△ lgf°2(FMQ) = 0.5—2.0,含斜方辉石和角闪石斑晶的流纹岩和英安岩的A lgf o2(FMQ) =1.0—2.0,含黑云母和/或角闪石斑晶的流纹岩的A lgf°2(FMQ) = 2.0—3.0。


有机化学中的氧化还原反应氧化还原反应是有机化学中一类重要的化学变化,指的是物质中电子的转移或共享。
在有机化学中,氧化还原反应是实现碳原子的功能团转化、合成和分解的关键步骤。
本文将为大家介绍有机化学中的氧化还原反应,并探讨其在有机合成中的应用。
一、氧化还原反应的基本概念氧化还原反应是指反应物中的一个物种失去电子,另一个物种获得电子的化学反应。
在有机化学中,氧化反应指一个物种失去电子,而还原反应则指一个物种获得电子。
该反应过程中,电子的转移或共享导致了物质结构的改变。
二、氧化还原反应的机理1. 氧化反应:氧化反应发生时,物种失去电子,并且氧化态数增加。
例如,烷烃在燃烧中与氧气发生反应,生成二氧化碳和水。
CH4 + 2O2 → CO2 + 2H2O2. 还原反应:还原反应发生时,物种获得电子,并且氧化态数减少。
例如,醛在还原反应中可以被还原为相应的醇。
RCHO + 2H2 → RCH2OH三、氧化还原反应在有机合成中的应用1. 氧化反应氧化反应广泛应用于有机合成中,能够实现一些重要的官能团转化。
例如,醇可以通过氧化反应转化为醛、酮或酸。
2. 还原反应还原反应在有机合成中也具有重要的应用价值。
例如,酮可以通过还原反应转化为相应的醇。
3. 氧化还原反应的催化剂氧化还原反应中,催化剂的选择和设计对反应的效率和选择性起着至关重要的作用。
金属催化剂被广泛应用于有机氧化还原反应中,能够提高反应速率、改善产率并实现对选择性的控制。
四、氧化还原反应的例子1. Wacker氧化Wacker氧化反应是一种将烯烃转化为醛或酮的重要反应。
该反应通常在氯铜配合物和碱的存在下进行。
2. 光氧化反应光氧化反应是指在光照条件下,有机物通过与氧气反应而产生氧化产物。
该反应广泛应用于药物合成等领域。
五、总结有机化学中的氧化还原反应是一类重要的化学变化,能够实现碳原子的功能团转化、合成和分解。
通过了解氧化还原反应的基本概念、机理以及应用,能够更好地理解有机化学反应的本质,并在有机合成中有针对性地设计反应路径和选择合适的催化剂。
氧化还原反应的本质与意义氧化还原反应(Redox Reaction)是一种化学反应,其中电子从一个原子(分子)转移到另一个原子(分子)。
在氧化还原反应中,原子(分子)的氧化态和还原态发生改变,同时伴随着电子的转移。
其中,被氧化的物质失去电子,被还原的物质获得电子,化学反应中的这类氧化还原反应的转移过程,即电子的转移,被称为氧化还原反应。
氧化还原反应的本质是介绍化学中的电子转移。
化学反应本质上是原子或离子之间的相互作用,这些原子或离子的电子外层总是存在空余电子或者缺少电子的情况,当两个物质接触时,它们会相互作用,从而导致电子的流动,这种电子流动的叫做氧化还原反应。
通常,氧化剂(Oxidant)的作用是使它们自己还原的物质得到电子,同时它们自己被氧化。
还原剂(Reducer)的作用与氧化剂相反,它们自己被氧化,同时使被还原的物质得到电子。
氧化还原反应在生物化学、环境化学、电化学和许多其他领域都具有重要的作用。
在生物化学中,氧化还原反应是细胞呼吸和能量生产的重要步骤,是细胞内代谢过程的主要动力。
在环境化学中,氧化还原反应是处理污染物和有机物等的主要方法之一,包括生物降解和自然生物地球化学循环等。
在电化学中,氧化还原反应是电池、电解和电镀等过程的基础。
氧化还原反应还具有重要的原理性知识意义。
它能够帮助我们理解化学反应的本质和物质之间的相互作用。
它可以帮助我们。
预测化学反应的结果以及对化学过程进行控制和制定计划。
此外,它还为我们理解许多其他学科提供了框架。
因此,氧化还原反应不仅仅是一种化学实验室中常见的反应,更是一种在各个领域中广泛使用的重要反应。
氧化还原反应的本质与意义是理解化学反应的本质,预测化学反应的结果以及对化学过程进行控制和制定计划。
1、克拉克值:是指元素地壳中重量百分含量。
2、元素的丰度值:每种化学元素在自然体中的质量,占自然体总质量(或自然体全部化学元素总质量)的相对份额(如百分数),称为该元素在该自然体中的丰度值.3、浓度克拉克值:浓度克拉克值=元素在某一地质体中平均含量/元素的克拉克值,它反映元素在地质体中集中和分散程度,大于1说明相对集中,小于1说明相对分散。
4、元素的地球化学迁移:元素从一种赋存状态转变为另一种赋存状态,并经常伴随元素组合和分布上的变化以及空间位移的作用称为地球化学迁移。
5、类质同象:某种物质在一定的外界条件下结晶时,晶体中的部分构造位置被介质的其它类似质点 (原子、离子、络离子、分子)所占据,结果只引起晶格常数的微小变化,而使晶体构造类型、化学键类型等保持不变的现象。
6、载体矿物和富集矿物载体矿物:载体矿物和富集矿物载体矿物是指岩石中所研究元素的主要量分配于其中的那种矿物。
但有时该元素在载体矿物中的含量并不很高,往往接近该元素在有时总体中的含量。
富集矿物是指岩石中所研究元素在其中的含量大大超过它在岩石总体中的含量的那种矿物。
7、元素的共生组合:具有共同或相似迁移历史和分配规律的元素常在特定的地质体中形成有规律的组合,称为元素的共生组合。
8、元素的赋存状态:也称为元素的存在形式、结合方式、相态、迁移形式等,指元素在其迁移历史的某个阶段所处的物理化学状态与共生元素的结合性质。
9、地球化学障:地球化学障指地壳中物理或化学梯度具有突变的地带,通常伴随着元素的聚集或堆积作用。
即在元素迁移过程中经过物理化学环境发生急剧变化的地带时,介质中原来稳定的元素迁移能力下降,形成大量化合物而沉淀,这种地带就称为地球化学障。
10、元素的地球化学亲和性:元素的地球化学亲和性,指阳离子在地球化学过程中趋向于同某种阴离子结合的性质。
分亲铁性(趋向于单质形式产出)、亲硫性(趋向于与硫形成强烈共价键的性质)和亲氧性(趋向于与氧形成强烈离子键的性质)11、亲氧元素:是指那些能与氧形成强烈离子键化合物的元素,如K、Na、Si、Al 等,通常以硅酸盐形式聚集于岩石圈。
化学中的氧化还原反应机制氧化还原反应,或者叫做氧化反应和还原反应,是我们化学学习中非常重要的一种反应类型。
它常常涉及到能源的转换和化学物质电子的传递和接受。
这种反应涵盖广泛,从生物过程到地球化学,都有着氧化还原反应的参与。
那么,围绕这个反应机制,我们需要了解哪些内容呢?定义和特征首先,我们来看看氧化还原反应的本质。
它是物质和氧或者其他电子接受者之间发生的一种化学反应,其中一个物质放弃了电子或者一些电子给了另外一个物质,这些电子转移导致原子数的变化。
这个放弃电子的物质被称为还原剂,接收电子的物质被称为氧化剂。
在氧化还原反应中,我们通常会看到一些特征,比如说颜色变化、气体生成、温度改变甚至是爆炸等等。
一个明显的氧化还原反应的例子是把金属加入到氢氧化钠中,得到氢气的反应。
这个过程中,金属原子将它的电子给了氢离子,形成一个离子化的金属和水分子,同时把氢离子还原成了氢气(还原剂是金属,氧化剂是氢离子)。
这个反应的方程式是2Na + 2H2O → 2NaOH +H2↑。
氧化剂和还原剂的特征那么,氧化剂和还原剂有哪些特征呢?首先要注意的是,氧化剂必须具有相对较高的电位,才能够接收电子。
氧化剂接受的电子来自还原剂,还原剂可能是离子(比如说氢离子),也可能是分子(比如说水)。
此外,那些化合物中含有相对较多氧的物质,往往就是氧化剂,因为氧元素很容易吸收电子。
还原剂能够失去电子,它们本身要相对具有较低的电位。
很多金属和非金属都有能够发生还原反应的性质。
另外,视过程而定,某些还原剂它们本身的构成可以是阳离子或阴离子。
电化学单元氧化还原反应的机制之一就是电化学单元。
它是一种可以通过电化学反应来产生电源的技术。
它利用了氧化还原的特性来导致电子的流动。
两个半电池被连接在一起,并且通过一个离子通道相互连接。
各个半电池中各自有一个电极和一个电解质。
当电子从一个电极分离时,与另一个电极的离子发生反应(也可能是一个电极中产生离子,被另一个电极的电子接收)。
氧化还原反应的本质与意义氧化还原反应是化学反应的一种重要类型,它涉及到化学物质之间的电子转移。
氧化还原反应的本质是电荷转移过程,其中一种物质失去电子,被氧化成为较高的氧化态,而另一种物质则接受这些电子,被还原为较低的氧化态。
氧化还原反应在自然界和人类生活中具有广泛的意义。
氧化还原反应是生物体能量转化的基础。
在生物体内,葡萄糖和氧气发生氧化还原反应,产生二氧化碳和水,释放出大量的能量。
这个反应是呼吸作用的核心,为我们的身体提供了能量。
氧化还原反应广泛存在于自然界的地球化学循环中。
大气中二氧化碳与水发生反应,生成碳酸和释放出氧气,这个过程叫做光合作用。
光合作用是地球上生命能够存在的基础,通过这个过程,植物能够利用太阳能将二氧化碳和水转化为有机物质,同时释放出氧气。
氧化还原反应还存在于许多其他的地球化学过程中,如降水的氧化反应、岩石和土壤中的还原反应等,这些过程和地球上的气候和环境变化有密切关系。
氧化还原反应在化学工业中也具有重要意义。
许多重要的化学反应都是以氧化还原反应为基础的。
电池和燃料电池就是利用氧化还原反应将化学能转化为电能的装置。
在工业生产中,许多金属的提取和精炼过程中,也需要进行氧化还原反应。
氧化还原反应还可用于合成有机化合物,如醛、酮、酯等。
氧化还原反应也在环境保护和治理中扮演重要角色。
废水处理中常常使用氧化还原反应来去除有毒物质和污染物。
还有一些氧化还原反应可以将有害气体转化为无害的物质,减少对环境的危害。
氧化还原反应是化学反应中的重要类型,涉及到电子转移和能量转化。
它在生物体能量转化、地球化学循环、化学工业生产以及环境保护和治理中都具有广泛的意义。
对于我们理解自然界和改善人类生活环境具有重要的价值。
第1篇摘要:光合作用是植物、藻类和某些细菌利用光能将无机物转化为有机物的过程。
在这个过程中,氧化还原反应起着至关重要的作用。
本文将从光合作用的概述、光合作用中的氧化还原反应类型、光合作用中的氧化还原反应机理以及光合作用氧化还原反应的意义等方面进行探讨。
一、光合作用的概述光合作用是植物、藻类和某些细菌利用光能将无机物转化为有机物的过程。
这个过程主要发生在植物叶片的叶绿体中,分为光反应和暗反应两个阶段。
二、光合作用中的氧化还原反应类型1. 光反应中的氧化还原反应光反应是光合作用的第一阶段,其主要功能是将光能转化为化学能。
在光反应中,氧化还原反应主要涉及以下两个过程:(1)水的光解:水分子在光的作用下分解为氧气、氢离子和电子。
反应式如下:2H2O → 4H+ + 4e- + O2(2)ATP和NADPH的合成:光能被捕获后,通过一系列的电子传递和质子转移,最终产生ATP和NADPH。
反应式如下:ADP + Pi + 2H+ + 2e- → ATPNADP+ + 2H+ + 2e- → NADPH + H+2. 暗反应中的氧化还原反应暗反应是光合作用的第二阶段,其主要功能是将光反应产生的ATP和NADPH用于固定二氧化碳,合成有机物。
在暗反应中,氧化还原反应主要涉及以下两个过程:(1)二氧化碳的固定:二氧化碳与五碳糖(RuBP)反应,生成两分子的三碳糖磷酸(3-PGA)。
反应式如下:CO2 + RuBP → 3-PGA(2)三碳糖磷酸的还原:三碳糖磷酸在ATP和NADPH的作用下,经过一系列的还原反应,最终生成糖类物质。
反应式如下:3-PGA + ATP + NADPH → 葡萄糖 + ADP + Pi + NADP+三、光合作用中的氧化还原反应机理1. 光反应机理光反应的机理主要包括以下步骤:(1)光能的吸收:叶绿素分子吸收光能,将光能转化为化学能。
(2)电子传递:吸收光能的叶绿素分子将电子传递给电子传递链中的其他分子,如P680、P700等。
第八章地球化学系统中的氧化还原反应缓冲剂、硅酸盐熔体氧逸度、硅酸盐熔体2+––3+平衡、变质岩氧逸度氧化-还原反应在水溶液、硅酸盐熔体、变质岩中都是常见的现象,这里对氧化-还原反应电化学方面暂不讨论,而以实例集中探讨氧逸度问题。
8.1 氧逸度缓冲剂(马鸿文辑,2001)氧逸度是影响岩浆演化途径、岩浆不混溶作用、岩浆的物理性质、以及岩浆系统相关系的重要参数。
在岩石学和热力学研究中,常用氧逸度缓冲剂表示系统氧逸度的大小。
常见的氧逸度缓冲剂和氧逸度(2)计算式应该指出的是,如果不与温度相联系,泛泛谈氧逸度是无意义的。
例如,缓冲剂的值在800—1200K之间要变化10个数量级( , 1986)。
2铁是自然界含量最为丰富的变价元素。
不同价态的含铁矿物可以概略地指示氧逸度的相对大小。
由自然铁()→方铁矿(2+)→磁铁矿(23+)→赤铁矿(3+),反映了其结晶时的氧逸度依次增高。
在火山岩中,铁镁矿物和氧逸度之间的平衡主要决定于熔体和斑晶相矿物的总成分。
在相似的温度下,随氧逸度由低到高,铁镁矿物一般将依次出现橄榄石、斜方辉石、角闪石和黑云母。
为讨论问题的方便,人们常用相对于缓冲剂的氧逸度(FMQ)lgf Δ2O 来表示岩浆系统氧逸度的大小,定义为(FMQ)f lg lgf (FMQ)lgf Δ222O O O -=。
某些火成岩(FMQ)lgf Δ2O 值如为:接近液相线的各种基性熔岩和大多数亏损型地幔尖晶石二辉橄榄石( = 0.90)的(FMQ)lgf Δ2O = ±2.0,含铁橄榄石斑晶的流纹岩的(FMQ)lgf Δ2O = 0.5—2.0,含斜方辉石和角闪石斑晶的流纹岩和英安岩的(FMQ)lgf Δ2O = 1.0—2.0,含黑云母和/或角闪石斑晶的流纹岩的(FMQ)lgf Δ2O = 2.0—3.0。
大多数洋底玄武岩的相对氧逸度在之下3个单位。
富碱贫硅的基性熔岩较之拉斑玄武岩的氧逸度要高许多,并可出现早期结晶的硫酸盐矿物。
洋底玄武岩具有相对稳定的氧逸度的原因是其含有足够量的硫,足以作为500 O 2的缓冲池。
对于任何富铁玄武岩的分异趋势,为使O 2缓冲所需的硫为500。
对于较小富铁的液相下降线,所需硫的浓度更小。
实际上,洋底玄武岩硫的丰度为1000—1800。
这就使整个岩浆通过硫化物氧化为硫酸盐的反应、从而作为一个封闭的化学系统而分异,维持一个相对恒定的氧逸度范围。
在粗安岩-流纹岩质熔体中,硬石膏在(NNO)lgf Δ2O >1.0—1.5的范围稳定存在。
在(NNO)lgf Δ2O <2.5—3.0的区域内,磁黄铁矿(或富的液态硫化物相)稳定存在。
在(NNO)lgf Δ2O =1.0—1.5至2.5—3.0区间,硬石膏与磁黄铁矿稳定共存。
8.2 岩浆岩的氧逸度(马鸿文辑,2001)铁是硅酸盐浆中呈两种价态存在的主要元素,2+–– 3+平衡不仅显著地影响岩浆作用的演化趋势,而且由于2+和3+在熔体相中具有不同的结构,从而影响熔体的性质,例如密度和黏度等。
氧是岩浆中具有相当化学活动性的组分。
岩浆演化过程中氧逸度的变化明显地影响岩浆的结构、流变学性质、化学成分和岩浆系统的相关系。
对熔体相2+––3+平衡的研究,可以获得氧逸度变化的信息,因而具有重要的岩石学意义。
8.2.1 橄榄石+斜方辉石+尖晶石组合与火成岩的氧逸度氧逸度是地幔作用过程中一个基本的、但又是了解得较少的一个强度变量。
对上地幔氧逸度的研究具有以下重要意义:(1)研究上地幔的氧逸度是否适合于富铁金属相的分凝作用而形成地核。
这对于研究地球的早期演化历史至关重要;(2)上地幔的氧逸度控制着与元素碳(石墨或金刚石)处于平衡状态下系统流体相的赋存状态。
流体在相对高氧逸度(约)的氧化条件下,主要呈22O。
在中等还原条件下(缓冲剂以下2—3个单位),呈H24。
在低氧逸度(缓冲剂)的强还原条件下,则主要呈42( , 1989)。
因此,氧逸度通过影响流体相的赋存状态间接地影响含挥发份条件下的上地幔部分熔融作用和地幔交代作用。
氧逸度也直接控制着在地球深部是否存在着永远耗不尽的天然气(O’ , 1987)?确定上地幔氧逸度的方法主要有三种:(1)采用电化学方法直接测定地幔橄榄岩包体的内在氧逸度;(2)通过分析原生玄武岩的2O3、含量来间接了解上地幔源区的氧逸度;(3)采用矿物温压计方法,根据相平衡实验或有关的热力学资料,计算地幔岩的矿物组合平衡的氧逸度。
对于上地幔I型(或A型,铬透辉石组合)和型(或B型,铝普通辉石组合)尖晶石二辉橄榄岩和方辉橄榄岩,其矿物组合平衡的氧逸度可以由以下的平衡反应来计算( , 1988):624 + O2= 322O6+ 23O4这一反应可称为()缓冲剂。
但是,实际上,由组合计算氧逸度时受到尖晶石相中3O4组分活度-成分关系(模型)的不确定度的严格限制。
因为在地幔尖晶石中,3O 4端元组分的含量很低(3O4=0.02—0.10 , 1988)。
对天然矿物的电子探针分析的一般误差将导致氧逸度计算结果相当大的误差。
鉴于此, . (1991)对人工合成的尖晶石二辉橄榄岩、方辉橄榄岩进行了相平衡实验,对氧逸度计予以标定。
实验条件为1040—1300ºC 、0.3—2.7 。
氧逸度由()、2()、()、3O 42O 3()缓冲剂所控制。
选择石墨、橄榄石、合金作为试样容器。
实验在活塞压力罐中和流体过剩的条件下进行。
结果表明,在实验的温度、压力、成分范围内,尖晶石相的3 比值是氧逸度的线性函数(2, 3 0.02, , 0.10, , 0.25, , 0.75)。
在一定的(FMQ)lgf ΔO2下,尖晶石相的3 比值与温度无关,而随尖晶石的含量的增大略有减小,随压力的增大而降低。
在一定的温度、熔融程度、总成分下,尖晶石的()比值随氧逸度的升高而增大。
. (1991)的实验中,尖晶石覆盖了很宽的成分范围:() = 0.20—0.85, 3 = 0.020—0.80。
因此,有可能对缓冲剂进行标定。
对于橄榄石+斜方辉石+尖晶石()组合,氧逸度由下式给出:Spn Mgt Opx Fs OlFa 000O22lga 3lga 6lga 2.303RTV P ΔH ΔS T Δlgf ++---= 相对于缓冲剂的氧逸度为:Spn MgtOpx Fs OlFa 0FMQ 0FFM 0FMQ 0FFM 0FMQ 0FFM O22lga 3lga 6lga 2.303RT )V Δ P(V ) H H (Δ)S ΔS T(Δ(FMQ)lgf Δ++------=. (1991)采用最小二乘法拟合实验资料,得到如下氧逸度计算公式:/T )2630(X 4lgX 2lgX /T)X 3200(16lga 400P/T 2505/T 0.27(FMQ)lgf Δ2Spn Al SpnFe3SpnFe22Ol Fe Ol Fa O2+++----+=++式中P 的单位为,+++=33Spn Fe3R /ΣFe X ,+=3Spn Al RAl/ΣX ,)Fe /(Fe Fe X 322Fe2+++++=。
为了简化计算,上式中消去的相当于OlFa a 理想部分的斜方辉石一项。
以上公式仅适用于地幔岩,不应该外推到OlFe X >0.15的富铁岩石。
对于更富铁的岩石,消去斜方辉石的简化是不正确的。
该方法也不适用于石榴石二辉橄榄岩和金刚石稳定区的条件。
因为在高Spn Cr X 和低氧逸度下,会出现镁方铁矿不符合化学计量性质或尖晶石相2+的替代作用。
实际应用表明,将上式应用于低至约800ºC 的温度下,仍可获得合理的结果。
应该强调指出,虽然在上式中未出现斜方辉石,但是,只有在橄榄石和斜方辉石同时存在而使系统的SiO2a 得以缓冲的条件下,所计算的氧逸度才是正确的。
(1992)应用 . (1991)的方法,发现与实验平衡的组合的氧逸度并不一致,其误差达0.5—1.0个单位,与尖晶石的比值具有依赖关系。
(1992)指出,采用尖晶石相中3O 4活度的—模型,可以获得更精确的(0.3—0.5个单位)与实验结果相吻合的氧逸度计算结果。
在800—1300ºC 下,对于Fe3O4X = 0.008—0.060的地幔尖晶石,其3O 4的活度为: Cr Mg Cr Al 2Cr Al Mg 2Al 2Fe3Fe2Fe3O4N 346N N 199N 229N N 653N 1/T(406N/4)N lg(N lga +++++=++式中为以4个氧为准计算的尖晶石分子式中元素的数量。
反应43622242O 2Fe O Si 3Fe O SiO 6Fe +=+的氧逸度为:SpnFe3O4Opx M2Fe M1Fe 2Ol Mg OlFeO2O22lga )X 3lg(X /T )2620(X - 12lgX -/T 3690P(GPa)-0.35220/T(K)(FMQ)lgf lgf ++++=由该式计算的氧逸度误差为±0.5个单位。
氧逸度的岩石学应用将 . (1991)的方法应用于典型的地幔岩和地幔衍生的原生熔体,揭示了如下的氧逸度变化趋势:未亏损的、富集型地幔源区及其衍生的熔体呈中等还原状态((FMQ)lgf Δ2O ≌—2);亏损型和深海橄榄岩呈(FMQ)lgf Δ2O ≌—1的氧化状态,可能代表了最上部大洋岩石圈的典型的氧逸度条件;富集型和交代的尖晶石方辉橄榄岩更为氧化((FMQ)lgf Δ2O —1);而岛弧玄武岩()和阿拉斯加型侵入体是最为氧化的火成岩(((FMQ)lgf Δ2O ≌2)。
上述结果对于了解地幔作用具有以下重要意义:(1)地幔交代作用伴随着氧化作用。
如果将计算的交代样品的氧逸度作为下限,则富集组分的氧化状态可能在1∽2之间;(2)如果计算的岛弧岩浆的氧逸度(2)代表地幔源区的氧化状态,则在火山弧下的硫化物是不稳定的。
亲铜元素在部分熔融过程中具有不相容元素的行为。
如果原生岛弧岩浆富含亲铜元素,那么,阿拉斯加型超镁铁侵入体、岛弧苦橄岩、富辉橄玄岩()质次火山岩通常含有铂族元素矿床显然是一种巧合。
与此类似,还原性的碳也是不稳定的,但可以出现碳酸岩或碳酸岩质熔体。
(3)在会聚板块边界,相对氧化的岩石圈的再循环有可能导致氧化状态的长期变化。
这可能是控制上地幔大规模的氧逸度结构的主要因素。
如果考虑在形成金刚石的过程中,氧化的再循环物质(富2的硅酸盐或碳酸岩熔体)与还原的()岩石圈相互作用,则含金刚石岩石圈的低氧化状态,可以解释为地球历史早期阶段的残余,当时的上地幔总体上处于更加还原的状态。
上地幔氧逸度的的下限如果上地幔二辉橄榄岩、方辉橄榄岩处于足够还原的氧逸度条件下,则最终将分凝出富的金属相。