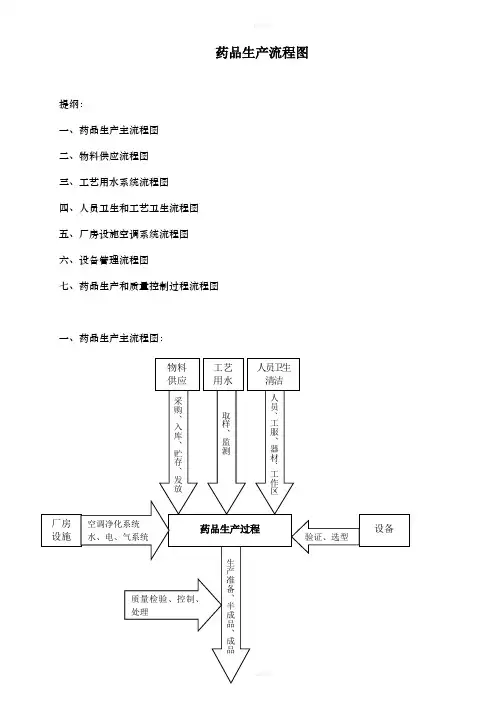
药品生产流程图
- 格式:doc
- 大小:148.91 KB
- 文档页数:8


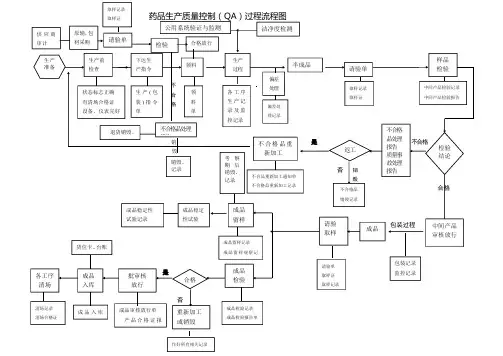
不合格销是不合格毁否销毁合格包装过程是否药品生产质量控制(QA)过程流程图生产准备生产前检查下达生产指令生产过程偏差处理样品检验检验结论返工成品成品留样生产(包装)指令单各工序生产记录及监控记录偏差处理记录半成品请验单取样记录取样证中间产品检验记录中间产品检验报告中间产品审核放行请验取样请验单取样证取样记录成品稳定性试验成品稳定性试验记录成品检验成品检验记录成品检验报告单成品留样记录成品留样观察记批审核放行合格成品入库成品审核放行单产品合格证报重新加工或销毁作好所有相关记录成品入库不合格品处理报告质量事故处理报告不合格品销毁记录不合格品重新加工不合品重新加工通知单不合格品重新加工记录状态标志正确有清场合格证设备、仪表完好领料领料单各工序清场清场记录清场合格证包装记录监控记录货位卡、台账洁净度检测公用系统验证与监测考察期后销毁、记录供应商审计原辅,包材采购请验单取样记录取样证检验合格放行不合格品处理报告退货销毁、销毁、记录文件产品质量标准省级以上药品检验报告单组织机构代码证税务登记证书应为合法有效版本审计:公司每年对所选择供应商进行审计(现场审计、非现场审计)并出具公司质量部的审计报告,具体按供应商审计管理标准内容进行。
每年未应制定出下年度的合格供应商目录,并受权人签字确认,分发至物料部门采购部门,质量部存档1.按以上目录内先择相应0购入材料的供应商,并签定购销合同及质量保证协议书同货存档,再进行采购。
1采购到位的合法材料,在进入库前进行初验,填写初验记录。
合格后进行待验区,做好状态标示及货位卡,填写请验单,请验质量部。
2.取样员取样应填写取样单、取样证、带好取样器具取样,并做好取样记录,填好货位卡的取样量。
物料部门应在取样前后做好取样车使用记录。
取过样的物料应放至最上层,生产时应先出。
1.取样后按时效进行分样检验(检验原始记录、检验台账(合格与不合格)、试剂领用、配制记录(毒剧试剂的领用、配制、销毁记录)、标准品、液领用、配制记录、标定复标记录、检验仪器使用记录、检定菌传代与使用销毁记录)并出具报告单(一式三份)。

硫酸庆大霉素生产工艺一、硫酸庆大霉素产品说明 1、产品名称及化学结构1。
1产品名称:硫酸庆大霉素(Gentamycin sulfate ) 1。
2化学结构: 1。
2。
1结构式:·2H 2SO 4C 1: R 1=R 2=CH 3C 2: R 1=CH 3 R 2=H C 1a : R 1=R 2=H 1。
2。
2分子式:C 1: C 21H 43N 5O 7=477.61 C 2: C 20H 41N 5O 7=463.58 C 3: C 19H 39N 5O 7=449.55 1。
2.3分子量: C 1: 477.61 C 2: 463.58 C 3: 449.55C 1、C 2、C 1a 为硫酸庆大霉素的三个组分,各组分与2个分子的硫酸相结合,其成分折干效价为590µ/ml 以上。
2、理化性质2.1性状:白色或类白色粉末,吸水性强,稳定性高,易溶于水,不溶于乙醇、丙酮、氯仿等有机溶剂。
2.2比旋度:+1070~ +12103、产品质量标准 (查药典)二、原材料、包装材料质量标准及规格1、发酵部分 OO N HR1R2NH 2OOO HN HOH CH 3N H 2OH N H 32、提取部分三、生产方法及原理简介硫酸庆大霉素的生产是以绛红色小单孢菌()2号作为庆大霉素生产用菌种,在蒸汽消毒的培养基中不断扩大培养、发酵,通过菌种的次级代谢分泌出具有抑菌活性的庆大霉素。
用离子交换树脂提取出菌分泌的活性物质,经精制、转盐生产出硫酸庆大霉素原料药.用以制成各种硫酸庆大霉素制剂,应用于临床治疗。
四、硫酸庆大霉素生产工艺流程图及操作条件硫酸庆大霉素的生产过程主要包括以下四个部分:发酵生产、提取、精制、无菌压缩空气、无菌喷雾干燥。
1、硫酸庆大霉素生产工艺流程图:35℃23hr 35℃35℃35℃种子瓶一级种子罐二级种子罐发酵罐250rpm 38hr 22hr 96hr酸化 6 hr放罐732树脂静态吸附过筛饱和树脂漂洗中和漂去酸洗4。
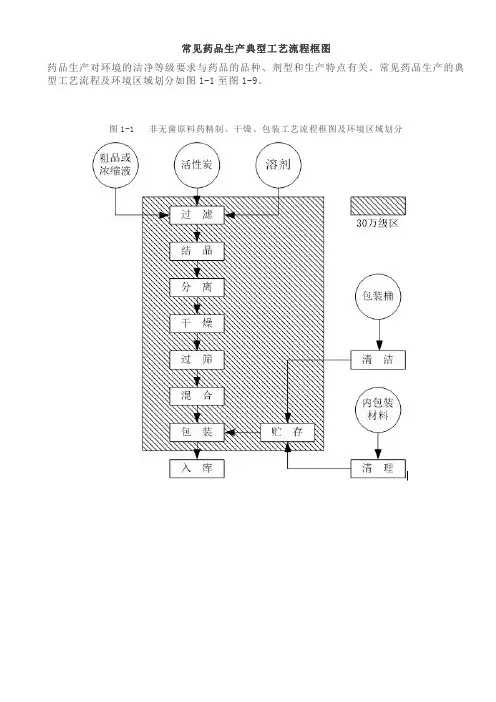
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关。
常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9。
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。

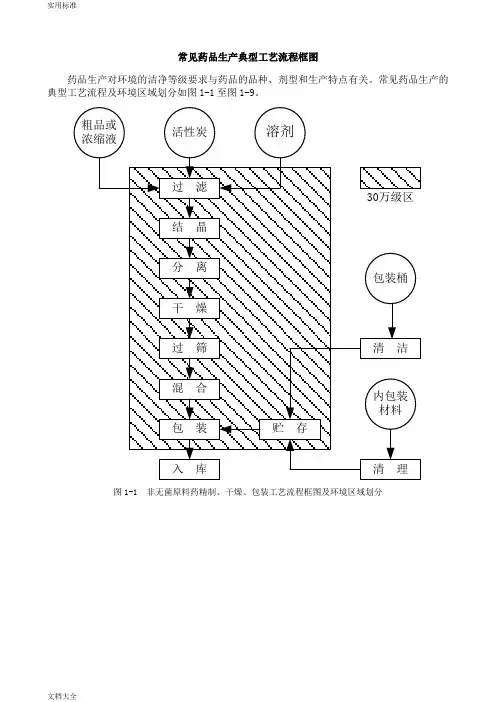
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关;常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9;
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。
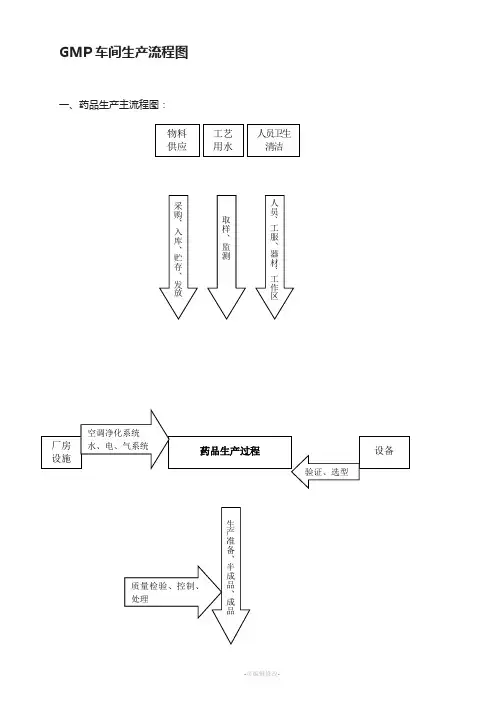
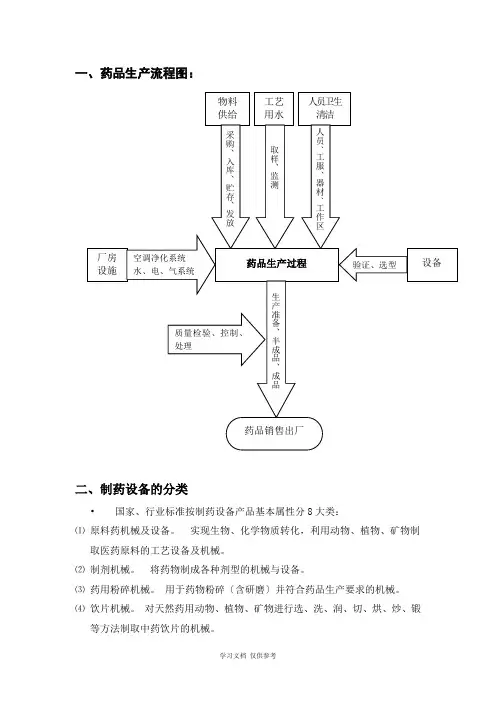
一、药品生产流程图:二、制药设备的分类•国家、行业标准按制药设备产品基本属性分8大类:⑴原料药机械及设备。
实现生物、化学物质转化,利用动物、植物、矿物制取医药原料的工艺设备及机械。
⑵制剂机械。
将药物制成各种剂型的机械与设备。
⑶药用粉碎机械。
用于药物粉碎〔含研磨〕并符合药品生产要求的机械。
⑷饮片机械。
对天然药用动物、植物、矿物进行选、洗、润、切、烘、炒、锻等方法制取中药饮片的机械。
⑸制药用水设备。
采用各种方法制取制药用水的设备。
⑹药品包装机械。
完成药品包装过程以及与包装过程相关的机械与设备。
⑺药用检测设备。
检测各种药物制品或半制品质量的仪器与设备。
⑻其他制药机械及设备。
执行非主要制药工序的有关机械与设备。
•其中制剂机械按剂型分14类:⑴剂机械。
将原料药与辅料经混合、造粒、压片、包衣等工序制成各种形状片剂的机械与设备。
⑵针剂机械。
将药液制作成安瓿针剂的机械与设备。
⑶生素粉、水针剂机械。
将粉末药物或药液制作成玻璃瓶抗生素粉、水针剂的机械与设备。
⑷液剂机械。
将药液制作成大剂量注射剂的机械与设备。
⑸胶囊剂机械。
将药物充填于空心胶囊内制作成硬胶囊剂的机械与设备。
⑹胶囊〔丸〕剂机械。
将药液先裹于明胶膜内的制剂机械与设备。
⑺剂机械。
将药物细粉或浸膏与赋形剂混合,制成丸剂的机械与设备。
⑻膏剂机械。
将药物与基质混匀,配制成软膏,定量灌装于软管内的制剂机械与设备。
⑼剂机械。
将药物与基质混合,制成栓剂的机械与设备。
⑽服液剂机械。
将药液制成口服液剂的机械与设备。
⑾膜剂机械。
将药物浸透或分散于多聚物薄膜内的制剂机械与设备。
⑿雾剂机械。
将药液和抛射剂灌注于耐压容器中,制作成药物以雾状喷出的制剂机械与设备。
⒀眼剂机械。
将药液制作成滴眼药剂的机械与设备。
⒁水、糖浆剂机械。
将药液制作成酊水、糖浆剂的机械与设备。
三、原料药生产设备生物制药反应过程设备一培养基配制及灭菌设备1、培养基实罐灭菌方法及设备2、培养基连续灭菌方法及设备连续灭菌的基本设备一般包括:①配料预热罐,将配制好的料液预热到60-75℃,以防止连续灭菌时由于料液与蒸汽温差过大而产生水汽撞击声;②连消塔,连消塔的作用主要是使高温蒸汽与料液迅速接触混和,并使料液的温度很快升高到灭菌温度〔126-132〕℃;③维持罐,连消塔加热的时间很短,光靠这段时间的灭菌是不够的,维持罐的作用是使料液在灭菌温度下保持5-7min,以到达灭菌的目的;④冷却管,从维持罐出来的料液要经过冷却排管进行冷却,生产上一般采用冷水喷淋冷却,冷却到40-50℃后,输送到预先已经灭菌过的发酵罐内。

****药业有限公司GMP培训教材《颗粒剂(冲剂)工艺流程图及生产管理要点》颗粒剂(冲剂)工艺流程图及环境区域划分示意图生产管理要点:1.备粒室1.1.备料室的洁净度级别与生产要求一致,并有捕尘和防止交叉污染的有效设施,也不得作为通路。
1.2.按批生产指令或批包装指令分别备料。
生产用原辅料及包装材料应分设备料室。
1.3.领取的物料均应有合格证或检验合格报告书,并同时核对物料的品名、批号、规格、数量等应相符。
1.4.根据不同性质物料,分别配备不同有效设施。
如垫货板、货架、货柜、货框等。
贵细药、毒麻药或标签等物料应入柜上锁。
1.5.备料室内物料均应有明显标志,并做到物料领发记录准确,手续齐全。
1.6.车间生产剩余物料,应检查质量,封口,包装完好后退库。
2.生产前准备2.1.原料、辅料、中间产品使用前需核对品名、规格、批号、厂牌和数量,并目检、过筛,液体应过滤。
2.2.处理后的原辅料应在容器内外附有标志,写明品名、规格和重量,做好记录。
2.3.直接接触药品的包装材料、容器,应符合要求,并采用双层包装,符合质量标准要求。
2.4.其它各项要求见通则3.生产过程3.1.配料3.1.1.浸膏应贮藏在洁净的容器中,并附合格证。
3.1.2.配料前先核对原料或浸膏和辅料品名、数量、规格、批号、生产厂,应与检验合格报告书相符。
配料计算、称量及投料应复核,操作者及复核者均应在记录上签名。
3.1.3.粘合剂的温度、浓度等技术参数应符合工艺要求。
3.2.制粉和制软材3.2.1.喷雾干燥制粉3.2.1.1.在浸膏中逐渐加入辅料或粘合剂,调节到适合喷雾干燥的相对密度。
3.2.1.2.按工艺要求制定喷雾干燥的进风温度、排风温度、雾化器的高速离心转速和加料器流量,并记录。
3.2.1.3.控制喷雾塔内温度,防止产生粘壁现象,并控制水分在规定范围内。
3.2.1.4.干燥后的粉末放凉后,装入洁净的容器中,注意防潮。
3.2.2.制软材:将药粉混均匀后,逐渐加入稠膏或粘合剂,制成适宜软材。