最新《元素周期表》(元素周期表的结构)
- 格式:ppt
- 大小:2.66 MB
- 文档页数:40

元素周期表的基本结构与特点元素周期表是化学中一项重要的工具,用于组织和分类元素。
它以一种整洁、有序的方式呈现了所有已知元素的基本信息。
本文将介绍元素周期表的基本结构和特点。
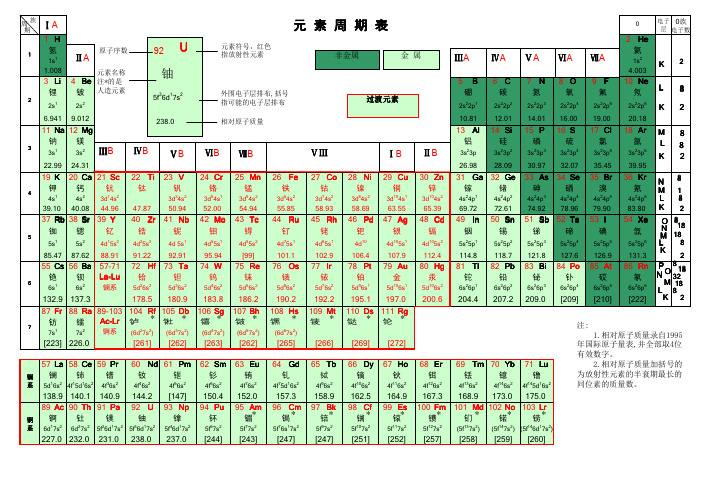
1. 元素周期表的基本结构元素周期表按照一定规律将所有元素分类,并将其排列在一个方格状的表格中。
表格中的每个方格代表一个元素,按照从左到右和从上到下的顺序排列。
每个方格包含了元素的符号、原子序数、相对原子质量和元素名称等信息。
2. 周期与族元素周期表按照元素的物理和化学性质将元素分为周期和族。
周期是指元素在周期表中的水平行,共有7个周期。
第一周期只包含两个元素(氢和氦),而第七周期则是目前尚未被发现的超重元素。
族是指元素在周期表中的垂直列,共有18个族。
族数越小,元素的性质越相似。
3. 元素周期表的特点(1)周期性:元素周期表的主要特点是周期性,即元素的性质和周期号有关。
同一周期的元素具有相似的外层电子结构,因此它们的化学性质也相似。
例如,第一周期的元素都是气体,具有较低的沸点和熔点。
(2)原子序数增加规律:从左到右和从上到下,元素的原子序数逐渐增加。
原子序数是指元素原子核中的质子数量,也是元素的唯一标识。
原子序数的增加反映了元素化学性质的变化。
(3)周期表的分区:周期表根据元素的一些共同特征进行了分区。
主要分为主族元素、过渡金属、稀土金属和贵金属等。
这种分区方式有助于我们了解元素的特性和应用。
(4)元素周期表的扩展:随着科学技术的发展和新元素的发现,元素周期表不断扩展。
最初的周期表只包含了少数元素,而今天的周期表已经扩展到118个已知元素。
4. 元素周期表的应用元素周期表不仅仅是化学教学的基础工具,还具有广泛的应用价值。
它可以帮助科学家研究元素的性质和相互作用。
此外,周期表还在材料科学、药物研发、环境保护等领域发挥着重要作用。
通过对周期表的研究和应用,人们可以更好地理解元素和它们之间的关系,推动科学的发展。
总结:元素周期表作为化学领域的重要工具,具有整洁美观的排列结构和明确的信息呈现方式。


化学元素周期表超清可打印
元素周期表是一张表格,用于展示元素的周期性和规律性。
其中,元素被分为周期和族两个维度。
周期是指元素的电子层数和电子排布方式。
周期数越大,元素的电子层数越多,化学性质也越复杂。
而族则是指元素的原子结构中,最外层电子的数量和排布方式。
族数越大,最外层电子数量越多,元素的化学性质也越相似。
周期表中的元素按照原子序数从小到大排列。
原子序数是指元素原子核中质子的数量,也是元素的唯一标识符。
元素符号则是用来代表元素的缩写,通常由元素名称的第一个或前两个字母组成。
元素周期表中的元素分为金属、非金属和半金属三类。
金属元素通常具有良好的导电性和热导性,而非金属元素则通常是不良导体。
半金属元素则介于两者之间,具有一些金属和非金属的性质。
元素周期表中的元素还可以按照其所属的族进行分类。
其中,IA到VIIIA族元素分别为碱金属、碱土金属、过渡金属、稀土金属、铂族元素、卤素和惰性气体。
这些族的元素具有各自独特的化学性质和用途。
总之,元素周期表是化学家们用来研究元素和化学反应的基础工具。
通过周期表,我们可以更好地了解元素之间的相互关系和规律,为科学家们的研究提供了便利。


化学元素周期表(完整版)
介绍
化学元素周期表是由化学元素按照其原子序数、电子排布和化学性质等规律进行排列的表格。
它是化学研究中的基础工具,用于传达元素的基本信息和特性。
本文档将提供一个完整的化学元素周期表,其内容包括元素的名称、原子序数、原子量、元素符号以及简要的特性说明。
元素列表
(注:上表只列出部分元素,完整版元素周期表可参考其他资源)
结论
元素周期表的完整版包含了大量的元素信息,通过学习元素周期表,可以更好地理解元素的特性和相互关系。
对于化学研究、材料开发和生命科学等领域的学习和实践,元素周期表都起到了重要的指导作用。
(完整版)元素周期表详解元素周期表中元素及其化合物的递变性规律1 原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
注意:原子半径在VIB族及此后各副族元素中出现反常现象。
从钛至锆,其原子半径合乎规律地增加,这主要是增加电子层数造成的。
然而从锆至铪,尽管也增加了一个电子层,但半径反而减小了,这是与它们对应的前一族元素是钇至镧,原子半径也合乎规律地增加(电子层数增加)。
然而从镧至铪中间却经历了镧系的十四个元素,由于电子层数没有改变,随着有效核电荷数略有增加,原子半径依次收缩,这种现象称为“镧系收缩”。
镧系收缩的结果抵消了从锆至铪由于电子层数增加到来的原子半径应当增加的影响,出现了铪的原子半径反而比锆小的“反常”现象。
2元素变化规律(1)除第一周期外,其余每个周期都是以金属元素开始逐渐过渡到非金属元素,最后一稀有气体元素结束。
(2)每一族的元素的化学性质相似3元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3) 所有单质都显零价4单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增5元素的金属性与非金属性(1)同一周期的元素电子层数相同。
因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增;(2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
6最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
最新化学元素周期表
现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,、
他将当时已知的63种元素依原子量大小并以表的形式排列,
把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
利用周期表
,门得列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,
发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质
,并把元素依照核内正电荷(即质子数或原子序)排列,经过多年修订后才
成为当代的周期表。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。