PCR扩增检测转基因大豆(精)
- 格式:ppt
- 大小:3.55 MB
- 文档页数:23



转基因大豆植株数字PCR在分析中的应用1。
介绍如今,转基因作物通常在美国种植。
根据从美国农业部最近的报告,基因种植作物(主要是玉米,棉花和大豆)种植约2013美国土地一半用于农作物(HTTP:/ / www.ers。
农业部政府/媒体/ 1282246 / err162 .pdf)。
其他国家,如中国和巴西,正在迅速赶上采用和种植转基因作物为工程性状的好处,如除草剂耐受性和抗虫性。
不过,公众仍然非常关注基因的潜在风险改性生物(转基因生物)对人类,动物和环境[ 1 ] - [ 6 ]。
一些国家已经采取严格的法规来控制转基因生物,例如,欧洲联盟(欧盟)。
检测和量化的转基因生物是必要的执行这些规定。
目前,各种DNA聚合酶链反应PCR(PCR)方法通常用于检测和/或量化转基因转基因生物由于其敏感性,例如,定期终点PCR和实时定量PCR(qPCR)方法,尤其是后者[ 5 ] [ 7 ] - [ 16 ]。
偶尔,其他方法,1如生物传感器和免疫测定,也用于分析转基因生物[ 5 ] [ 7 ]—[ 13 ]。
此外,一些新技术,如新一代测序和数字PCR(dPCR),也被用在分析转基因生物,例如,[ 15 ] [ 17 ] [ 18 ][ 19 ] [ 20 ] [ 21 ]。
采用反应是基于以下原则:一是充分的DNA模板随后稀释成许多独立的小等体积反应(在威尔斯或液滴中)。
以及这些反应中模板分子的数目服从泊松分布。
因此,绝对量化可以通过以下方式实现比较正面和负面的反应[ 14 ] [ 22 ] [ 23 ] [ 24 ] [ 25 ] [ 26 ]。
因此,检测具有以下在qPCR的潜在优势。
检测可以准确在未经认证的参考下确定样品中核酸分子的数目材料和标准曲线;一个模板也相应稀释稀释可能出现在模板使检测抑制剂不敏感的抑制剂[ 27 ] [ 28 ],因此进一步提高精度和效率。
这些属性和很多的应用优势使得检测灵敏度或一个很好的工具需要精确的核酸定量,如识别突变或拷贝肿瘤细胞的数量变化,低拷贝核酸靶的检测,或检查基因表达在单细胞水平[ 26 ] [ 29 ] [ 30 ] [ 31 ] ]。



大豆转基因检测标准1. 背景介绍大豆是世界上最重要的农作物之一,它不仅是一种重要的食物来源,还被广泛用于饲料和工业原料。
然而,随着转基因技术的发展,转基因大豆的种植和使用逐渐增多。
转基因大豆不仅在农业上具有重要意义,还引发了广泛的争议。
因此,制定一套严格的大豆转基因检测标准对于保障食品安全和消费者权益至关重要。
2. 转基因技术概述转基因技术是指通过人工手段将外源基因导入到目标生物体中,并使之在目标生物体中表达。
在大豆中引入外源基因可以使其具有抗虫、抗草甘膦等特性。
然而,转基因技术也引发了人们对食品安全和环境影响等问题的担忧。
3. 国际转基因检测标准为了保证食品安全和国际贸易畅通,国际上制定了一系列关于转基因检测的标准。
其中最为知名且被广泛采用的是国际贸易法组织(Codex Alimentarius Commission)制定的转基因食品检测指南。
该指南包括了转基因检测的样品准备、检测方法、结果解释等方面的要求,为各国制定转基因食品标签要求提供了依据。
4. 国内大豆转基因检测标准现状在国内,大豆转基因检测标准的制定和执行也取得了一定进展。
2002年,中国农业部发布了《农业转基因生物安全管理办法》,其中包括了对农产品生产和加工中使用的转基因生物的监管要求。
此外,中国质量认证中心还发布了《农产品质量安全监督管理规范》,其中涉及到对大豆及其加工产品中转基因成分的监管。
5. 大豆转基因检测方法为了准确、可靠地检测大豆中是否存在转基因成分,科研人员开发出多种不同的检测方法。
目前常用的方法包括PCR法、ELISA法和质谱法等。
PCR法是一种通过扩增目标DNA片段来判断是否存在特定外源DNA 序列的方法;ELISA法是一种通过特异性抗体与外源蛋白质结合来判断是否存在特定外源蛋白质的方法;质谱法则是通过检测样品中特定外源蛋白质的氨基酸序列来判断是否存在转基因成分。
6. 大豆转基因检测标准的制定制定一套严格的大豆转基因检测标准对于确保食品安全和保护消费者权益至关重要。
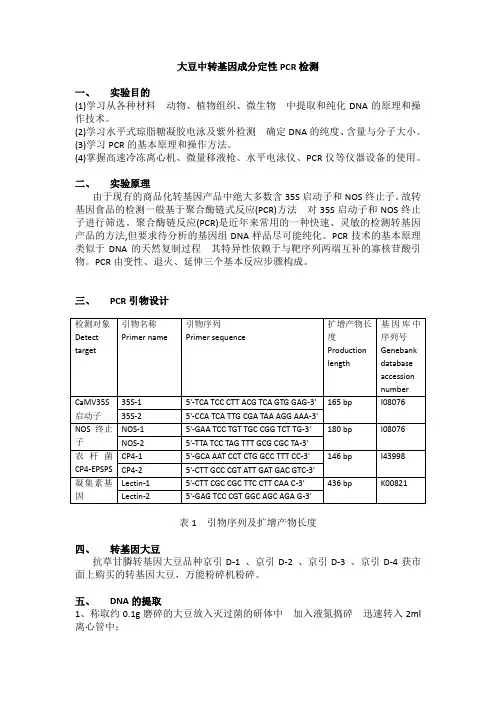
大豆中转基因成分定性PCR 检测一、 实验目的 (1)DNA 的原理和操作技术。
(2)DNA 的纯度、含量与分子大小。
(3)学习PCR 的基本原理和操作方法。
(4)掌握高速冷冻离心机、微量移液枪、水平电泳仪、PCR 仪等仪器设备的使用。
二、 实验原理由于现有的商品化转基因产品中绝大多数含35S 启动子和NOS 终止子。
故转基因食品的检测一般基于聚合酶链式反应(PCR)35S 启动子和NOS 终止子进行筛选。
聚合酶链反应(PCR)是近年来常用的一种快速、灵敏的检测转基因产品的方法,但要求待分析的基因组DNA 样品尽可能纯化。
PCR 技术的基本原理类似于DNA物。
PCR 由变性、退火、延伸三个基本反应步骤构成。
三、 PCR 引物设计表1 引物序列及扩增产物长度四、 转基因大豆抗草甘膦转基因大豆品种京引D-1 、京引D-2 、京引D-3 、京引D-4获市面上购买的转基因大豆,万能粉碎机粉碎。
五、 DNA 的提取 1、称取约0.1g 2ml 离心管中;2、加入600μl CTAB(十六烷基三甲基溴化铵)缓冲液震荡均匀,65℃水浴保温30min;3、加入500μl 酚:三氯甲烷:异戊醇(25:24:1),振荡均匀,12000r/min离心15min;4、吸取上清液,放入另一新管中加入500ul的异丙醇,12000r/min离心10min。
5、弃去上清液,加入70%乙醇溶液洗涤,12000r/min离心1min。
6、弃去上清液,干燥,用50μl TE缓冲溶液溶解沉淀。
7、加入5μl RNA酶溶液,37℃水浴保温30min。
8、加入400μl的CTAB缓冲溶液,振荡均匀。
9、加入250μl的三氯甲烷:异戊醇(1:1),振荡均匀,12000r/min离心15min。
10、吸取上清液,放入另一个新管中,加入200μl的异丙醇,12000r/min离心10min。
11、弃去上清液,干燥,用50μl TE缓冲液溶解沉淀。

PCR检测转基因大豆:[目的]定性检测转基因大豆。
[方法]以非转基因大豆和CP4-EPSPS转基因大豆为材料,以大豆内源基因Lectin和外源基因5-莽草酸-3-磷酸合成酶基因(CP4-EPSPS)为检测的目的片段,建立PCR反应体系。
采用改进CTAB法提取大豆基因组DNA,并对所提DNA进行PCR扩增和电泳检测,确定转基因大豆的PCR检测限。
实时荧光定量PCR技术检测转基因大豆方法的建立:采用实时荧光定量PCR技术,通过使用特异的引物和探针,对大豆中的内源基因Lectin和转基因大豆中的外源基因EPSPS进行了定量检测,建立了Monsanto公司生产的商业化转基因大豆Roundup Ready○R的定量PCR检测方法。
该方法的检测灵敏度<001%,是国际上设定的转基因最低限量的100倍用巢式和半巢式PCR检测转基因大豆Roundup Ready及其深加工食品:用从转基因大豆(Glycinemax )颗粒中提取的DNA作为模板,经过稀释,形成不同浓度梯度的DNA溶液,然后用巢式和半巢式PCR进行扩增反应。
结果表明,巢式和半巢式PCR均可以扩增DNA浓度为10-14g/μL的溶液。
用巢式和半巢式PCR对市场的食品原料和深加工食品进行检测,可以从大豆油、酱油、面酱、大豆磷脂、豆腐、豆浆等食品原料和深加工食品的17个品牌的食品中检测出大豆内标基因(housekeepinggene)。
ELISA方法定量检测转基因大豆及其产品的研究:以美国、阿根廷、巴西转基因大豆等为材料,建立了ELISA法定量检测抗草甘膦转基因大豆CP4 EP- SPS蛋白的方法,成功检测出美国转基因大豆含量为3.768%、阿根廷转基因大豆含量为2.820%、巴西转基因大含量为1.920%,转基因豆粉、转基因豆粕和中国大豆未检测到CP4 EPSPS蛋白。
此方法具有简便、快速、稳定等优点,其检测灵敏度可达到0.0075%,并且稳定性良好,为抗草甘膦转基因大豆中CP4EPSPS蛋白的定量检测提供了有效的手段。

一种多重PCR技术在转基因大豆检测中的应用研究摘要:为了可以同时对待测样品的基因序列进行检测,在本次有那就中采用多重pcr分析技术来全方位检测转基因大豆食品,为了将增扩结果当中的假阴性结果排除,大豆外援凝集素基因和肌动蛋白基因作为内部对照来针对所有pcr反应效率进行评价。
实验结果可以证明,在转基因大豆含量为1.5‰时,仍然可以保持较高的转基因鉴定可靠性,所以这种检测方法敏感度较高。
本文针对这种检测方法进行了介绍,其检测程序简单,敏感程度高,需要单一反应就可以对多个目标基因序列进行检测,所以可以用于转基因原料加工进行高精度和高灵敏度检测。
关键词:转基因食品;多重PCR;聚合酶链反应;扩增图谱转基因作物的出现对我国农产品数量和质量的提高起到了关键的作用,所以近年来转基因作物得到了充分的发展,种植面积不断扩大。
在食品市场当中,转基因食品份额越来越高,现在其已经成为人们的重要的食品来源,足以说明现代科学技术对于农业生产所起到的作用,但与此同时,也与很多人认为转基因作物会对人体健康和生态环境造成影响,所以这就要求不断完善相关法律法规,促进立法,出于国际贸易和食品监督法规的需要,转基因食品检测也得到了人们的广泛重视。
Pcr是聚合酶链反应的简称,其用于转基因食品检测是非常普遍的,但是过去的研究主要针对于扩增当合基因,然而随着转基因技术的发展,农作物当中也包含了越来越多的转基因成分,但未必所有成分都经过了政策批准,所以一旦食品当中含有较多的转基因成分,就需要分别检测每种靶序列,最终才能确定转基因成分,在这个过程中需要进行多次pcr反应,大大提高了检测成本。
多重pcr是针对常规pcr技术进行改进的一个成果,其可以同时对多个基因序列进行检测,可靠性和适应性较强,并且能够大大降低检测成本,所以在本次研究当中,我们可以将简单dna提取方法结合于多重pcr扩增,针对转基因大豆进行检测。
一、材料与方法(一)材料(1)样品转EPSPS基因大豆和未转基因大豆由本室保存。

实时荧光定量PCR方法快速检测转基因大豆朱德斌;邢晓波【摘要】A real-time fluorescence quantitative PCR method was developed to detect genetically modified ( GM ) soybean using SYBR Green I,a double-stranded DNA-selective fluorescent dye. Special primers were used to amplify 35S promoter that was often used in GM soybeans. The fluorescence of SYBR Green I was used to monitor the quantity of PCR product. The results show that the detection limit for 35S promoter is 0. 005 nmol/L and the linear range is more than three orders of magnitude. The GM soybean and the non-GM soybean can be clearly discriminated. Thus, the method may become a convenient tool for daily GM food detection due to its rapidness, simplicity, sensitivity, safety, high throughput and low cost.%针对转基因大豆中普遍含有的35S启动子进行引物设计,以双链DNA染料SYBR Green Ⅰ为荧光标记物,利用实时荧光定量PCR方法对大豆样品进行检测.该法检测转基因大豆的检测低限为0.005 nmol/L的35S启动子,线性范围达3个数量级,可快速区分转基因大豆和非转基因大豆,具有快速、简便、灵敏、安全、高通量、低成本等优点,可推广用于转基因植物产品的快速定量检测.【期刊名称】《激光生物学报》【年(卷),期】2012(021)003【总页数】4页(P279-282)【关键词】实时荧光定量PCR;转基因大豆;35S启动子【作者】朱德斌;邢晓波【作者单位】华南师范大学生物光子学研究院激光生命科学研究所、暨激光生命科学教育部重点实验室,广东广州510631;华南师范大学生物光子学研究院激光生命科学研究所、暨激光生命科学教育部重点实验室,广东广州510631【正文语种】中文【中图分类】Q503;Q78随着近年来人们对转基因产品(genetically modified organism,GMO)安全性的日益重视,GMO标识已成为各国GMO监管的重要部分。

一、实验目的本研究旨在通过农杆菌介导法对大豆进行遗传转化,将目的基因导入大豆基因组中,并成功获得转基因大豆植株。
通过本实验,旨在探索大豆遗传转化技术,为大豆育种提供新的技术手段,提高大豆的产量和品质。
二、实验材料1. 大豆品种:Williams822. 农杆菌菌株:E. coli DH5α3. 转化载体:含有目的基因的质粒pBI1214. 实验试剂:抗生素、植物激素、DNA提取试剂盒等5. 实验设备:离心机、PCR仪、凝胶成像系统、组织培养室等三、实验方法1. 质粒提取与鉴定(1)采用DNA提取试剂盒提取质粒DNA。
(2)通过PCR扩增质粒中的目的基因,并进行琼脂糖凝胶电泳鉴定。
2. 农杆菌培养与活化(1)将农杆菌菌株E. coli DH5α接种于含有抗生素的LB培养基中,37℃培养过夜。
(2)将活化后的农杆菌接种于含有抗生素的YEB培养基中,28℃培养过夜。
3. 转化载体的构建(1)将目的基因插入到质粒pBI121的T-DNA区域。
(2)通过PCR和琼脂糖凝胶电泳鉴定转化载体。
4. 农杆菌介导的大豆遗传转化(1)将转化载体与活化后的农杆菌共培养,使农杆菌吸收转化载体。
(2)将农杆菌接种于含有抗生素的YEB培养基中,28℃培养过夜。
(3)将农杆菌悬浮液滴加到大豆子叶节上,进行农杆菌介导的大豆遗传转化。
5. 转基因大豆植株的再生与筛选(1)将转化后的大豆子叶节接种于含有抗生素和植物激素的培养基上,进行组织培养。
(2)通过PCR和琼脂糖凝胶电泳筛选阳性植株。
6. 转基因大豆植株的鉴定(1)采用RT-PCR技术检测目的基因在转基因大豆植株中的表达。
(2)通过Western blot技术检测目的蛋白在转基因大豆植株中的表达。
四、实验结果1. 质粒提取与鉴定:成功提取质粒DNA,并通过PCR和琼脂糖凝胶电泳鉴定出目的基因。
2. 农杆菌培养与活化:成功活化农杆菌菌株E. coli DH5α。
3. 转化载体的构建:成功构建含有目的基因的转化载体。
PCR检测转基因大豆:[目的]定性检测转基因大豆。
[方法]以非转基因大豆和CP4-EPSPS 转基因大豆为材料,以大豆内源基因Lectin和外源基因5-莽草酸-3-磷酸合成酶基因(CP4-EPSPS)为检测的目的片段,建立PCR反应体系。
采用改进CTAB法提取大豆基因组DNA, 并对所提DNA进行PCR扩增和电泳检测,确定转基因大豆的PCR检测限。
实时荧光定量PCR技术检测转基因大豆方法的建立:采用实时荧光定量PCR技术 ,通过使用特异的引物和探针 ,对大豆中的内源基因Lectin和转基因大豆中的外源基因EPSPS进行了定量检测 ,建立了Monsanto公司生产的商业化转基因大豆Roundup Ready○R 的定量PCR检测方法。
该方法的检测灵敏度 <0 0 1% ,是国际上设定的转基因最低限量的 10 0倍用巢式和半巢式PCR检测转基因大豆Roundup Ready及其深加工食品:用从转基因大豆(Glycinemax )颗粒中提取的DNA作为模板,经过稀释,形成不同浓度梯度的DNA溶液,然后用巢式和半巢式PCR进行扩增反应。
结果表明,巢式和半巢式PCR均可以扩增DNA浓度为10-14g/μL的溶液。
用巢式和半巢式PCR对市场的食品原料和深加工食品进行检测,可以从大豆油、酱油、面酱、大豆磷脂、豆腐、豆浆等食品原料和深加工食品的17个品牌的食品中检测出大豆内标基因(housekeepinggene)。
ELISA方法定量检测转基因大豆及其产品的研究:以美国、阿根廷、巴西转基因大豆等为材料,建立了ELISA法定量检测抗草甘膦转基因大豆CP4 EP- SPS蛋白的方法,成功检测出美国转基因大豆含量为3.768%、阿根廷转基因大豆含量为2.820%、巴西转基因大含量为1.920%,转基因豆粉、转基因豆粕和中国大豆未检测到CP4 EPSPS蛋白。
此方法具有简便、快速、稳定等优点,其检测灵敏度可达到0.0075%,并且稳定性良好,为抗草甘膦转基因大豆中CP4 EPSPS蛋白的定量检测提供了有效的手段。
大豆转基因检测标准
大豆转基因检测标准是指用于检测大豆中转基因的方法和要求的规定。
以下是常见的大豆转基因检测标准:
1. 法规标准:不同国家和地区的法规要求可能有所不同。
例如,欧盟对转基因食品有严格的标识和审批要求,而中国国家标准规定了大豆转基因检测的方法和限量要求。
2. PCR法检测:PCR法是一种常用的转基因检测方法,能够检测到外源基因或转基因组分。
检测方法需要明确指明所要检测的外源基因或转基因。
3. 高通量测序检测:近年来,高通量测序技术的应用逐渐增多。
通过对大豆基因组的测序,可以检测到其中的转基因成分。
4. 限量要求:标准中通常规定了转基因成分的限量要求,即检测出来的转基因成分不能超过某个阈值。
不同国家和地区对于转基因成分的限量要求可能有所不同。
5. 检测方法的验证:标准通常要求检测方法的验证,包括准确性、可靠性和精确度等方面的评估。
总的来说,大豆转基因检测标准涵盖了检测方法、限量要求和方法的验证等方面的规定,以确保转基因大豆产品的质量和安全。
不同国家和地区的标准可能有所不同,但都致力于保护消费者的权益和健康。
PCR检测转基因大豆钱翔宇;柳毅;顾守进;苏旭东;马晓燕;张伟【期刊名称】《安徽农业科学》【年(卷),期】2009(037)029【摘要】[目的]定性检测转基因大豆.[方法]以非转基因大豆和CP4-EPSPS转基因大豆为材料,以大豆内源基因Lectin和外源基因5-莽草酸-3-磷酸合成酶基因(CP4-EPSPS)为检测的目的片段,建立PCR反应体系.采用改进CTAB法提取大豆基因组DNA,并对所提DNA进行PCR扩增和电泳检测,确定转基因大豆的PCR检测限.[结果]改进CTAB法提取的大豆基因组DNA电泳条带清晰完整,转基因大豆和非转基因大豆基因组DNA均可扩增出约409 bp的条带即Lectin基因,而只在转基因大豆中检测出CP4-EPSPS特异性片段;当转基因大豆的含量为100%~0.2%时,均可扩增出特异性条带.[结论]该研究建立了转基因大豆的PCR检测方法.【总页数】4页(P14032-14034,14115)【作者】钱翔宇;柳毅;顾守进;苏旭东;马晓燕;张伟【作者单位】河北农业大学食品科技学院,河北保定,071001;河北农业大学食品科技学院,河北保定,071001;河北农业大学食品科技学院,河北保定,071001;河北农业大学食品科技学院,河北保定,071001;河北农业大学食品科技学院,河北保定,071001;河北农业大学食品科技学院,河北保定,071001【正文语种】中文【中图分类】S565.1【相关文献】1.荧光PCR和数字PCR法检测转基因DAS-44406-6品系大豆 [J], 于晓帆;高宏伟;孙敏;肖西志;李荣贵2.大豆油中转基因成分的Nested PCR和Semi-nested PCR检测方法研究 [J], 闻伟刚;崔俊霞;赵秀玲3.转基因大豆中外源基因g10evo-epsps的qPCR检测方法的建立和验证 [J], 徐晓丽;纪艺;陈笑芸;王鹏飞;缪青梅;来勇敏;徐俊锋4.微滴式数字PCR和实时荧光定量PCR检测大豆中的转基因成分 [J], 杨晨;邓嘉慧;陈佩虹;丁清龙;陈丹霞;周露5.巢式PCR和SYBR Green Ⅰ实时PCR检测转基因大豆方法的研究 [J], 彭新凯;宋涛平;谭舸;陈娜;胡朝晖;杨丽霞因版权原因,仅展示原文概要,查看原文内容请购买。