高一化学必修一第四章方程式总结
- 格式:doc
- 大小:176.00 KB
- 文档页数:8

高一化学《必修一》方程式总结第一、二早:1、硫酸根离子的检验:BaCI2 + Na2SO4=BaS04 J + 2NaCl2、碳酸根离子的检验:CaCI2 + Na2CO3=:CaC03 J + 2NaCl3、银离子的检验:Cl—+ Ag + = AgCl4、木炭还原氧化铜:2CuO + C 亠也2Cu + C02 T5、铁片与硫酸铜溶液反应:Fe + CuS04 = FeS04 + Cu占燃6、镁在二氧化碳中燃烧:2Mg + C02 2MgO + CAVV ------ *第二早:一、钠1、钠在空气中燃烧(黄色的火焰):2Na + 02」一Na zQ2、钠块在空气中变暗:4Na+ Q= 2NaO3、Na>0在空气中加热(变黄):2NaO+ 2NaO24、金属锂在空气中燃烧:4Li + 02 2Li 2O5、钠与水反应(浮、熔、游、响、红)2Na + 2H20 = 2Na0卅H2 T2Na + 2H20 = 2Na++ 20H 一+ H2 T二.N Q0、NaQ的相关反应:1、碱性氧化物N@0与水的反应:N@0+ H0= 2Na0H2、过氧化钠与水的反应(放热反应、NaQ是强氧化剂,可用于漂白)2NaQ + 2H20 = 4Na0H + 02 T2N Q Q + 2H20 = 4Na + + 40H _ + QT3、碱性氧化物N Q0与C0的反应N Q0 + C02 = Na2C04、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是: 2Na 2Q + 2CQ = 2Na2C0 + 025、Na20 + S02 = Na2S0 Na 2Q + SQ = Na2S06、Na>0 + 2HCl = 2NaCl + 比07、2N Q0 + 4 HCl = 4 NaCl + 2 H 20 + 02 T三.NaHCO与Na2CO31、小苏打受热分解:2NaHCO = Na z CO + H2O + CO T2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热△NaHCO + NaOH : Na z CO + H2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO + NaOH = Na z CO + H2O HCO 3_+ OH — H z O + CQ2_4、向NaOH§液中通入少量CO : 2NaOH + CO= Na z CO + H 2O5、继续通入过量CO : N Q CO + CQ + H2O = 2 NaHCQ总反应方程式:NaOH + CO= NaHCQ6、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液N Q CO + 2HCl = 2NaCl + H2O + CO T 2 —+CO 3 + 2H = H2O + CO2 T②纯碱溶液中滴加盐酸,至过量N Q CO + HCl = NaHCO + NaCl CO 3+ H = HCONaHC3+ HCI= NaCl+ HC+ CO T HCO 3—+ H+= H2O + CQ T7、⑴Na2CO3溶液、NaHCO溶液与Ca(OH)反应:Na2CO3+ Ca(OH),= CaCO3;+ 2 NaOHNaHCO + Ca(OH)(多)=CaCO3;+ NaOH + H.O2NaHCO + Ca(OH》(少)=CaCO3;+ Na2CO3 + 2HO& Na2CO3溶液、NaHC(溶液与CaCb反应:Na2CO3+ CaCl2 = CaCO3;+ 2 Na ClNaHC3溶液与CaCl2不反应;四.Al点燃1、铝与氯气反应:2Al + 3Cl 2 2AlCl 32、铝片与稀盐酸反应+ 6H+= 2Al 3++ 3H T2Al + 6HCl = 2AlCl 3 + 3H2T 2Al3、铝与氢氧化钠溶液反应2Al + 2NaOH+ 2HO = 2NaAlO2 + 3H T4、高温下铁与水蒸气反应 :3Fe + 4H 2O(g ) 咼温Fe 3^ + 4H 22AI + 20H - + 2HHO = 2AI0?- + 3出 T△电解4、 4AI + 302 2AI 20电解熔融的氧化铝:2AbQ ----------- 4AI + 302 T5、 铝与三氧化二铁高温下反应【铝热反应】: 2AI + Fe 20 上鱼2Fe + AI 206、 不稳定性:2AI(OH )3 = AI2Q + 3H 2O7、硫酸铝溶液中滴过量氨水【实验室制备 AI(0H )3】AI 2(SC 4) 3 + 6NH ・ HO 2AI(0H )3; + (NH )2S0 AI 3++ 3 NH 3 • "0 = AI(0H) 3 J+ 3NH 4+&向NaAIQ 溶液中通入C022NaAIQ + C02 + 3H 20 = 2AI(0H) 3 J+ N Q C0五.Fe1、 铁与硫加热反应 Fe + S 上一FeS2、 铁与氧气加热反应 3Fe + 2Q 丄一Fe 3043、 铁在氯气中加热反应 2Fe + 3CI 2 —— 2FeCI 32AIO 2— + C02 + 3H0 = 2AI(0H) 3 J + 9、 氧化铝溶于氢氧化钠溶液 AI2Q + 2Na0H ——2NaAI02 + H0 10、氧化铝溶于盐酸:Ab0 + 6HCI = 2AICI 3 + 3 出0 11、AI(0H) 3溶液中加盐酸:AI(0H) 3 + 3HCI = AICI 3 + 3出0 12、AI(0H) 3与 Na0H 溶液反应:AI(0H )3 + Na0H = NaAIO ? + 2 出013、 铝盐、偏铝酸盐反应生成 AI(0H )3 CO2AI 20 + 20H - = 2AIO 2- + H 20AI 203 + 6H += 2AI 3++ 3 H 2OAI(OH) 3 + 3H + = AI 3+ + 3H 2OAI(OH) 3 + 0H_ = AIO 2- + 2 H 2O一3+3AI0 2一 + AI + 6H 2O = 4 AI(OH) 3;5、铁与盐酸反应:Fe + 2HCI = FeCI 2 + H2 T Fe + 2H+= Fe2++ H2T6. 铁的氧化物FeO、F Q O、Fe s C4溶于盐酸中:1) FeO + 2HCI = FeCI 2 + H2O FeO + 2H+ = Fe2+ + H2O丰3丰2) Fe2Q + 6HCI = 2FeCb + 3比0 Fe 2Q + 6H = 2Fe + 3比02+ 3+3) Fe 304 + 8HCI = FeCI 2 + 2FeCb + 4HO Fe 3O + 8H = Fe + 2Fe + 4 H2O7. Fe(OH)2、Fe(OH)3 的制备:1) FeSO4 + 2NaOH = Fe(OH)2 J + N@SO Fe 2 ++ 2OH - = Fe(OH)2 J氯化铁中滴入氢氧化钠溶液(红褐色沉淀)2) FeCI3 + 3NaOH = Fe(OH) 3 J + 3NaCI Fe 3 ++ 3OH - = Fe(OH) 3 J氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色沉淀)3) 4Fe (OH)2 + O2 + 2H2O = 4Fe (OH) 34) 不稳定性:2Fe(OH)3 = F Q Q + 3H2O8. Fe2 +、Fe3+之间的转化:1) 氯化亚铁溶液中通入氯气(或者加氯水)2 +3 +2FeCI 2 + CI 2 = 2FeCI 3 2 Fe + CI 2 = 2 Fe + 2CI -2) 氯化铁溶液中加入铁粉:2FeCI3 + Fe = 3FeCI 2 2Fe3 + + Fe = 3Fe2+3) 用KSCN佥验Fe3+的存在:离子方程式:Fe3++3SCN = Fe (SCN) 3 (血红色)4) 印刷电路板:2FeCI3 + Cu = 2FeCI 2 + CuCb第四章:一.硅(1) 工业制单质硅(碳在高温下还原二氧化硅):咼温SiO2 + 2C Si + 2CO T (硅单质的实验室制法,粗硅的制取)(2) 硅单质与氢氟酸、Si + 4HF = SiF 4 T + 2 H4(3) 硅单质与NaOH溶液反应:Si + 2NaOH + H20 = NaSiO s +2H2 T二.Si及其化合物:(一)二氧化硅(1)二氧化硅与氢氧化钠反应Si0 2 + 2NaOH = Na z S© + H2O SiO 2 + 20H - = SQ32- + H2O(2)二氧化硅与氧化钙高温反应:SiO2 + CaO 丄鼻CaSiO s(3)二氧化硅与氢氟酸反应:SiO z + 4HF = SiF 4 T + 2 H 2O(二)硅酸(HSiQ)(1)往硅酸钠溶液中通入二氧化碳:N aSiO s + CO2 + H2O = Na2CO3 + H 2SQ3 J(2)硅酸钠与盐酸反应:NaSiO s + 2HCl = 2NaCl + H 2SQ3 (胶体)(3)硅酸受热分解:"SiO s =— SiO2 + H2O(4)工业制玻璃原理:SiO2 + Na z CO 丄鼻NaSiO s + CO%SiO2 + Ca CO3 Ca SO + CO%三.氯(一)氯气(1)氯气实验室制法:(仪器:分液漏斗,圆底烧瓶)MnO + 4HCI(浓)亠MnC2+ CI2T + 2HO MnO 2 + 4H++ 2C「丄MrT + CI2 %+ 2HO2、氯气性质:A、金属和氯气的反应:占燃(1)铜丝在氯气中剧烈燃烧(棕色烟):Cu + CI 2 CuCl2之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)点燃(2)氯气和金属钠反应:2Na + CI 2 2NaCI占燃(3)铁在氯气中剧烈燃烧:2Fe + 3CI2 3FeCb(4)氢气在氯气中燃烧(苍白色火焰):H + CI 2 =基2HCI(5)氟气与氢气反应(黑暗处即可爆炸):H+ F2= 2HFB氯气与水反应(6)氯气溶于水(新制氯水中含H、CI _、CIO _、OH、CI2、HCIO HOCI 2+ H2O = HCI + HCIO CI 2 + H2O =H+ + CI -+ HCIO新制氯水注入盛溴化钠溶液的试管中(7 )CI2 + 2NaBr = Br 2 + 2NaCI CI 2 + 2Br =Br 2 + 2CI 一(8 ) CI2 + 2NaI = 2NaCI + I 2 CI 2 + 2I 一=I2 +2CI-(9) 次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):~2光&0 2HCI + O2 T C氯气和碱和的反应:(10) 工业制漂白粉的原理:2Ca(OHl+ 2CI2 = Ca(CIO)2 + CaCb + 2出02Ca(OH》+ 2CI2 = 2C# + + 2CIO_ + 2CI _ + 2HO(11) 漂白粉长期置露在空气中失效的原理:光昭Ca(CIO)2+ CO+ HO= CaCOj+ 2HCIO 2HCIO HC「+ O2TCeT+ 2CIO_ + CO2 + H2O = CaCOj+ 2HCIO(12) 制漂白液(或氯气尾气处理):CI 2 + 2NaOH = NaCI + NaCIO + H 2O四.硫和氮的化合物:(1)硫与非金属:S + O2 =点鼻SO2 H2+ S= H2S、—人= △△(2)硫与金属:Fe + S FeS 2Cu + S Cu2S(3)二氧化硫与水反应:SO2 +=H^O H2SO3(4)二氧化硫与碱性氧化物反应:SO2 + CaO = CaSO3(5)二氧化硫与碱反应:SO2 + 2NaOH = Na2SO3 + H2O SO2 + Ca(OH)2 = CaSO3 J + H2O(6)二氧化硫与硫化氢气体反应:2H2S +SO2 = 3S J + 2H2O(7)二氧化硫通入氯水中:SO2 + CI2 + 2H2O = 2HCI + H2SO4 ( CI2 可换作Br2、催化剂I2 ) (8)二氧化硫被O2氧化:2SO2夫02 ' 2SO3(9)三氧化硫与水反应:SO3 + H2O = H2SO4(10) 三氧化硫与碱反应:SO3 + Ca(OH)2 = CaSO4j + H2O催化剂(12)工业合成氨:2 + 3H 2 ■■ 高温高- 2NH 3(14) NH 在水中的反应:NH +、H 2O NH 3? H 2O NH4 + OH(15)氨水受热分解:NH3PH2O = NH3T + H2O(16) 实验室制取氨气:2NH4C1 + Ca(OH)2 = CaCI2 + 2NH3 T + 2H2O (17) 碳酸氢铵受热分解 :NHHCO — NH T+ H 2OT + CQ T (18) 用浓盐酸检验氨气(白烟生成): HCI + NH 3 =NH 4CI(19) 氯化铵受热分解:NHCI = NH 3 T + HCI T (20) 硫酸铵溶液与氢氧化钠溶液混合加(NH 4)2SO + 2NaOH 2NH T+ N@SO + 2HO NH 4++ OHNH 3 T+ H 2O(21)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验N/的方法)NH 4NO + NaOH = NH 3 T+ "O + NaNO NH + + OH_ = NH 3 T + H 2O (22) 氮气和氧气 放电下反应(雷雨发庄稼) 放电N 2 + O 2 NO 2NO + O 2 ---------------------------- 2NQ(23) 二氧化氮溶于水 :3NO + H 2O ---------- 2HNO + NO3NO2+ H 2O ——2H + + 2NQ — + NO(24) NO 、Q 的混合气通入水中无剩余气体 :4NQ + O 2 + 2出0 = 4 HNO 3 (25) NO 、O 的混合气通入水中无剩余气体 :4NO + 3O 2 + 2出0 = 4 HNO 3(26) NO NO 的回收:NO + NO + 2NaOH = 2Na NQ + H 2O 5、浓硫酸、HNO 与Cu 反应: AI 、Fe 遇浓HNQ 浓硫酸钝化(常温)(27) Cu 与浓 HNO 加热:Cu + 4HNO(浓)=Cu(NO )2+ 2NO T + 2H 2O (28) Cu 与稀 HNO 反应:3Cu+ 8HNO(稀)=3Cu(NQ )2 + 2NOt + 4比0 (29) 铜与浓硫酸反应:Cu + 2HSO (浓)亠 CuSO + 2HO+ SO T(13)氨的催化氧化 :4NH + 5Q4NO + 6H 2O(30)浓硫酸与木炭反应:C+ 2HSO (浓)2H2O+ CO T + 2SO T(31)浓硝酸与木炭反应:C+ 4HNO(浓)丄,2H2O+ CO T+ 4NO T名师精编欢迎下载。

化学必修一第四章《非金属元素及其化合物》化学方程式总结化学必修一第四章《非金属元素及其化合物》化学方程式总结第四章《非金属及其化合物》化学方程式及主要知识点一、硅及其化合物性质1.硅与氧气反应:2.硅与氟气反应:3.硅与氢氧化钠反应:4.硅与氢氟酸反应:5.二氧化硅与氢氧化钠溶液反应:6.二氧化硅与氢氟酸反应:7.二氧化硅与氧化钙反应:8.二氧化硅与氢氧化钠反应:二、氯及其化合物性质1、钠与氯气反应现象:2、铜与氯气反应现象:3、铁与氯气反应现象:4、氢气与氯气反应5、将氯气通入水中6、用氯气制漂白液7、工业上制漂白粉的原理8、漂白粉在空气中变质9、漂白粉与稀盐酸反应10、次氯酸见光分解三、氮及其化合物的性质1.“雷雨发庄稼”涉及反应原理(三个反应):2.氨的工业制法:3.氨的实验室制法:⑴反应原理:⑵装置类型:⑶收集方法:⑷检验方法:①②③⑸干燥方法:4.氨与水的反应:5.氨与浓盐酸反应:现象:6.氨与浓硝酸反应:现象:7.氨与稀硫酸反应:8.氨的催化氧化:9.氯化铵受热分解:10.碳酸氢铵受热分解:11.碳与浓硝酸反应:12.铜与浓硝酸反应:13.铜与稀硝酸反应:14.铜与浓硝酸反应:四、硫及其化合物的性质1.铁与硫蒸气反应:2.铜与硫蒸气反应:3.用硫来处理洒落在地上的汞4.二氧化硫与硫化氢反应:5.二氧化硫的催化氧化:6.二氧化硫使氯水褪色:7.二氧化硫使溴水褪色:8.用氢氧化钠吸收制备二氧化硫的尾气:9.将少量SO2通入澄清石灰水:10.将过量SO2通入澄清石灰水:11.将SO2通入亚硫酸钠溶液中12.将SO2通入饱和碳酸氢钠溶液中13.铜与浓硫酸反应:14.碳与浓硫酸反应:15.浓硫酸与亚硫酸钠反应。
扩展阅读:高中化学第四章《非金属元素及其化合物》单元测试题人教版必修1人教版必修1第四章《非金属元素及其化合物》测试题(A卷)本试卷分第一部分(选择题)和第二部分(非选择题),满分100分,考试时间40分钟。

高中化学必修一第四章知识点总结(详细)(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学必修一第四章知识点总结(详细)(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学必修一第四章知识点总结(详细)(word版可编辑修改)的全部内容。
教学重点:常见非金属元素(H、C、N、O、Si、S、Cl等)单质及其重要化合物的主要性质及应用。
教学难点:了解硅、氯、氮、硫及其重要化合物的主要性质。
教学过程:一.硅1.相关反应Si物理性质无色气体、有刺激性气味、密度小于空气、1:700溶于水化学性质与H2O NH3 + H2O NH3·H2O NH4++ OH—与酸NH3 + HCl = NH4Cl氨的催化氧化4NH3 + 5O2错误! 4NO + 6H2O实验室制取原理NH4+ + OH-错误! NH3↑+ H2O2NH4Cl +Ca(OH )2错误! 2NH3↑+ CaCl2 + 2H2O5.实验室制取干燥NH3的方法:制取原理: 2NH4Cl +Ca(OH )2错误! 2NH3↑+ CaCl2 + 2H2O气体成分: NH3( H2O )除水用试剂:碱石灰(不用浓H2SO4 、CaCl2原因是:2NH3+ H2SO4= (NH4)2SO4 ; CaCl2 + 8NH3 =CaCl2·8NH3)6.受热易分解 NH3·H2O 错误! NH3↑+ H2O NH4HCO3 错误! NH3↑+ CO2↑+ H2O7.氨水中的微粒分子:H2O NH3·H2O NH3 离子:NH4+ H+ OH-四.硫1.SO2的性质物理性质无色气体、有刺激性气味、有毒、1:40溶于水、密度大于空气化学性质与H2O SO2 + H2O = H2SO3与碱溶液先:SO2 +2NaOH = Na2SO3+H2O后:SO2 + Na2SO3 + H2O = 2NaHSO3 SO2过量时总反应:SO2 + NaOH = NaHSO3 与盐溶液SO2 + Na2CO3 = CO2+ Na2SO3 ( SO2不过量时 )与氯水SO2 + Cl2 + 2H2O = H2SO4 + 2HClH2SO3 + Cl2 + H2O = H2SO4 + 2HCl漂白性SO2能使品红溶液 (有机色质)褪色(生成了不稳定的无色物质),但加热褪色后的无色溶液,又恢复为原来的红色(不稳定的无色物质分解复原)实验室制法Na2SO3 +H2SO4(浓) = Na2SO4 + SO2↑+ H2O2.H2S物理性质无色气体、剧毒、有臭鸡蛋气味、1:2.6溶于水、密度大于空气化学性质与浓H2SO4H2S + H2SO4(浓)= S↓+ SO2 + 2H2O与碱溶液先H2S + NaOH= NaHS + H2O; 后NaHS + NaOH = Na2S + H2O。

高一化学《必修一》方程式总结第四章:硅(1)工业制单质硅(碳在高温下还原二氧化硅):SiO2+2C 高温Si +2CO↑(硅单质的实验室制法,粗硅的制取)(2)硅单质与氢氟酸、Si +4HF = SiF4↑+ 2H2↑(3)硅单质与NaOH溶液反应:Si + 2NaOH + H2O = Na2SiO3 +2H2↑Si及其化合物:(一)二氧化硅(1)二氧化硅与氢氧化钠反应SiO2+2NaOH =Na2SiO3+H2O SiO2+2OH -=SiO32-+H2O (2)二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3(3)二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2 H2O(二)硅酸(H2SiO3)(1)往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓(2)硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3(胶体)(3)硅酸受热分解:H2SiO3△SiO2+H2O(4)工业制玻璃原理:SiO2 + Na2CO3高温Na2SiO3 + CO2↑SiO2 + Ca CO3高温Ca SiO3 + CO2↑氯(一)氯气(1)氯气实验室制法:(仪器:分液漏斗,圆底烧瓶)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2OMnO2+4H++2Cl-Mn2++Cl2↑+2H2O2、氯气性质:A、金属和氯气的反应:(1)铜丝在氯气中剧烈燃烧(棕色烟):Cu +Cl2点燃CuCl2之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)(2)氯气和金属钠反应:2Na +Cl2点燃2NaCl(3)铁在氯气中剧烈燃烧:2Fe +3Cl2点燃3FeCl3(4)氢气在氯气中燃烧(苍白色火焰):H2+Cl2点燃2HCl(5)氟气与氢气反应(黑暗处即可爆炸):H2+F2=2HFB、氯气与水反应(6)氯气溶于水(新制氯水中含H+、Cl -、ClO -、OH-、Cl2、HClO、H2O)Cl2+H2O =HCl +HClO Cl2+H2O =H++Cl -+HClO 新制氯水注入盛溴化钠溶液的试管中(7)Cl2+2NaBr =Br2+2NaCl Cl2+2Br-=Br2+2Cl-(8)Cl2+2NaI =2NaCl +I2Cl2+2I-=I2 +2Cl-光照(9)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2HClO 2HCl +O2↑C、氯气和碱和的反应:(10)工业制漂白粉的原理:2Ca(OH)2 + 2Cl 2 =Ca(ClO)2 + CaCl 2 + 2H 2O 2Ca(OH)2 +2Cl 2 =2Ca 2++2ClO -+2Cl -+2H 2O (11)漂白粉长期置露在空气中失效的原理:Ca(ClO)2+CO 2+H 2O =CaCO 3↓+2HClO 2HClO HCl + O 2↑ Ca 2++2ClO - + CO 2 + H 2O =CaCO 3↓+ 2HClO(12)制漂白液(或氯气尾气处理): Cl 2 +2NaOH = NaCl + NaClO + H 2O 硫和氮的化合物:(1)硫与非金属:S + O2 点燃SO2 H2+ S△H2S(2)硫与金属: Fe + S△FeS 2Cu + S△Cu2S(3)二氧化硫与水反应:SO2 + H2O H2SO3 (4)二氧化硫与碱性氧化物反应:SO2 + CaO = CaSO3 (5)二氧化硫与碱反应:SO2 + 2NaOH = Na2SO3 + H2OSO2 + Ca(OH)2 = CaSO3↓ + H2O(6)二氧化硫与硫化氢气体反应:2H2S +SO2 = 3S ↓ + 2H2O(7)二氧化硫通入氯水中:SO2 + Cl2 + 2H2O = 2HCl + H2SO4(Cl2可换作Br2、I2) (8)二氧化硫被O2氧化:2SO2 + O2 2SO3(9)三氧化硫与水反应:SO3 + H2O = H2SO4(10)三氧化硫与碱反应:SO3 + Ca(OH)2 = CaSO4↓ + H2O (12)工业合成氨:N 2 + 3H 2催化剂 高温高压2NH 3(13)氨的催化氧化 :4NH 3 +5O 24NO + 6H 2O(14)NH 3在水中的反应:NH 3 + H 2O NH 3• H 2O NH4+ + OH -(15)氨水受热分解:NH3•H2O△NH3↑ + H2O催化剂 光照 △(16)实验室制取氨气:2NH4Cl + Ca(OH)2△CaCl2 + 2NH3↑+ 2H2O(17)碳酸氢铵受热分解:NH4HCO3△NH3↑+H2O↑+CO2↑(18)用浓盐酸检验氨气(白烟生成):HCl +NH3=NH4Cl(19)氯化铵受热分解:NH4Cl △NH3↑+ HCl↑(20)硫酸铵溶液与氢氧化钠溶液混合加(NH4)2SO4+2NaOH △2NH3↑+Na2SO4+2H2ONH4++ OH -△NH3↑+ H2O(21)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验NH4+的方法)NH4NO3+NaOH =NH3↑+H2O +NaNO3 NH4++OH-=NH3↑+H2O (22)氮气和氧气放电下反应(雷雨发庄稼)N2+O 2 2NO 2NO +O22NO2(23)二氧化氮溶于水:3NO2+H2O 2HNO3+NO3NO2+H2O 2H++2NO3-+NO(24)NO2、O2的混合气通入水中无剩余气体:4NO2+O2+2H2O =4 HNO3(25)NO 、O2的混合气通入水中无剩余气体:4NO+3O2+2H2O =4 HNO3(26)NO、NO2的回收:NO2 + NO + 2NaOH = 2Na NO2+H2O5、浓硫酸、HNO3与Cu反应:Al、Fe遇浓HNO3、浓硫酸钝化(常温)(27)Cu与浓HNO3加热:Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O (28)Cu与稀HNO3反应:3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O (29)铜与浓硫酸反应:Cu+2H2SO4 (浓)CuSO4 +2H2O+SO2 ↑(30)浓硫酸与木炭反应:C+2H2SO4(浓)2H2O+CO2↑+2SO2↑(31)浓硝酸与木炭反应:C+4HNO3(浓)2H2O+CO2↑+4NO2↑放电。

高中化学必修1第四章化学方程式总结高中化学必修1第四章化学方程式总结1、硅及其化合物的转化关系※①SiO2+4HF=SiF4↑+2H2O(刻蚀玻璃)SiF①4※②SiO2+2NaOH=Na2SiO3+H2O--(SiO2+2OH=SiO32+H2O)④※③NaSiO+2HCl=HSiO(胶体)+2NaClSiO2CaSiO32323②+2-(SiO3+2H=H2SiO3(胶体))③Na2SiO3H2SiO3高温④SiO2+CaOCaSiO32、氯及其化合物的转化关系点燃Ca(ClO)①2Fe+3Cl22FeCl3HClO2点燃⑦⑥⑨②Cu+Cl2CuCl2⑤③2FeCl3+Cu=2FeCl2+CuCl2⑧+++ClHCl2NaClO2Fe3+Cu=2Fe2+Cu2④点燃②①④H2+Cl22HCl或光照△③※⑤MnO2+4HCl(浓)MnCl2+Cl2↑+2H2OCuCl2FeCl3+-△2+(MnO2+4H+2ClMn+Cl2↑+2H2O)※⑥Cl2+H2O=HCl+HClO※⑦2HClO2HCl+O2↑光照+-+-(Cl2+H2O=H+Cl+HclO)(2HClO2H+2Cl+O2↑)※⑧Cl2+2NaOH=NaCl+NaClO +H2O※⑨2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O---(Cl2+2OH=Cl+ClO+H2O)3、硫及其化合物的转化关系⑦Cu⑧C点燃①S+O2SO2①②③SSO2SO3H2SO4催化剂④⑤⑥※②SO2+O2加热2SO3③SO3+H2O=H2SO4H2SO3CaSO3CaSO4④SO2+H2OH2SO3⑤SO2+CaO△光照CaSO3或SO2+Ca(OH)2=CaSO3↓+H2O+-(SO2+Ca2+2OH=CaSO3↓+H2O)⑥SO3+CaO=CaSO4或SO3+Ca(OH)2=CaSO4+H2O※⑦Cu+2H2SO4(浓)※⑧C+2H2SO4(浓)△△CuSO4+SO2↑+2H2OCO2↑+2SO2↑+2H2O4、氮及其化合物的转化关系⑥⑦※①N2+O2高温或放电2NON2NH3NH4Cl※②2NO+O2=2NO2⑧※③3NO2+H2O=2HNO3+NO⑨①+-(3NO2+H2O=2H+2NO3+NO)NO②NO③HNO23④③⑤※④Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(Cu+4H+2NO3=Cu2+2NO2↑+2H2O) +-+※⑤3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O⑥N2+3H2+-+(3Cu+8H+2NO3=3Cu2+2NO↑+4H2O)⑦NH3+HCl=NH4Cl⑧NH4Cl++催化剂高温高压2NH3△(NH3+H=NH4)(水溶液中)NH4HCO3⑧NH4Cl+NaOH(NH4+OH+-3△NH↑+HCl↑NH3↑+H2O+CO2↑△△NaCl+NH3↑+H2O△NH3↑+H2O)※⑧2NH4Cl+2Ca(OH)2CaCl2+2NH3↑+2H2O催化剂⑨4NH3+5O2△4NO+6H2O扩展阅读:高中化学必修1化学方程式总结高中化学必修1化学方程式总结1、钠及其化合物的转化关系Na2O⑨①⒃④⑦②⒁⒄⑥NaOH⑾NaClNaNaCONaHCONaCl233⑿⒂③⑤⑧⑩⒀Na2O2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2NaCl+H2↑++++Na2O+2H=2Na+H2O2Na+2H=2Na+H2↑③2Na2O2+4HCl=4NaCl+O2↑+2H2O④4Na+O2=2Na2O2Na2O2+4H+=4Na++O2↑+2H2O※⑥2Na+2H2O=2NaOH+H2↑※⑤2Na+O2△Na2O22Na+2H2O=2Na++2OH+H2↑-⑦Na2O+H2O=2NaOH※⑧2Na2O2+2H2O=4NaOH+O2↑+-+-Na2O+H2O=2Na+2OH2Na2O2+2H2O=4Na+4OH+O2↑⑨Na2O+CO2=Na2CO3※⑩2Na2O2+2CO2=2Na2CO3+O2⑾2NaOH+CO2=Na2CO3+H2O⑿Na2CO3+Ca(OH)2=CaCO3↓+2NaOH---+2OH+CO2=CO32+H2OCO32+Ca2=CaCO3↓⒀NaOH+CO2=NaHCO3※⒁Na2CO3+H2O+CO2=2NaHCO3----OH+CO2=HCO3CO32+H2O+CO2=2HCO3※⒂2NaHCO3△Na2CO3+H2O+CO2↑或※NaHCO3+NaOH=Na2CO3+H2O---HCO3+OH=CO32+H2O⒃Na2CO3+2HCl=2NaCl+H2O+CO2↑⒄NaHCO3+HCl=NaCl+H2O+CO2↑-+-+CO32+2H=H2O+CO2↑HCO3+H=H2O+CO2↑补充:①石灰水中加入少量NaHCO3:Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O +--Ca2+OH+HCO3=CaCO3↓+H2O②石灰水中加入过量NaHCO3:Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O+---Ca2+2OH+2HCO3=CaCO3↓+CO32+2H2O2、铝及其化合物的转化关系AlCl3⑥①⑿④⑦②⑧⑾AlAl2O3Al(OH)3KAl(SO4)2③⑤⑨⑩NaAlO2①2Al+6HCl=2AlCl3+3H2↑②4Al+3O2++△2Al2O32Al+6H=2Al3+3H2↑※③2Al+2NaOH+2H2O=2NaAlO2+3H2↑④Al2O3+6HCl=2AlCl3+3H2O--++2Al+2OH+2H2O=2AlO2+3H2↑Al2O3+6H=2Al3+3H2O※⑤Al2O3+2NaOH=2NaAlO2+H2O⑥AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl--++Al2O3+2OH=2AlO2+H2OAl3+3NH3H2O=Al(OH)3↓+3NH4⑦Al(OH)3+3HCl=AlCl3+3H2O⑧2Al(OH)3++△Al2O3+3H2OAl(OH)3+3H=Al3+3H2O☆⑨NaAlO2+HCl+H2O=Al(OH)3↓+NaCl或NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3-+--AlO2+H+H2O=Al(OH)3↓AlO2+2H2O+CO2=Al(OH)3↓+HCO3++※⑩Al(OH)3+NaOH=NaAlO2+2H2O☆⑾Al3+3H2OAl(OH)3胶体+3H--Al(OH)3+OH=AlO2+2H2O明矾净水+--⑿AlCl3+4NaOH=NaAlO2+3NaCl+2H2OAl3+4OH=AlO2+2H2O3、铁及其化合物的转化关系⑦③①FeOFeFeClFe(OH)2342⑧②⑤⑥⑨④⒁FeCl3⑩Fe(SCN)Fe(OH)3⑿Fe2O33⑾⒀①Fe3O4+4CO△3Fe+4CO2※②3Fe+4H2O(g)高温Fe3O4+4H2Fe3O4③Fe+2HCl=FeCl2+H2↑或3Fe+2O2++Fe+2H=Fe2+H2↑④2Fe+3Cl2点燃点燃2FeCl3※⑤2FeCl2+Cl2=2FeCl3※⑥Fe+2FeCl3=3FeCl2++-++2Fe2+Cl2=2Fe3+2ClFe+2Fe3=3Fe2⑦FeCl2+2NaOH=Fe(OH)2↓+2NaCl⑧Fe(OH)2+2HCl=FeCl2+2H2O+-++Fe2+2OH=Fe(OH)2↓Fe(OH)2+2H=Fe2+2H2O※⑨4Fe(OH)2+O2+2H2O=4Fe(OH)3⑩FeCl3+3NaOH=Fe(OH)3↓+3NaCl+-白色沉淀迅速变成灰绿色,最后变成红褐色Fe3+3OH=Fe(OH)3↓++⑾Fe(OH)3+3HCl=FeCl3+3H2OFe3+3H2OFe(OH)3胶体+3H(净水)Fe(OH)3+3H=Fe3+3H2O⑿2Fe(OH)3++△Fe2O3+3H2O⒀Fe2O3+6HCl=2FeCl3+3H2O※⒁FeCl3+3KSCN=Fe(SCN)3+3KCl+++-Fe2O3+6H=2Fe3+3H2OFe3+3SCN=Fe(SCN)34、硅及其化合物的转化关系SiF4①Si+O2△SiO2④③高温②SiO2+2CSi+2CO↑①⑤SiSiO2CaSiO3※③SiO2+4HF=SiF4↑+2H2O(刻蚀玻璃)②⑥⑨④Si+4HF=SiF4↑+2H2↑⑦Na2SiO3H2SiO3⑤SiO2+CaO⑧高温CaSiO3CaSiO3+CO2↑※⑥SiO2+2NaOH=Na2SiO3+H2OSiO2+CaCO3--高温SiO2+2OH=SiO32+H2O※⑦Na2SiO3+2HCl=H2SiO3↓+2NaClSiO2+Na2CO3高温Na2SiO3+CO2↑SiO32+2H=H2SiO3↓-+※⑦Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2=H2SiO3↓+2NaHCO3----SiO32+H2O+CO2=H2SiO3↓+CO32或SiO32+2H2O+2CO2=H2SiO3↓+2HCO3⑧H2SiO3+2NaOH=Na2SiO3+2H2O⑨H2SiO3H2SiO3+2OH=SiO32+2H2O5、氯及其化合物的转化关系--△H2O+SiO2点燃①2Fe+3Cl22FeCl3⑩HClOCa(ClO)2点燃⑦⑥⑨②Cu+Cl2CuCl2⑤③2FeCl3+Cu=2FeCl2+CuCl2⑧+++ClHCl2NaClO2Fe3+Cu=2Fe2+Cu2④点燃②①④H2+Cl22HCl或光照△③※⑤MnO2+4HCl(浓)MnCl2+Cl2↑+2H2OCuCl2FeCl3+-△2+MnO2+4H+2ClMn+Cl2↑+2H2O※⑥Cl2+H2O=HCl+HClO※⑦2HClO2HCl+O2↑光照+-+-Cl2+H2O=H+Cl+HClO2HClO2H+2Cl+O2↑※⑧Cl2+2NaOH=NaCl+NaClO+H2O※⑨2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O---Cl2+2OH=Cl+ClO+H2O工业制漂白粉※⑩Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO或Ca(ClO)2+2HCl=CaCl2+2HClO +--+Ca2+2ClO+H2O+CO2=CaCO3↓+2HClO或ClO+H=HClO漂白粉的漂白原理向漂白粉溶液中通入过量的CO2:Ca(ClO)2+2H2O+2CO2=Ca(HCO3)2+2HClO --ClO+H2O+CO2=HCO3+HClO3光照6、硫及其化合物的转化关系⑨Cu⑩C点燃①S+O2SO2①④③SOSSO23H2SO4②2H2S+SO2=3S+2H2O⑥②⑤催化剂CaSO3⑦CaSO※③SO+O2SO3224加热⑧氯水④SO3+H2O=H2SO4⑤SO2+CaO△CaSO3或SO2+Ca(OH)2=CaSO3↓+H2O+-⑥SO3+CaO=CaSO4SO2+Ca2+2OH=CaSO3↓+H2OSO3+Ca(OH)2=CaSO4+H2O⑦2CaSO3+O2△2CaSO4※⑧SO2+Cl2+2H2O=H2SO4+2HCl※⑨Cu+2H2SO4(浓)SO2+Cl2+2H2O=4H+SO42+2ClCu+2H2SO4(浓)+--△+△CuSO4+SO2↑+2H2O-Cu2+SO42+SO2↑+2H2O※⑩C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O7、氮及其化合物的转化关系⑥⑦※①N2+O2高温或放电2NO4ClN2NH3NH※②2NO+O2=2NO2⑧※③3NO2+H2O=2HNO3+NO⑨①+-3NO2+H2O=2H+2NO3+NO②NONO③HNO以上三个反应为“雷雨发庄稼”原理23③④扩展反应有:4NO2+O2+2H2O=4HNO3⑤4NO+3O2+2H2O=4HNO3※④Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O上面两个反应主要用于气体溶于水时的计算Cu+4H+2NO3=Cu2+2NO2↑+2H2O或4HNO3光照4NO2↑+O2↑+2H2O+-+C+4HNO3(浓)+△CO2↑+2NO2↑+2H2O浓硝酸见光易变黄的原因催化剂高温高压※⑤3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O⑥N2+3H2-+2NH33Cu+8H+2NO3=3Cu2+2NO↑+4H2O合成氨反应是人工固氮的主要途径⑦NH3+HCl=NH4Cl⑧NH4Cl++△NH3↑+HCl↑△NH3+H=NH4(水溶液中)补充:NH4HCO3NH3↑+H2O+CO2↑※⑧NH4Cl+NaOH氨气与酸均能反应生成铵盐,且与挥发性酸铵盐受热都易分解,但并不是所有的铵盐(如浓HCl、浓HNO3)相遇时空气中有白烟都分解出氨气,如NH4NO3、(NH4)2SO4△△+-NaCl+NH3↑+H2ONH4+OH△NH3↑+H2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。

非金属及其化合物硅及其化合物1、硅与氟气反应:______________________________2、二氧化硅与氢氟酸反应:(雕刻玻璃)_____________________3、二氧化硅与氧化钙反应:__________________________4、二氧化硅与氢氧化钠反应:_________________________5、二氧化硅与氢氧化钠反应(离子方程式):__________________6、二氧化硅与碳反应:____________________________7、四氯化硅与氢气反应:___________________________8、硅酸钠与二氧化碳反应制取硅酸:______________________9、硅酸钠与盐酸反应制取硅酸_________________________10、二氧化硅与碳酸钠高温下反应________________________11、二氧化硅与碳酸钙在高温下反应______________________12、硅与氢氧化钠溶液的反应__________________________13、硅与氢氟酸反应:_____________________________14、硅酸钠与氯化钙反应____________________________氯及其化合物15、钠在氯气中燃烧:_____________________________16、铁在氯气中燃烧:____________________________17、铜在氯气中燃烧:____________________________18、氢气在氯气中燃烧:___________________________19、氯气与水反应:_____________________________20、氯水的成分________________________________21、氯气与氢氧化钠反应:__________________________22、氯气与氢氧化钠反应(离子方程式):____________________23、工业生产漂白粉的原理:_________________________24、工业生产漂白粉的原理(离子方程式):___________________25、氯气与溴化钾反应:___________________________26、氯气与溴化钾反应(离子方程式):_____________________27、氯气与淀粉碘化钾反应:__________________________28、氯气与淀粉碘化钾反应(离子方程式):___________________29、溴水与碘化钾反应:___________________________30、溴水与碘化钾反应(离子方程式):_____________________31、次氯酸见光分解:____________________________32、漂白粉的漂白原理:___________________________33、漂白液的漂白原理:___________________________34、氯气的实验室制法:___________________________35、氯气的实验室制法:(离子方程式)____________________硫及其化合物36、硫的燃烧:_______________________________37、硫与浓硫酸的反应、___________________________38、硫与水银反应___________________________39、硫与氢氧化钠反应___________________________40、二氧化硫与水反应:___________________________41、二氧化硫与氢氧化钠反应:________________________42、二氧化硫与氢氧化钠反应(离子方程式):__________________43、二氧化硫(少量)与氢氧化钙的反应_____________________44、二氧化硫(过量)与氢氧化钙的反应_____________________45、二氧化硫与氧化钙的反应__________________________46、二氧化硫的催化氧化:__________________________47、三氧化硫与水反应:___________________________48、三氧化硫与氧化钙反应:_________________________49、三氧化硫与氢氧化钙反应:________________________50、二氧化硫与氯气反应:__________________________51、二氧化硫与硫化氢气体的反应:______________________52、实验室制取二氧化硫:_________________________53、酸雨酸性增强:____________________________54、硫化氢与氧气反应_____________________________55、硫和铜反应________________________________56、硫和铁反应______________________________氮及其化合物57、氮气在放电条件下与氧气反应:______________________58、氮气在在加热条件下与镁的反应:_____________________59、工业上合成氨:_____________________________60、一氧化氮与氧气反应:__________________________61、二氧化氮与水反应:___________________________62、二氧化氮与水反应(离子方程式):_____________________63、二氧化氮与氧气、水反应生成硝酸______________________64、一氧化氮与氧气、水反应生成硝酸______________________70、氨气与水反应:_____________________________71、氨气与氯化氢反应:___________________________72、氨气与氧气反应:____________________________73、氨水受热分解:_____________________________74、氯化铵受热分解:____________________________75、碳酸氢铵受热分解:___________________________76、硝酸铵与氢氧化钠反应:_________________________77、氨气的实验室制法:___________________________78、浓硝酸与铜反应:____________________________79、稀硝酸与铜反应:____________________________80、浓硫酸与铜加热反应___________________________81、浓硫酸与碳加热反应___________________________其他化学方程式82、氢气还原氧化铜:____________________________83、碳还原氧化铜:_____________________________84、一氧化碳还原氧化铜:__________________________85、二氧化碳与澄清石灰水反应:_______________________86、高锰酸钾制氧气:____________________________87、过氧化氢制氧气:____________________________88、大理石与盐酸反应:___________________________。

化学必修一第四章公式总结化学化学必修一第四章公式总结第四章公式总结一、无机非金属材料的主角硅1、SiO2与HF反应的化学方程式:SiO2+4HF=SiF4↑+2H2O2、SiO2是酸性氧化物,与CaO反应的方程式:SiO2+CaO高温CaSiO3SiO2与强碱NaOH反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O3、制备硅酸(H2SiO3)的化学方程式:Na2SiO3+2HCl=2NaCl+H2SiO3↓二、富集在海水中会的元素氯1、实验室制取氢氧化钾的方程式:MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O2、Cl2与金属Na、Fe、Cu反应的方程式2Na+Cl2===2NaCl2Fe+3Cl2===2FeCl3、Cu+Cl2===CuCl2Cl2与非金属H2反应的现象:安静地燃烧,发出苍白色火焰,喉部有白雾化学方程式:H2+Cl2===2HCl3、Cl2与水异构化的化学方程式:Cl2+H2O=HCl+HClO离子方程式:Cl2+H2O=H++Cl+HClO次氯酸见光纯化的化学方程式:2HClO===2HCl+O2↑4、Cl2与NaOH异构化的化学方程式:2NaOH+Cl2=NaCl+NaClO+H2O离子方程式:2OH+Cl2=Cl+ClO+H2OCl2与石灰乳异构化的化学方程式:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O离子方程式:Ca(OH)2+Cl2=Ca2++Cl+ClO+H2O漂白原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO5、氯离子的检验算法:硝酸酸化的硝酸银溶剂,释放出不不溶于硝酸的白色沉淀离子方程式:Ag++Cl=AgCl↓三、硫和氮的氧化物1、S与O2反应的化学方程式:S+O2===SO2SO2与水反应的化学方程式:SO2+H2OSO2与O2反应的化学方程式:2SO2+O2H2SO32SOSO2的检验方法:滴加品红溶液,溶液红色褪去;加热后,溶液又恢复红色2、SO3是酸性氧化物,SO3与水反应的化学方程式:SO3+H2O=H2SO4SO3与CaO反应的方程式:SO3+CaO=CaSO4SO3与Ca(OH)2反应的材料科学方程式:SO3+Ca(OH)2=CaSO4+H2O3、N2与O2反应的材料科学方程式:N2+O2=2NONO与O2反应的材料科学方程式:2NO+O2=2NO2NO2与水反应的材料科学方程式:3NO2+H2O =2HNO3+NO4、NO2与O2通入水中恰好完全异构化:4NO2+O2+2H2O=4HNO3NO与O2通入水中恰好完全异构化:4NO+3O2+2H2O=4HNO3四、氨、硝酸、硫酸1、工业动物细胞的反应方程式:N2+3H22NH3实验室制备NH3的化学方程式:2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O2、氨水生成与分解的反应:NH3+H2O=NH3H2O、NH3H2O==NH3↑+H2O3、NH3与HCl反应方程式:NH3+HCl=NH4ClNH4Cl加热分解的方程式:NH4Cl=NH3↑+HCl↑NH4HCO3加热分解的方程式:NH4HCO3=NH3↑+H2O↑+CO2↑NH4NO3与NaOH反应的方程式:NH4NO3+NaOH==NaNO3+NH3↑+H2O4、检验NH4+的方法:(灵活运用与碱的反应检验NH4+离子的存在)向样品中加入碱溶液,加热,若放出石蕊试纸的气体能而使湿润的红色石蕊试纸变蓝,证明含NH4+5、浓H2SO4具有吸水性、脱水性和强氧化性浓H2SO4与Cu反应的方程式:2H2SO4(浓)+Cu==CuSO4+2H2O+SO2↑浓H2SO4与C反应的方程式:2H2SO4(浓)+C==CO2↑+2SO2↑+2H2O6、浓HNO3与Cu反应的方程式:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O离子方程式:Cu+4H++2NO3==Cu2++2NO2↑+2H2O稀HNO3与Cu反应的方程式:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O离子方程式:3Cu+8H++2NO3==3Cu2++2NO↑+4H2O1、硫酸根氧的检验:BaCl2+Na2SO4=BaSO4↓+2NaCl2、碳酸根离子的抽样:CaCl2+Na2CO3=CaCO3↓+2NaCl3、碳酸钠与盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑4、木炭还原氧化铜:2CuO+C高温2Cu+CO2↑5、铁片与硫酸铜溶液底物:Fe+CuSO4=FeSO4+Cu6、氯化钙与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl7、钠在空气中燃烧:2Na+O2△Na2O28、过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑9、过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2↑10、钠与水反应:2Na+2H2O=2NaOH+H2↑11、铁与水蒸气反应:3Fe+4H2O(g)=Fe3O4+4H2↑12、铝与过氧化氢溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑13、氧化钙与水反应:CaO+H2O=Ca(OH)214、氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O15、氧化铝与硝酸反应:Al2O3+6HCl=2AlCl3+3H2O16、氧化铝与过氧化氢溶液反应:Al2O3+2NaOH=2NaAlO2+H2O17、氯化铁与氢氧化钠溶液反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl18、硫酸亚铁与氢氧化钠溶液硫酸反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2=4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3△Fe2O3+3H2O↑21、物理组制取氢氧化铝:Al2(SO4)3+6NH3H2O=2Al(OH)3↓+3(NH3)2SO422、氢氧化铝与硝酸反应:Al(OH)3+3HCl=AlCl3+3H2O23、氢氧化铝与过氧化氢溶液反应:Al(OH)3+NaOH=NaAlO2+2H2O24、氢氧化铝蒸发分解:2Al(OH)3△Al2O3+3H2O25、盐酸与醋酸溶液反应:HCl+AgNO3=AgCl↓+HNO340、钠与氧气反应:4Na+O2=2Na2O47、浓硫酸与铜反应:Cu+2H2SO4(浓)△CuSO4+2H2O+SO2↑48、碳与水反应:C+H2O高温H2+CO49、氧化铜与氢气反应:CuO+H2△Cu+H2O50、碳酸氢钠加压分解:2NaHCO3△Na2CO3+H2O+CO251、氧化铁和盐酸溶液反应:Fe+2HCI=FeCl2+H2O52、三氧化二铁和盐酸溶液反应:Fe2O3+6HCl=2FeCl3+H2O。
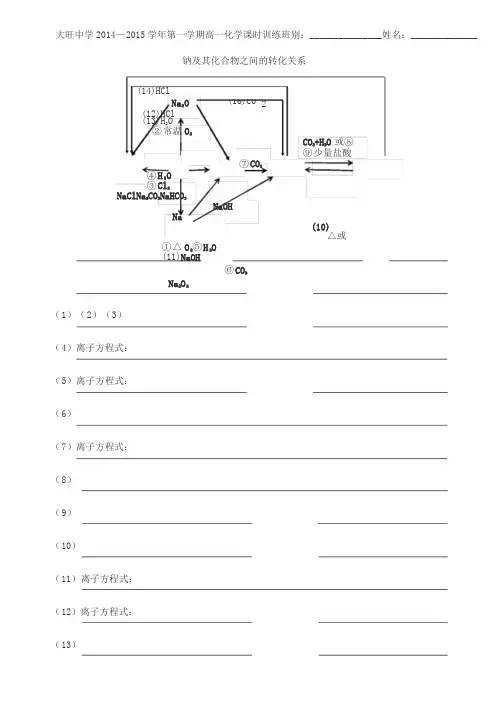
大旺中学2014—2015学年第一学期高一化学课时训练班别:_______________姓名:______________钠及其化合物之间的转化关系(14)HClNa2O (16)CO 2(12)HCl(13)H2O②常温O2CO2+H2O或⑧⑨少量盐酸⑦CO2④H2O③Cl2NaClNa2CO3NaHCO3NaOHNa(10)△或①△O2⑤H2O(11)NaOH⑥CO2Na2O2(1)(2)(3)(4)离子方程式:(5)离子方程式:(6)(7)离子方程式:(8)(9)(10)(11)离子方程式:(12)离子方程式:(13)(14)离子方程式:(15)离子方程式:-1-大旺中学2014—2015学年第一学期高一化学课时训练班别:_______________姓名:______________铝及其化合物之间的转化关系AlHClO 2NaOH+H 2O HClNaOHAlCl3Al2O3NaAlO2NH 3·H 2O 或少量NaOHHClNaOH △ HClCO+HO 或22Al(OH)3(1) (2)离子方程式:(3)离子方程式:(4)离子方程式:(5)离子方程式:(6)离子方程式:(7)离子方程式:(8) (9)离子方程式:(10)离子方程式:(11)离子方程式:(12)-2-铁及其化合物之间的转化关系FeOHClNaOH FeCl2Fe(OH)2△H2HClHClFe3O4△H2FeCl2FeO2+H2OO2点燃或H2O(气)高温△H2Cl2点燃NaOHFe2O3HClFeCl3Fe(OH)3HCl△(1)离子方程式:(2)(3)(4)(5)离子方程式:(6)离子方程式:(7)离子方程式:(8)(9)离子方程式:(10)离子方程式:(11)离子方程式:(12)离子方程式:(13)(14)-3-第四章非金属元素及其化合物1.硅及其化合物之间的转化关系SiCl4NaOHCl2O2△NaOH SiH2SiO3Na2SiO3SiO2△F2 HF HCl或CO2+H2OHFSiF4NaOH (1)(2)(3)(4)(5)离子反应方程式:(6)(7)(8)(9)离子反应方程式:(10)离子反应方程式:-4-大旺中学2014—2015学年第一学期高一化学课时训练班别:_______________姓名:______________ 2.氯及其化合物之间的转化关系CuCl2CuFeCl3FeCl2FeCl2AgNO3AgClCu点燃Fe点燃FeAgNO3H2点燃或光照见光HCl或Ca(ClO)2Cl2HClHClOMnO2△CO2+H2OH2OCa(OH)2(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)(14)(15)-5-大旺中学2014—2015学年第一学期高一化学课时训练班别:_______________姓名:______________3.硫及其化合物之间的转化关系Na2SO3O2Na2SO4NaOHNaOHH2S O2点燃O2点燃SH2△H2SS O2O2催△SO3H2O H2SO4BaCl2BaSO4H2OCu或C△H2SO3O2(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)(14)(15)-6-大旺中学2014—2015学年第一学期高一化学课时训练班别:_______________姓名:______________4.氮及其化合物之间的转化关系O2△催化剂Ca(OH)2△光照NH4ClHClNH3H2O△NH3·H2O H2高温高压催化剂N2O2放电O2NONO2HNO3NH4NO3HONH3稀HNO3浓HNO3Cu(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)(14)(15)-7-大旺中学2014—2015学年第一学期高一化学课时训练班别:_______________姓名:______________常见金属元素及其化合物2.钠及其化合物之间的转化关系Na2OCO2NaHCO3 NaClNaNaOHNa2CO3Na2O2Na2C N O a32·CO103H·21O0H2O3.铝及其化合物之间的转化关系AlAlCl3Al2O3NaAlO2Al(OH)34.铁及其化合物之间的转化关系FeOFeCl2Fe(OH)2Fe3O4FeFe2O3FeCl3Fe(OH)3-8-大旺中学2014—2015学年第一学期高一化学课时训练班别:_______________姓名:______________常见非金属元素及其化合物5.硅及其化合物之间的转化关系SiSiO2H2SiO3Na2SiO3SiF46.氯及其化合物之间的转化关系CuCl2FeCl3FeCl2AgClCl2HClHClOCa(ClO)27.硫及其化合物之间的转化关系Na2SO3Na2SO4H2SSSO2SO3H2SO4BaSO4H2SO38.氮及其化合物之间的转化关系NH4ClNH3N2NONO2HNO3NH4NO3△NH3·H2O -9-大旺中学2014—2015学年第一学期高一化学课时训练班别:_______________姓名:______________-10-WORD格式大旺中学2014—2015学年第一学期高一化学课时训练班别:_______________姓名:______________。

化学必修一第四章公式总结第四章公式总结一、无机非金属材料的主角硅1、SiO2与HF反应的化学方程式:SiO24HF=SiF4↑2H2O2、SiO2是酸性氧化物,与CaO反应的方程式:SiO2CaO高温CaSiO3SiO2与强碱NaOH反应的化学方程式:SiO22NaOH=Na2SiO3H2O3、制备硅酸(H2SiO3)的化学方程式:Na2SiO32HC=2NaCH2SiO3↓二、富集在海水中的元素氯1、实验室制取氯气的方程式:MnO24HC(浓)==MnC2C2↑2H2O2、C2与金属Na、Fe、Cu反应的方程式2NaC2===2NaC2Fe3C2===2FeC3、CuC2===CuC2C2与非金属H2反应的现象:安静地燃烧,发出苍白色火焰,瓶口有白雾化学方程式:H2C2===2HC3、C2与水反应的化学方程式:C2H2O=HCHCO离子方程式:C2H2O=HCHCO次氯酸见光分解的化学方程式:2HCO===2HCO2↑4、C2与NaOH反应的化学方程式:2NaOHC2=NaCNaCOH2O离子方程式:2OHC2=CCOH2OC2与石灰乳反应的化学方程式:2CaOH22C2=CaCO2CaC22H2O离子方程式:CaOH2C2=Ca2CCOH2O漂白原理:CaCO2CO2H2O=CaCO3↓2HCO5、氯离子的检验方法:硝酸酸化的硝酸银溶液,产生不溶于硝酸的白色沉淀离子方程式:AgC=AgC↓三、硫和氮的氧化物1、S与O2反应的化学方程式:SO2===SO2SO2与水反应的化学方程式:SO2H2OSO2与O2反应的化学方程式:2SO2O2H2SO32SOSO2的检验方法:滴加品红溶液,溶液红色褪去;加热后,溶液又恢复红色2、SO3是酸性氧化物,SO3与水反应的化学方程式:SO3+H2O=H2SO4SO3与CaO反应的方程式:SO3CaO=CaSO4SO3与CaOH2反应的化学方程式:SO3CaOH2=CaSO4H2O3、N2与O2反应的化学方程式:N2+O2=2NONO与O2反应的化学方程式:2NO+O2=2NO2NO2与水反应的化学方程式:3NO2+H2O=2HNO3+NO4、NO2与O2通入水中恰好完全反应:4NO2O22H2O=4HNO3NO与O2通入水中恰好完全反应:4NO3O22H2O=4HNO3四、氨、硝酸、硫酸1、工业固氮的反应方程式:N23H22NH3实验室制备NH3的化学方程式:2NH4CCaOH2==CaC22NH3↑2H2O2、氨水生成与分解的反应:NH3H2O=NH3H2O、NH3H2O==NH3↑H2O3、NH3与HC反应方程式:NH3HC=NH4CNH4C加热分解的方程式:NH4C=NH3↑HC↑NH4HCO3加热分解的方程式:NH4HCO3=NH3↑H2O↑CO2↑NH4NO3与NaOH反应的方程式:NH4NO3NaOH==NaNO3NH3↑H2O4、检验NH4的方法:(利用与碱的反应检验NH4离子的存在)向样品中加入碱溶液,加热,若放出的气体能使湿润的红色石蕊试纸变蓝,证明含NH45、浓H2SO4具有吸水性、脱水性和强氧化性浓H2SO4与Cu反应的方程式:2H2SO4浓Cu==CuSO42H2OSO2↑浓H2SO4与C反应的方程式:2H2SO4(浓)C==CO2↑2SO2↑2H2O6、浓HNO3与Cu反应的方程式:Cu4HNO3浓==CuNO322NO2↑2H2O离子方程式:Cu4H2NO3==Cu22NO2↑2H2O 稀HNO3与Cu反应的方程式:3Cu8HNO3稀==3CuNO322NO↑4H2O离子方程式:3Cu8H2NO3==3Cu22NO↑4H2O扩展阅读:高一化学必修1公式总结1、硫酸根离子的检验:BaC2Na2SO4=BaSO4↓2NaC2、碳酸根离子的检验:CaC2Na2CO3=CaCO3↓2NaC3、碳酸钠与盐酸反应:Na2CO32HC=2NaCH2OCO2↑4、木炭还原氧化铜:2CuOC高温2CuCO2↑5、铁片与硫酸铜溶液反应:FeCuSO4=FeSO4Cu6、氯化钙与碳酸钠溶液反应:CaC2Na2CO3=CaCO3↓2NaC7、钠在空气中燃烧:2NaO2△Na2O28、过氧化钠与水反应:2Na2O22H2O=4NaOHO2↑9、过氧化钠与二氧化碳反应:2Na2O22CO2=2Na2CO3O2↑10、钠与水反应:2Na2H2O=2NaOHH2↑11、铁与水蒸气反应:3Fe4H2Og=Fe3O44H2↑12、铝与氢氧化钠溶液反应:2A2NaOH2H2O=2NaAO23H2↑13、氧化钙与水反应:CaOH2O=CaOH214、氧化铁与盐酸反应:Fe2O36HC=2FeC33H2O15、氧化铝与盐酸反应:A2O36HC=2AC33H2O16、氧化铝与氢氧化钠溶液反应:A2O32NaOH=2NaAO2H2O17、氯化铁与氢氧化钠溶液反应:FeC33NaOH=FeOH3↓3NaC18、硫酸亚铁与氢氧化钠溶液反应:FeSO42NaOH=FeOH2↓Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4FeOH22H2OO2=4FeOH320、氢氧化铁加热分解:2FeOH3△Fe2O33H2O↑21、实验室制取氢氧化铝:A2SO436NH3H2O=2AOH3↓3NH32SO422、氢氧化铝与盐酸反应:AOH33HC=AC33H2O23、氢氧化铝与氢氧化钠溶液反应:AOH3NaOH=NaAO22H2O24、氢氧化铝加热分解:2AOH3△A2O33H2O25、盐酸与硝酸银溶液反应:HCAgNO3=AgC↓HNO340、钠与氧气反应:4NaO2=2Na2O47、浓硫酸与铜反应:Cu2H2SO4浓△CuSO42H2OSO2↑48、碳与水反应:CH2O高温H2CO49、氧化铜与氢气反应:CuOH2△CuH2O50、碳酸氢钠加热分解:2NaHCO3△Na2CO3H2OCO251、氧化铁和盐酸溶液反应:Fe2HCI=FeC2H2O52、三氧化二铁和盐酸溶液反应:Fe2O36HC=2FeC3H2O。

高中化学人教版必修一第四章知识点总结
本文档总结了高中化学人教版必修一第四章的知识点。
1. 化学方程式
- 化学方程式是描述化学反应的方法。
- 化学方程式由反应物、生成物和反应条件组成。
- 化学方程式中的物质用化学式表示,化学式由元素符号和下标组成。
2. 氧化还原反应
- 氧化还原反应是指物质在反应中发生电荷转移的化学反应。
- 氧化还原反应中存在氧化剂和还原剂两个概念。
- 氧化剂能够接受电子,还原剂能够捐赠电子。
3. 浓度与溶液的配制
- 浓度是指溶液中溶质的含量。
- 浓度可以用质量分数、摩尔浓度等表示。
- 溶液的配制可以根据所需浓度和配溶液的体积来计算所需溶质的质量。
4. 氧化和还原
- 氧化是指物质失去电子或氢原子的过程。
- 还原是指物质得到电子或氢原子的过程。
- 氧化和还原是氧化还原反应的基本概念。
5. 盐类的基本概念
- 盐类是酸和碱经过中和反应生成的产物。
- 盐类可由阳离子和阴离子组成。
- 盐类有不同的命名方法,如一价阳离子+一价阴离子为氯化物。
以上是高中化学人教版必修一第四章的知识点总结。
详细内容
请查阅相应教材或教辅资料。

【最新】高一化学必修一第四章非金属及其化合物(硅、氯)知识点总结高一化学必修一第四章非金属及其化合物(硅.氯)知识点总结非金属及其化合物〔一〕一.硅Si1.硅单质存在结构:化合态〔自然界〕,在地壳中的含量第二〔仅次于氧〕物理性质:灰黑色,金属光泽,硬度大,有脆性,熔沸点高的固体,是良好的半导体材料〔硅芯片.光电池〕性质化学性质〔常温下化学性质稳定〕以下关于硅的说法不正确的选项是〔〕A.硅是非金属元素,它的单质是灰黑色有金属光泽的固体B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料C.硅的化学性质不活泼,常温下不与任何物质反响D.加热到一定温度时硅能与H2.O2等非金属反响答案:C2.二氧化硅其化学性质很不活泼,氢氟酸HF是唯一能与之反响的酸!!!天然二氧化硅的存在形式:结晶形和无定形应用:石英光导纤维,石英坩埚,玛瑙饰品类别晶体结构熔沸点与水反响方程式与酸反响方程式与烧碱反响方程式与CaO反响方程式存在状态二氧化硅酸性氧化物原子晶体〔四面体网状结构〕高不反响SiO2+4HF==SiF4↑+2H2OSiO2+2NaOH==Na2SiO3+H2OSiO2+CaO高温[来源:学.科.网Z._._.K]CaSiO3水晶.玛瑙.石英.硅石.沙子1.以下物质的主要成分不是SiO2的是〔〕A.石英B.水晶C.金刚砂D.玛瑙答案:C2.以下说法正确的选项是〔〕A.SiO2溶于水显酸性B.CO2通入水玻璃可得硅酸C.SiO2是酸性氧化物,它不溶于任何酸D.SiO2晶体中不存在单个SiO2分子答案:BD3.硅酸1.特点:溶解度很小,酸性很弱〔比碳酸弱〕2.什么是〝硅胶〞?硅胶的用途:多孔.吸水能力强,故可做枯燥剂;也做催化剂的载体1.将足量的CO2通入以下溶液中,能产生沉淀的是〔〕A.硅酸钠溶液B.石灰水C.氯化钡溶液D.氯化钙溶液答案:A2.碳化钛〔TiC〕.碳化硼〔B4C3〕.氮化硅〔Si3N4〕等非氧化物陶瓷是新型无机非金属材料,合成这些物质需在高温条件下进行,在合成它们的过程中必须注意〔〕答案:BA.通入足量氧气B.防止与氧气接触C.通入少量氯气D.通入少量氧气3.以下物质属于酸性氧化物但不溶于水的是A.二氧化碳B.二氧化硅C.二氧化硫D.氧化铁答案:B4.以下说法正确的选项是〔〕A.硅是良好的半导体材料,能与盐酸或氢氧化钠溶液反响B.二氧化硅不导电,能与盐酸或氢氧化钠溶液反响C.硅酸具有多孔性结构,可用作吸附剂或催化剂的载体D.二氧化硅是酸性氧化物,能与氢氟酸反响,也能与氢氧化钠溶液反响答案:D4.硅酸盐1.大多硅酸盐不溶于水,化学性质稳定2.硅酸钠Na2SiO3性质:可溶于水,其水溶液俗称水玻璃用途:制备硅胶和木材防火剂的原料Na2SiO3+H2O+CO2=Na2CO3+H2SiO3或Na2SiO3+2HCl=H2SiO3+2NaCl产品:陶瓷.玻璃.水泥小练:写出以SiO2为原料制备H2SiO3的化学方程式答案:SiO2+2NaOH====Na2SiO3+H2ONa2SiO3+2HCl====2NaCl+H2SiO3↓或Na2SiO3+CO2+H2O====Na2CO3+H2SiO3↓Na2SiO3+2CO2+2H2O====2NaHCO3+H2SiO3↓二.氯Cl1.氯气很强的氧化性!!!有毒气体!!!重要性质与金属钠反响方程式与金属铁反响方程式与金属铜反响方程式与氢气反响方程式与水反响方程式制漂白液反响方程式制漂白粉反响方程式实验室制法氯离子的检验试剂以及反响方程式2Na+Cl22Fe+3Cl2Cu+Cl2点燃2NaCl2FeCl3CuCl22HCl点燃点燃H2+Cl22HCl;H2+Cl2H2O+Cl2==HCl+HClOCl2+2NaOH==NaCl+NaClO+H2O2Cl2+2Ca(O H)2==CaCl2+Ca(ClO)2+2H2OMnO2+4HCl〔浓〕△MnCl2+Cl2↑+2H2OAgN O3溶液:Ag ++Cl—==AgCl1.以下气体,被当作化学武器首次使用于战争的是〔〕A.氯气 B.一氧化碳C.芥子气D.沙林答案:A—2.检验Na2SO4溶液中含有Cl的方法是〔〕A.先加BaCl2溶液,再加AgNO3溶液B.先加AgNO3溶液,再加稀HNO3C.先加足量的Ba〔NO3〕2溶液,再加AgNO3溶液D.先加足量Ba〔OH〕2溶液,再加AgNO3溶液答案:C3.以下气体,既有颜色又有毒性的是〔〕A.N2B.COC.Cl2D.CO2答案:C4.以下说法正确的选项是〔〕A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味[来源:Z#__#]B.用排水集气法便可以收集到纯洁的氯气C.氯气有漂白性D.自来水常用氯气来杀菌.消毒答案:D5.欲除去Cl2中的少量HCl气体,可选用〔〕A.NaOH溶液B.AgNO3溶液[来源:学科网Z__K]C.饱和食盐水D.石灰水答案:C2.氯水〔混合物〕〔1〕溶液中含H+:具有酸性〔2〕溶液中含Cl2.HClO:具有强氧化性(3)溶液中含Cl—:具有Cl—的性质〔4〕溶液中含HClO:具有漂白性分类颜色成分性质液氯纯洁物黄绿色Cl2氧化性新制氯水混合物黄绿色Cl2.H2O.HClO.H +.Cl—.ClO—.极少量的为OH—氧化性.酸性.漂白性久置氯水混合物[来源:Z__]无色H+.Cl—.H2O.极少量的OH—稀盐酸酸性氯水在保存是要密封,避光保存.因为氯水不稳定,见光易分解.3.次氯酸〔1〕弱酸性:比碳酸弱〔2〕见光容易分解:2HClO==2HCl+O2↑(3)强氧化性:杀菌消毒,漂白漂白性的思考:起漂白作用的物质有哪些?枯燥氯气能否漂白物质???1.氯气可用来杀菌消毒,又可作漂白剂,其中起作用的是〔〕A.Cl2B.HClOC.HCl 答案:B2.以下物质不能作漂白剂的是A.SO2B.Ca(ClO)2C.NaClOD.H2SO4(浓)答案:D3.以下物质中,既含有氯分子,又含有氯离子的是〔〕A.氯化钠溶液 B.新制氯水C.漂白粉D.液氯答案:B4.以下物质能使枯燥的有色布条褪色的是〔〕A.氯水B.液氯C.氯气D.次氯酸答案:AD5.以下表达能证明次氯酸是一种弱酸的是〔〕A.次氯酸不稳定,易分解B.次氯酸是一种强氧化剂C.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸D.次氯酸能使染料和有机色质褪色答案:C6.有一包白色固体,它可能是KCl.K2CO3.KNO3中的一种或几种,进行以下实验:①溶于水,得无色溶液;[来源:学科网]②在所得溶液中滴入AgNO3溶液,生成白色沉淀〔说明:Ag2CO3为白色沉淀〕;③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成.根据上述现象判断: 〔1〕白色固体一定含有的成分是_______________,可能含有的成分是_______________.〔2〕请写出上述实验中有关反响的离子方程式______________________________________.思路解析:由②产生白色沉淀知,可能含有K2CO3和KCl中的一种或两种;由③沉淀量减少且有气泡生成知,一定含有K2CO3;又由沉淀不完全消失可知,一定含有KCl.答案:〔1〕KCl和K2CO3KNO3 2〔2〕Ag++Cl-====AgCl↓,2Ag++CO3====Ag2CO3↓,D.O2Ag2CO3+2H+====2Ag++H2O+CO2↑扩展阅读:高中化学必修一第四章__非金属及其化合物知识点总结第四章非金属及其化合物【内容结构】氧化性:与金属及其他非金属反响Cl2与水.碱反响:消毒剂.漂白剂(漂白液与漂白粉)单S可燃性:生成SO2质N2稳定性:空气的主要成分Si亲氧性:以SiO2及硅酸盐的形式存在半导体性:信息技术与光电技术材料非金属SO与水反响:酸雨2.NO2及与环境的关系:大气污染与防治氧化物其化与强碱反响:制NaSiO2SiO32合硅酸盐材料的根底物与水反响:制氨水氢化物与酸反响:制铵盐化NH3合液化:制冷剂物H2SO4.HNO3.HClO氧化性含氧酸H不溶性2SiO3胶体性质:制硅胶NaClO.Ca(ClO)2消毒剂.漂白粉含氧酸盐Na2SiO3黏胶剂(水玻璃).防火剂复杂硅酸盐陶瓷.玻璃.水泥【知识要点】一.硅及其化合物的相互转化SiF4SiSiO2H2SiO3Na2SiO3二.氯及其化合物的相互转化CuCl2NaClNaClOHClCl2HClOFeCl2FeCl3Ca(ClO)2三.硫及其化合物的相互转化 H2SSSO2SO3H2SO4FeSNa2SNa2SO3CaSO3BaSO4四.氮及其化合物的相互转化NH4HCO3NH3H2ONH3N2NONO2HNO3NH4ClNaNO3二.本章知识结构梳理(一)硅及其化合物1.二氧化硅和二氧化碳比拟类别晶体结构熔沸点与水反响方程式与酸反响方程式与烧碱反响方程式与CaO反响方程式存在状态高不反响SiO2+4HF==SiF4↑+2H2OSiO2+2NaOH==Na2SiO3+H2O高温二氧化硅酸性氧化物原子晶体二氧化碳_酸性氧化物分子晶体低CO2+H2OH2CO3不反响少:2NaOH+CO2==Na2CO3+H2O过:NaOH+CO2==NaHCO3CaO+CO2==CaCO3人和动物排放SiO2+CaOCaSiO3水晶.玛瑙.石英.硅石.沙子2.硅以及硅的化合物的用途物质硅单质SiO2硅酸钠SiC用途半导体材料.光电池〔计算器.人造卫星.登月车.探测器〕饰物.仪器.光导纤维.玻璃矿物胶砂纸.砂轮的磨料(二)氯1.液氯.新制的氯水和久置的氯水比拟分类颜色液氯纯洁物黄绿色新制氯水混合物黄绿色Cl2.H2O.HClO.H +.Cl—.ClO—.极少量的为OH—氧化性.酸性.漂白性久置氯水混合物无色H +.Cl—.H2O.极少量的OH—稀盐酸酸性成分Cl2性质氧化性2.氯气的性质与金属钠反响方程式与金属铁反响方程式2Na+Cl2点燃2NaCl2FeCl32Fe+3Cl2点燃与金属铜反响方程式与氢气反响方程式与水反响方程式制漂白液反响方程式制漂白粉反响方程式实验室制法氯离子的检验试剂以及反响方程式H2+Cl2Cu+Cl2点燃CuCl22HCl2HCl;H2+Cl2H2O+Cl2==HCl+HClOCl2+2NaOH==NaCl+NaClO+H2O2Cl2+2C a(OH)2==CaCl2+Ca(ClO)2+2H2OMnO2+4HCl〔浓〕△MnCl2+Cl2↑+2H2OAgNO3溶液Ag++Cl—==AgCl(三)硫.氮1.二氧化硫的性质物理性质颜色状态黄绿色密度比空气___大___毒性有毒SO2+H2OH2SO3SO2+2NaOH==Na2SO3+H2O与烧碱反响方程式Na2SO3+SO2+H2O==2NaHSO3SO2+NaOH==NaHSO3化学性质漂白性复原性氧化性漂白原理:由于它能跟某些有色物质生成:无色物质曾学过的具有漂白性的物质与氧气反响方程式与氯水反响方程式吸附漂白:活性炭氧化漂白:HClO.O3.Na2O22SO2+O2===2SO3SO2+Cl2+2H2O==H2SO4+2HCl与水反响方程式酸性与硫化氢反响方程式SO2+2H2S==3S↓+2H2O2.浓硫酸和浓硝酸的性质相同点与Cu浓硫酸Cu+2H2SO4(浓)△浓硝酸CuSO4+Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O反响SO2↑+2H2O与木炭反响与铁铝反响异同点C+2H2SO4(浓)△CO2↑C+4HNO3(浓)△CO2↑+4NO2↑+2H2O+2SO2↑+2H2O发生钝化现象,所以可以用铁制或铝制容器来存放冷的浓硫酸和浓硝酸①吸水性枯燥剂②脱水性蔗糖变黑王水:浓硝酸和浓盐酸〔__1__:3___〕3.氨气.氨水与铵盐的性质氨气颜色状态的物无色有刺理性激性气味质的气体NH3+H2O密度比空气__小___水溶性易溶〔1:_700_〕可以形成喷泉,水溶液呈_碱_性.氨气与水反响的化方程式学性与盐酸反质应方程式实验室制法氨水NH3H2ONH4++OH—NH3+HCl==NH4Cl△Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2ONNH3.成分NH3H2O.H2O.NH4+.OH—.极少量的H+铵盐物理性质:铵盐都是_无色_色晶体,____能_____溶于水化学性质氯化铵分解反响方程式碳酸氢铵分解反响方程式NH4Cl△NH3+HClNH4HCO3△NH3↑+H2O+CO2↑高中化学必修一第四章非金属及其化合物二氧化硅1结构:二氧化硅晶体是由氧原子和硅原子构成的,在二氧化硅晶体中无二氧化硅晶体.在晶体中每个硅原子与四个氧原子结合,每个氧原子与两个硅原子结合,向空间网状结构,即二氧化硅晶体由硅原子和氧原子按1:2的比例组成的空间网状结构晶体2物理性质:二氧化硅具有硬度大.熔点高.不溶于水.不导电等性质,纯洁的二氧化硅晶体无色透明3化学性质:①二氧化硅是酸性氧化物,能与碱和碱性氧化物反响,如:②弱氧化性:③特性二氧化硅是酸性氧化物,却能与氢氟酸发生反响: 4用途:制备高性能通讯材料光导纤维;制备石英玻璃.石英钟;制造电子工业中的重要部件.光学仪器.精密仪器.轴承.耐磨器皿;装饰品硅酸:硅酸是一种弱酸,比碳酸还弱,切难溶于水.通过复分解反响制的硅酸形成胶体溶液,进一步形成凝胶,硅酸凝胶经枯燥脱水可形成常用作枯燥剂的〝硅胶〞硅酸的制备:硅酸盐1硅酸盐是由硅.氧和金属组成的化合物的总称.硅酸盐是一类结构复杂的物质,一般都不溶于水.化学性质稳定,是地壳岩石的主要成分2最简单最常用的硅酸盐是硅酸钠,其水溶液熟称水玻璃,其化学性质稳定,不能燃烧,不易被腐蚀,热稳定性强,有粘性.可用作建筑材料.纸张粘合剂,木材织物的防腐剂.防火剂3硅酸盐由于组成比拟复杂,通常用二氧化硅和金属氧化物的形式表示其组成.如:Na2SiO3→Na2O.SiO2氯气氯气通常状况下呈黄绿色,是一种具有强烈刺激性气味的有毒气体,化学性质活泼,具有较强的氧化性1氯气与金属反响〔除金.铂外〕①产生黄色的火焰和大量白烟②产生大量棕色气体③产生大量棕色的烟2氯气与氢气反响方程式:氢气在氯气中燃烧,发出苍白火焰.氢气燃烧结束后,抽去盖在集气瓶口处的毛玻璃片,及其瓶口处有白雾3氯气和水反响氯气的水溶液叫氯水.氯气与水反响生成盐酸和次氯酸,氯气既是氧化剂又是复原剂方程式:①氯水的成分:三分子〔水分子,氯气.次氯酸分子〕四离子〔氢离子.氯离子.次氯酸根离子.少量氢氧根离子〕②颜色:新制的饱和的氯水呈浅黄绿色③因含有盐酸和次氯酸而成酸性,但主要是由于盐酸④沉淀性:与银离子反响生成沉淀⑤强氧化性因含有次氯酸和氯气而呈强氧化性,但氧化性主要由次氯酸决定,氯气的强氧化性决定它具有漂白性⑥不稳定性:由于次氯酸:4氯气与碱反响:方程式:①吸收多余的氯气用氢氧化钠②漂白粉的有效成分是次氯酸钙5氯气与某些复原性物质的反响氯气具有强氧化性,可与二氧化硫,亚硫酸根,硫离子.溴离子.碘离子.亚铁离子等具有复原性的微粒发生氧化复原反响6氯气的用途:自来水杀菌;制造盐酸;制造漂白剂;合成塑料.橡胶.人造纤维;农药.燃料.药品.氯气的实验室制法方程式:制得的气体含有盐酸和水,因此分别通过饱和食盐水.浓硫酸〔氯化钙〕等进行除杂.气体用向上排空气法或排饱和食盐水法收集.尾气用氢氧化钠吸收.卤素1卤素包括氟氯溴碘2卤素均具有强氧化性,并且氟>氯>溴>碘>爱3化学性质:①与金属反响:卤素都能与金属反响生成金属卤化物②都与氢气反响生成对应的酸③与水反响:④与碱反响:二氧化硫:1物理性质:无色.有刺激性气味的有毒气体,密度比空气大,易于液化2化学性质:①与水反响生成显酸性的物质,具有漂白作用,但漂白后新物质不稳定,受热易恢复原色②常见的能被二氧化硫漂白的物质有:品红溶液.白纸浆.毛.丝.草帽辫.但二氧化硫不能漂白酸碱指示剂③二氧化硫的氧化性和复原性与氧气反响:与氯气反响:与溴反响:与碘反响:与硫化氢反响:亚硫酸根与氯气反响:亚硫酸与氯气反响:亚硫酸根与氧气反响:亚硫酸与氧气反响:氮的重要氧化物NO和NO21一氧化氮:无色无味气体,不溶于水,易被氧气氧化,方程式:(反响现象:无色气体变成红棕色有刺激性气味的气体),有毒,能与血红蛋白结合2二氧化氮:红棕色气体,有刺激性气味,有毒,刺激呼吸器官导致呼吸道.肺部病变,浓度大时引起死亡化学性质:与水反响方程式:雷雨发庄稼的化学原理:氨1物理性质:无色有刺激性气味气体,密度较小,极易溶于水,易液化2化学性质:①与水反响:②与氯化氢反响:3氨的实验室制备方程式:收集方法:向下排空气法尾气处理:用稀硫酸吸收验满方法:用湿润的红色石蕊试纸检验:试纸变蓝;用浓盐酸检验:产生大量白烟枯燥方法:碱石灰枯燥氨的用途:肥料.化工合成.制冷剂铵盐1物理性质:晶体,易溶于水2化学性质:①受热易分解:氯化铵分解:碳酸铵分解:碳酸氢铵分解:硝酸铵分解:②铵盐与碱反响:〔铵盐的特征反响〕硫酸铵与氢氧化钠反响:硝酸铵与氢氧化钠反响:硝酸1硝酸与金属铜反响铜与稀硝酸反响:铜与浓硝酸反响:硝酸是一种强氧化剂,几乎能与所有金属反响〔金.铂〕除外,但是与铝.铁在冷的浓硝酸中会发生钝化现象.浓度越大,氧化性越大.一旦沾在皮肤上,用小苏打水或肥皂水洗涤2硝酸与非金属反响硝酸与碳反响:硫酸1浓硫酸的物理性质纯洁的硫酸是无色粘稠油状液体,沸点较高,不易挥发,密度大于水,溶于水时放出大量的热2浓硫酸的三大特性:吸水性.脱水性.强氧化性①浓硫酸的吸水性:由于浓硫酸有吸水性常可以作为枯燥剂,但是浓硫酸不能枯燥碱性气体,氨,复原性气体,如:硫化氢.溴化氢.碘化氢②浓硫酸的脱水性:脱水性是化学变化③浓硫酸的氧化性:a浓硫酸具有很强的氧化性,可以把复原性很弱的银氧化,但遇到铝.铁发生钝化b在做氧化剂时一般会复原为二氧化硫浓硫酸与碳反响:。
必修一第四章知识点总结1、二氧化硅和二氧化碳比较硅的化合物的转化H2SiO3 Na2SiO3SiO2H2Si03+2NaOH==Na2SiO3+2H2ONa2SiO3+2HCl==2NaCl+H2SiO3↓SiO2+2NaOH == Na2SiO3+H2OSiO2+Na2CO3高温Na2SiO3+CO2↑2、液氯、新制的氯水和久置的氯水比较新制氯水变质的原理:H2O+Cl2==HCl+HClO2HClO==2HCl+O2↑3、氯气的性质与金属钠反应方程式2Na+Cl2点燃2NaCl与金属铁反应方程式2Fe+3Cl2点燃2FeCl3(常温下,干燥的铁和Cl2不反应)与金属铜反应方程式Cu+Cl2点燃CuCl2与氢气反应方程式H2+Cl22HCl;H2+Cl22HCl与水反应方程式H2O+Cl2 ==HCl+HClO制漂白液反应方程式Cl2+2NaOH==NaCl+NaClO+H2O制漂白粉反应方程式2Cl2 +2C a(O H)2==CaCl2+C a(C l O)2+2H2O实验室制法MnO2+4HCl(浓)△MnCl2 +Cl2↑+2H2O氯离子的检验试剂以及反应方程式AgNO3溶液Ag++Cl―==AgCl↓Cl2的检验使湿润的KI-淀粉试纸变蓝Cl2+2KI==2KCl+I24、二氧化硫的性质化学性质酸性与水反应方程式SO2+H2O H2SO3与烧碱反应方程式SO2+2NaOH==Na2SO3+H2ONa2SO3+SO2+H2O==2NaHSO3SO2+NaOH==NaHSO3漂白性漂白原理:由于它能跟某些有色物质生成:无色物质曾学过的具有漂白性的物质吸附漂白:活性炭氧化漂白:HClO、O3、Na2O2还原性与氧气反应方程式2SO2 + O2 2SO3 与卤素反应方程式SO2 + Cl2 +2H2O == H2SO4+2HClSO2 + Br2 +2H2O == H2SO4+2HBrSO2 + I2 +2H2O == H2SO4+2HI 氧化性与硫化氢反应方程式SO2+2H2S == 3S↓+2H2O5、浓硫酸和浓硝酸的性质6强酸制弱酸强酸+弱酸盐===弱酸+强酸盐CaCO3+2HCl==CaCl2+H2O+CO2↑Ca CO3+2H+==Ca2+++H2O+CO2↑Na2SiO3+2HCl==2NaCl+H2SiO3↓SiO32-+2H+==H2SiO3↓C a(C l O)2+2HCl== CaCl2+2HClO 2C l O-+2H+==2HClO应用(1) Na2SiO3溶液敞口放置在空气中变质Na2SiO3+H2O+CO2==Na2CO3+H2SiO3↓SiO32-+H2O+CO2==CO32-+H2SiO3↓Na2SiO3+2H2O+2CO2==2NaHCO3+H2SiO3↓SiO32-+2H2O+2CO2==HCO3-+H2SiO3↓(2) 漂白粉在空气中变质C a(C l O)2+H2O+CO2== CaCO3↓+2HClO C a2++2C l O-+H2O+CO2== CaCO3↓+2HClO(3) 实验室制SO2Na2SO3+2H2SO4==Na2SO4+H2O+SO2↑SO32-+2H+==H2O+SO2↑(3) 实验室制H2SFeS+H2SO4==FeSO4+H2S↑FeS+2H+==Fe2++H2S↑(4)除杂质CO2中混有SO2SO2+2NaHCO3=Na2SO3+H2O+2CO2↑CO2中混有HClHCl+NaHCO3=NaCl+H2O+CO2↑SO2中混有HClHCl+NaHSO3= NaCl+H2O+SO2↑7 、氨气、氨水与铵盐的性质NH4+的检验药品中加NaOH溶液然后加热,产生的气体使红色石蕊试纸变蓝,说明产生了NH3进而说明样品中有NH4+七年级英语期末考试质量分析一、试卷分析:本次试卷的难易程度定位在面向大多数学生。
与盐溶液反应Cl2 + Na2SO3 + H2O = 2HCl + Na2SO4Cl2 + 2KI = I2 + 2KCl实验室制取原理MnO2 + 4HCl(浓) △MnCl2 + Cl2↑+2H2O 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O NaCl O + 2HCl = NaCl + Cl2↑+ H2O ( 离子方程式: Cl O-+ 2H+ + Cl- = Cl2↑+ H2O )2.新制氯水成分分子:H2O HClO Cl2 离子:H+Cl-ClO-OH-久置氯水成分分子:H2O 离子:H+Cl-OH-3.实验室如何制取纯净的氯气制取原理:MnO2 + 4HCl(浓) △MnCl2 + Cl2↑+2H2O 气体成分:Cl2 (HC l、H2O)操作顺序仪器中盛装的药品各试剂的作用应出现的现象①先通入饱和食盐水除去HC l有晶体析出(NaCl)②再通入浓H2SO4除去H2O4.漂白粉①制法:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O ②有效成分:Ca(ClO)2 成分:CaCl2和Ca(ClO)2③漂白原理:Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO (在溶液中)漂白慢Ca(ClO)2 + 2HCl = CaCl2 + 2HClO 漂白快④久置失效发生的反应:Ca(ClO)2 + CO2 + H2O = CaCO3+ 2HClO 2HClO光照或加热2HCl + O2↑5.Br2、I2在不同溶剂中的颜色水苯或汽油四氯化碳Br2黄~橙橙~橙红橙~橙红I2深黄~褐淡紫~紫红紫~深紫6.置换反应Cl2 + 2NaBr = Br2+ 2NaCl Br2 + 2KI = I2 + 2KBr ∴氧化性Cl2 >Br2 >I27.I2遇淀粉溶液后,溶液呈蓝色 I-氧化剂——————→I2三.氮1.氮的氧化物NO:无色气体、有毒(同CO)、难溶与水2NO + O2 = 2NO2NO2:红棕色气体、有毒、与水反应3NO2 + 2H2O = 2HNO3 + NO2.有关NO与O2或NO2与O2混合通入水中,液面上升一定高度时用的方程式4NO2 + O2 + 2H2O = 4HNO3 4NO+ 3O2 + 2H2O = 4HNO33.硝酸物理性质无色液体、有刺激性气味、能以任意比溶于水化学性质酸的通性强氧化性与金属氧化物3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑+ 5H2O与金属3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2OCu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2H2O 与非金属 C + 4HNO3(浓) △CO2↑+ 4NO2↑+ 2H2O不稳定性4HNO3光照或加热4NO2↑+ O2↑+ H2O4.氨( NH3 )物理性质无色气体、有刺激性气味、密度小于空气、1:700溶于水化学性质与H2O NH3 + H2O NH3·H2O NH4++ OH-与酸NH3 + HCl = NH4Cl氨的催化氧化4NH3 + 5O2催化剂加热4NO + 6H2O实验室制取原理NH4+ + OH-△NH3↑+ H2O。
高一化学《必修一》方程式(按章节归纳)第一、二章:1、硫酸根离子的检验:2、碳酸根离子的检验:3、银离子的检验:4、木炭还原氧化铜:5、铁片与硫酸铜溶液反应:6.镁在二氧化碳中燃烧:第三章:一、钠1、钠在空气中燃烧(黄色的火焰):2、钠块在空气中变暗:3、Na2O在空气中加热(变黄):4、金属锂在空气中燃烧:5、钠与水反应(浮、熔、游、响、红)化方离方二、Na2O、Na2O2的相关反应:1、碱性氧化物Na2O与水的反应:2、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)化方离方3、碱性氧化物Na2O与CO2的反应4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是:5、Na2O+SO2=Na2O2+SO2=6、Na2O+2HCl=7、2Na2O2+4HCl=三、NaHCO3与Na2CO31、小苏打受热分解:2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:4、向NaOH溶液中通入少量CO2:5、继续通入过量CO2:总反应方程式:6、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液化方离方②纯碱溶液中滴加盐酸,至过量化方离方化方离方7、(1)Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2=NaHCO3+Ca(OH)2(多)=2NaHCO3+Ca(OH)2(少)=8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3+CaCl2=NaHCO3溶液与CaCl2不反应;铝1、铝与氯气反应:2、铝片与稀盐酸反应化方离方3、铝与氢氧化钠溶液反应化方离方4、4Al+3O 22Al 2O 3电解熔融的氧化铝:2Al 2O 34Al +3O 2↑5、铝与氧化铁高温下反应【铝热反应】6、不稳定性:2Al(OH)3Al 2O 3+3H 2O7、硫酸铝溶液中滴过量氨水【实验室制备Al(OH)3】化方离方8、向NaAlO 2溶液中通入CO 2化方离方9、氧化铝溶于氢氧化钠溶液化方离方10、氧化铝溶于盐酸:化方离方11、Al(OH)3溶液中加盐酸:化方离方12、Al(OH)3与NaOH 溶液反应:化方离方13、铝盐、偏铝酸盐反应生成Al(OH)3:离方铁1、铁与硫加热反应:2、铁与氧气中燃烧:3.铁在氯气中燃烧:4、高温下铁与水蒸气反应:5、铁与盐酸反应:化方离方6.铁的氧化物FeO、Fe2O3、Fe3O4溶于盐酸中:化方离方化方离方化方离方7.Fe(OH)2、Fe(OH)3的制备:1)FeSO4+2NaOH=Fe(OH)2↓+Na2SO4Fe2++2OH-=Fe(OH)2↓氯化铁中滴入氢氧化钠溶液(红褐色沉淀)2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl Fe3++3OH-=Fe(OH)3↓氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色沉淀)3)4)不稳定性:2Fe(OH)3Fe2O3+3H2O8.Fe2+、Fe3+之间的转化:1)氯化亚铁溶液中通入氯气(或者加氯水):化方离方2)氯化铁溶液中加入铁粉:化方离方3)用KSCN检验Fe3+的存在:离子方程式:Fe3++3SCN-=Fe(SCN)3(血红色)4)印刷电路板:第四章:一、硅(1)工业制单质硅(碳在高温下还原二氧化硅):(硅单质的实验室制法,粗硅的制取)(2)硅单质与氢氟酸(3)硅单质与NaOH溶液反应:Si及其化合物:二、二氧化硅(1)二氧化硅与氢氧化钠反应:化方离方(2)二氧化硅与氧化钙高温反应:(3)二氧化硅与氢氟酸反应:三、硅酸(H2SiO3)(1)往硅酸钠溶液中通入二氧化碳:(2)硅酸钠与盐酸反应:(3)硅酸受热分解:(4)工业制玻璃原理:四、氯气(1)氯气实验室制法:(仪器:分液漏斗,圆底烧瓶)化方离方2、氯气性质:A、金属和氯气的反应:(1)铜丝在氯气中剧烈燃烧(棕色烟):之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)(2)氯气和金属钠反应:(3)铁在氯气中剧烈燃烧:(4)氢气在氯气中燃烧(苍白色火焰):(5)氟气与氢气反应(黑暗处即可爆炸):B、氯气与水反应(6)氯气溶于水(新制氯水中含H+、Cl-、ClO-、OH-、Cl2、HClO、H2O)化方离方(7)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):C、氯气和碱的反应:(8)工业制漂白粉的原理:化方离方(9)漂白粉长期置露在空气中失效的原理:(10)制漂白液(或氯气尾气处理):五、硫和氮的化合物:(1)硫与非金属:(2)硫与金属:(3)硫与氢氧化钠溶液反应:(4)二氧化硫与水反应:(5)二氧化硫与碱性氧化物反应:(6)二氧化硫与碱反应:(7)二氧化硫与硫化氢气体反应:(8)二氧化硫通入氯水中:(9)二氧化硫被O2氧化:(10)三氧化硫与水反应(11)三氧化硫与碱反应:(12)硫化氢气体通入氯水:(13)亚硫酸钠与浓硫酸反应制备二氧化硫:(14)工业合成氨:(15)氨的催化氧化:(16)NH3在水中的反应:(17)氨水受热分解:(18)实验室制取氨气:(19)碳酸氢铵受热分解:(20)用浓盐酸检验氨气(白烟生成):(21)氯化铵受热分解:(22)硫酸铵溶液与氢氧化钠溶液混合加热化方离方(23)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验NH4+的方法)化方离方(24)氮气和氧气放电下反应(雷雨发庄稼)(25)二氧化氮溶于水:(26)NO2、O2的混合气通入水中无剩余气体:(27)NO、O2的混合气通入水中无剩余气体:5、浓硫酸、HNO3与Cu反应:Al、Fe遇浓HNO3、浓硫酸钝化(常温)(30)Cu与浓HNO3加热:(31)Cu与稀HNO3反应:(32)铜与浓硫酸反应:(33)浓硫酸与木炭反应:(34)浓硝酸与木炭反应:。
必修1 第四章非金属及其化合物一、硅及硅的化合物
二、氯及氯的化合物
三、硫及硫的化合物之间的转化关系
是对的,因为SO2是有刺激性气味的气体。
b、SO2将通入酚酞变红的溶液,溶液颜色褪去,表
达了SO2与水反响生成亚硫酸,是酸性氧化物的性质,
而不是漂白性,SO2不能漂白指示剂。
③SO2具有强复原性,能与强氧化剂(如酸性高锰
酸钾溶液、氯气、氧气等)反响。
SO2能使酸性KMnO4
溶液、新制氯水褪色,显示了SO2的强复原性(不是
SO2的漂白性)。
(催化剂:粉尘、五氧化二钒)
(将SO2气体与Cl2气体混合后作用于有色溶液,漂白效果将大大减弱。
)
④SO2的弱氧化性:如2H2S+SO2=3S↓+2H2O
(有黄色沉淀生成)
⑤SO2的漂白性:SO2能使品红溶液褪色,加热会
复原原来的颜色。
用此可以检验SO2的存在。
三氧化硫
硫酸(1)浓硫酸的物理性质:纯的硫酸为无色油状粘稠液体,
能与水以随意比互溶(稀释浓硫酸要标准操作:注
酸入水且不断搅拌)。
不挥发,沸点高,密度比水
大。
(2)浓硫酸三大性质:
①吸水性:浓硫酸可汲取结晶水、湿存水与气体中的水
蒸气,可作枯燥剂,可枯燥H2、
O2、SO2、CO2等气体,但不行以用来枯燥NH3、
H2S气体。
②脱水性:能将有机物(蔗糖、棉花等)以H与O原子
个数比2︰1脱去,炭化变黑。
③强氧化性:浓硫酸在加热条件下显示强氧化性(+6
价硫表达了强氧化性),能与大多数金属反响,也能与
非金属反响。
四、氮及氮的化合物之间的转化关系。
化 学 方 程 式含硅矿物与信息材料1、Si+2F 2=SiF 4Si+4HF =SiF 4↑+2H 2↑Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑Si+C SiCSi+O 2SiO 2Si+2Cl 2SiCl 4 高温 粗硅的提纯硅在常温下的三个反应 高温 硅在加热或高温下的三个反应SiCl 4+2H 2Si+4HCl2、SiO 2+2C Si+2CO ↑ (工业制粗硅)3、SiO 2+CaO CaSiO 34、SiO 2+CaCO 3CaSiO 3+CO 2↑SiO 2+Na 2CO 3Na 2SiO 3+CO 2↑5、SiO 2+2NaOH =高温 高温 高温 高温制玻璃原理Na2SiO3+H2O(碱液腐蚀玻璃并引起粘连)SiO2+4HF=SiF4↑+2H2O (用于雕刻玻璃,氢氟酸保存在塑料瓶中)强酸制弱酸6、Na2SiO3+2HCl=2NaCl+H2SiO3↓Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓7、2NaOH+H2SiO3=Na2SiO3+2H2OH2SiO3SiO2+H2O (SiO2与水不反应)氯及其化合物8、MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(实验室制氯气,氧化剂还可以是KMnO 4、KClO 3等。
固—液—加热装置,饱和食盐水除杂,浓硫酸干燥,向上排空气法或排饱和食盐水法收集,氢氧化钠溶液吸收尾气)KMnO 4 + HCl(浓) KClO 3 + HCl(浓) 9、2Fe+3Cl 2 2FeCl 3 (棕点燃点燃褐色的烟)Cu+Cl 2 CuCl 2 (棕黄色的烟)2Al+3Cl 2 2AlCl 3 2Na+Cl 2 2NaCl (白烟)H 2+Cl 2 2HCl (苍白色火焰,光照则爆炸)H 2+Br2 2HBr 点燃 点燃点燃H 2+I2 2HI2FeCl 2+Cl 2=2FeCl 3 2FeBr 2+Br 2=2FeBr 310、2Fe 3++2I -=2Fe 2++I 2 2FeCl 3+Fe =2FeCl 3 2FeCl 3+Cu =2FeCl 2+CuCl 211、Cl 2+H 2O HCl+HClO(歧化反应;氯水的成光照氧化性:Cl 2> Br 2> Fe 3+> I >S分:三分子三离子)2HClO2HCl+O2↑(久置的氯水即盐酸溶液)12、Cl2+2NaOH=NaCl+NaClO+H2O(歧化反应;制漂白液)▲3Cl2+6NaOH5NaCl+NaClO3+3H2O(歧化反应)Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (歧化反应;制漂白粉)强酸制弱酸Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO(漂白原理)Ca(ClO)2+2HCl=CaCl2+2HClO13、Cl2+2NaBr=2NaCl+Br2Cl 2+2KI =2KCl+I 2 Br 2+2KI =2KBr+I 2 2F 2+2H 2O =4HF+O 2(氧化性:F 2>O 2)X 2+H 2O =HX+HXO (X=Cl 、Br 、I )14、NaCl+AgNO 3=AgCl ↓(白色沉淀)+ NaNO 3 NaBr+AgNO 3=AgBr ↓氧化性:Cl 2> Br > ICl -、Br -、I -的检验(淡黄色沉淀)+ NaNO3KI+AgNO3=AgI↓(黄色沉淀)+ KNO3含硫化合物的性质和应用15、S+O2 SO2S+ H2 H2SS+ Fe FeSS+ 2Cu Cu2S▲3S+6NaOH2Na 2S+Na 2SO 3+3H 2O(歧化反应) (类比氯气与氢氧化钠的反应)16、4FeS2+11O 22Fe 2O 3+ 8SO 2↑ 2SO 2+O 22SO 3 SO 3+H 2O =H 2SO 417、SO 2+H 2O H 2SO 3催化剂 高温 工业生产硫酸SO 2+2NaOH=Na 2SO 3+H 2OSO 2+Ca(OH)2=CaSO 3↓+H 2O SO 2+Na 2O =Na 2SO 3 18、SO 2+2H 2S =3S + 2H 2O (若在溶液中进行的S 打↓)SO 2+Na 2O 2=Na 2SO 419、Na 2SO 3+H 2SO 4(浓)=SO 2是酸性氧化物 氧化还原反应Na 2SO 4+H 2O+SO 2↑ (实验室制取SO 2,固—液—不加热装置)20、Na 2SO 3+ SO 2+H 2O =2NaHSO 3Na 2SO 3+2HCl=2NaCl+H 2O+SO 2↑NaHSO 3+HCl=NaCl+H 2O+SO 2↑ 除SO2中HCl 用饱和的NaHS O 溶液21、SO 2+2NaHCO 3=Na 2SO 3+ H 2O +2CO 2(除CO 2中SO 2用饱和的NaHCO 3溶液)22、CaCO 3CaO+ CO 2↑ CaO+ SO 2CaSO 3 2CaSO 3+O 2=2CaSO 423、Na 2SO 3+BaCl 2=BaSO 3↓+2NaCl3BaSO 3+2HNO 3=石灰石消除SO 2的污染3BaSO4+2NO↑+ H2O(亚硫酸根的检验中不能使用硝酸) 24、SO2+X2+2H2O=H2SO4+2HX (X=Cl、Br、I) 2H2SO3+O2=2H2SO4 (亚硫酸变质;酸雨的形成)2Na2SO3+O2=2Na2SO4 (Na2SO3溶液变质)25、Cu+2H2SO4(浓)CuSO4+浓硫酸的强氧化性SO2↑+2H2OC+2H2SO4(浓)CO2↑+2SO2↑+2H2OH2S + H2SO4(浓)=S↓+SO2↑+ 2H2O(H2S的干燥不能用浓硫酸,也不能用碱石灰,只能用无水CaCl2)▲26、FeS+H2SO4(稀)=FeSO4+H2S↑ (实验室制取H2S) FeS+2HCl(稀)=FeCl2+H2S↑(实验室制取H2S) NaHS+HCl=NaCl+H2S↑(除H2S中HCl用饱和的NaHS溶液)H2S+CuSO4=CuS↓+H2SO4(用于H2S的检验、吸收) ▲27、2H 2S +O22S + 2H 2O2H 2S +3O22SO 2 + 2H 2O2Na 2S+Na 2SO 3+3H 2SO43S ↓+3Na 2SO 4+ 3H 2O (归中反应)生产生活中的含氮化合物 高温、高压催化剂28、N 2+ 3 H 2 2NH 3 (工业合成氨)N 2+O 22NO 29、2NO+O 2=2NO 2 3NO 2+H 2O =2HNO 3+NO4NO 2+O 2+2H 2O =4HNO 34NO+3O 2+2H 2O =放电 固氮 NO 2、NO 、O 2、H 2O 的反应计算催化剂4HNO330、4NH3+5O24NO+6H2O(氨的催化氧化,工业制硝酸的基础)31、NH 3+H 2O NH 3·H 2O NH 4++OH - NH 3+HCl =NH 4Cl (大量白烟,可用于氨气、氯化氢气体的检验)NH 3·H 2O+HCl =NH 4Cl+H 2O2NH 3·H 2O+H 2SO 4=碱 的 通 性(NH 4)2SO 4+2H 2ONH 3·H 2O+HNO 3=NH 4NO 3+H 2O2NH 3·H 2O+MgCl 2=Mg(OH)2↓+2NH 4Cl3NH 3·H 2O+AlCl 3=Al(OH)3↓+3NH 4ClAlCl 3溶液中滴入过量的氨水白色沉淀不溶解 32、NH 3·H 2O NH 3↑+H 2O (可用于快速制取少量氨气,还可用NaOH 、CaO 固体作吸水放热剂)33、NH 4Cl NH 3↑+HCl ↑(NH 4)2CO32NH 3↑+H 2O+CO 2↑NH 4NO3N 2↑+O 2↑+2H 2O ↑(爆炸)2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+H 2O(实验室制氨气,干燥NH 3用碱石灰) 34、NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O(NH 4)2SO 4+2NaOH =不能用铵盐的受热分解制取氨气Na2SO4+2NH3·H2O(NH4)2SO4+2NaOH子的检验)光照35、4HNO34NO2↑+O2↑+2H2O36、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(用于实验室制取NO2气体)3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO ↑+4H 2O (用于实验室制取NO 气体)C+4HNO 3(浓)4NO 2↑+CO 2↑+2H 2OHNO 3与Fe 、H 2S 、BaSO 3、HI 、HBr 、Fe 2+、S 2-、SO 32-、I -、B r -等发生氧化还原反应浓、稀硝酸的强氧化性。
高一化学必修一方程式总结高一化学必修一(一)课堂导学1一、氨1.氨气的物理性质是无色气体,有刺激性气味,密度比空气小,极易溶于水(易液化)。
2.氨气易溶于水——喷泉实验操作及现象:(1)打开止水夹,并挤压滴管的胶头(2)烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,瓶内液体呈红色结论:氨易溶于水,水溶液呈碱性3.将分别蘸有浓氨水、浓盐酸的两支玻璃棒渐渐靠近,观察到的现象是有大量白烟产生,这是因为浓氨水挥发产生的氨气与浓盐酸挥发产生的HCl气体在空气中相遇迅速反应生成氯化铵晶体小颗粒,反应的化学方程式是NH3+HCl===NH4Cl。
4.NH3分子中氮元素的化合价为-3价,在化学反应中氮元素化合价可能的变化是只能升高,不能降低,因此氨具有还原性。
请写出氨气与氧气在催化剂作用下生成NO的化学方程式:4NH3+5O2催化剂4NO+6H2O。
归纳总结11.氨气的化学性质(1)氨与水反应生成一水合氨:NH3+H2O?NH3·H2O。
(2)氨与酸反应生成铵盐:NH3+H+===NH4+。
(3)氨的催化氧化反应:4NH3+5O2催化剂4NO+6H2O。
2.氨水的性质(1)氨溶于水,大部分和水反应生成NH3·H2O。
NH3·H2O很不稳定,受热易分解为氨气和水,反应的化学方程式是NH3·H2O△=====NH3↑+H2O。
(2)氨水具有弱碱性,电离方程式是NH3·H2O?NH4++OH-,能使酚酞试液变红色(或使湿润的红色石蕊试纸变蓝色),能与氯化铝溶液反应,离子方程式是Al3++3NH3·H2O===Al(OH)3↓+3NH4+。
课堂导学2二、铵盐及氨气的制取1.农业上常用的铵态氮肥,如NH4HCO3、(NH4)2SO4、NH4NO3等都属于铵盐,它们都易溶于水。
其化学性质是(1)铵盐受热易分解NH4Cl受热分解的化学方程式:NH4Cl△=====NH3↑+HCl↑。
高一化学《必修一》方程式总结第一、二章:1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl3、银离子的检验: Cl -+ Ag += AgCl ↓ 4、木炭还原氧化铜: 2CuO + C高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu 6. 镁在二氧化碳中燃烧 : 2Mg + CO 2点燃2MgO + C第三章: 一、钠1、钠在空气中燃烧(黄色的火焰):2Na + O 2 Na 2O 22、 钠块在空气中变暗 :4Na +O 2=2Na 2O3、Na 2O 在空气中加热(变黄):2Na 2O +O 2 △2Na 2O 24、金属锂在空气中燃烧 :4Li + O 2△2Li 2O5、钠与水反应(浮、熔、游、响、红) 2Na + 2H 2O = 2NaOH + H 2 ↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2 ↑ 二.Na 2O 、Na 2O 2的相关反应:1、碱性氧化物Na 2O 与水的反应 :Na 2O +H 2O =2NaOH2、过氧化钠与水的反应(放热反应、Na 2O 2是强氧化剂,可用于漂白)2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑ 2Na 2O 2 + 2H 2O = 4Na ++4OH -+O 2↑3、碱性氧化物Na 2O 与CO 2的反应Na 2O + CO 2 = Na 2CO 34、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是: 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 25、 Na 2O + SO 2 = Na 2SO 3 Na 2O 2 + SO 2 = Na 2SO 46、Na 2O +2HCl = 2NaCl + H 2O7、2Na 2O 2 +4 HCl = 4 NaCl + 2 H 2O + O 2 ↑三.NaHCO3与Na2CO31、小苏打受热分解: 2NaHCO3△Na2CO3+ H2O +CO2↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+ NaOH △ Na2CO3+ H2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO3+ NaOH = Na2CO3+ H2O HCO3-+ OH -= H2O + CO32-4、向NaOH溶液中通入少量CO2 :2NaOH + CO2= Na2CO3+ H2O5、继续通入过量CO2 :Na2CO3+ CO2+ H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+ 2HCl = 2NaCl + H2O +CO2↑ CO32-+ 2H+= H2O + CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+ HCl =NaHCO3+ NaCl CO32-+ H+= HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+= H2O +CO2↑7、(1)Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3 +Ca(OH)2= CaCO3↓+2 NaOHNaHCO3+Ca(OH)2(多)= CaCO3↓+ NaOH +H2O2NaHCO3+Ca(OH)2(少)= CaCO3↓+ Na2CO3 +2H2O8、 Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3 +CaCl2= CaCO3↓+2 Na ClNaHCO3溶液与CaCl2不反应;四.Al1、铝与氯气反应:2Al + 3Cl2点燃2AlCl32、铝片与稀盐酸反应2Al + 6HCl = 2AlCl3+ 3H2↑ 2Al + 6H+= 2Al3++3H2↑3、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O = 2NaAlO2+3H2↑2Al + 2OH -+2H2O = 2AlO2-+ 3H2↑4、4Al + 3O2△2Al2O3电解熔融的氧化铝:2Al2O34Al + 3O2↑5、铝与三氧化二铁高温下反应【铝热反应】:2Al + Fe2O3高温2Fe + Al2O36、不稳定性:2Al(OH)3 △Al2O3+ 3H2O7、硫酸铝溶液中滴过量氨水【实验室制备Al(OH)3】Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+(NH4)2SO4Al3++ 3 NH3·H2O = Al(OH)3↓+ 3NH4+8、向NaAlO2溶液中通入CO22NaAlO2 +CO2 +3H2O = 2Al(OH)3↓+Na2CO32AlO2-+CO2 +3H2O = 2Al(OH)3↓+CO32-9、氧化铝溶于氢氧化钠溶液Al2O3+ 2NaOH 2NaAlO2+H2O Al2O3+ 2OH -= 2AlO2-+ H2O10、氧化铝溶于盐酸:Al2O3+ 6HCl = 2AlCl3+ 3 H2O Al2O3+ 6H+= 2Al3++3 H2O11、Al(OH)3溶液中加盐酸:Al(OH)3+ 3HCl = AlCl3+ 3H2O Al(OH)3+ 3H+= Al3++ 3H2O12、Al(OH)3与NaOH溶液反应:Al(OH)3+ NaOH NaAlO2+2 H2O Al(OH)3+ OH-= AlO2-+2 H2O13、铝盐、偏铝酸盐反应生成Al(OH)3 3AlO2-+Al3++ 6H2O = 4 Al(OH)3↓五.Fe1、铁与硫加热反应 Fe + S FeS2、铁与氧气加热反应 3Fe+2O2 Fe3O43. 铁在氯气中加热反应 2Fe+3Cl2 2FeCl34、高温下铁与水蒸气反应: 3Fe + 4H2O(g)高温 Fe3O4+ 4H2电解5、铁与盐酸反应:Fe + 2HCl = FeCl2+ H2↑ Fe + 2H+= Fe2++ H2↑6.铁的氧化物FeO 、Fe2O3、Fe3O4溶于盐酸中:1)FeO + 2HCl = FeCl2+ H2O FeO + 2H+= Fe2++ H2O2)Fe2O3+ 6HCl = 2FeCl3+ 3H2O Fe2O3+ 6H+= 2Fe3++ 3H2O3) Fe3O4+ 8HCl = FeCl2+2FeCl3+4H2O Fe3O4+ 8H+=Fe2++2Fe3++4 H2O7.Fe(OH)2、Fe(OH)3的制备:1) FeSO4+ 2NaOH = Fe(OH)2↓+Na2SO4Fe2++ 2OH -= Fe(OH)2↓氯化铁中滴入氢氧化钠溶液(红褐色沉淀)2)FeCl3+ 3NaOH = Fe(OH)3↓+3NaCl Fe3++ 3OH -= Fe(OH)3↓氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色沉淀)3)4Fe (OH)2+ O2+ 2H2O = 4Fe (OH)34)不稳定性:2Fe(OH)3 △Fe2O3+ 3H2O8.Fe2+、Fe3+之间的转化:1)氯化亚铁溶液中通入氯气(或者加氯水)2FeCl2+ Cl2= 2FeCl32 Fe2++ Cl2= 2 Fe3++ 2Cl-2)氯化铁溶液中加入铁粉:2FeCl3+ Fe = 3FeCl22Fe3++ Fe = 3Fe2+3)用KSCN检验Fe3+的存在:离子方程式:Fe3++3SCN-= Fe (SCN)3(血红色)4)印刷电路板:2FeCl3+ Cu = 2FeCl2+CuCl2第四章:一.硅(1)工业制单质硅(碳在高温下还原二氧化硅):SiO2+ 2C 高温 Si + 2CO↑(硅单质的实验室制法,粗硅的制取)(2)硅单质与氢氟酸、Si +4HF = SiF4↑+ 2H2↑(3)硅单质与NaOH溶液反应:Si + 2NaOH + H2O = Na2SiO3+2H2↑二.Si及其化合物:(一)二氧化硅(1)二氧化硅与氢氧化钠反应SiO2+ 2NaOH = Na2SiO3+ H2O SiO2+ 2OH -= SiO32-+ H2O(2)二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO3(3)二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2 H2O(二)硅酸(H2SiO3)(1)往硅酸钠溶液中通入二氧化碳:Na2SiO3+ CO2 + H2O = Na2CO3 + H2SiO3↓(2)硅酸钠与盐酸反应:Na2SiO3+ 2HCl = 2NaCl + H2SiO3(胶体)(3)硅酸受热分解:H2SiO3△SiO2+ H2O(4)工业制玻璃原理:SiO2 + Na2CO3高温Na2SiO3+ CO2↑SiO2 + Ca CO3高温 Ca SiO3+ CO2↑三.氯(一)氯气(1)氯气实验室制法:(仪器:分液漏斗,圆底烧瓶)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O MnO2+4H++2Cl-Mn2++Cl2↑+2H2O2、氯气性质:A、金属和氯气的反应:(1)铜丝在氯气中剧烈燃烧(棕色烟):Cu + Cl2点燃CuCl2之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)(2)氯气和金属钠反应:2Na + Cl2点燃2NaCl(3)铁在氯气中剧烈燃烧:2Fe + 3Cl2点燃3FeCl3(4)氢气在氯气中燃烧(苍白色火焰):H2+ Cl2点燃 2HCl(5)氟气与氢气反应(黑暗处即可爆炸):H2+F2=2HFB、氯气与水反应(6)氯气溶于水(新制氯水中含H+、Cl -、ClO -、OH-、Cl2、HClO、H2O)Cl2+ H2O = HCl + HClO Cl2+ H2O = H++ Cl -+ HClO新制氯水注入盛溴化钠溶液的试管中(7)Cl2+ 2NaBr = Br2+ 2NaCl Cl2+ 2Br-= Br2+ 2Cl-(8)Cl2+ 2NaI = 2NaCl + I2Cl2+2I-=I2+ 2Cl-(9)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2HClO 2HCl + O2↑C、氯气和碱和的反应:(10)工业制漂白粉的原理:2Ca(OH)2 + 2Cl2=Ca(ClO)2+ CaCl2+ 2H2O2Ca(OH)2 +2Cl2=2Ca2++2ClO-+2Cl -+2H2O(11)漂白粉长期置露在空气中失效的原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 2HClO HCl + O2↑Ca2++2ClO-+ CO2+ H2O =CaCO3↓+ 2HClO(12)制漂白液(或氯气尾气处理): Cl2 +2NaOH = NaCl + NaClO + H2O四.硫和氮的化合物:(1)硫与非金属:S + O2 点燃 SO2 H2+ S △H2S(2)硫与金属: Fe + S △FeS 2Cu + S△Cu2S(3)二氧化硫与水反应:SO2 + H2O H2SO3(4)二氧化硫与碱性氧化物反应:SO2 + CaO = CaSO3(5)二氧化硫与碱反应:SO2 + 2NaOH = Na2SO3 + H2O SO2 + Ca(OH)2 = CaSO3↓ + H2O(6)二氧化硫与硫化氢气体反应:2H2S +SO2 = 3S↓ + 2H2O(7)二氧化硫通入氯水中:SO2 + Cl2 + 2H2O = 2HCl + H2SO4(Cl2可换作Br2、I2)(8)二氧化硫被O2氧化:2SO2 + O2 2SO3(9)三氧化硫与水反应:SO3 + H2O = H2SO4(10)三氧化硫与碱反应:SO3 + Ca(OH)2 = CaSO4↓ + H2O(12)工业合成氨:N2+ 3H2催化剂高温高压2NH3(13)氨的催化氧化:4NH3+5O24NO + 6H2O催化剂光照光照△(14)NH3在水中的反应:NH3+ H2O NH3• H2O NH4++ OH-(15)氨水受热分解:NH3•H2O △ NH3↑ + H2O(16)实验室制取氨气:2NH4Cl + Ca(OH)2 △ CaCl2 + 2NH3↑+ 2H2O(17)碳酸氢铵受热分解:NH4HCO3△NH3↑+ H2O↑+ CO2↑(18)用浓盐酸检验氨气(白烟生成): HCl + NH3= NH4Cl(19)氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑(20)硫酸铵溶液与氢氧化钠溶液混合加(NH4)2SO4+2NaOH△2NH3↑+Na2SO4+2H2O NH4++ OH -△ NH3↑+ H2O(21)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验NH4+的方法)NH4NO3+ NaOH = NH3↑+H2O + NaNO3NH4++ OH-= NH3↑+H2O(22)氮气和氧气放电下反应(雷雨发庄稼)N2+ O22NO 2NO + O22NO2(23)二氧化氮溶于水:3NO2+ H2O 2HNO3+ NO3NO2+ H2O 2H++ 2NO3-+NO(24)NO2、O2的混合气通入水中无剩余气体: 4NO2+ O2+ 2H2O = 4 HNO3(25)NO 、O2的混合气通入水中无剩余气体: 4NO+ 3O2+ 2H2O = 4 HNO3(26)NO、NO2的回收:NO2+ NO + 2NaOH = 2Na NO2+ H2O5、浓硫酸、HNO3与Cu反应:Al、Fe遇浓HNO3、浓硫酸钝化(常温)(27)Cu与浓HNO3加热:Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+ 2H2O(28)Cu与稀HNO3反应:3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+ 4H2O(29)铜与浓硫酸反应:Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑(30)浓硫酸与木炭反应:C+2H2SO4(浓) 2H2O+CO2↑+2SO2↑(31)浓硝酸与木炭反应:C+4HNO3(浓) 2H2O+CO2↑+4NO2↑放电。