(推荐)酯化反应机理
- 格式:doc
- 大小:91.50 KB
- 文档页数:2

酯化反应机理酯化反应是有机合成中常见的一种反应,它是通过酸催化下醇与酸酐(或酸)反应形成酯的过程。
酯化反应通常具有较高的化学反应速度和较高的转化率,因此在工业生产和实验室中被广泛应用。
酯化反应的机理可以分为两步:酸催化下的缩水酶反应和亲核取代反应。
在缩水酶反应中,醇分子作为亲核试剂与酸酐(或酸)反应,形成酮中间体。
这一步通常是迅速进行的,可通过酸的加入,并加热以提高反应速率。
反应中酸可引发酸酐中的缩水酶反应,形成酮中间体。
此中间体在不同的反应条件下可能进一步反应。
在亲核取代反应中,酮中间体与另一个醇分子反应。
首先,醇分子通过亲核作用攻击酮中间体中的羰基碳,形成一个四元环中间体。
这个四元环中间体会发生开环反应,最终生成酯产物和水。
这一步通常也是迅速进行的,需要用亲核试剂过量,以保证反应的完全进行。
需要注意的是,酯化反应是一个可逆反应。
在实际应用中,通过采取适当的取代方案,可以驱使反应向产物的方向进行。
例如,过量使用亲核试剂和及时去除生成的水,可以使平衡向产物方向偏移。
此外,在反应过程中也可以使用不可逆的酸催化剂来增加产物的收率。
总而言之,酯化反应是通过酸催化下醇与酸酐(或酸)反应形成酯的过程。
它的机理包括缩水酶反应和亲核取代反应。
缩水酶反应形成酮中间体,而亲核取代反应将酮中间体与亲核试剂反应形成酯产物。
酯化反应具有较高的化学反应速度和转化率,广泛应用于工业生产和实验室合成中。
在实际应用中,酯化反应有广泛的应用领域,包括食品、医药、香料、涂料和塑料工业等。
酯化反应可以用来合成食品添加剂、医药中间体、香料物质和可降解塑料等化合物。
在食品工业中,酯化反应被广泛应用于制备具有特殊香味和味道的食品添加剂。
例如,水果的香气往往来自于其中的酯类化合物,通过酯化反应可以合成这些香气物质。
此外,酯化反应也用于制备甘油三酯(食用油脂)和甘油(食品增稠剂)等。
在医药领域,酯化反应被广泛用于制备药物中间体。
许多药物都是通过酯化反应合成而成的。

酯化反应机理催化剂酯化方法酯化反应是一种常见的有机合成反应,它是通过醇与酸反应生成酯的过程。
酯化反应在工业上具有广泛的应用,例如生产香料、塑料、溶剂、涂料等。
本文将介绍酯化反应的机理、常见的催化剂以及酯化反应的方法。
酯化反应通常是使用醇和酸发生酸催化反应来生成酯。
在酸性条件下,酸会负责催化酸酯交换反应。
其机理主要分为四个步骤:1.酸催化:酸作为催化剂使酯化反应加速进行。
酸可以与醇或酸形成氢键,使得醇中的-OH基和酸中的-COOH基增加亲电性,促进了反应的进行。
2.亲核进攻:醇中的氧原子攻击酸中的羰基碳原子,形成一个酰氧离子。
这是反应的决速步骤。
3.水解:酰氧离子失去一个负电荷,并与酸中的-OH基结合,生成产物酯。
4.生成酸与醇:剩余的酸与醇进行酸酯交换反应,生成酮和水。
酯化反应催化剂:为了提高酯化反应的速度和产率,常常使用催化剂来加速反应。
常见的催化剂包括:1.酸催化酯化催化剂:例如硫酸、磷酸和苯甲酸等。
酸具有高度的亲电性,可以促进亲核取代反应。
2.酶催化酯化催化剂:例如酯酶,可以在温和的条件下促进酯化反应的进行。
酶作为生物催化剂,具有高效和特异性。
3.有机催化剂:例如有机酸,可以作为替代传统无机酸的催化剂使用,并且具备环境友好性。
酯化反应方法:酯化反应可以通过多种方法进行,根据反应条件的不同可以分为以下几种方法:1.酸催化酯化反应:将酸和醇加热反应,酸催化酯化反应是一种常见的酯化反应方法,常用的酸包括硫酸、盐酸、磷酸等。
2.酯交换反应:通过醇的交换来进行酯化反应,常用的催化剂包括金属醇盐、酯化酶等。
3.酰氯法:将酸与氯化物反应生成酰氯,然后将酰氯与醇反应生成酯。
酰氯法具有反应速度快、操作简单等特点,常用于大规模工业生产。
4.酸酐法:将酸酐与醇反应生成酯。
酸酐反应具有较高的选择性和反应速度,常用于特定的酯化反应。
总结:酯化反应是一种重要的有机合成反应,其机理是通过酸催化,亲核进攻,水解和生成酸与醇等步骤完成的。

酯化反应的机理-概述说明以及解释1.引言1.1 概述酯化反应是一种重要的有机反应,在有机合成领域具有广泛的应用。
它是通过酸催化或碱催化而发生的一种化学反应,通过在有机酸与醇之间发生酯基的交换,形成酯化产物和水。
酯化反应可以用于合成多种化合物,具有重要的工业价值和科学意义。
酯的合成是酯化反应的关键过程,其机理复杂而多样。
酸催化下的酯化反应机理通常采用亲核取代机制,其中酸催化剂起到了提供质子、促进酯基反应进程的作用。
而碱催化下的酯化反应机理则采用加成-消除机制,其中碱催化剂起到了提供碱性的作用。
这两种机理虽然有所不同,但都可以解释酯化反应发生的原理和过程。
酯化反应的机理研究对于进一步理解其反应过程、优化合成条件以及设计新型酯化催化剂具有重要意义。
了解机理可以帮助我们探索酯化反应的影响因素,例如底物结构、溶剂选择和反应条件等,从而提高反应效率和产物选择性。
本文将对酯化反应的机理进行深入探讨,并从酯化背景知识、基本原理到具体的反应机理,全面介绍酯化反应的相关内容。
通过对现有研究成果的总结和归纳,为酯化反应的进一步应用和发展提供理论基础和指导。
此外,我们还将展望酯化反应的未来发展前景,提出一些可能的应用方向和研究方向。
总之,本文旨在系统地梳理和阐述酯化反应的机理,为读者提供全面深入的理论知识和科学研究参考,进一步推动该领域的发展和应用。
1.2 文章结构文章结构部分:本文主要讨论酯化反应的机理。
为了更好地阐述酯化反应的机理,我们将文章分为引言、正文和结论三个部分。
引言部分首先对酯化反应进行了概述,简要介绍了酯化反应的基本概念和背景。
接着,对整篇文章的结构进行了说明,确立了章节的组织和内容的安排。
针对酯化反应的研究目的,本文明确了对酯化反应机理进行深入分析和探究的目标。
最后,在引言部分对整篇文章的内容进行了总结,为读者提供了文章的大致框架和内容导向。
正文部分分为三个小节,分别是酯化反应的背景知识、酯化反应的基本原理和酯化反应的机理。

酯化反应的机理:羧酸与醇生成酯的反应是在酸催化下进行的。
在一般情况下,羧酸与伯醇或仲醇的酯化反应,羧酸发生酰氧键断裂,其反应过程为:在酯化反应中,存在着一系列可逆的平衡反应步骤。
步骤②是酯化反应的控制步骤,而步骤④是酯水解的控制步骤。
这一反应是SN2反应,经过加成-消除过程。
采用同位素标记醇的办法证实了酯化反应中所生成的水是来自于羧酸的羟基和醇的氢。
但羧酸与叔醇的酯化则是醇发生了烷氧键断裂,中间有碳正离子生成。
在酯化反应中,醇作为亲核试剂对羧基的羰基进行亲核攻击,在质子酸存在时,羰基碳更为缺电子而有利于醇与它发生亲核加成。
如果没有酸的存在,酸与醇的酯化反应很难进行。
硫酸的作用:酯化反应中浓硫酸的作用只要答催化作用就行,或答催化和脱水,也可加上吸水作用(其实这是个非均相反应,浓硫酸的吸水性对平衡的移动已没有多少作用)。
4、酯化和酯水解的反应机理返回(1) 酯化反应机理酯化反应是一个可逆反应,其逆反应是酯的水解。
酯化反应随着羧酸和醇的结构以及反应条件的不同,可以按照不同的机理进行。
酯化时,羧酸和醇之间脱水可以有两种不同的方式:(I)(II)(Ⅰ)是由羧酸中的羟基和醇中的氢结合成水分子,剩余部分结合成酯。
由于羧酸分子去掉羟基后剩余的是酰基,故方式(Ⅰ)称为酰氧键断裂。
(Ⅱ)是由羧酸中的氢和醇中的羟基结合成水,剩余部分结合成酯。
由于醇去掉羟基后剩下烷基,故方式(Ⅱ)称为烷氧键断裂。
当用含有标记氧原子的醇(R'18OH)在酸催化作用下与羧酸进行酯化反应时,发现生成的水分子中不含18,标记氧原子保留在酯中,这说明酸催化酯化反应是按方式(Ⅰ)进行的。
按这种方式进行的酸催化酯化反应,其机理表示如下:首先是H+与羰基上的氧结合(质子化),增强了羰基碳的正电性,有利于亲核试剂醇的进攻,形成一个四面体中间体,然后失去一分子水和H+,而生成酯。
实验证明,绝大部分羧酸与醇的酯化反应是按方式(Ⅰ)进行。
对于同一种醇来说,酯化反应速度与羧酸的结构有关。

酯化反应机理酯化反应是有机化学中常见的一种重要反应类型,也是合成酯类的常用方法之一。
本文将介绍酯化反应的机理和相关实例,希望能对读者有所帮助。
一、酯化反应的定义和原理酯化反应是一种酸催化下醇与酸酐之间发生的酯键形成反应。
在酸催化条件下,酸酐与醇反应生成酯和水。
酯化反应的形成机制主要有酸催化机制和醇缺失机制。
酸催化机制:在强酸存在的条件下,酸催化剂(如硫酸)将酸酐中的羧基质子化,形成硫酸酯中间体。
此时,醇与硫酸酯中的氧原子形成氢键,发生亲核加成,产生酯和硫酸作为副产物。
醇缺失机制:在无水条件下,由于酸酐和醇中含有水分,酸酐中的羧基经过质子化形成羧阳离子,与醇中的氧原子形成亲核加成,反应生成酯和水。
二、酯化反应的机理例如,醋酸与乙醇反应生成乙酸乙酯的酯化反应可以作为酯化反应的机理示例。
1. 酸催化机制首先,乙酸醋酸中的羧基会受到硫酸催化剂的质子化作用,生成乙酸阳离子。
然后,乙醇中的氧原子通过质子化,生成亲核剂。
此时,醇中的氧原子与乙酸中的羰基碳原子形成键融合,生成中间体。
接下来,乙酸醋酸中的硫酸作为副产物失去一个质子,并与水生成硫酸乙酯。
最后,中间体中的氧碳键断裂,生成乙酸乙酯和水。
总的反应方程式可以表示为:CH3COOH + CH3CH2OH →CH3COOCH2CH3 + H2O2. 醇缺失机制首先,乙酸醋酸中的羧基会受到质子化作用,生成乙酸阳离子。
然后,乙醇中的氧原子形成亲核剂。
醇中的氧原子与乙酸中的羰基碳原子形成键融合,生成中间体。
最后,中间体中的氧碳键断裂,生成乙酸乙酯和水。
总的反应方程式可以表示为:CH3COOH + CH3CH2OH →CH3COOCH2CH3 + H2O三、酯化反应的应用酯化反应在化学和生物化学中具有广泛的应用,例如:1.合成香精和香料:酯类化合物是香精和香料的主要成分之一,酯化反应可以合成各种具有芳香性的酯类化合物,为香精和香料的合成提供了重要的方法。
2.合成药物:许多药物的制造过程中都需要酯化反应。


酯化和酯水解的反应机理(1) 酯化反应机理酯化反应是一个可逆反应,其逆反应是酯的水解。
酯化反应随着羧酸和醇的结构以及反应条件的不同,可以按照不同的机理进行。
酯化时,羧酸和醇之间脱水可以有两种不同的方式:(I) (II)(Ⅰ)是由羧酸中的羟基和醇中的氢结合成水分子,剩余部分结合成酯。
由于羧酸分子去掉羟基后剩余的是酰基,故方式(Ⅰ)称为酰氧键断裂。
(Ⅱ)是由羧酸中的氢和醇中的羟基结合成水,剩余部分结合成酯。
由于醇去掉羟基后剩下烷基,故方式(Ⅱ)称为烷氧键断裂。
当用含有标记氧原子的醇(R'18OH)在酸催化作用下与羧酸进行酯化反应时,发现生成的水分子中不含18,标记氧原子保留在酯中,这说明酸催化酯化反应是按方式(Ⅰ)进行的。
按这种方式进行的酸催化酯化反应,其机理表示如下:首先是H+与羰基上的氧结合(质子化),增强了羰基碳的正电性,有利于亲核试剂醇的进攻,形成一个四面体中间体,然后失去一分子水和H+,而生成酯。
实验证明,绝大部分羧酸与醇的酯化反应是按方式(Ⅰ)进行。
对于同一种醇来说,酯化反应速度与羧酸的结构有关。
羧酸分子中α-碳上烃基越多,酯化反应速度越慢。
其一般的顺序为:HCOOH>RCH2COOH >R2CHCOOH>R3CCOOH这是由于烃基支链越多,空间位阻作用越大,醇分子接近越困难,影响了酯化反应速度。
同理,醇的酯化反应速度是伯醇>仲醇>叔醇。
(2)酯的酸性水解酯的酸性水解反应大部分情况下是酰氧键断裂的加成 消除机理,即是酸催化酯化反应的逆反应。
酸催化时,羰基氧原子先质子化,使羰基碳的正电性增强,从而提高了它接受亲核试剂进攻的能力,水分子向羰基碳进攻,通过加成-消除而形成羧酸和醇。
羧酸和醇又可重新结合成酯,所以酸催化下的酯水解不能进行到底。
(3)酯的碱性水解用同位素标记方法证明,酯的碱性水解过程大多数情况下也是以酰氧键断裂方式进行的。
例如:乙酸戊酯在含18O的水中进行碱催化水解,结果发现18O是在乙酸盐中,而不是在戊醇中。
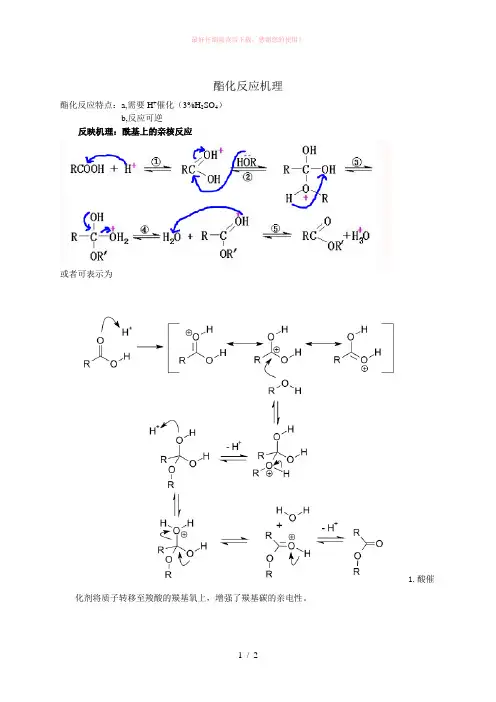
酯化反应机理
酯化反应特点:a,需要H+催化(3%H2SO4)
b,反应可逆
反映机理:酰基上的亲核反应
或者可表示为
1.酸催
化剂将质子转移至羧酸的羰基氧上,增强了羰基碳的亲电性。
由于羰基是强吸电子基,使得与其相连的羟基的电子云密度降低,羰基氧原子显负性使得质子氢与之结合。
再经过电子的重排,使得羰基碳带更高的正电性,有利于亲核试剂醇的进攻。
2.醇的氧原子亲核进攻羧酸的羰基碳。
由于醇的羟基氧上有孤对电子,与显正电性的羰基碳发生亲核加成形成氧鎓离子。
3.氧鎓离子去质子化。
4.羟基质子化,生成一个新的鎓离子。
5.鎓离子消除水,再去质子化,得到酯。
其实你所说的“醇脱羟基酸脱氢”这种情况是有的,但仅限于叔醇(羟基碳与三个碳原子相连)与羧酸的酯化。
那是因为叔醇的羟基与质子氢结合过后在脱去一分子水能形成稳定的活性中间体----三级碳正离子。
羧基羰基氧作为亲核试剂与碳正离子反应。
结论:
伯醇、仲醇酯化---酸脱羟基醇脱氢
叔醇酯化---醇脱羟基酸脱氢。


酯化反应机理及其在生物医学中的应用一、酯化反应机理酯化反应是一个广泛应用的化学反应,常见于有机合成、生物化学、食品工业等领域。
其本质是通过酯的形成将醇和酸进行化合,这个过程涉及到醇的羟基和酸的羧基发生结合。
具体而言,酯化反应的机理如下:首先,酸的羧基羰基(C=O)接受醇的氢氧根(OH)使羰基还原生成一个酯基,同时醇失去一个氢离子,产生出一个离子态的铵盐。
这个反应的化学式为:RCOOH + ROH → RCOOR' + H2O在这个过程中,H2O成为了反应的产物。
而且,这个产物的生成数量决定了这个反应的方向性,越是产生H2O副反应的情况下,反应的方向就越倾向于左侧有机酸的生成。
其次,酯的形成在不同的情况下是非常灵活的。
例如,当酸的浓度比较高的时候,将会促进这个反应的驱动力。
而当酸的浓度不足,或者是酸的活性有问题的时候,在反应的过程中还需要加入其他的物质以促进反应的顺利进行。
最后,酯化反应中的化学平衡是很重要的。
因为这个反应趋力很具有自发性,也就是说,当反应产物达到一定浓度时,反应方向由生成酯变成了消耗酯并生成醇和酸。
化学式如下:RCOOR' + H2O → RCOOH + ROH这个方向是很重要的,因为他说明了在酯化反应中反应平衡的位置。
需要注意的是,在不同的温度和压力下,反应平衡位置是不同的。
例如,在高压和低温的情况下,反应平衡位置会偏向生成酯,而在低压和高温的情况下,反应平衡位置会偏向消耗酯。
二、酯化反应在生物医学中的应用生物医学包括许多领域,例如制药、医学诊断、药物传递等领域。
酯化反应以其高效的化学转换和强大的柔性成为生物医学中的常见应用方式之一。
1、药物合成在药物合成领域,酯化反应是一种重要的合成方法。
它可以用于制备有生物活性的化合物,同时,酯化反应在药物制备过程中常被用来实现药物传递和酶识别等特定功能的装配。
例如,近年来一些药物以酯化反应为基础,被设计用来实现特定的药物作用机制。

酯化反应原理
酯化反应是一种酸催化的化学反应,通过酸性催化剂的作用,将酸性醇与酸性酸酐进行酯结合的过程。
该反应发生在醇和酸酐的羟基与羰基之间的缩合反应。
在酸性条件下,醇中的羟基与酸酐中的羰基发生亲核加成反应,形成一个中间产物-酯酸盐。
随后,酯酸盐发生内消旋,失去
酸中的水分子,生成酯。
这个内消旋过程是通过脱水作用来推动的。
酯化反应的原理可以用以下的步骤概括:
1. 酸性条件下,酸酐发生质子化,生成一个带正电荷的电离态。
2. 醇中的羟基通过亲核攻击,将带正电荷的酸酐质子化位点上的羰基替换掉。
3. 形成酯酸盐中间产物,其中酯酸盐通过脱水反应进一步消旋形成酯。
4. 水分子作为副产物从反应中生成。
酯化反应广泛应用于化学和生物领域。
在化学领域,酯化反应常用于酯的合成,酯是一类重要的溶剂、溶剂中的溶剂和中间体化合物。
在生物领域,酯化反应参与脂质的生物合成过程,例如在细胞膜的合成中起着重要作用。
此外,酯也是食物、香精等领域的重要物质。
总的来说,酯化反应是一种通过酸催化将醇与酸酐反应生成酯的过程。
该反应原理在化学和生物领域具有广泛的应用。
酯化反应的原理
酯化反应是一种重要的有机合成反应,其原理是通过酸或碱的催化作用,醇和
酸酐(或酸)在适当的条件下发生酯键的形成。
酯化反应在化工生产和有机合成中具有广泛的应用,可以制备出各种酯类化合物,具有重要的工业和实验价值。
酯化反应的机理可以分为酸催化和碱催化两种方式。
在酸催化的条件下,醇先
与酸酐发生加成反应生成酯酸中间体,然后经过缩合反应生成酯类产物。
而在碱催化条件下,醇先与酸酐发生缩合反应生成酯类产物。
无论是酸催化还是碱催化,酯化反应都是通过亲核加成-缩合机理进行的。
酯化反应的条件包括温度、催化剂、反应物摩尔比等因素。
一般来说,酯化反
应需要在一定的温度下进行,通常在40-60摄氏度之间。
对于酸催化,常用的催化
剂包括硫酸、磷酸等;而对于碱催化,常用的催化剂包括氢氧化钠、氢氧化钾等。
此外,反应物的摩尔比也会对反应的进行产生影响,通常情况下需要确保醇和酸酐的摩尔比接近1:1。
酯化反应的应用非常广泛,其中最重要的应用之一就是酯类的合成。
酯类化合
物在日常生活和工业生产中都有着重要的用途,比如乙酸乙酯、苯甲酸甲酯等,它们被广泛应用于溶剂、香料、涂料、塑料等领域。
此外,酯化反应还可以用于生产医药中间体、食品添加剂等化合物,具有重要的经济和社会意义。
总之,酯化反应是一种重要的有机合成反应,其原理是通过酸或碱的催化作用,醇和酸酐在适当的条件下发生酯键的形成。
酯化反应的条件包括温度、催化剂、反应物摩尔比等因素。
酯化反应具有广泛的应用,可以制备出各种酯类化合物,具有重要的工业和实验价值。
大学有机化学反应方程式总结酯化反应酯化反应是有机化学中常见的反应类型之一,可以通过酸催化或酶催化等方式进行。
在酯化反应中,酸与醇反应生成酯,释放出水分子。
这种反应广泛应用于染料、药物、食品和香料等化合物的合成过程中。
本文将对酯化反应的机理和常见的酯化反应方程式进行总结。
一、酯化反应机理酯化反应的机理可以分为两种类型:酸催化和酶催化。
1. 酸催化酯化反应机理在酸催化酯化反应中,通常使用强酸催化剂,如硫酸、磷酸或琼脂酸等。
反应中,酸催化剂将醇分子质子化,使其成为良好的亲电子试剂。
醇与酸发生质子转移反应生成醇质子,而醇质子亲核攻击羧酸的羰基碳,形成酰基氧负离子。
最后,酰基氧负离子与质子化的醇中的水分子发生酸催化的质子转移反应,生成酯和水。
2. 酶催化酯化反应机理在酶催化酯化反应中,常使用酶作为催化剂。
酶可以是脂肪酶、酸性酯酶、酯酶等。
这类反应一般发生在生物体内或水溶液中。
酶能够催化底物分子的结构变化,使其能够接近催化活性位点,并降低活化能。
二、常见的酯化反应方程式下面列举了几个常见的酯化反应方程式:1. 酸催化酯化反应方程式酸醇反应生成酯的反应方程式可以表示为:酸 + 醇→ 酯 + 水例如,乙酸与乙醇反应生成乙酸乙酯的方程式为:CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O2. 酶催化酯化反应方程式酶催化酯化反应的方程式可以表示为:酶 + 酸 + 醇→ 酯 + 水例如,脂肪酶催化下,乙酸与甘油反应生成三酸甘油酯的方程式为:CH3COOH + HOCH2CH(OH)CH2OH →CH3COOCH2CH(OH)CH2OH + H2O三、总结酯化反应是一种重要的有机化学反应,在许多领域中具有广泛的应用。
通过酯化反应,可以合成出各种不同的酯类化合物,具有重要的研究和应用价值。
酯化反应的机理可以分为酸催化和酶催化两种类型,通过质子化和亲核攻击等步骤完成。
根据反应条件和催化剂的不同,反应的具体机理和方程式也会有所差异。
有机合成酯的合成和反应机理酯是一类重要的有机化合物,广泛应用于化学工业和生物领域。
它们具有多样的结构和性质,可以通过不同的合成方法得到。
本文将介绍有机合成酯的合成方法以及相关的反应机理。
一、酯的合成方法:1. 酯化反应:酸酯化反应是最常用的合成酯的方法之一。
它基于酸和醇之间的酯化反应,其中酸可以是无机酸如硫酸、盐酸,也可以是有机酸如乙酸、苯甲酸等。
合成酯的反应一般在适当的温度下进行,通常需要酸催化剂如硫酸或硫酸三甲酯。
该反应的通式如下:酸 + 醇→ 酯 + 水这种方法适用于合成酯的多数情况,但由于生成水的同时也会生成酸,因此需要采取一些措施来将水脱离反应体系。
2. 酸催化醇缩合反应:酸催化醇缩合反应是一种有效的酯化方法。
在此反应中,醇与含有活性氢的化合物如酮、醛等在酸的作用下发生缩合反应,生成相应的酯。
该反应的通式如下:醇 + 含有活性氢的化合物→ 酯 + 水这种方法可以合成具有复杂结构的酯,并且在反应中利用了原料中含有的活性氢。
3. 醇酸缩合反应:醇酸缩合反应是一种经典的合成酯的方法。
在此反应中,醇与酸在干燥剂的作用下发生缩合反应,生成酯。
该反应的通式如下:醇 + 酸→ 酯 + 水这种方法常用于合成含有芳香环的酯,在反应体系中需要保持干燥,以促进反应的进行。
二、酯反应的机理:酯化反应的机理是一个酶催化的加成-消除反应。
首先,酸催化剂将酸和醇分别质子化,生成酸的电离态和醇的离子形式。
然后,酸中的负离子攻击醇中的氢原子,形成酰离子和醇阳离子的加成产物。
接下来,水分子进一步质子化剩余的醇,产生水的离子形式。
最后,酰离子和水的离子形式发生消除反应,生成酯和水。
整个反应过程如下:酸 + 醇⇄酮缩合反应⇄酰离子 + 醇阳离子酮缩合反应⇄水的电离酰离子 + 水的离子⇄酯 + 水酸催化醇缩合反应和醇酸缩合反应的机理与酯化反应类似,但具体机理细节有所不同。
总结:有机合成酯的合成方法主要包括酯化反应、酸催化醇缩合反应和醇酸缩合反应。
酯化反应机理
酯化反应是化学反应中重要的一类,涉及醇和羧酸通过酯键生成酯。
本文主要探讨两种主要的酯化反应机理:缩水酶反应和亲核取代反应。
1. 缩水酶反应
缩水酶是催化酯化反应的酶,它可以在温和的条件下促进羧酸与醇的酯化。
这种反应机理可以分为三步:
(1) 羧酸与醇形成四面体结构的中间物。
(2) 中间物中的羟基与羧基相互作用,脱去水分子。
(3) 形成的酯与酶解离。
缩水酶反应具有高度的选择性,可以在温和的条件下进行,并且产率高。
然而,该反应需要特定的酶作为催化剂,不适用于所有情况。
2. 亲核取代反应
亲核取代反应是一种通用的酯化反应机理,适用于大多数酸和醇。
该反应是通过亲核试剂(通常是醇或胺)攻击羧酸的羰基碳,从而取代羧基上的氢原子。
该过程可以分为三步:
(1) 亲核试剂与羧酸形成共价中间物。
(2) 共价中间物中的氢原子被质子转移所取代。
(3) 生成的酯与亲核试剂解离。
亲核取代反应可以在广泛的酸和醇之间进行,但是通常需要一些添加剂(如酸或碱)以促进反应。
此外,该反应可能受到副反应和动力学控制的影响。
总的来说,酯化反应的机理可以根据催化剂和反应条件的不同而变化。
了解这些机理可以帮助我们更好地理解酯的性质和合成方法。
化学反应中的酯化反应机理解析化学反应是物质转变的过程,其中酯化反应是一种常见的有机化学反应。
酯化反应是通过酸催化或酶作用下,酸与醇反应生成酯的过程。
本文将对酯化反应的机理进行解析。
一、酯化反应的机理概述酯化反应属于一种酸催化的加成-消除反应,通常涉及醇和酸的反应。
其机理主要分为两步:酸催化的亲核加成和消除反应。
具体步骤如下:1. 亲核加成阶段:首先,酸(通常为无机酸如硫酸或有机酸如苯甲酸)将负载在溶剂中,生成氢离子(H+)。
然后,醇中的氢原子会被酸催化地剥夺,生成一个氧化中心(即互变的质子)。
2. 消除反应阶段:在亲核加成阶段之后,发生一个醇和酸中的羧基(酸中的O-H基团)之间的酸催化消除反应。
经过这个反应,生成的产物是一个酯和一分子水。
二、酯化反应的具体机理解析1. 酸催化的亲核加成阶段:在酸催化下,醇分子中的一个氢离子(H+)会被质子剥夺,生成一个质子化的醇离子。
同时,产生的质子会形成一个氧化中心。
2. 消除反应阶段:在亲核加成阶段之后,发生一个醇和酸中的羧基之间的酸催化消除反应。
质子在这个步骤中转移到羧基上,从而生成一个酯。
需要注意的是,酯化反应的反应速率对酸的选择和反应条件具有一定的依赖性。
选择适当的催化剂和反应条件能够提高反应速率和产物收率。
三、酯化反应的应用领域酯化反应在有机合成中有着广泛的应用。
以下是几个常见的应用领域:1. 酯的合成:酯化反应是合成酯的一种重要方法。
酯广泛应用于香料、香精、染料和润滑剂等领域。
2. 多肽合成:酯的合成在多肽合成中也有着重要的应用。
通过酯化反应,可以用酯作为中间体,进一步合成多肽链。
3. 药物合成:酯化反应在药物合成中也占有重要地位。
通过酯化反应,可以合成一些重要的药物原料。
四、总结酯化反应是一种重要的有机化学反应,通过酸催化和消除反应,将酸和醇转化为酯。
在反应过程中,酸催化的亲核加成和消除反应是关键步骤。
酯化反应在酯的合成、多肽合成和药物合成等领域具有广泛的应用。
酯化反应是一种常见的有机化学反应,通常指酸醇酯化反应,即通过酸催化的醇和酸反应生成酯。
下面是一些与酯化反应相关的内容:1.酯化反应的基本原理:酯化反应是通过酸催化产生醇和酸的质子交换,酸分子中的质子被醇中的氢原子替代,形成水分子。
2.反应机理:酯化反应的机理可以分为两步:首先,酸催化剂中的质子攻击醇的氧原子,形成醇中的氧带正电荷的间歇状态;接着,由于酸催化剂中的质子转移到醇分子中的氧原子上,形成催化剂的醇质子,同时产生一个正离子。
然后,醇中的氧正离子进行亲核攻击,与酸分子结合形成水,同时产生酯产物。
3.特征现象:a.酯化反应通常是可逆的,反应达到平衡时会有一定的酯和水存在,而高负荷反应条件可以推动平衡向产酯方向移动。
b.酯化反应对酸催化剂的要求较高,常用的酸催化剂有浓硫酸、浓盐酸等。
c.反应速率受温度的影响很大,反应温度越高,反应速率越快。
d.酯化反应对反应物的选择性也较高,一个醇可以与多个酸反应,产生不同的酯。
e.酯化反应通常需要在惰性气氛下进行,以防止产物受到空气中水汽的水解。
f.酯化反应在工业上广泛应用,例如用于聚酯纤维的生产,人工合成香精和药物等。
4.应用与意义:a.酯化反应是有机合成中最重要的反应之一,可以合成大量有机酯。
b.多种香料和食品添加剂是通过酯化反应合成的,如水果香精、食品调味剂等。
c.酯化反应也被广泛用于生物学研究中,如合成脂肪酸甘油酯等。
d.酯化反应还可应用于制备高性能聚酯材料,用于制备纤维和塑料等。
总结:酯化反应是一种常见的有机化学反应,通过酸催化的醇和酸反应生成酯。
该反应具有可逆性、受温度影响较大、对反应物选择性高等特点。
酯化反应在工业上具有广泛的应用价值,用于合成大量有机酯、香料、食品添加剂等,并可用于生物学研究和聚合物制备。
酯化反应机理
酯化反应特点:a,需要H+催化(3%H2SO4)
b,反应可逆
反映机理:酰基上的亲核反应
或者可表示为
1.酸催化剂将质子转移至羧酸的羰基氧上,增强了羰基碳的亲电性。
由于羰基是强吸电子基,使得与其相连的羟基的电子云密度降低,羰基氧原子显负性使得质子氢与之结合。
再经过电子的重排,使得羰基碳带更高的正电性,有利于亲核试剂醇的进攻。
2.醇的氧原子亲核进攻羧酸的羰基碳。
由于醇的羟基氧上有孤对电子,与显正电性的羰基碳发生亲核加成形成氧鎓离子。
3.氧鎓离子去质子化。
4.羟基质子化,生成一个新的鎓离子。
5.鎓离子消除水,再去质子化,得到酯。
其实你所说的“醇脱羟基酸脱氢”这种情况是有的,但仅限于叔醇(羟基碳与三个碳原子相连)与羧酸的酯化。
那是因为叔醇的羟基与质子氢结合过后在脱去一分子水能形成稳定的活性中间体----三级碳正离子。
羧基羰基氧作为亲核试剂与碳正离子反应。
结论:
伯醇、仲醇酯化---酸脱羟基醇脱氢
叔醇酯化---醇脱羟基酸脱氢
(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。