文件:第三章环烷烃
- 格式:doc
- 大小:363.00 KB
- 文档页数:9








第三章环烷烃
教学目的与要求:
1.掌握环烷烃的构造异构和顺反异构及其命名方法;
2.了解环烷烃的物理性质,掌握环烷烃的化学性质;
3.理解环的张力;
4.掌握环己烷和取代环己烷的的构像;
5.了解多环烃命名方法。
教学重点、难点:
环烷烃的化学性质;环己烷和取代环己烷的的构像。
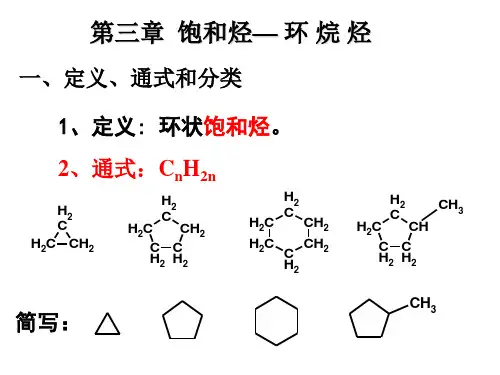
环烷烃是指分子中碳原子以单键互相连接成闭合的碳环,剩余的价完全与氢原子相连。
将链烃变为环烃,要在分子中增加一个碳-碳单键,同时减少两个氢原子,因此,单环烷烃的通式为C n H2n 。
§ 3.1环烷烃的异构和命名
3.1.1 环烷烃的异构
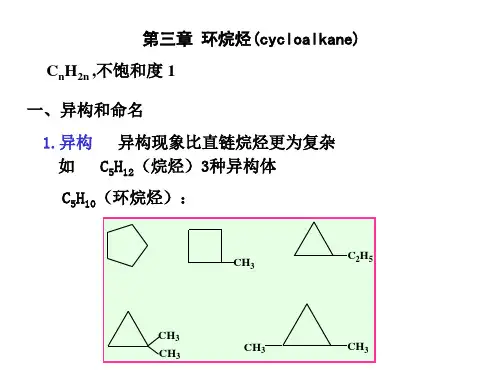
1.构造异构:环烷烃由于环的大小,侧链的长短及位置的不同而产生构造异构体。
C3H6
无构造异构
C4H8
C5H10
2. 顺反异构
1,4-二甲基环己烷分子中,两个甲基可以在环平面的同侧,也可以在环平面的异侧,形成顺反异构:
333
3
顺反异构体由于环的存在,不能互变(断键)。
其物理性质有差异。
3.1.2 环烷烃的命名 1.单环体系
1)根据环中碳原子数目叫做环某烷。
2)有取代基时,编号应使取代基位次尽可能小。
3)有不同取代基时,编号从小基团开始。
CH 3
CH 3
CH 3
CH 3
CH 2
CH
CH 3
1-甲基-3-乙基环戊烷 1-甲基-4-异丙基环己烷
2. 顺反异构体命名时,取代基在环平面同侧称顺式(cis-),异侧称反式(trans-)。
3
3
3
3
顺-1.4-二甲基环己烷 反-1.4-二甲基环己烷
为书写方便,环烷烃常用键线式:
戊烷
3-环己基己烷
§3.2 环烷烃的物理性质和化学反应 3.2.1 环烷烃的物理性质
环烷烃的熔点、沸点和比重都较相应的开链烷烃高。
因环烷烃的环状结构,分子较有序,排列较紧密,分子间作用力较大。
而直链烷烃分子自由摇摆,有序度小,分子间作用力较弱,故熔点、沸点和比重较小。
3.2.2 环烷烃的反应
环烷烃与直链烃结构相似,所表现出的化学性质也相似(常温下,不与强酸、强碱、强氧化剂、强还原剂起反应,可以起燃烧、热解、卤代等反应)。
三元环和四元环等小环化合物有一些特殊的性质,即容易开环生成开链化合物。
1. 氢解
+
+
+
H 2
H 2
H 2
Ni Ni 。
CH 3CH 2CH 3
CH 3CH 2CH 2CH 3
CH 3CH 2CH 2CH 2CH 3
2. 加溴
+
+
+
BrCH 2CH 2CH 2Br
Br 2
Br 2
Br
2
Br
hv
Br
Br
+
Br 2
Br
Br
3. 加溴化氢
+
CH 3CH 2CH 2Br HBr
+
CH 3CH 2CHCH 3
CH 3
HBr
4. 氧化
三元环烷烃对氧化剂相当稳定:
+
O
O
O
2
§ 3.3 环烷烃的来源和用途(阅读)
§ 3.4 环的张力
3.4.1 拜尔张力学说
由环烷烃的化学性质可看出,环的稳定性与环的大小有关。
小环不稳定,大环较稳定。
为了解释这一事实拜尔在1885年提出了张力学说。
1.假定成环的碳原子都在同一平面上,并排成正多边形;
2.环中碳-碳键键角的变形会产生张力。
环中碳-碳键键角的偏转程度:
正常键角:109028ˊ109028ˊ109028ˊ109028ˊ
实际键角:60090010801200
偏转程度:+24044ˊ+9044ˊ+0044ˊ-5016ˊ
示意图:
028ˊ
240
3. 张力使环的稳定性降低,张力越大,环的反应活性也越大。
张力环为减小张力,有生成更稳定的开链化合物的倾向。
与正常键角偏差越大,环张力越大,越易起开环反应。
角向内压缩,负值表示键角向外扩张。
根据张力学说,环己烷以上因键角向外扩张而存在张力,且环越大,键角扩张越大,环越不稳定,而事实上,它的都是稳定的。
拜尔张力学说对小环的结论是正确的,但无法解释负环以上大环的稳定性,其原因是成环碳原子都处于同平面这个假设是错误的,它们实际上是不共平面的。
3.4.2 环烷烃的燃烧热
小环烷烃不稳定,内能较高,燃烧热数值大。
主要由张力能引起。
由燃烧热数值可得出,张力越大,环越不稳定,张力越小,环越稳定,环己烷,及大环烷烃几乎为无张力环,都很稳定。
3.4.3 张力能
有机化合物中能产生张力的因素有四种:
1.非键作用
分子中两个非键合的原子或原子团由于几何原因互相靠近,当它们之间的距离小于两者范德华半径之和时,这两个原子或原子团就强烈的互相排斥,由此引起的体系能量的升高用E nb 表示。
2.键长变化
分子中由于几何原因,必须使某一个键伸长或缩短,体系能量随之升高,用El 表示。
3.键角变化
分子中由于几何原因要使键角的大小发生变化,就引起的体系的能量升高,用E θ表示。
4. 扭转角变化
分子中由于几何原因,使扭转角发生变化就引起能量升高,用E φ表示。
如环癸烷:
HH
H
H H H
§3.5 环己烷的构象
3.5.1 椅式构象
H H
H H H
H H H H
H
H H
H
球棍模型 透视式 纽曼投影式
椅式构像中,碳原子1,3,5在同一平面上,2,4,6在同一平面上:
4
直立键
平伏键
e
e
3.5.2 船式构象
H
H
球棍模型 透视式
纽曼投影式 3.5.3扭船式构象
球棍模型 透视式
室温下,环己烷的椅式构像通过环的翻转,变成另一椅式构像:
H
H
室温下,环己烷的椅式构像约占99.9% 。
§3.6 取代环己烷的构像分析
3.6.1 一取代环己烷
两种构像形成动态平衡:
CH 3
CH 3
95%
5%
构像所占的百分数不同,是因为取代基上的氢原子与邻近氢原子间存在的排斥作用不一样:
H
H H
H H
H
C
e-甲基
a-甲基
e-取代排斥作用小,a-取代排斥作用大。
再如:
H
H
C C(CH 3)3
3
3
CH 3>99.99%
3.6.2 二取代环己烷
ae 型
ae 型
aa 型
ee 型
H
CH 3
CH 3CH 3
CH 3
H H
H
H
CH 3
CH 3CH 3
CH 3
H H H
顺-1,2-二甲基环己烷 反-1,2-二甲基环己烷
稳定性: 顺-1,2-二甲基环己烷 < 反-1,2-二甲基环己烷 原 因: 反-1,2-二甲基环己烷稳定构像中, e-键甲基比顺-1,2-二甲基环己烷多。
3.6.3 环己烷的平面表示方法
3
3
3
3
3
3
§3.7 其它单环环烷烃的构像
3.7.1 小环
3.7.2 环戊烷
信封式
§3.8 多环烃 §3.8.1 多环烃的命名
1. 螺环:两环共用一个碳原子的环烷烃。
(1) 根据碳原子数,称螺某烷,在方括号中标出除共用碳以外两环的碳数。
(2) 编号从较小环中与共用碳相邻的碳原子开始,从小环经共用碳到大环,并使取代基位数最小。
CH 2CH 2
CH 2CH 2
CH 2CH 2CH 2CH 2
C
CH 2CH 2
CH 2CH 2
CH 2
CH 2CH 2
C
螺 [ 4.4 ] 壬烷
螺 [ 3.4 ] 壬烷
CH 2CH 2
CH 2CH 2
CH 2
CH 2
C
CH 3
1-甲基 螺 [ 3.4 ] 壬烷
2. 桥环:两环共用两个以上碳原子的环烃。
(1)以环数为词头,按环上碳总数称某烷。
(2)找出桥头碳,排出长短桥,编号从桥头开始从大桥到小桥,并使取代基位数最小。
(3)方括号内由大到小注明各桥的碳数。
2
10
5
9
1
3
7
6
8
4
二环[ 2.2.1 ] 庚烷二环[ 4.4.0 ] 癸烷三环[ 3.3.1.13,7 ] 庚烷§3.8.2 十氢萘
顺和反十氢萘的平面投影式:
或
H
H H
顺十氢萘反十氢萘用圆点表示向上方申出的氢:
顺十氢萘反十氢萘。