二氧化碳的吸收实验
- 格式:ppt
- 大小:4.97 MB
- 文档页数:24

有机胺法吸收二氧化碳实验报告有机胺法是一种有效的二氧化碳吸收技术,被广泛应用于各种实验和工业应用中。
本文将结合实验报告,介绍有机胺法如何吸收二氧化碳的过程。
实验步骤:1. 实验材料有机胺(如乙醇胺、二乙醇胺等)、气密容器、二氧化碳气瓶、滴定管、pH计等。
2. 实验流程①将实验用容器放在天平上,记录初始质量,并注入二氧化碳气体。
②在实验材料中加入适量的有机胺溶液,将气密容器密封。
注意,有机胺的浓度要视二氧化碳气体的浓度而定。
③将气密容器加热,并定期翻动,以促进二氧化碳和有机胺的反应。
该反应产生的产物是碳酸盐和胺醇。
④反应结束后,取出气密容器,记录容器的质量。
⑤将反应产物放入滴定管中,使用酸碱滴定法测量其pH值,以确定反应产物是否为碳酸盐。
3. 结果通过以上实验,得到以下结果:①二氧化碳的吸收率与有机胺的浓度和反应时间有关。
②在加热和翻动的条件下,二氧化碳气体可以完全被有机胺吸收。
③反应产物是胺醇和碳酸盐,表明二氧化碳已被有效吸收。
4. 分析通过实验,我们可以发现有机胺法吸收二氧化碳的过程是一个化学反应过程。
有机胺在加热和搅拌的条件下,会与二氧化碳发生反应,生成碳酸盐和胺醇。
这个过程可以有效地将二氧化碳气体吸收,并转化为化学产物,不仅可以减少环境污染,同时还可以开发新的能源和化学品。
5. 总结有机胺法吸收二氧化碳是一种简单有效的二氧化碳减排技术,可以在工业生产中得到广泛应用。
本文通过实验报告阐述了该技术使用过程,并对实验结果进行了分析,为读者提供了一定的参考。
作为一项对环境和社会都有益的技术,我们有必要进一步研究和开发这种技术,以解决二氧化碳排放的问题。
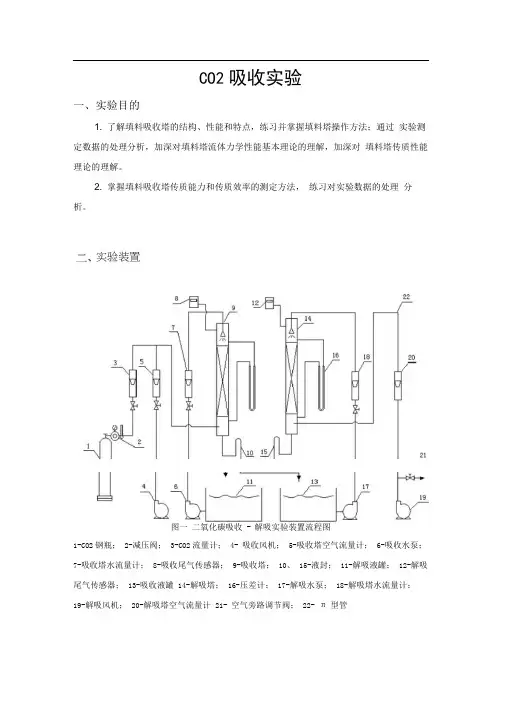
CO2吸收实验一、实验目的1. 了解填料吸收塔的结构、性能和特点,练习并掌握填料塔操作方法;通过实验测定数据的处理分析,加深对填料塔流体力学性能基本理论的理解,加深对填料塔传质性能理论的理解。
2. 掌握填料吸收塔传质能力和传质效率的测定方法,练习对实验数据的处理分析。
图一二氧化碳吸收- 解吸实验装置流程图1-CO2钢瓶;2-减压阀;3-CO2流量计;4- 吸收风机;5-吸收塔空气流量计;6-吸收水泵;7-吸收塔水流量计;8-吸收尾气传感器;9-吸收塔;10、15-液封;11-解吸液罐;12-解吸尾气传感器;13-吸收液罐14-解吸塔;16-压差计;17-解吸水泵;18-解吸塔水流量计;19-解吸风机;20-解吸塔空气流量计21- 空气旁路调节阀;22- π型管实验装置三、实验原理传质性能:吸收系数是决定吸收过程速率高低的重要参数,实验测定可获取吸收系数。
对于相同的物系及一定的设备(填料类型与尺寸),吸收系数随着操作条件及气液接触状况的不同而变化。
根据双膜模型的基本假设,气侧和液侧的吸收质A 的传质速率方程可分别表达为:气膜G A k g A(p A p Ai )(1-1 )液膜G A k l A(C Ai C A)(1-2)式中: G A—A 组分的传质速率, kmoI s 1;A —两相接触面积,m2;P A —气侧A组分的平均分压,Pa;P Ai —相界面上A 组分的平均分压,Pa;C A—液侧A 组分的平均浓度,kmol m3C Ai —相界面上A组分的浓度 kmol mk g—以分压表达推动力的气侧传质膜系数, kmol m 2s 1Pa k l —以物质的量浓度表达推动力的液侧传质膜系数, m s 1。
以气相分压或以液相浓度表示传质过程推动力的相际传质速率方程又可分别表达为:G A K G A(p A p A)(1-3)G A K L A(C A C A)(1-4)式中:p A —液相中A组分的实际浓度所要求的气相平衡分压,Pa;3C A —气相中 A 组分的实际分压所要求的液相平衡浓度, K G —以气相分压表示推动力的总传质系数或简称为气相传质总系数,kmol m 2s 1Pa 1;K L —以气相分压表示推动力的总传质系数,或简称为液相传质总系数,1m s 。


化学法吸收二氧化碳的实验研究共3篇化学法吸收二氧化碳的实验研究1化学法吸收二氧化碳的实验研究二氧化碳是一种温室气体,能够导致气候变化和海平面上升等环境问题。
作为人类社会的一部分,我们需要找到解决和减缓其影响的方法。
其中,一种方法是通过吸收和固定二氧化碳来达到目的。
在这方面,化学法吸收二氧化碳是一个非常有前途的选择。
化学法吸收二氧化碳的原理是在一定的条件下,将二氧化碳与化学物质反应,形成固体或液体物质。
这些物质往往是碱性物质,如氢氧化钠、氢氧化钾、氨水等。
它们与二氧化碳反应后,产生碳酸盐、碳酸氢盐等物质。
在实验研究中,我们采用了氢氧化钠作为吸收剂,通过反应形成碳酸钠等物质。
首先,准备好实验所需的材料和器材,包括氢氧化钠、二氧化碳气罐、反应装置、分析天平、草图本等。
然后,将反应装置中的氢氧化钠加入到蒸馏水中进行稀释,得到1mol/L浓度的氢氧化钠溶液。
在这个浓度下,氢氧化钠具有较好的二氧化碳吸收效果。
接下来,将二氧化碳气罐与反应装置连接起来,打开气罐阀门,将二氧化碳气体流入反应装置中。
同时,将氢氧化钠溶液一点一点滴入,反应开始。
观察反应瓶内的现象,可以看到氢氧化钠与二氧化碳反应后,溶液从透明变为混浊,并放出了大量的气体。
此时,反应已经基本完成。
最后,我们用分析天平称量出反应后的固体产物的质量,确定吸收二氧化碳的量。
根据反应方程式,可以计算出吸收的二氧化碳量。
在实验中,我们发现当氢氧化钠浓度达到1mol/L时,每克氢氧化钠可以吸收0.44克二氧化碳。
通过本次实验研究,我们发现化学法吸收二氧化碳是一种有效的方法。
这种方法具有较高的吸收速度和反应完整性,可以达到固定二氧化碳的效果。
同时,它也有一定的经济适用性和可操作性,可以被广泛地应用在各个领域。
但是,在应用中还需要考虑到吸收剂的成本、处理固体和液体废物的问题等。
这些问题需要进一步地研究和解决通过本次实验研究,我们了解到化学法吸收二氧化碳是一种高效的固定二氧化碳方法,具有较高的吸收速度和反应完整性。

二氧化碳的吸收与解析,实验的误差分析。
二氧化碳的吸收与解析是化学分析学中一种基本的定量分析方法。
常用于测定空气、工业废气、汽车尾气、大气等中的二氧化碳含量。
方法是利用KOH(氢氧化钾)溶液可以吸收二氧化碳,并且有一个明确的化学反应式:
CO2 + 2KOH → K2CO3 + H2O
因此可以通过测定KOH溶液的消耗量来定量二氧化碳含量。
在实验中,误差可能产生于如下方面:
1. 试剂纯度:如果试剂的纯度不能保证,可能会影响吸收和解析过程中的化学反应,进而影响测量结果。
2. 装置漏气:实验装置如果出现气泡漏气等问题,会导致二氧化碳的流失,测量结果将不准确。
3. 操作技巧:实验操作不规范,包括倒液不准确、加热温度不够等等,也会导致实验误差。
4. 仪器准确性:实验中所使用的仪器可能存在读数误差和灵敏度等问题,这也可能导致测量结果的误差。
因此,在实验过程中,我们需要严格控制实验条件、使用高纯度试剂、保证操作技巧规范、使用准确的仪器和科学的数据处理方法,以尽可能减小误差并获得准确的二氧化碳含量测量结果。

二氧化碳吸收实验报告二氧化碳吸收实验报告引言:二氧化碳是一种重要的温室气体,它的排放是导致全球气候变暖的主要原因之一。
为了减少二氧化碳的排放,许多科学家和研究人员致力于寻找有效的二氧化碳吸收方法。
本实验旨在探究不同材料对二氧化碳吸收的效果,并评估其吸收能力及可行性。
实验过程:1. 实验材料准备:我们选择了三种常见的材料作为实验样本:活性炭、氧化铁和纳米孔材料。
这些材料都具有一定的吸附能力,有望在二氧化碳吸收中发挥作用。
2. 实验装置搭建:我们使用了一套自制的实验装置,包括一个二氧化碳气源、一个装有样本的吸附罐和一个二氧化碳浓度测量仪。
吸附罐中的样本与二氧化碳气体接触,通过测量浓度变化来评估吸附效果。
3. 实验操作:首先,我们将吸附罐中的样本与二氧化碳气体充分接触,使其吸附二氧化碳。
然后,使用浓度测量仪测量吸附后的二氧化碳浓度,并记录下来。
重复以上步骤,以获得准确的数据。
实验结果:通过多次实验,我们得到了以下结果:1. 活性炭吸附效果较好:活性炭是一种多孔材料,具有较大的比表面积,因此具有较好的吸附能力。
在实验中,我们发现活性炭对二氧化碳的吸附效果较好,能够有效地降低二氧化碳的浓度。
2. 氧化铁表现出一定的吸附能力:氧化铁是一种常见的吸附材料,它与二氧化碳之间存在一定的相互作用力。
实验结果显示,氧化铁对二氧化碳的吸附效果较活性炭略逊一筹,但仍具有一定的吸附能力。
3. 纳米孔材料吸附效果有待改进:纳米孔材料是一种新型的吸附材料,具有微小的孔隙结构,有望提高吸附效果。
然而,在我们的实验中,纳米孔材料对二氧化碳的吸附效果较差,需要进一步改进和优化。
讨论与结论:通过本次实验,我们得出了以下结论:1. 活性炭是一种较为理想的二氧化碳吸附材料,具有较好的吸附效果和可行性。
2. 氧化铁虽然吸附效果稍逊于活性炭,但仍具备一定的吸附能力,值得进一步研究和应用。
3. 纳米孔材料在二氧化碳吸附方面表现不佳,需要进一步改进和优化。

吸收物系的变化—二氧化碳吸收解析实验二氧化碳吸收实验,听起来是不是有点高大上?但这个实验就像一场科学的魔术秀,能让你对周围的世界有更深的了解。
想象一下,咱们的空气中满是二氧化碳,这家伙可不是个善茬,它可是导致全球变暖的罪魁祸首之一。
今天,就让我们一起“亲密接触”一下这个小家伙,看看它到底是怎么被“吸收”的。
得有个好的开始嘛。
咱们准备些简单的工具,像是烧杯、试管,还有那种一看就让人想起化学课的液体,哎呀,就是指示剂。
然后,拿出一些植物的叶子,像是小草、小花,它们可是一等一的二氧化碳吸收高手。
咱们把这些小家伙放进水里,稍微等待一会儿,嘿,这时候空气中的二氧化碳就开始“请客”了,逐渐被水吸收。
你知道吗,水就像是一个大海绵,把二氧化碳吸得津津有味。
这个过程其实就是个化学反应,水和二氧化碳结合,形成了碳酸。
这碳酸可不是啥好东西,喝多了可得牙齿发愁。
但咱们的实验可不是为了让你口渴,而是要让大家明白二氧化碳的存在。
哎,真是个有趣的小家伙,光吃不喝的!然后,咱们就可以观察水的变化了,水的颜色会因为指示剂的存在而发生变化。
小伙伴们,这个时候可得注意了,看到颜色变得多么美丽,就像魔法一样!这可不是单纯的变化,而是告诉我们,二氧化碳的浓度在下降,水吸收得可真不错。
这种变化,既神奇又令人振奋,仿佛在告诉我们:大自然的力量真是无穷无尽!实验还可以变得更加有趣,咱们可以尝试不同的条件。
比如说,增加光照,这可让植物更加努力地“工作”。
嘿,植物可不是吃白饭的,它们需要光、需要水,也需要二氧化碳来进行光合作用。
想象一下,阳光照射下,植物们就像是上了发条的小人儿,开始加速吸收二氧化碳,简直是一场“吸收大赛”!实验的过程中难免会遇到小麻烦。
比如说,没注意水温,或者指示剂用得太少,这可会影响结果。
别着急,这都是实验的一部分嘛,犯错了就重新来。
就像生活,跌倒了再爬起来,重要的是坚持不懈,才能见到成果。
实验的最终结果就像是一个大揭晓,咱们通过简单的步骤,竟然能看到二氧化碳被“吸收”了。

二氧化碳的吸收与解吸实验报告摘要:本实验旨在研究二氧化碳的吸收与解吸过程,并观察其对环境条件的敏感性。
通过使用氢氧化钠(NaOH)溶液作为吸收剂,测量二氧化碳溶液中的pH值和溶液的体积变化,以评估吸收和解吸的效果。
实验结果表明,二氧化碳能够被NaOH 溶液吸收,并在一定条件下释放。
1. 引言二氧化碳(CO2)是一种常见的气体,它在大气中的浓度增加与全球气候变化密切相关。
因此,研究CO2的吸收与解吸过程对于理解和控制大气中CO2浓度的变化至关重要。
本实验旨在模拟CO2吸收与解吸的过程,并观察其在不同条件下的反应情况。
2. 实验步骤2.1 实验材料:-氢氧化钠(NaOH)固体-蒸馏水-二氧化碳气源- pH计-称量器具-实验室玻璃器皿2.2 实验过程:(1)准备NaOH溶液:称取适量的NaOH固体,加入一定量的蒸馏水中,搅拌溶解。
(2)装置实验装置:将NaOH溶液倒入实验室玻璃器皿中,置于实验台上。
(3)测量初始条件:使用pH计测量NaOH溶液的初始pH 值,并记录初始溶液的体积。
(4)注入CO2气体:将二氧化碳气体缓慢地通入NaOH溶液中,观察溶液的变化,并记录每次通气的时间和CO2气体的体积。
(5)测量pH值:定期使用pH计测量溶液的pH值,并记录下来。
(6)测量溶液体积:测量在吸收和解吸过程中溶液的体积变化,并记录下来。
3. 实验结果实验期间,我们记录了二氧化碳气体通入溶液的时间、CO2气体的体积以及溶液的pH值变化。
根据实验结果,我们绘制了相应的数据表和图表。
4. 讨论与分析根据实验结果,我们观察到二氧化碳气体通入NaOH溶液后,溶液的pH值逐渐下降,说明二氧化碳被NaOH吸收并生成了碳酸。
随着二氧化碳的继续通入,溶液的体积也有所增加,这是由于二氧化碳的溶解导致溶液的体积增大。
在观察解吸过程时,我们停止通入二氧化碳气体,溶液开始释放二氧化碳,并逐渐恢复到初始状态。
此时,溶液的pH 值逐渐升高,说明碳酸在解吸过程中分解为二氧化碳和水,并释放出二氧化碳气体。

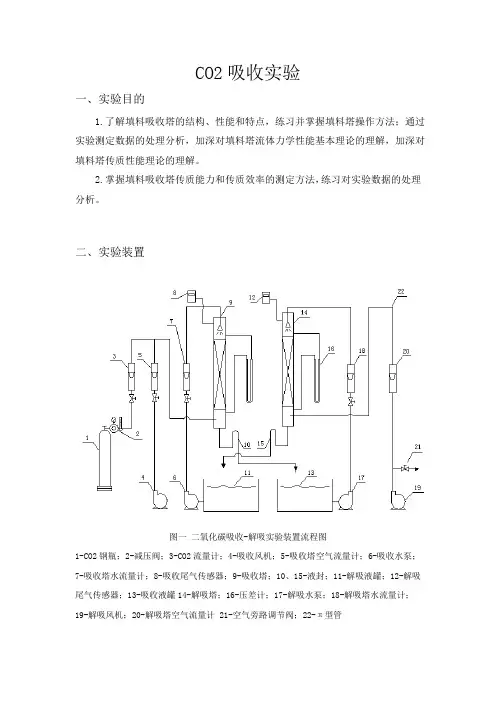
CO2吸收实验一、实验目的1.了解填料吸收塔的结构、性能和特点,练习并掌握填料塔操作方法;通过实验测定数据的处理分析,加深对填料塔流体力学性能基本理论的理解,加深对填料塔传质性能理论的理解。
2.掌握填料吸收塔传质能力和传质效率的测定方法,练习对实验数据的处理分析。
二、实验装置图一二氧化碳吸收-解吸实验装置流程图1-CO2钢瓶;2-减压阀;3-CO2流量计;4-吸收风机;5-吸收塔空气流量计;6-吸收水泵;7-吸收塔水流量计;8-吸收尾气传感器;9-吸收塔;10、15-液封;11-解吸液罐;12-解吸尾气传感器;13-吸收液罐14-解吸塔;16-压差计;17-解吸水泵;18-解吸塔水流量计;19-解吸风机;20-解吸塔空气流量计 21-空气旁路调节阀;22-π型管三、实验原理传质性能:吸收系数是决定吸收过程速率高低的重要参数,实验测定可获取吸收系数。
对于相同的物系及一定的设备(填料类型与尺寸),吸收系数随着操作条件及气液接触状况的不同而变化。
根据双膜模型的基本假设,气侧和液侧的吸收质A 的传质速率方程可分别表达为:气膜 )(Ai A g A p p A k G -= (1-1) 液膜 )(A Ai l A C C A k G -= (1-2)式中:A G —A 组分的传质速率,1-⋅s kmoI ;A —两相接触面积,m 2;A P —气侧A 组分的平均分压,Pa ;Ai P —相界面上A 组分的平均分压,Pa ;A C —液侧A 组分的平均浓度,3-⋅m kmolAi C —相界面上A 组分的浓度3-⋅m kmolg k —以分压表达推动力的气侧传质膜系数,112---⋅⋅⋅Pa s m kmol ;l k —以物质的量浓度表达推动力的液侧传质膜系数,1-⋅s m 。
以气相分压或以液相浓度表示传质过程推动力的相际传质速率方程又可分别表达为:)(*-=A A G A p p A K G (1-3))(A A L A C C A K G -=*(1-4)式中:*A p —液相中A 组分的实际浓度所要求的气相平衡分压,Pa ;*A C —气相中A 组分的实际分压所要求的液相平衡浓度,3-⋅m kmol ;G K —以气相分压表示推动力的总传质系数或简称为气相传质总系数,112---⋅⋅⋅Pa s m kmol ;L K —以气相分压表示推动力的总传质系数,或简称为液相传质总系数,1-⋅s m 。

化学法吸收二氧化碳的实验研究一、本文概述随着全球气候变暖问题日益严重,二氧化碳(CO₂)的减排和捕集成为了全球关注的焦点。
化学法吸收二氧化碳作为一种有效的减排技术,近年来受到了广泛的关注和研究。
本文旨在探讨化学法吸收二氧化碳的实验研究,通过对吸收剂的选择、反应条件的优化以及吸收过程的动力学和热力学研究,以期为提高化学法吸收二氧化碳的效率和降低其成本提供理论依据和实践指导。
本文首先对化学法吸收二氧化碳的基本原理进行介绍,然后详细阐述实验研究的方案和方法,包括实验材料的选择、实验装置的设计、实验步骤的确定等。
在此基础上,本文将分析实验结果,讨论各种因素对吸收效果的影响,并提出优化措施。
本文还将对化学法吸收二氧化碳的应用前景进行展望,以期为推动全球碳减排事业做出积极贡献。
二、化学法吸收二氧化碳的原理化学法吸收二氧化碳主要是利用化学反应将二氧化碳转化为无害或低害的化合物。
这种方法通常涉及使用碱性溶液或固体吸收剂,如氢氧化钠、氢氧化钙、氨水等,与二氧化碳进行反应,生成相应的碳酸盐或碳酸氢盐。
在化学吸收过程中,吸收剂的选择至关重要。
理想的吸收剂应具备高吸收速率、高吸收容量和良好的选择性,即只与二氧化碳反应,而不与其他气体发生显著反应。
吸收剂还应易于再生和循环使用,以降低处理成本和减少废弃物产生。
化学吸收过程可以在不同的操作条件下进行,如温度、压力、液气比等。
这些操作条件对吸收速率、吸收容量和反应产物的性质有重要影响。
因此,优化操作条件是提高化学吸收法性能的关键。
化学吸收法的另一个重要方面是反应产物的处置和利用。
生成的碳酸盐或碳酸氢盐可以通过不同的途径进行处理,如转化为有价值的化学品、用作肥料或建筑材料等。
这种资源化利用不仅可以减少废弃物产生,还可以实现二氧化碳的减排和资源的循环利用。
化学法吸收二氧化碳的原理是利用化学反应将二氧化碳转化为无害或低害的化合物。
通过选择合适的吸收剂、优化操作条件和实现产物的资源化利用,化学法吸收二氧化碳在减少温室气体排放和促进可持续发展方面具有重要作用。
二氧化碳的吸收与解吸实验思考题一、实验介绍二氧化碳是一种重要的气体,它在地球大气中起着重要的作用。
本实验主要是探究二氧化碳在水中的溶解过程,以及二氧化碳的吸收与解吸过程。
二、实验原理1. 二氧化碳在水中的溶解二氧化碳可以溶解在水中,形成碳酸。
当空气中的二氧化碳与水接触时,会发生以下反应:CO2 + H2O → H2CO3其中,H2CO3是碳酸。
2. 二氧化碳的吸收与解吸当空气中含有较多的二氧化碳时,它会被水吸收。
相反地,当空气中含有较少的二氧化碳时,水会释放出已经溶解在其中的二氧化碳。
三、实验步骤1. 准备一个透明的玻璃杯,并将其放置在平坦表面上。
2. 在玻璃杯里加入适量的自来水(约半杯)。
3. 将一张白纸放在玻璃杯下方,并将玻璃杯移到白纸上。
4. 将一个小碗放在玻璃杯旁边,并将其里面装满了小颗粒的碳酸钠。
5. 将一根吸管插入碳酸钠中,并将其另一端放在玻璃杯内,但不要让吸管接触到水面。
6. 观察玻璃杯内的水,当吸管中的气体流入水中时,会产生气泡。
这是因为二氧化碳溶解在水中时会产生气泡。
7. 等待几分钟,观察气泡是否消失。
如果消失了,说明二氧化碳已经被完全溶解在水中。
四、实验思考题1. 为什么二氧化碳会被水吸收?答:二氧化碳可以与水反应生成碳酸,而这个反应是一个可逆反应。
当空气中含有较多的二氧化碳时,它会被水吸收。
相反地,当空气中含有较少的二氧化碳时,水会释放出已经溶解在其中的二氧化碳。
2. 为什么加入小颗粒的碳酸钠?答:加入小颗粒的碳酸钠可以增加实验的效果,因为碳酸钠可以与酸反应,产生二氧化碳。
当吸管中的气体流入水中时,会产生气泡。
这是因为二氧化碳溶解在水中时会产生气泡。
3. 为什么要等待几分钟?答:等待几分钟是为了让二氧化碳充分地溶解在水中。
如果没有等待足够的时间,实验结果可能不准确。
4. 实验过程中有哪些注意事项?答:实验过程中需要注意以下事项:(1)使用透明的玻璃杯;(2)将玻璃杯放在平坦表面上;(3)不要让吸管接触到水面;(4)使用小颗粒的碳酸钠;(5)等待足够的时间,让二氧化碳充分地溶解在水中。
二氧化碳吸收实验报告数据处理引言:二氧化碳(CO2)是一种重要的温室气体,它的排放对地球气候产生着极大的影响。
为了解决全球变暖问题,减少CO2的排放已成为全球关注的焦点。
本实验旨在探究不同条件下CO2的吸收情况,通过数据处理和分析,为减少CO2排放提供科学依据。
方法:实验中,我们选取了三个不同温度的溶液进行CO2吸收实验,分别是25℃、35℃和45℃。
每个温度下,我们分别测量了不同时间点的CO2浓度,并记录下来。
实验时间为60分钟,测量间隔为10分钟。
结果:在25℃温度下,CO2浓度随时间的变化如下:- 10分钟:0.04%- 20分钟:0.03%- 30分钟:0.02%- 40分钟:0.02%- 50分钟:0.01%- 60分钟:0.01%在35℃温度下,CO2浓度随时间的变化如下:- 10分钟:0.06%- 20分钟:0.05%- 30分钟:0.04%- 40分钟:0.03%- 50分钟:0.02%- 60分钟:0.02%在45℃温度下,CO2浓度随时间的变化如下:- 10分钟:0.08%- 20分钟:0.07%- 30分钟:0.06%- 40分钟:0.05%- 50分钟:0.03%- 60分钟:0.03%讨论:根据实验结果,我们可以得出以下结论:1. 随着时间的推移,CO2浓度逐渐降低。
这表明在实验条件下,溶液能够吸收二氧化碳。
2. 随着温度的升高,溶液对CO2的吸收能力提高。
这说明温度对CO2的吸收有着积极的影响。
3. 在实验时间内,CO2浓度的降低速度随温度的升高而加快。
这与溶解度的变化有关,温度的升高可以增加溶解度,促进CO2的吸收。
结论:通过本实验的数据处理和分析,我们发现温度对CO2的吸收有着显著的影响。
在实验条件下,随着温度的升高,溶液对CO2的吸收能力增强,CO2浓度的降低速度加快。
这为减少CO2排放提供了科学依据,未来可以尝试利用高温条件下的溶液来吸收CO2,从而降低温室气体的排放。
探究不同温度对二氧化碳的吸收情况
本实验旨在探究不同温度对二氧化碳的吸收情况,为环境保护和资源利用提供参考。
实验步骤:
1.在室温条件下,将100ml的水加入试管中
2.用洗涤瓶向试管中通入25ml的二氧化碳
3.立即插上气泡计,记录起始气泡体积并浸入水中
4.接着使用温控槽分别将试管放置在20℃、30℃和40℃的水中
5.记录每个温度下20分钟后的气泡体积
6.取出试管,用滴定管加入氢氧化钠至底部形成碱性底液
7.读取计时器,记录气泡体积与时间的变化率
实验结果:
在20℃下,二氧化碳的吸收变化率为0.05ml/min。
在30℃下,二氧化碳的吸收变化率为0.1ml/min。
而在40℃下,二氧化碳的吸收变化率达到了0.15ml/min。
可以看出,在升高温度的情况下,二氧化碳的吸收变化率也随之增加。
实验结论:
本实验结果表明,二氧化碳在水中的吸收与温度密切相关。
在升高温度的情况下,二氧化碳的吸收变化率也随之增加。
因此,在环境保护和资源利用方面,人们应当关注气候变化,减少碳排放,从而降低地球温度,避免不良环境后果的发生。
二氧化碳吸收实验报告
《二氧化碳吸收实验报告》
实验目的:通过实验观察二氧化碳在不同条件下的吸收情况,了解二氧化碳在自然界中的行为。
实验材料:试管、烧杯、二氧化碳气源、水、苏打粉、酚酞指示剂。
实验步骤:
1. 在试管中倒入一定量的水,并加入少量的酚酞指示剂。
2. 将试管放在烧杯中,然后向试管中注入二氧化碳气体。
3. 观察试管中的颜色变化,记录下来。
4. 将苏打粉逐渐加入试管中,观察颜色的变化。
实验结果:
1. 当二氧化碳气体注入试管中时,试管中的水变成了酸性的红色。
2. 当加入苏打粉后,试管中的颜色逐渐变成了蓝色,表示二氧化碳被吸收。
实验分析:
通过这个实验,我们可以得出结论:二氧化碳在水中会形成碳酸,而碳酸在碱性物质的作用下会转化为碳酸盐,从而二氧化碳被吸收。
这个实验也说明了二氧化碳在自然界中被水体吸收的过程。
实验结论:
通过这个实验,我们了解了二氧化碳在不同条件下的吸收情况,也加深了对二氧化碳在自然界中的行为的理解。
这对于我们认识环境中的二氧化碳循环过程有着重要的意义。