用柚子皮提取果胶的工艺优化研究
- 格式:pdf
- 大小:60.22 KB
- 文档页数:2

学士学位论文系别:生命科学系学科专业:食品科学与工程姓名:赵志荣 ____运城学院2010年 5 月酸法提取柚子皮中果胶的工艺研究系别:生命科学系学科专业:食品科学与工程姓名:赵志荣 __指导教师:苗莉云 _运城学院2010年 5月目录1 前言 (6)1.1金银花国内外研究进展............................................ 错误!未定义书签。
1.2金银花最早出处及药用部位........................................ 错误!未定义书签。
1.3金银花的化学成分 (9)1.3.1 黄酮类物质 (9)1.3.1 挥发油 (9)1.3.2 有机酸 (10)1.3.3 其它成分 (10)1.4金银花的药理作用 (10)1.4.1 抗炎及解热作用 (10)1.4.2 利胆保肝作用 (10)1.4.3 降血脂、止血作用 (10)1.4.4 抗生育作用 (11)1.4.5 氧化作用 (11)1.4.6 抗肿瘤作用 (11)1.4.7 其他作用 (11)1.5黄酮类化合物 (11)1.5.1 黄酮类化合物结构及性质 (11)1.5.2 黄酮类化合物的药理作用 (11)1.6黄酮类化合物的提取方法 (12)1.6.1 热水提取法 (12)1.6.2 有机溶剂提取法 (12)1.6.3 碱性稀醇提取法 (12)1.6.4 微波提取法 (12)1.6.5 超临界流体萃取法 (12)1.6.6 超声波提取法 (12)1.6.7 酶解法 (13)1.6.8 半仿生提取技术 (13)1.6.9 大孔树脂吸附法 (13)1.6.10 紫外分光光度法 (13)1.7本文研究的目的和意义 (13)2 实验材料与方法 (14)2.1材料与仪器 (14)2.1.1 材料及试剂 (14)2.1.2 实验仪器 (14)2.2实验方法 (14)2.2.1 冷浸法提取金银花中总黄酮 (16)2.2.2 超声波法各因素对金银花总黄酮提取效果的影响 (17)2.2.3 正交实验法法优化金银花中总黄酮的提取工艺 (17)2.2.4 金银花不同器官总黄酮含量比较 (17)2.2.5金银花总黄酮含量测定 (18)3 实验结果与分析 (19)3.1芦丁标准曲线 (19)3.2冷浸法提取金银花总黄酮提取率比较 (19)3.3超声波法各因素对金银花黄酮提取效果的影响 (20)3.3.1 乙醇浓度对黄酮提取率的影响 (20)3.3.2 料液比对总黄酮提取率的影响 (21)3.3.3 超声温度对总黄酮提取率的影响 (22)3.3.4 超声时间对总黄酮提取率的影响 (22)3.4正交实验结果 (23)3.5不同方法提取金银花总黄酮 (24)3.6金银花不同器官总黄酮提取率比较 (24)4 讨论 (26)致谢 (27)参考文献 (28)酸法提取柚子皮中果胶的工艺研究赵志荣(运城学院生命科学系,山西运城 044000)摘要:柚子( CitrusgrandisL.Osbeck)为芸香科柑橘亚科柑橘属水果,其化学成分包括黄酮类物质、芳香油、果胶、色素、膳食纤维等。



一、实验目的1. 探究柚子皮中天然果胶的提取方法。
2. 评估柚子皮提取的果胶在食品、医药等领域的应用潜力。
二、实验材料与仪器1. 实验材料:柚子皮、无水乙醇、蒸馏水、盐酸、氢氧化钠、硫酸铜、无水硫酸钠、碘化钾、淀粉等。
2. 实验仪器:电子天平、烘箱、微波炉、超声波清洗器、离心机、可见分光光度计、烧杯、玻璃棒、漏斗、滤纸等。
三、实验方法1. 柚子皮预处理:将柚子皮清洗干净,去除外层绿色部分,切成小块,用蒸馏水浸泡1小时,然后用超声波清洗器清洗30分钟。
2. 果胶提取:将预处理后的柚子皮加入一定量的无水乙醇,在室温下浸泡过夜。
将浸泡后的柚子皮与乙醇混合物进行离心分离,收集沉淀物,用蒸馏水洗涤3次,再用无水乙醇洗涤1次,以去除杂质。
3. 果胶纯化:将洗涤后的沉淀物加入适量的蒸馏水,煮沸30分钟,使果胶充分溶解。
冷却后,用离心机分离溶液中的杂质,收集上清液。
将上清液加入适量的95%乙醇,使果胶沉淀,过滤收集沉淀物,用无水乙醇洗涤3次,以去除杂质。
4. 果胶含量测定:采用硫酸铜法测定果胶含量。
将一定量的果胶溶液与硫酸铜溶液混合,在特定条件下反应,生成红色复合物。
通过比色法测定红色复合物的吸光度,根据标准曲线计算果胶含量。
5. 果胶应用研究:将提取的果胶应用于食品、医药等领域,如制作果冻、酸奶、药物缓释剂等,并对其性能进行评估。
四、实验结果与分析1. 柚子皮预处理效果:通过超声波清洗,柚子皮中的杂质被有效去除,提高了果胶提取率。
2. 果胶提取率:在最佳提取条件下,柚子皮提取的果胶含量为5.2%。
3. 果胶纯化效果:通过乙醇沉淀和离心分离,成功提取出纯度较高的果胶。
4. 果胶含量测定:采用硫酸铜法测定果胶含量,结果显示提取的果胶纯度为95%。
5. 果胶应用研究:将提取的果胶应用于食品、医药等领域,实验结果表明,柚子皮提取的果胶具有良好的应用潜力。
五、实验结论1. 本实验成功从柚子皮中提取出天然果胶,提取率为5.2%,纯度为95%。


从柚子皮中提取果胶研究摘要:以干燥的柚子皮粉末为原料,利用酸性水解和乙醇沉淀,同时根据正交试验法进行果胶提取的优化实试验。
结果表明:浸泡时间与水解过长或者过短,酸碱度以及水解温度过高或者过低,果胶的产率均不高,提取果胶的最佳条件是:温度(A)83摄氏度,料液比(B,g/g)1:16,PH值(C)1.0,提取时间(D)90min,即最佳组合条件为A3B 2C4D3,此时果胶质量最好。
关键词:柚子皮果胶我国柚子资源产量丰富,但作为柚子的副产品,柚子皮的利用非常有限,而柚子皮的主要成分果胶的利用更是极其有限。
果胶是人类第七大营养素中可溶性膳食纤维的主要成分,果胶是由半乳糖组成的一种天然复合多糖大分子化合物,为白色或者淡黄色粉状物,提取出来的果胶有很好的商业价值,可用于食品中制作果冻,果脯,凝胶剂,组织成型剂和稳定剂等。
一、实验原料,试剂与主要仪器设备1.实验原料柚子皮实验所用的柚子皮取自市场普遍销售的柚子。
2.主要试剂无水乙醇、盐酸;3.主要仪器设备FZ102型植物粉碎机;800型离心沉淀器;电热恒温水浴器分析天平;DHG-9070A型电热恒温鼓风干燥箱等。
二、实验方法与原理1.流程1.1 柚子皮的加工柚子→选果→去皮→水洗→干燥→粉碎→选瓶备用1.2 提取工艺流程柚子皮粉末→水解→过滤→真空浓缩→沉淀→离心分离→干燥→粉碎→果胶2.实验材料处理2.1 水解液的制备将浓度为37%的盐酸分别稀释成PH值为3.0,2.0,1.5,1.0的不同浓度稀盐酸溶液,放入试剂瓶中。
2.2 原料的预处理将购得的新鲜柚子洗净,去皮,所得到的柚子皮放到沸水中煮7~8min,除去果胶酶;然后将柚子皮在流水中漂洗,可除去可溶性糖、有机酸、色素及苦味物质、挤干水后放入60℃干燥至恒重,用研体粉碎,即可得粗品柚子皮粉末。
2.3 柚子皮果胶提取方法2.3.1称量取一只干燥洁净的烧杯放在电子天平上,添加一定量的柚子皮粉末,记下质量。
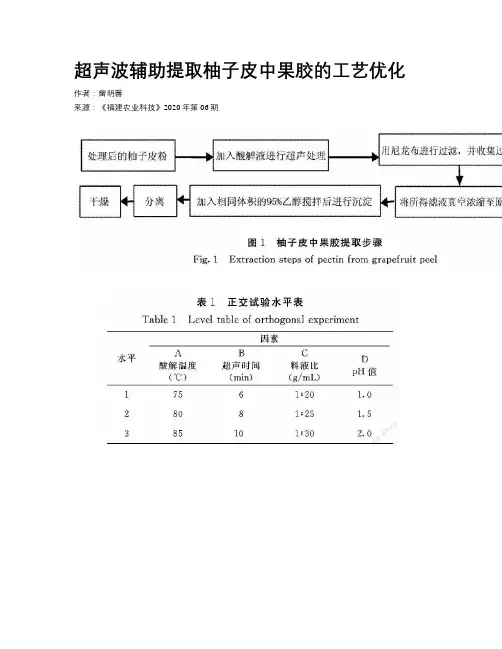
超声波辅助提取柚子皮中果胶的工艺优化作者:***来源:《福建农业科技》2020年第06期摘要:以柚子皮为原料,采用超声波辅助提取果胶,通过单因素和正交试验研究料液比、pH值、超声时间以及酸解温度等对果胶得率的影响,确定最佳提取柚子皮果胶的工艺。
试验结果表明:柚子皮果胶提取最佳工艺为料液比1∶ 25、酸解温度80℃、pH值1.5、超声时间8 min,在此最佳工艺条件下果胶得率为12.56%。
超声波辅助提取柚子皮中果胶不仅能够满足日益增长的市场需求,同时大大节约了提取时间,也提高了果胶的提取率。
关键词:柚子皮渣;果胶;超声波提取;工艺优化中图分类号: TS255.4文献标志码: A文章编号: 0253-2301(2020)06-0033-04DOI:10.13651/ki.fjnykj.2020.06.007Optimization of Ultrasonic-assisted Extraction of Pectin from Grapefruit PeelLEI Ming-xin(Modern Agriculture Branch Institute, Chengdu Agricultural College, Chengdu, Sichuan 611130, China)Abstract:By using the grapefruit peel as the raw material, the ultrasonic-assisted extraction of pectin was carried out, and the effects of the solid-liquid ratio, pH value, ultrasonic time and acidolysis temperature on the yield of pectin were studied by using the single factor experiment and orthogonal experiment, in order to determine the best extraction technology of pectin from grapefruit peel. The results showed that the optimal extraction process of pectin from grapefruit peel was as follows: the solid-liquid ratio was 1∶ 25, the acidolysis temperature was 80℃, the pH value was1.5 , and the ultrasonic time was 8 min. The yield of pectin was12.56 % under the optimal process conditions. The ultrasonic-assisted extraction of pectin from grapefruit peel could not only meet the growing market demands, but also greatly save the extraction time and improve the extraction rate of pectin.Key words:Grapefruit peel; Pectin; Ultrasonic-assisted extraction; Process optimization柚子皮中富含生物活性成分:柚皮苷、橙皮苷等黃酮类化合物,类胡萝卜素、水溶性黄色素等天然色素,以及果胶、膳食纤维、香精油等。

从柚子皮中提取果胶的研究【摘要】采用酸解乙醇沉淀法从柚皮中提取果胶,以促进柚子的综合利用开发。
得出在酸水解提取果胶的工艺中提取液酸度是影响果胶收率的主要因素,并取得了果胶提取的最优提取条件为酸度为pH = 2,提取温度为90℃,提取时间为70min,在该条件下果胶收率最高【关键词】柚子皮;果胶;提取1.引言果胶是由半乳糖组成的一种天然复合多糖大分子化合物,为米白色或淡黄色粉末状物,无臭,味甜且带微酸,它是一种亲水性植物胶【1】,广泛存在于高等植物的根、茎、叶、果的细胞壁中,具有良好的胶凝化和乳化稳定作用,其用途很广,在食品、医药和其它工业中被广泛应用,可用于制作果酱、果冻、果汁的增稠剂,在医药工业中也用作肠机能调节剂、止血剂、抗毒剂,还可以代替琼脂用于化妆品生产等【2、3】。
图1. 果胶的结构式果胶是一种高分子聚合物,分子量介于5~30万之间,果胶又分为果胶液、果胶粉和低甲氧基果胶三种,其中尤以果胶粉的应用最为普遍。
近年来,我国普遍开展了果胶的研制工作。
由于提取工艺复杂,技术要求严格,故其工业化提取还不多,而且产量不稳定,产品单一。
随着功能性多糖的开发研究,果胶作为水溶性膳食纤维,越来越受到重视,果胶需求量呈高速增长趋势【4】,应用必定会越来越广泛。
有关资料表明:全世界果胶的年需求量在2万吨左右,20 世纪末全世界果胶的年需求量达到了27000吨,并以每年5%的速度增长。
据不完全统计,我国每年的果胶需求量约在1500 吨以上,而80%靠从国外进口。
目前世界上果胶的生产商主要集中在英国、丹麦、法国、德国、以色列及瑞士等国【5】。
果胶作为一种食品添加剂在我国还处在起步阶段,而进口果胶的价格远远高于国产果胶,因此,大力开发果胶资源,摸索出切实可行的果胶生产工艺,对于发展我国食品和食品添加剂工业具有重要意义。
此外,我国南方地区每年都有大量的柚子上市,大量的柚皮因丢弃而霉烂变质,不仅造成资源极大的浪费,而且污染了环境,这项研究能有效的实现物质再利用,具有很高的环境保护和节能意义【6】。


柚皮果胶的提取及脱色工艺研究陈艳红;田友明;肖琼;吴昌正;肖安风【摘要】以柚皮粉为原材料,果胶得率为指标,研究了酸法浸提柚皮果胶工艺中浸提温度、pH、浸提时间、液料比对柚皮果胶得率的影响.结果表明,柚皮果胶的最佳提取工艺为:浸提时间90 min,浸提液pH 1.5,液料比(g/mL)20:1,浸提温度100℃,在此条件下,柚皮粗果胶得率达到19.9%.然后,以柚皮粗果胶为原料,考察了脱色剂的种类、脱色剂添加量、脱色时间、脱色温度及果胶醇沉条件对柚皮粗果胶脱色效果及最终得率的影响.结果表明,以珍珠岩为脱色剂,在添加量为2%,脱色温度为70℃,脱色时间为20 min时,果胶脱色率最高为66.4%,当果胶浸提液与乙醇的体积比为5:4时,果胶得率达到最大(11.5%).【期刊名称】《泉州师范学院学报》【年(卷),期】2018(036)006【总页数】6页(P14-19)【关键词】柚皮果胶;提取工艺;脱色工艺;优化【作者】陈艳红;田友明;肖琼;吴昌正;肖安风【作者单位】集美大学食品与生物工程学院,福建厦门361021;福建省食品微生物与酶工程重点实验室,福建厦门361021;厦门市食品与生物工程技术研究中心,福建厦门 361021;厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建厦门 361021;集美大学食品与生物工程学院,福建厦门361021;福建省食品微生物与酶工程重点实验室,福建厦门361021;厦门市食品与生物工程技术研究中心,福建厦门 361021;厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建厦门 361021;集美大学食品与生物工程学院,福建厦门361021;福建省食品微生物与酶工程重点实验室,福建厦门361021;厦门市食品与生物工程技术研究中心,福建厦门 361021;厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建厦门 361021;集美大学食品与生物工程学院,福建厦门361021;福建省食品微生物与酶工程重点实验室,福建厦门361021;厦门市食品与生物工程技术研究中心,福建厦门 361021;厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建厦门 361021;集美大学食品与生物工程学院,福建厦门361021;福建省食品微生物与酶工程重点实验室,福建厦门361021;厦门市食品与生物工程技术研究中心,福建厦门 361021;厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建厦门 361021【正文语种】中文【中图分类】TQ920.6柚皮中含有丰富的果胶、类黄酮、类柠檬苦素、类胡萝卜素、抗坏血酸和香精油等对人体健康具有促进作用及对一些疾病有防治作用的生理活性成分[1].果胶是一种复杂的天然高分子多糖,具有良好的增稠、胶凝化、乳化稳定作用,在食品科学、化妆品、营养、医药等领域有着广泛的应用[2].目前,用于食品行业的果胶大部分来源于柑橘皮,柑橘皮提取的果胶胶凝度高、级别高.琯溪蜜柚是福建省平和县著名的地方传统珍贵名果,已成为该县的经济支柱产业.随着平和蜜柚产量的逐年提高,每年因食用或生产加工产生大量的柚皮资源.大量的柚皮因霉烂变质而丢弃,造成了资源浪费和环境污染.由于柚皮资源丰富且以它为来源的果胶价格低廉,因此从柚皮中提取果胶具有较高的经济效益和社会效益.此外,因为植物细胞内多种酚类物质容易发生褐变[3-4]、焦糖化褐变等,因此,果胶的色泽成为目前制约国内果胶产量的原因之一.本研究以平和蜜柚皮为原料,着重分析酸水解乙醇沉淀法对平和蜜柚皮果胶的提取工艺的影响,同时比较不同脱色剂及脱色因素对果胶脱色的影响,确定其最佳提取及脱色工艺,以便为蜜柚的果胶生产提供参考.1 材料与方法1.1 主要试验材料和仪器平和蜜柚,购于漳州平和;浓盐酸、NaOH等试剂均为市售AR;工业酒精,厦门市绿茵试剂玻仪有限公司;分光光度计,尤尼柯(上海)仪器有限公司(型号7200);快速水分测定仪,梅特勒-托利多国际有限公司(型号HB43-S).1.2 柚皮果胶工艺将新鲜柚皮烘干、粉碎,用盐酸调节浸提液pH,控制浸提液温度,将粉碎的柚皮粉与浸提液按照一定的液料比均匀混合一段时间,浸提完毕后将浸提混合液进行离心,收集上清液即为粗果胶溶液.向粗果胶溶液中加入一定量的脱色剂,控制脱色温度,一段时间后离心收集上清液即为脱色果胶溶液,将脱色果胶溶液与乙醇按一定比例均匀混合,沉淀一段时间后过滤,沉淀烘干即为果胶成品.1.3 柚皮果胶酸法提取工艺研究1.3.1 工艺流程图柚皮果胶酶法提取工艺流程图见图1.图1 从柚皮中提取果胶的流程图Fig.1 The flow chart of extracting pectin from pumelo peel1.3.2 单因素试验 (1)浸提时间的影响.选取浸提温度为90 °C,液料比(g/mL)为20∶1,浸提液pH 1.5,浸提时间分别取30,40,50,60,70,80,90 min.浸提完毕,将浸提液过滤,收集滤液.待滤液冷却后,加乙醇并搅拌,静置.过滤得沉淀,用乙醇溶液洗涤数次,再过滤.将沉淀置于55 °C烘至恒重,粉碎.试验重复3次,根据果胶提取得率确定最适浸提时间.(2)浸提液pH值的影响.选取浸提温度为90 °C,液料比(g/mL)为20∶1,浸提液的pH值分别取1.0,1.5,2.0,2.5,3.0,3.5,4.0.浸提完毕,将浸提液过滤,收集滤液.待滤液冷却后,加乙醇并搅拌,静置.过滤得沉淀,用乙醇溶液洗涤数次,再过滤.将沉淀置于55 °C烘至恒重,粉碎.试验重复3次,根据果胶提取得率确定最适浸提pH.(3)液料比的影响.选取浸提温度为90 °C,浸提时间为90 min,浸提液pH 1.5,液料比(g/mL)分别取10∶1,15∶1,20∶1,25∶1,30∶1,35∶1.浸提完毕,将浸提液过滤,收集滤液.待滤液冷却后,加乙醇并搅拌,静置.过滤得沉淀,用乙醇溶液洗涤数次,再过滤.将沉淀置于55 °C烘至恒重,粉碎.试验重复3次,根据果胶提取得率确定最适液料比.(4)浸提温度的影响.选取浸提时间为60 min,液料比(g/mL)为20∶1,用盐酸将溶液pH调至2.0,浸提温度分别取 40,50,60,70,80,90,100 °C.浸提完毕,将浸提液过滤,收集滤液.待滤液冷却后,加乙醇并搅拌,静置.过滤得沉淀,用乙醇溶液洗涤数次,再过滤.将沉淀置于55 °C烘至恒重,粉碎.试验重复3次,根据果胶提取得率确定最适浸提温度.1.4 柚皮果胶脱色及乙醇沉淀果胶工艺1.4.1 脱色剂对柚皮果胶脱色效果的影响分别以活性炭、高岭土、珍珠岩为脱色剂进行脱色,添加质量浓度为2%的脱色剂至粗果胶溶液中,于70 °C脱色30 min.脱色完毕,将果胶混合液进行离心,3 500 r/min离心15 min,取上清液即为脱色果胶溶液,并测其在630 nm处的吸光度,以粗果胶溶液吸光度为对照.1.4.2 脱色剂的添加量对柚皮果胶脱色效果的影响分别向粗果胶溶液中添加质量浓度为1%,2%,3%,4%,5%,6%的珍珠岩,于70 °C脱色30 min.脱色完毕,将果胶混合液进行离心,3 500 r/min离心15 min,取上清液即为脱色果胶溶液,并测其在630 nm处的吸光度,以粗果胶溶液吸光度为对照.1.4.3 脱色温度对柚皮果胶脱色效果的影响向粗果胶溶液中加入质量浓度为2%的珍珠岩,分别于60,70,80,90,100 °C脱色30 min.脱色完毕,将果胶混合液进行离心,3 500 r/min离心15 min,取上清液即为脱色果胶溶液,并测其在630nm处的吸光度,以粗果胶溶液吸光度为对照.1.4.4 脱色时间对柚皮果胶脱色效果的影响向粗果胶溶液中加入2%的珍珠岩,70 °C分别脱色10,20,30,40,50 min.脱色完毕,将果胶混合液进行离心,3 500r/min离心15 min,取上清液即为脱色果胶溶液,并测其在630 nm处的吸光度,以粗果胶溶液吸光度为对照.1.4.5 乙醇添加量对柚皮果胶得率的影响向粗果胶溶液中加入2%的珍珠岩,70 °C分别脱色30 min.脱色完毕,将果胶混合液进行离心,3 500 r/min离心15 min,取上清液即为脱色果胶溶液.分别向脱色果胶中按照脱色果胶溶液与乙醇溶液的体积比为5∶2、2∶1、5∶3、5∶4、1∶1添加乙醇,醇沉30 min,过滤并收集胶体沉淀.将沉淀于50~60 °C下烘干,粉碎,称得果胶质量.1.5 测定方法1.5.1 水分含量利用快速水分测定仪进行测定.1.5.2 果胶得率其计算公式为:果胶得率1.5.3 果胶脱色[5] 分别以活性炭、高岭土、珍珠岩为脱色剂,按一定量添加至果胶浸提液中,80 ℃下搅拌脱色 20 min,离心取上清液,得果胶脱色液,测定其在 630 nm处的吸光度,以果胶浸提液的吸光度为对照,计算脱色率公式为:果胶脱色率2 结果与分析2.1 酸法提取果胶工艺研究研究了酸法浸提柚皮果胶工艺中浸提温度、pH、浸提时间、液料比对柚皮果胶得率的影响,结果见图2.图2 浸提时间(a)、浸提pH(b)、浸提温度(c)、液料比(d)对果胶得率的影响Fig.2 Effect of extraction time (a),extraction pH (b),extraction temperature(c) ,and liquid-material ratio(d),on yield of pectin浸提时间对果胶提取的影响很大.浸提时间短,果胶提取不完全.浸提时间长,有利于果胶充分水解,能够提高果胶得率;但浸提时间过长,会导致果胶发生解酯、裂解,分解成小分子物质,导致果胶得率下降.从图2(a)中可以看出,当浸提时间为60~90 min时,果胶得率随着浸提时间的增加而增加;当浸提时间为90~135 min时,果胶得率随着浸提时间的增加而逐渐降低,这是因为浸提时间过长,在较高温度和酸性条件下会导致果胶降解从而降低果胶得率,并且使外观颜色加深,给后处理带来不便;当浸提时间为90 min时,果胶得率达到最大,为17.8%.该结果与李百健等[6]研究结果相同,但其提取率为13%;毕双同等[9]利用酸法提取橙皮果胶,提取时间为120 min,果胶得率为16%左右;Liew等[7]以西番莲果为原料,选择浸提时间为120 min,果胶得率为7.7%.果胶浸提过程中,适当的浸提液pH有利于果胶的溶解于浸提液中,但是pH过低或过高会导致果胶释放不完全或者易导致果胶稳定性降低,进而导致果胶分解,降低果胶得率[8].从图2(b)中可以看出,随着pH的增大,果胶得率逐渐增高;当浸提液pH为1.5时,果胶得率达到最大,为17.3%;随着pH继续增大,果胶得率逐渐下降,这是因为pH过高原果胶不能完全从原料中分离,果胶提取得率降低;而pH过低,果胶极易水解成果胶酸,得率下降且产品色泽变深.这一结果与陈发河等[8]的研究结果相同,其果胶得率为20%左右.刘义武等[9]选择浸提液pH为2.0,果胶得率为13%左右;Seixas等[10]以酸法提取西番莲果皮中的果胶,当pH为2.1时,提取果胶效果最佳.温度对果胶提取得率、色泽及凝胶特性的影响较大.较高的温度能够加速果胶的酸性水解,将进一步增加果胶产率[11];而温度过低,则需很长的浸提时间,并且果胶溶出不完全.由图2(c)可知,酸提取法制备果胶的工艺中最佳提取温度为100 °C,果胶得率19.9%.低于100 °C时,随着温度的升高,得率逐渐提高,因为温度的升高有利于果胶质的水化溶出.这与Vriesmann等[12]报道的结果类似,其证实温度的升高会促进可可果皮中果胶的提取得率.台建祥等[13]选择浸提果胶温度为42 °C,果胶得率为13.7% 左右;应珊珊等[14]以火龙果皮为原材料提取过胶,选择浸提温度为95 °C,果胶得率为2% 左右;Wang等[15]在120 °C浸提柑橘皮果胶,得率达到68.9%;Liew等[7]在85 °C酸法浸提果胶,得率达到5.76%.在浸提过程中,适当的液料比是果胶提取工艺中关键步骤.液料比过大,则果胶醇沉耗费的乙醇量过大,成本高,而且醇沉效果差;但也不能过小,否则果胶不能完全转移到液体中,会使得果胶提取不完全[16].从图2(d)中可以看出,随着液料比的增大,果胶得率也随之增大;当液料比为20∶1时,果胶得率达到最大,为19.8%;当液料比超过20∶1时,果胶得率随着液料比的增大而下降.这是由于果胶在过量的酸浸提液中发生水解,并且粘度降低,导致沉淀效果不理想,使得果胶得率下降.这一结果与王乐等[17]报道的结果相似,但果胶得率不同;于海莲等[18]以梨渣为原料,选择液料比为16∶1进行果胶浸提,果胶得率为7% 左右;Chan 等[19]以可可果壳为原料浸提果胶,选择液料比为25∶1,果胶得率达到7.62%. 通过以上试验,得到以柚皮果胶的提取工艺条件为:液料比20∶1,pH为1.5,浸提温度100 ℃,浸提时间90 min,在此工艺条件下进行试验,柚皮中果胶的得率为 19.9%.2.2 果胶脱色及醇沉工艺研究以柚皮粗果胶为原料,考察了脱色剂的种类,脱色剂添加量,脱色时间,脱色温度及果胶醇沉条件对柚皮粗果胶脱色效果及最终得率的影响,结果见图3~7.图3 不同脱色剂对脱色效果的影响图4 珍珠岩添加量对脱色效果的影响Fig.3 Effects of different decolorizers on decoloration Fig.4 Effects of perlite adding on decoloration从图3中可以看出,3种脱色剂中,高岭土的脱色效果最差,脱色率只有37.7%;活性炭与珍珠岩脱色效果相差无几,分别为44.3% 和45.3%.但是以活性炭为脱色剂时,所得果胶色泽较深,且部分活性炭残留,不易去除,影响果胶品质.因此,试验选择珍珠岩为脱色剂.不同的脱色剂,脱色效果不同,如苏东林等[20]选择活性碳/聚酰胺混合使用剂作为脱色剂,脱色率为62%;曹霞敏等[21]选择大孔树脂XAD-16HP作为脱色剂,脱色效果最佳.从图4中可以看出,随着珍珠岩的添加量的增大,脱色率逐渐增加;当珍珠岩添加量为2%时,脱色率达到最大,为50.8%;随着珍珠岩添加量继续增大,脱色率几无变化.因此,试验选择珍珠岩添加量为2%.王冬妮等[22]以1%的活性炭进行果胶脱色,效果最佳;吴国利等[23]以0.04 g/mL的D101树脂进行脱色,脱色率达到74.4%.从图5中可以看出,随着脱色温度的增加脱色率逐渐增加,当温度为80 °C时,脱色率达到最大,为52.2%.当温度继续增加,脱色率随之下降.由于70 °C时,脱色率为51.9%,与80 °C时脱色率相差无几.因此,从节能角度考虑,试验选择脱色温度为70 °C.图5 脱色温度对脱色效果的影响图6 脱色时间对脱色效果的影响Fig.5 Effects of decoloring temperature on decoloration Fig.6 Effects of decoloring time on decoloration图7 果胶浸提液与乙醇体积比对脱色效果的影响Fig.7 Effects of volume ratio between pectin extracted and ethanol on decoloration从图6中可以看出,随着脱色时间的增加,脱色率逐渐增加,当脱色时间为20 min时,脱色效果最佳,脱色率可达到66%;随着脱色时间的继续增加,脱色效果无明显变化.因此,试验选择脱色时间为20 min.杨琼琼等[24]选择大孔树脂S-8进行脱色,脱色时间为60 min,脱色率达到81%;韩瑞等[25]选择XDA-7树脂进行脱色,脱色时间为630 min,脱色率达到36.17%.从图7中可以看出,当果胶浸提液与乙醇体积逐渐增大时,果胶得率也随之增大;当果胶浸提液与乙醇的体积比为5∶4时,果胶得率达到最大,为11.5%;当果胶浸提液与乙醇体积比继续增大时,果胶得率无明显差异.因此,试验选择最适果胶浸提液与乙醇的体积比为5∶4.3 结论本试验以果胶得率为指标,考察了浸提温度、浸提时间、浸提液pH及液料比对平和蜜柚皮中果胶浸提效果的影响,得到了柚皮果胶最佳浸提及脱色工艺.结果表明,柚皮果胶制备的工艺条件为:以柚皮为原料,按液料比20∶1加入pH为1.5的盐酸水溶液,于100 ℃的浸提温度下浸提90 min;在此工艺条件下进行试验,柚皮中果胶的得率为 19.9%.同时,本试验对果胶脱色的最佳脱色剂进行了选择,并考察其脱色条件.结果表明,按2%的添加量于果胶浸提液中添加珍珠岩作为脱色剂,于70 ℃的温度下脱色20 min可达到较好的脱色效果,脱色率达到66.4%.采用乙醇沉淀法获得果胶,当果胶浸提液与乙醇的体积比为5∶4时,果胶得率达到最大,为11.5%.参考文献:【相关文献】[1] 龚盛昭,陈秋基,曾海宇.柚皮中有效成分综合利用的途径[J]. 广州食品工业科技,2003,19(3):81-83.[2] KOUBALA B B,KANSCI G,MBOME L I,et al.Effect of extraction conditions on somephys icochemical characteristics of pectins from “Amelioree” and “Mango” mangopeels[J].Food Hydrocolloids,2007,7(7):1-7.[3] 石碧,狄莹.植物多酚[M].北京:科学出版社,2000.[4] BABSKY N E,TORIBIUIO J L,LOSANO J E.Influence of storageon the composition of clarified apple juice on concentrate[J].Journal of Food Science,1986(3):564-567.[5] 李百健,吴超,邵京.柑橘皮果胶的制备及其脱色工艺[J].湖北农业科学,2013,52(23):5816-5820.[6] 毕双同.赣南脐橙皮果胶的提取工艺及其性质研究[D].南昌:南昌大学,2008.[7] LIEW S Q,CHIN N L,YUSOF Y A,et parison of acidic and enzymatic pectin extraction from passion fruit peels and its gel properties[J].Journal of Food Process Engineering,2015,39(5):501-511.[8] 陈发河,吴光斌,陈旭.琯溪蜜柚果皮中果胶提取工艺优化研究[J].食品科学,2006,27(11):387-391.[9] 刘义武,王碧.柠檬皮中果胶提取工艺研究[J].内江师范学院学报,2011,26(10):14-17.[10] SEIXAS F L,FUKUDA D L,TURBIANI F R B,et al. Extraction of pectin from passion fruit peel (Passiflora edulis, f. flavicarpa) by microwave-induced heating[J].Food Hydrocolloids,2014,38(38):186-192.[11] CHAN S Y,CHOO W S.Effect of extraction conditions on the yield and chemical properties of pectin from cocoa husks[J].Food Chemistry,2013,141(4):3752-3758.[12] VRIESMANN L C,TEOFILO R F.Extraction and characterization of pectin from cacao pod husks (Theobroma cacao,L.)with citric acid[J].LWT-Food Science and Technology,2012,49(1):108-116.[13] 台建祥,范鸿雁,薛慧,等.菠萝蜜果皮果胶提取工艺的优化[J].食品科技,2014(1):236-239.[14] 应姗姗.火龙果皮中果胶提取及改性研究[D].杭州:浙江大学,2014.[15] WANG X,CHEN Q,XIN L.Pectin extracted from apple pomace and citrus peel by subcritical water[J].Food Hydrocolloids,2014,38(3):129-137.[16] LEFSIH K,GIACOMAZZA D,DAHMOUNE F,et al.Pectin from Opuntia ficusindica:optimization of microwave-assisted extraction and preliminary characterization[J].Food Chemistry,2016,221:91.[17] 王乐.厚皮蜜瓜果胶提取工艺优化的研究[D].呼和浩特:内蒙古农业大学,2014.[18] 于海莲,张利.梨渣中果胶的提取工艺[J].食品研究与开发,2010,31(9):105-106.[19] CHAN S Y,CHOO W S.Effect of extraction conditions on the yield and chemical properties of pectin from cocoa husks[J].Food Chemistry,2013,141(4):3752-3758.[20] 苏东林,李高阳,刘伟,等.柑橘果胶液的脱色与浓缩纯化工艺优化研究[J].中国食品学报,2011,11(4):108-114.[21] 曹霞敏,周林燕,吴继红,等.微波辅助提取中pH值与脱色对苹果果胶的影响[J].农业工程学报,2010,26(S2):410-415.[22] 王冬妮,陈熠,熊海蓉,等.野生火棘果中果胶的提取及脱色研究[J].中国食品学报,2010,10(3):175-179.[23] 吴国利.甜菜粕果胶树脂脱色工艺及不同分子量脱色果胶的特性研究[D].广州:华南理工大学,2013.[24] 杨琼琼,凌敏,刘桃李.蚕沙中果胶的提取及脱色工艺优化[J].食品工业科技,2013,34(23):215-218.[25] 韩瑞,邓红,周文珊,等.苹果渣果胶树脂吸附静态与动态脱色工艺研究[J].食品工业科技,2010,31(6):254-258.。

柚子皮中提取果胶的研究海洋学院陈苏1363401481.实验原理果胶具有一定水溶性,不溶于乙醇及其他有机溶剂。
果胶提取的方法目前主要是酸提取法、离子提取法、微生物法、微波辅助提取法和金属盐沉淀法。
本实验即用盐酸溶液浸泡柚子皮,使之水解,过滤,滤液蒸发浓缩,用乙醇进行沉淀,最后离心分离、烘干,即得产品。
2.仪器器材(1)原料:新鲜柚子皮(2)药品:1mol/L盐酸、95%乙醇(3)仪器:天平、剪刀、电加热套,恒温水浴锅,真空抽滤装置、离心沉淀机、干燥箱以及实验室一些常规的玻璃容器3.称取30g柚子皮用清水清洗,再用剪刀将柚子皮切成1x1cm大小的颗粒,洗干净后将柚子皮放入一个500ml的烧杯中,加入150ml水,在60℃的恒温水浴锅中浸泡30分钟后,将柚子皮取出用大量的水漂洗,初步除去果皮中的芳香物质、糖分、苦味物质以及色素等一些非胶体物质。
(2)水解萃取往经上述处理的柚子皮中加入跟柚子皮量相当的3倍蒸馏水,而后用浓度为1mol/L的稀盐酸溶液调节溶液的酸度至pH=2,将烧杯放入90℃的恒温水浴锅中,使得混合溶液保持微沸状态,持续时间大概为50~60分钟至水解完毕为止,在此过程需注意要不时搅拌。
将水解完全的柚子皮及溶液倒入布袋内压榨除去大部分残渣,再将液体转入布氏漏斗,用真空泵进行抽滤,进一步除去残渣。
所得滤液用烧杯装好,置于80℃恒温水浴锅中蒸发浓缩溶液至半后取出冷至室温。
(3)沉淀果胶往上述浓缩液中加入与浓缩体积相等的95%的乙醇,加入的同时进行搅拌,而后静置10分钟左右,让果胶沉淀完全。
等果胶完全后所得的混合溶液用真空泵进行抽滤,沉淀少量的无水乙醇洗涤1~2分钟。
洗涤过后的果胶还含较多水分,这时候可将所得的果胶进行快速离心分离,就可得到含税较少的淡黄色果胶。
将果胶放入干燥箱,调温至50℃左右烘干,即得果胶成品。
(4)干燥果胶4.优化实验及结果按上述步骤,取3份30g左右柚子皮放入烧杯,标记为A、B、C组,改变其水解的pH5.影响实验的因素(1)处理原料时,柚子皮的形貌大小直接影响到提取果胶的产率问题,经过实验证实,柚子皮的形貌越小,提过的果胶的产率越高,我们分析原因可能是颗粒越小,果胶与嗯呢个充分的与盐酸接触,相应的提取产率就会增大。
柚子皮中果胶的提取工艺研究
张秀芳;王克冰;贺文英;闫晓霖;孙芳;朱健
【期刊名称】《内蒙古农业大学学报:自然科学版》
【年(卷),期】2012(33)2
【摘要】本文采用酸提取乙醇沉淀法从柚皮中提取果胶,分别对水料比、pH值、提取温度、提取时间、乙醇浓度等因素进行了单因素试验,研究这几个因素对果胶提取效果的影响,通过对结果的分析确定酸提取果胶的最佳工艺条件为水料比20∶1,酸度控制在pH值2.0,温度控制在80℃,提取果胶时间为75min,用粉末状的活性炭进行脱色,乙醇浓度为95%。
实验结果表明:设计的优化工艺条件生产果胶是可行的,果胶质量是符合要求的,其产率也是理想的。
【总页数】4页(P245-248)
【关键词】柚皮;果胶提取;乙醇沉淀法
【作者】张秀芳;王克冰;贺文英;闫晓霖;孙芳;朱健
【作者单位】内蒙古农业大学理学院
【正文语种】中文
【中图分类】TQ432.71
【相关文献】
1.微波-超声波辅助酸法提取柚子皮中果胶的工艺研究 [J], 王鑫
2.微波法提取柚子皮中果胶的工艺研究 [J], 李勇慧;于向利;周露
3.微波协同提取柚子皮中果胶的工艺研究 [J], 白永庆;张璐;易均辉
4.微波-超声波辅助酸法提取柚子皮中果胶的工艺研究 [J], 王鑫;
5.酶法协同超声波辅助酸法提取柚子皮中果胶工艺条件优化 [J], 刘媛洁; 张良; 胡欢平; 严美婷
因版权原因,仅展示原文概要,查看原文内容请购买。
第3期王福海:柚子皮中果胶的提取研究·27·第31 卷第3 期萍乡高等专科学校学报2014 年6 月Vol.31 NO.3 Journal of Pingxiang College June.2014柚子皮中果胶的提取研究王福海(内江师范学院化学化工学院,四川内江641112)摘要:用单因素和正交实验探讨乙醇沉淀法对提取柚皮中果胶的工艺条件。
考察了酸度、温度、时间及料液比对果胶提取率的影响。
实验结果表明:PH 为2.0,温度为85℃,液料比为1:20,时间为80min 的条件下提取效果最佳。
果胶提取率可达到15.9%。
关键词:柚皮;乙醇沉淀;果胶中图分类号:N33 文献标识码:A 文章编号:1007-9149(2014)03-0028-05前言果胶是一种天然高分子聚合物,[1]其基本结构为D-毗喃半乳糖[2],具有无色无味、无固定熔点和溶解度以及不溶于乙醇等有机溶剂,但溶于热水,微溶于冷水等性质,[3-5]广泛存在于植物及水果的细胞壁中。
[6,7]因为其结构关系,果胶具有凝胶、乳化和稳定等作用,[8-10]其生理作用广泛,不仅对降低胆固醇和血糖、治疗心血管疾病有作用,且还可做抗癌药物和重金属的解毒剂,[1]同时因为其具有低糖、低热量等优点,所以还是重要的食品添加剂,[11]不仅如此,果胶还在化妆品、纺织、印染、治金、烟草等行业领域的应用具有广阔的前景。
[12-14]果胶因其广泛的应用使其需求量很大,全世界果胶的年需求量达到2 万吨,其中中国每年消耗的果胶就高达2000 多吨,但是其中80%都要依靠进口来满足国内需求,随着化妆品、纺织、保健品和药物的发展,我国果胶的需求量以5%的年增长量持续增大[15,16]。
我国的柚子资源丰富,柚子的使用量很大,但是其使用后的大量废弃柚皮却大多数被扔掉,即浪费了大量资源,又对环境造成了一定的污染,没有对柚皮进行很好的综合利用。
柚皮中的果胶含量较多,所以现对于从废弃柚皮中提取果胶的研究是很有必要的,这样既可以对提高柚皮的综合利用率,还可以为我国急需的果胶市场提供更多的果胶产品。
用柚子皮提取果胶的工艺优化研究柚子皮是柚子果实的外皮,含有丰富的果胶。
果胶是一种多糖类物质,具有良好的结胶性和凝胶性,广泛应用于食品、药品、化妆品等领域。
因此,提取柚子皮中的果胶具有重要的研究价值和应用前景。
果胶的提取工艺优化研究是指通过合理的实验设计和参数调控,提高果胶的提取率和质量,从而实现对柚子皮中果胶的高效提取。
下面将从柚子皮的预处理、提取工艺和优化方法等方面进行详细阐述。
柚子皮的预处理对果胶的提取影响较大。
柚子皮应先进行清洗和晾干处理,以去除表面的污物和水分,避免对果胶提取过程的干扰。
此外,对柚子皮进行粉碎处理可增加果胶的提取面积,有利于果胶的释放和溶解。
提取工艺是影响果胶提取效果的关键因素之一。
传统的果胶提取方法通常采用酸法和碱法。
酸法是指将柚子皮粉末与酸性溶液反应,使果胶与酸发生酯化反应,从而得到果胶酯。
碱法则是将柚子皮粉末与碱性溶液反应,使果胶与碱发生酯化反应,得到果胶酯。
然后,通过酸或碱的中和反应,使果胶酯转化为果胶。
这两种方法各有优缺点,需要根据具体情况选择合适的提取方法。
优化方法是提高果胶提取效率和质量的重要途径。
常见的优化方法有改变提取温度、提取时间、酸碱浓度、料液比等参数,以及使用辅助酶解剂或超声波辅助提取等技术手段。
通过合理调节这些参数和方法,可以最大限度地提高果胶的提取率和质量。
柚子皮中果胶的提取工艺优化研究具有重要的意义。
通过合理的预处理、选择适当的提取工艺和优化方法,可以提高果胶的提取效率和质量,为柚子皮的资源化利用提供技术支撑和理论指导。
相信在未来的研究中,我们可以进一步完善果胶提取工艺,提高果胶的利用价值,推动柚子皮产业的发展。