九年级化学原子的构成[人教版]
- 格式:pdf
- 大小:1.99 MB
- 文档页数:15

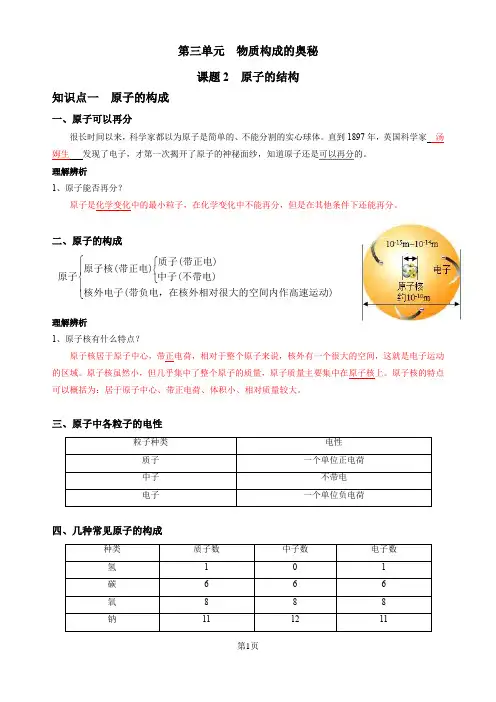
第三单元 物质构成的奥秘课题2 原子的结构知识点一 原子的构成一、原子可以再分很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。
直到1897年,英国科学家 汤姆生 发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
理解辨析1、原子能否再分?原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
二、原子的构成⎧⎧⎨⎪⎨⎩⎪⎩质子(带正电)原子核(带正电)原子中子(不带电)核外电子(带负电,在核外相对很大的空间内作高速运动)理解辨析1、原子核有什么特点?原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就是电子运动的区域。
原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原子核上。
原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
三、原子中各粒子的电性四、几种常见原子的构成理解辨析1、原子一定是由质子、中子、核外电子构成的吗?原子一般由质子、中子、电子这三种粒子构成,但某种氢原子中只有一个质子和一个核外电子,无中子。
五、原子中各种粒子之间的关系1、原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原子不显电性。
2、在原子中,核电荷数=质子数=核外电子数。
3、不同种类的原子,核内质子数不相等。
例题1、下列关于原子的叙述,正确的是( C)A.原子是不能再分的粒子B.一切原子的原子核都是由质子和中子构成的C.原子核内质子数等于核外电子数D.原子核内质子数必等于中子数例题2、有关原子带电情况的解释正确的是(B)A.原子中质子带浮负电,电子带正电B.原子核带正电C.电子不带电D.电子和中子电荷中和使得原子不带电例题3、在分子、原子、质子、中子、电子、原子核这些粒子中选择填空:(1)能保持物质化学性质的粒子是分子;(2)化学变化中的最小微粒是原子;(3)能直接构成物质的粒子是分子、原子;(4)构成原子核的粒子是质子、中子;(5)带正电的粒子是质子、原子核;(6)带负电的粒子是电子;(7)不带电的粒子是中子;(8)质量与氢-1原子质量近似相等的粒子是质子、中子;(9)质量最小的的是电子;(10)在同一原子中数目相等的是质子、电子。
![新人教版九年级上册化学[原子的结构 知识点整理及重点题型梳理]](https://uimg.taocdn.com/171838451711cc7931b7164f.webp)
新人教版九年级上册初中化学重难点有效突破知识点梳理及重点题型巩固练习原子的结构【学习目标】1.了解原子是由质子、中子和电子构成的;知道不同种类原子的区别。
2.初步了解相对原子质量的概念,并能利用相对原子质量进行简单的计算。
3.记住两个等量关系:核电荷数=质子数=核外电子数;相对原子质量≈质子数+中子数。
【要点梳理】要点一、原子的构成(《原子的构成》)1.原子是由下列粒子构成的:原子由原子核和核外电子(带负电荷)构成,原子核由质子(带正电荷)以及中子(不带电)构成,但并不是所有的原子都是由这三种粒子构成的。
例如:普通的氢原子核内没有中子。
2.原子中的等量关系:核电荷数=质子数=核外电子数在原子中,原子核所带的正电荷数(核电荷数)就是质子所带的电荷数(中子不带电),每个质子带1个单位正电荷,每个电子带一个单位负电荷,原子整体是呈电中性的粒子。
3.原子内部结构揭秘—散射实验(如下图所示):1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔时,发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来。
实验结论:(1)原子核体积很小,原子内部有很大空间,所以大多数α粒子能穿透金箔;(2)原子核带正电,α粒子途经原子核附近时,受到斥力而改变了运动方向;(3)金原子核的质量比α粒子大得多,当α粒子碰到体积很小的金原子核被弹了回来。
【要点诠释】1.原子是由居于原子中心带正电的原子核和核外带负电的电子构成,原子核又是由质子和中子构成,质子带正电,中子不带电;原子核所带正电荷(核电荷数)和核外电子所带负电荷相等,但电性相反,所以整个原子不显电性。
2.区分原子的种类,依据的是原子的质子数(核电荷数),因为不同种类的原子,核内的质子数不同。
要点二、相对原子质量1.概念:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量(符号为Ar)。

课题2 原子结构第1课时 原子的构成 相对原子质量【基础 主干落实】 一、原子的构成 1.原子的构成特别提醒 并不是所有原子的原子核中都有中子,如普通氢原子的原子核中没有中子。
2.核电荷数与构成原子的粒子数目之间的关系: 在原子中,核电荷数= 质子 数= 核外电子 数。
3.原子的电性:原子核内质子所带正电荷总数 等于 核外电子所带负电荷总数,中子不带电,故原子不显电性。
二、相对原子质量1.定义:以一种碳原子(碳-12)质量的112为标准,其他原子的质量与它相比,作为这种原子的相对原子质量,符号为A r 。
2.表达式:相对原子质量(A r )=一个原子的实际质量一种碳原子质量×1123.近似计算:相对原子质量≈ 质子 数+ 中子 数。
特别提醒 相对原子质量是一个比值,单位是“1”,一般省略不写。
【漫画助学】原子核内的质子数不同,原子的种类不同。
【交流讨论】“原子核内的质子数一定等于中子数”,这种说法是否正确?提示:不正确,原子核内的质子数不一定等于中子数,如钠原子质子数为11,中子数为12。
【妙法指引】①相对原子质量不是原子的实际质量,但原子的实际质量越大,其相对原子质量越大;②不同种原子的实际质量之比等于它们的相对原子质量之比。
【重点案例探析】考点原子的构成【典题】(2023秋·邯郸丛台区期末)如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子。
下列说法正确的是(D)A.原子中a的质量和c的质量相同B.原子中b与c的数目和等于原子质量C.原子中b与c的数目一定相同D.原子的质量主要集中在微粒b和c上方法点拨构成原子的各粒子之间的关系(1)数量关系:核电荷数=质子数=核外电子数(与中子数无关)。
(2)质量关系:组成原子核的质子和中子的质量相差不大,都比电子质量大得多,原子的质量主要集中在原子核上。
(3)体积关系:原子核居于原子中心,在原子中占的体积很小。



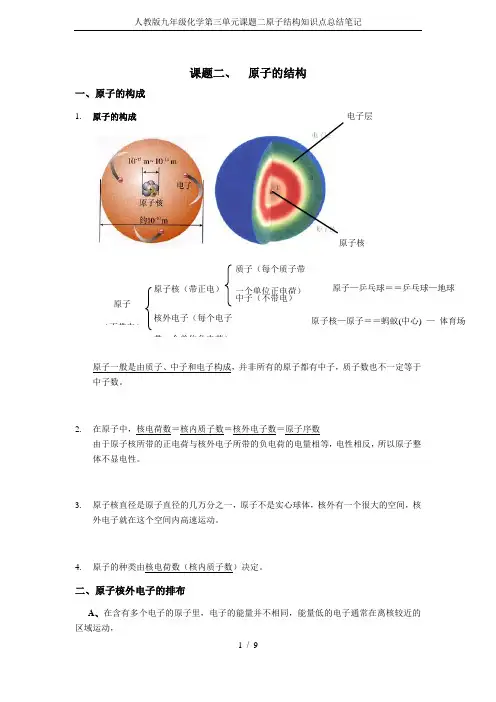
课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。



课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。
课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。
人教版初三化学上册原子的结构知识点原子的中心是一些带正电的粒子,外围是一些绕转着的电子,下面是查字典化学网整理的原子的结构知识点,希望对大家有帮助。
知识点一、原子的构成1. 原子的构成原子由原子核和电子构成,原子核由质子和中子构成。
2. 每个质子带一个单位正电荷,每一个电子带一个单位负电荷,中子不带电。
原子核所带的正电荷数为核电荷数。
电子的质量很小,可忽略不计,原子的质量主要集中在原子核上。
3. 构成原子的粒子一般是质子、中子、电子。
构成原子的必要粒子是质子和电子,决定原子种类的是质子。
4. 原子核所带正电荷数(核电荷数)和核外电子所带负电荷数相等,但电性相反,所以整个原子不显电性。
5. 在原子中核电荷数=质子数=电子数,原子核内质子数不一定等于中子数。
二、相对原子量国际上以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子量(Ar)。
注意:相对原子量只是一个比,不是原子的实际质量。
相对原子量的计算公式:电子的质量很小,跟质子和中子相比可以忽略不计,所以Ar≈质子数+中子数课后练习1.(2021年福州质检)11H、12H、13H、H+、H2是()A.氢的五种同位素B.五种氢元素C.氢的五种核素D.氢元素的五种不同粒子2.下列有关钋(210 84Po)的说法正确的是()A.钋原子的核外电子数是126B.钋原子核内中子数与质子数之差是42C.钋是金属元素,最外层电子数小于4D.钋元素的相对原子质量是2103.四种主族元素的离子aXm+、bYn+、cZn-和d Rm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是 ()①a-b=n-m ②元素的原子序数a>b>c>d③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>YA.②③B.③C.①②③④D.①②③4.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是()A.质子数c>dB.离子的还原性Y2->Z-C.气态氢化物的稳定性H2Y>HZD.原子半径X5.假设R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为x,则W g Rm-离子所含中子的物质的量为() A.(A-x+m)mol B.(A-x-m)mol C.WA(A-x+m)molD.WA(A-x-m)mol6.短周期元素X、Y的原子序数相差7,下列有关判断错误的是()A.X和Y可能处于同一周期B.X和Y可能处于相邻周期C.X和Y可能处于同一主族D.X和Y可能处于相邻主族7.下列关于元素周期表的叙述,不正确的是()A.共有7个周期,16个族B.形成化合物种类最多的元素在第二周期C.第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族D.某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n 8. (20XX?嘉兴模拟)下列有关物质性质的比较中,正确的是 ()①热稳定性:CH4>NH3>H2O ②还原性:I->Br->Cl- ③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>OA.①③B.②④C.①④D.②③可以更好的学习。