促甲状腺激素(TSH)测定试剂盒(电化学发光免疫分析法)产品技术要求lianzhongtaike
- 格式:docx
- 大小:33.80 KB
- 文档页数:2

促甲状腺激素(TSH)质控品
组成:
促甲状腺激素(TSH)质控品由高、低两水平质控品组成,基质液为含添加0.1%生物防腐剂的P.B缓冲液。
注:质控品质控范围批特异、具体浓度详见标签。
适用范围:促甲状腺激素(TSH)质控品与本公司生产的促甲状腺激素(TSH)测定试剂盒(磁微粒化学发光法)配套使用,用于促甲状腺激素(TSH)测定项目的室内质量控制。
2.1 外观
质控品包装标签应清晰,无磨损;呈澄清透明的液体,无沉淀或絮状物,液体无渗漏。
2.2 装量
质控品装量不少于标示量。
2.3 预期结果
测定高值、低值浓度质控品,其结果均应在质控范围内。
2.4 均匀性
2.4.1 瓶内均匀性
取同批号的一定数量(n≥10)最小包装单元的高、低值质控品,分别重复检测3次,变异系数(CV)应不高于10.0%。
2.4.2 瓶间均匀性
变异系数(CV)应不高于15.0%。
2.5 稳定性
2.5.1 开瓶稳定性
质控品开瓶后,2℃~8℃储存,有效期15天,稳定期末质控品与新开瓶质控品检测结果的差异不显著。
2.5.2 效期稳定性
质控品原包装2℃~8℃储存,有效期12个月,效期后两个月内检测2.3项,其结果应符合要求。

Roche E2010检测系统测定促甲状腺激素(TSH)分析灵敏度与功能灵敏度的验证杜彦丹;孙刚;孙辉;吴平平【摘要】目的:对Roche E2010检测系统测定促甲状腺激素(TSH)项目的检测低限、功能灵敏度进行验证.方法:对空白样品进行连续10 d重复性实验,验证TSH检测低限;制备系列低浓度的TSH样品,验证其功能灵敏度.结果:RocheE2010检测系统测定TSH的最低检测限为0.007 mIU/L,与Roche厂家产品说明书声称有差异,其最低检测限为0.005 mIU/L;功能灵敏度验证值为0.010 mIU/L,与Roche厂家产品说明书声称有差异(0.014 mIU/L).结论:实验室必须验证和建立本实验室条件的功能灵敏度,为甲状腺患者提供准确可靠的促甲状腺激素(TSH)低值结果.【期刊名称】《内蒙古医学杂志》【年(卷),期】2010(042)005【总页数】3页(P568-570)【关键词】促甲状腺激素(TSH);检测低限;功能灵敏度【作者】杜彦丹;孙刚;孙辉;吴平平【作者单位】内蒙古林业总医院检验科,内蒙古,牙克石,022150;内蒙古林业总医院检验科,内蒙古,牙克石,022150;内蒙古林业总医院检验科,内蒙古,牙克石,022150;内蒙古林业总医院检验科,内蒙古,牙克石,022150【正文语种】中文【中图分类】R335.2;R446.11甲状腺疾病是目前内分泌疾病中最常见的一类,甲状腺功能检测的结果是临床诊断与鉴别诊断的重要依据。
促甲状腺激素(TSH)是诊断亚临床甲亢和甲减、临床甲亢和原发性甲减首选指标,根据TSH的检测结果是否异常,再检测游离甲状腺素对甲状腺疾病鉴别诊断。
亚临床甲亢是一种常见的甲状腺疾病,以外周血中TSH降低而甲状腺激素正常为基本特征,第三代TSH测定以免疫化学发光法(ICMA)为代表,灵敏度为 0.01~0.02 m IU/L。
基本可以取代TRH兴奋试验和T3抑制试验[1]。

总甲状腺素(TT4)测定试剂盒(化学发光免疫分析
法)
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;R1 组分应为棕色含固体微粒的液体,无板结、无絮状物。
R2 和R3 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
其中R1≥5.6mL,R2≥6.0mL,R3≥6.0mL。
2.3准确性
用T4 国家标准品配制成与试剂盒对应校准品定标曲线中相应的5 个浓度点进行分析测定,用双对数或其他适当的数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t 检验);以T4 国家标准曲线为对照,试剂盒定标曲线校准品的实测值与标示值的效价比在0.900~1.100 之间。
2.4最低检出限
最低检出限应不大于0.5 μg/dL。
2.5线性
试剂盒在0.5-24 μg/dL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 8%。
2.7批间差
变异系数CV 应≤ 15%。
2.8特异性
浓度不低于500ng/mL 的TT3,检测结果应不高于15.0ng/mL。
浓度不低于50ng/mL 的rT3,检测结果应不高于最低检出限。

1.性能指标
1.1外观检查
外观应平整,材料附着应牢固,各组分应齐全、完整,标签清晰,卡固定紧密,液体无渗漏。
1.2物理检查
膜条宽为 4.0±0.5mm ;液体移行速度应不低于10mm/min。
1.3准确性
对于没有配备系列校准品的试剂盒,可在试剂盒规定的测量范围内检测国家标准品,其实测值与理论值之比应在0.850~1.150 之间。
1.4最低检出限
应不高于0.1 mIU/L。
1.5剂量-反应曲线的线性
在(0.1~100)mIU/L 区间内,用双对数或其他适当的数学模型拟合,剂量- 反应曲线线性相关系数(r)应不小于0.9900。
1.6精密度
1.6.1分析内精密度
手工操作试剂盒参考品测定结果的变异系数(CV)应不大于15%。
1.6.2批间精密度
在多个不同批次产品之间,参考品测定结果的变异系数(CV)应不大于20%。
1.7特异性
1.7.1与促卵泡生成素(FSH)
浓度不低于200mIU/mL 的FSH,在本试剂盒上的测量结果应不高于本试剂盒的最低检出量水平。
1.7.2与促黄体生成素(LH)
浓度不低于200mIU/mL 的LH,在本试剂盒上的测量结果应不高于本试剂盒的最低检出量水平。
1.7.3与人绒毛膜促性腺激素(hCG)
浓度不低于1000mIU/mL 的hCG,在本试剂盒上的测量结果应不高于本试剂盒的最低检出量水平。
1.8分析间精密度
在 3 次独立分析之间,参考品测定结果的变异系数(CV)应不大于20%。

促甲状腺素(TSH)免疫测定用国家标准品使用说明书
1.促甲状腺素(TSH)免疫测定用国家标准品(批号:150530-0312)是以人垂体源TSH 为原料制备,供TSH免疫分析使用。
2.本标准品为冻干品,每支安瓿内含TSH约0.333μg,人血清白蛋白(HAS)10mg,磷酸盐微量。
3.以TSH国际标准品(80/558)为对照品,经协作标定,本标准品每支安瓿内免疫活性为600μIU。
4.使用时应以一定量含蛋白的磷酸盐缓冲液(PH=7.2-7.4)或其他含蛋白的中性缓冲体系将内容物完全溶解,充分混合后使用。
5.本标准品长期保存应在-20℃以下;复融后如需多次使用可分装小瓶。
密封,-20℃保存,避免反复冻融。
中国药品生物制品检定所
2003.12。
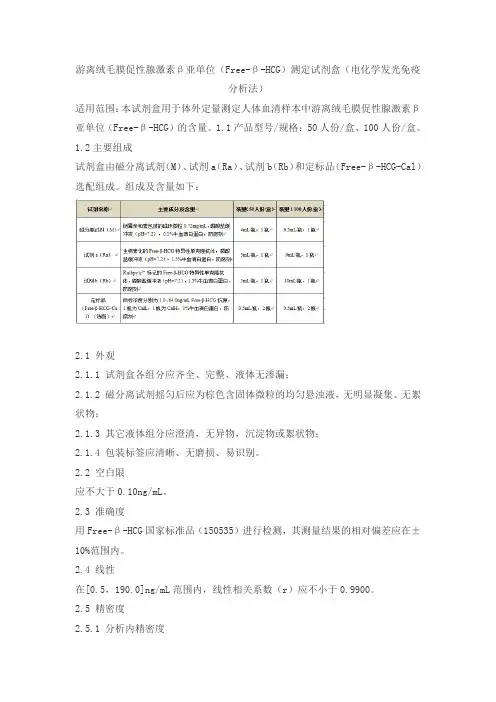
游离绒毛膜促性腺激素β亚单位(Free-β-HCG)测定试剂盒(电化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人体血清样本中游离绒毛膜促性腺激素β亚单位(Free-β-HCG)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(Free-β-HCG-Cal)选配组成。
组成及含量如下:2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.10ng/mL。
2.3 准确度用Free-β-HCG国家标准品(150535)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性在[0.5,190.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(10.0±2.0ng/mL)和(30.0±6.0ng/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(10.0±2.0ng/mL)和(30.0±6.0ng/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 特异性2.6.1 与促甲状腺激素(TSH)浓度不低于200μIU/mL促甲状腺激素(TSH)样品,在本试剂盒测定结果应不大于1.25ng/mL;2.6.2 与促黄体生成素(LH)浓度不低于200mIU/mL促黄体生成素(LH)样品,在本试剂盒测定结果应不大于1.25ng/mL;2.6.3 与促卵泡生成素(FSH)浓度不低于200mIU/mL促卵泡生成素(FSH)样品,在本试剂盒测定结果应不大于1.25ng/mL;2.6.4 与人绒毛促性腺激素(HCG)浓度不低于1000mIU/mL人绒毛膜促性腺激素(HCG)样品,在本试剂盒测定结果应不大于2.50ng/mL。

【产品名称】通用名称:甲状腺球蛋白检测试剂盒(电化学发光法)英文名称:Tg II【包装规格】100测试/盒【预期用途】主要用途用于体外定量测定人血清和血浆的甲状腺球蛋白含量。
Tg的测定能辅助监控甲状腺切除术后的情况。
Elecsys和cobas e 免疫分析仪的工作原理是电化学发光免疫分析“ECLIA”。
临床应用甲状腺球蛋白是一种分子量接近660 kDa的糖蛋白。
4Tg由甲状腺细胞大量合成并释放到甲状腺滤泡腔内。
TSH、甲状腺内碘缺乏、促甲状腺激素免疫球蛋白均可刺激Tg的生成。
Tg对外周甲状腺激素T3和T4的合成起决定作用。
它含有约130种酪氨酸残基,其中一部分在TPO(甲状腺过氧化物酶)和碘化物存在时被碘化为单碘-和二碘酪氨酸(MIT和DIT)。
3随后也是在Tg和TPO的作用下,MIT和DIT偶联结合成T3和T4。
5甲状腺细胞合成Tg以及将Tg转送到滤泡的过程中,少量蛋白可进入血流。
因此无甲状腺疾病的健康个体中也能检出低浓度Tg。
Tg浓度升高在不同的甲状腺疾病中均有报道,桥本氏病、葛瑞夫兹病等。
Tg还有助于鉴别亚急性甲状腺炎和人为甲状腺毒症。
对于先天性甲状腺功能减退症Tg的检测可用于鉴别先天性甲状腺缺失和甲状腺发育不全或其它病理情况。
5,6,7Tg检测主要用于甲状腺全切或次全切术后病人的随访。
由于甲状腺是Tg的唯一已知来源,在甲状腺全切或次全切伴随放射性碘成功消融残留甲状腺组织后,血清Tg浓度将降至极低,甚至检测不到。
对于部分甲状腺切除的病人,检测到的Tg水平取决于手术后残留的甲状腺组织的多少。
若甲状腺全切术后仍可检出Tg则提示DTC残留或复发。
因此Tg明显升高常提示该疾病复发。
8,9,10,11,12,13采用高灵敏度Tg检测后,“甲状腺球蛋白阳性”病人数量增加,即使这些病人并未表现出疾病症状。
13不能认为这些病人没有疾病,应根据当前指南进行监测随访。
已有不同临界值报道用以鉴别仅需监测的病人和那些需要接受进一步诊断和治疗的复发病人。


促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)1.性能指标1.1试剂条性能指标1.1.1外观试剂盒各组分应齐全、完整,液体无渗漏,包装标签应清晰、准确、牢固;试剂条中第7孔内组分应为棕色含固体微粒的液体或含棕色固体沉淀的透明液体;第12孔内化学发光底物应为无色或淡绿色液体;其余皆应为无色透明液体,无悬浮物、无沉淀、无絮状物。
1.1.2空白限应不大于0.005μIU/mL。
1.1.3准确度1.1.3.1在试剂盒规定的线性区间内,检测促甲状腺素国家标准品,测定结果的相对偏差应在±10%范围内。
1.1.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差应在±10%范围内。
1.1.4线性区间试剂盒在0.02μIU/mL~100μIU/mL区间内,其线性相关系数(r)应不小于0.9900。
1.1.5分析内精密度变异系数(CV)应不大于8.0%。
1.1.6批间精密度变异系数(CV)应不大于15.0%。
1.1.7特异性a)含浓度不低于200mIU/mL的FSH的零浓度TSH样本,检测结果应不高于0.005μIU/mL;b)含浓度不低于200mIU/mL的LH的零浓度TSH样本,检测结果应不高于0.005μIU/mL;c)含浓度不低于1000mIU/m L的HCG的零浓度TSH样本,检测结果应不高于0.005μIU/mL。
1.2校准品性能指标1.2.1外观校准品应为无色或浅黄色透明液体。
1.2.2装量装量偏差应在±10%之内。
1.2.3准确度Cal1、Cal2实测值与标示值的偏差应在±10%以内。
1.2.4均一性对同一瓶校准品1、校准品2分别重复10次检测,对同一批次10瓶校准品1、校准品2进行检测,检测校准品1、校准品2瓶内差CV应≤10%,批内瓶间差CV应≤10%。
1.3质控品性能指标1.3.1外观质控品应为无色或浅黄色透明液体。

化学发光微粒子免疫法与电化学发光法测定促甲状腺激素的性能比较目的:比较化学发光微粒子免疫法(CMIA)与电化学发光法(ECLINA)测定血清促甲状腺激素的性能。
方法:每天选取临床样本8份,包括门诊与住院患者,排除溶血、脂血及用药情况。
分别用CMIA与ECLINA测定样本促甲状腺激素含量,连续测定7 d,记录检验结果。
去除离群点,以电化学发光法为对比方法作为X轴,化学发光微粒子法为实验方法为Y轴,计算化学发光微粒子免疫法与电化学发光法的线性方程和相关系数,进行偏差评估。
结果:CMIA与ECLINA测定促甲状腺激素的线性回归方程为Y=0.7863X+0.0632,相关系数r2=0.9946,两种检测方法的测定值之间存在着高度相关关系(P<0.01)。
两种实验方法均存在随着结果增高偏差增大现象,但均能满足临床要求。
结论:ARCHITEC和ECLINA具有高度相关性,可以建立相关方程,在某一方法不能满足实验室而参考值又不能变换时可以用另一方法代替。
促甲状腺激素(Thyroid stimulating hormone,TSH)是由腺垂体嗜碱性细胞分泌的一种糖蛋白类激素,是判断下丘脑-垂体-甲状腺轴功能的首选指标,是诊断甲状腺疾病重要的第一线指标[1-2]。
随着检验医学的发展,化学发光法测定血清TSH已成为甲状腺功能检查的常规手段。
然而不同的化学发光分析系统检测结果是否一致,是实验室需要探讨的重点。
因为在甲状腺疾病诊断中,促甲状腺激素的水平至关重要,特别对于亚临床患者,主要看促甲状腺激素水平。
因此,本文对血清TSH电化学发光免疫分析与化学发光微粒子免疫分析测定结果进行分析,系统地对两种不同方法进行对比分析及偏移评估,从而探讨不同检测系统间对同种测定项目的检测结果是否具有可比性,并为判断临床的可接受性提供依据,现报道如下。
1 材料与方法1.1 仪器与试剂电化学发光法所用仪器为罗氏CobasE602全自动电化学发光分析仪,所用试剂为德国罗氏试剂(批号:182942-01,规格:200测试/盒),质控品为德国罗氏免疫通用质控品(批号:177813-04),定标液为德国罗氏TSH 定标液(批号:180413-01);化学发光微粒子免疫法所用仪器为雅培I2000SR化学发光免疫分析仪,试剂为美国雅培试剂(批号:44904U100,规格:4×500测试/盒);TSH校准品为雅培试剂(批号:45240u100),质控为美国伯乐免疫分析用质控液(批号:40271 40273)1.2 样本采集遂宁市中心医院本部门诊及住院患者当日血清8份,连续采集7 d,共56份。

促甲状腺激素测定试剂盒产品技术要求北京美联泰科促甲状腺激素测定试剂盒(磁微粒化学发光法)是一种用来检测人体内促甲状腺激素水平的试剂盒。
在促甲状腺激素测定的过程中,该试剂盒采用磁微粒化学发光法,通过特定的试剂盒,可以快速、准确地检测出人体内促甲状腺激素的浓度。
根据国家相关标准和技术要求,促甲状腺激素测定试剂盒(磁微粒化学发光法)的产品技术要求包括以下几个方面:
1.试剂盒的稳定性要求:试剂盒必须具有较长的保存期限,并且在保存期间,其性能稳定性应能满足测量的需要。
2.试剂盒的灵敏度和特异性要求:试剂盒使用的抗体必须具有较高的灵敏性,能够检测出较低浓度的促甲状腺激素。
此外,试剂盒还应具有较高的特异性,确保只能检测出促甲状腺激素,而不受其他物质的干扰。
3.试剂盒的精确度和准确性要求:试剂盒的使用应具有较高的精确度和准确性,确保能够得到可靠的测量结果。
同时,试剂盒的成本控制也是一个考虑因素。
4.试剂盒的操作简便性要求:试剂盒的操作应简便易行,不需要复杂的专业技能,便于广泛应用于临床实验室。
5.试剂盒的安全性要求:试剂盒必须符合相关的安全标准和规定,确保操作人员的安全。
6.试剂盒的报告范围和结果解释要求:试剂盒显示的测量结果应具有合理的报告范围,且结果能够清楚地解释,并与实际情况相符。
除了上述技术要求外,促甲状腺激素测定试剂盒(磁微粒化学发光法)还需要符合国家食品药品监督管理部门的相关注册要求,包括质量控制要
求和生产工艺要求等。
同时,还需要进行相关的临床验证和评估,以确保
其在实际应用中的可靠性和准确性。
电化学发光和化学发光测TSH的方法学比较【摘要】目的探究分析电化学发光和化学发光测TSH的效果和临床应用价值。
方法选取130份血清标本(2020年5月—2021年5月于我院门诊接受诊疗的患者所提供)作为本次研究材料,再根据所选血清标本编号的数字奇偶性将其划分为对照组和观察组两组,每组均分到65份标本材料,均需对促甲状腺激素(TSH)的水平进行测定。
其中,对照组所在的所有血清标本均采用化学发光免疫法进行检测,而观察组所在的所有血清标本均采用电化学发光免疫法进行检测,连续检测1周,记录检测数据,对比两种不同检测方式的TSH检测效果。
结果(1)就精密度上来看,观察组所用检测方式的低、中、高批内和批间变异系数值(CV)均低于对照组,结果数据经对比显示(P<0.05)有统计学意义;(2)就准确度上来看,观察组所用检测方式的精准度显著高于对照组,结果数据经对比显示(P<0.05)有统计学意义。
结论电化学发光和化学发光测TSH都可以获得相应的检测结果,但就检测的精密性和准确度来看,电化学发光法更具优势,检测价值更高,可以考虑于后期进一步增强对该检测法的推广应用力度。
【关键字】TSH;促甲状腺激素;电化学发光免疫法;化学发光免疫法;检测效果促甲状腺激素(TSH)是腺垂体分泌的重要激素,其主要生理功能在于刺激甲状腺细胞的发育、合成和促进甲状腺激素分泌,是平衡甲状腺功能的重要因素。
因此,在临床中,TSH是检测评估患者甲状腺功能的重要指标之一。
诸多专家根据多年的研究发现,不同的检测方式对于TSH的检测作用不一样,得到的检测结果也具有差异,如何选择合适的检测方式是诊断与TSH水平变化相关疾病的关键[1]。
由此可见,研究出科学有效的TSH检测方式具有重要的临床意义。
笔者为研究电化学发光和化学发光测TSH的效果和临床应用价值,此次特从院中抽取130例患者提供的血清标本进行分组调研,相关分析报告如下。
1对象和方法1.1对象选取130份血清标本(2020年5月—2021年5月于我院门诊接受诊疗的患者所提供)作为本次研究材料,再根据所选血清标本编号的数字奇偶性将其划分为对照组和观察组两组,每组均分到65份标本材料,均需对促甲状腺激素(TSH)的水平进行测定。
2. 性能指标2.1 装量试剂盒各溶液最大允许负偏差为 6.0%。
2.2 外观试剂盒中校准品为无色或者淡黄色液体,其它液体组份试剂均为澄清透明;微孔反应板应封口良好,无破损。
2.3 灵敏度试剂盒的灵敏度应不高于0.25μIU/ml。
2.4 特异性用黄体生成素(hLH)250U/L 进行检测,测得表观hTSH 浓度不高于0.25μIU/ml。
用促卵泡激素(hFSH)250U/L 进行检测,测得表观hTSH 浓度不高于0.25μIU/ml。
用绒毛膜促性腺激素(hCG)10000U/L 进行检测,测得表观hTSH 浓度不高于0.25 μIU/ml。
2.5 线性相关系数试剂(盒)的线性范围(0.25 μIU/ml~324 μIU/ml)内的线性应符合如下要求:a)线性相关系数r≥0.990;b)检测浓度<100μIU/ml 的hTSH 时,线性的绝对偏差应在±10μIU/ml 范围内;检测浓度≥100μIU/ml 的hTSH 时,线性相对偏差不超过±20%。
2.6 测量准确度测定浓度为50μIU/ml(允许偏差为±20%)的hTSH 国家标准品,测定结果的相对偏差应在±10%范围内。
2.7 测量精密度2.7.1 批内不精密度试剂盒的批内不精密度(CV)应不超过15.0%;2.7.2 批间不精密度试剂盒的批间不精密度(CV)应不超过20.0%。
2.8 质控品测定值用三种不同浓度的质控品进行测定,测定结果应在允许范围内。
2.9 HOOK 效应检测浓度为2000μIU/ml 的hTSH 时,其荧光值仍高于324μIU/ml 校准品的荧光值。
促甲状腺素吖啶酯化学发光免疫分析方法的建立周齐洋;徐海伟【摘要】目的建立一种定量检测人血清促甲状腺素(TSH)的方法.方法根据双抗体夹心法实验原理,分别用吖啶酯和生物素标记两株不同的单克隆抗体,链霉亲和素包被微粒,通过链霉亲和素-生物素系统分离固相和液相完成检测.结果本方法的最低检测限为0.01 μIU/mL,线性范围0.3~60μIU/mL,批内变异为1.9%~2.3%,总变异为6.4%~8.6%,与ROCHE公司的促甲状腺素检测试剂盒(电化学发光法)比对,相关系数r=0.9935.结果本方法的各项指标均能满足临床检测的要求,可以临床推广应用.【期刊名称】《标记免疫分析与临床》【年(卷),期】2015(022)012【总页数】4页(P1283-1286)【关键词】促甲状腺素;化学发光;免疫定量分析【作者】周齐洋;徐海伟【作者单位】江苏省医疗器械检验所,江苏南京210012;苏州长光华医生物试剂有限公司,江苏苏州215163【正文语种】中文TSH的主要生理作用是调节甲状腺激素的合成与分泌,血液中甲状腺激素水平与腺垂体分泌TSH的量之间有负反馈抑制关系。
测定血清中TSH的浓度是判断甲状腺功能是否正常的首选指标,也是研究下丘脑-垂体-甲状腺轴反馈调节机制等的重要参数,临床上多用于甲状腺功能亢进(甲亢)和减退(甲减)的诊断、原发与继发性甲减的鉴别诊断、监测甲亢和甲减的疗效、亚临床甲亢的诊断、新生儿甲低的筛查以及垂体TSH瘤的实验室诊断等。
本文根据化学发光免疫定量分析法的原理,采用吖啶酯化学发光免疫分析技术,用双抗体夹心法建立了测定人血清中TSH含量的方法,并通过对标记抗体稀释度、加样量、反应时间等条件选择实验,对本方法的各项性能指标进行了分析,建立了参考范围。
现将实验结果报道如下。
材料与方法1 实验仪器和材料促甲状腺素单克隆抗体和抗原购自Fitzgerald公司,吖啶酯和生物素购自Sigma 公司,化学发光底物液及链霉亲和素包被的磁微粒由苏州长光华医生物试剂有限公司提供,其他试剂均为分析纯。
促甲状腺激素(TSH)检测方法小析作者:宋立军来源:《科技创新导报》2012年第19期摘要:促甲状腺激素(Thyroid stimulating hormone,thyrotropin,TSH)由脑垂体前叶的嗜碱性细胞分泌,以游离的形式存在于血液中,含量很低,性质稳定的一种糖蛋白激素。
主要生理功能是促进甲状腺的发育和分泌,从而影响全身的代谢。
鉴于TSH检测结果的重要临床意义,其检测方法有很多,主要有放射免疫分析,免疫放射分析等。
随着生物、化学以及材料等学科的发展,科学家们正在努力寻求更准确、更便捷、低成本的检测方法,为内分泌疾病的临床诊断提供快速、准确的数据。
关键词:促甲状腺激素(Thyroid stimulating hormone,thyrotropin,TSH) 放射免疫分析 TSH检测方法中图分类号:R446 文献标识码:A 文章编号:1674-098X(2012)07(a)-0004-03促甲状腺激素(Thyroid stimulating hormone,thyrotropin,TSH)由脑垂体前叶的嗜碱性细胞分泌,以游离的形式存在于血液中,含量很低,性质稳定的一种糖蛋白激素。
其相对分子量为25~28kDa。
与促卵泡刺激激素(follicle stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)以及人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)一样均为异源二聚体糖蛋白激素,由非特异的α亚基和特异性β亚基以非共价键联结而成[1,2]。
主要生理功能是促进甲状腺的发育和分泌,从而影响全身的代谢。
TSH是受下丘脑-脑垂体-甲状腺这一条轴线控制的,下丘脑是最高层,分泌的促甲状腺激素释放激素(Thyroid-stimulating hormone releasing hormone,TRH)而甲状腺是最底层,释放的是甲状腺素,脑垂体前叶居于中间,上受到下丘脑分泌的TRH调控,下有受到甲状腺分泌的甲状腺激素(T3,T4)的反馈调节。
罗氏Cobas8000 e602检测促甲状腺激素的性能验证张淑瑛;史伟峰【摘要】Objective To verify and evaluate the performance of thyroid stimulating hormone(TSH) by e602 Cobas8000 electrochemical luminescence immunoassay analyzer module.Methods According to the guideline from Clinical and Laboratory Standards Institute(CLSI), precision, accuracy, linear range, reference interval and the test results were verified between different Cobas8000 modules in the detection of TSH.Results The Intra-batch precision of the TSH were 1.9% and 1.3%, which were both less than 1/4 TEa(CLIA′88).Inter-batch precision were 2.2% and 1.5%, which were both less than 1/3 TEa(CLIA′88).The result of proficiency testing was 80%, and the accuracy was qualified.The linear range was 0.446~89.76μIU/mL, and the result w ere in accordance with the kit.In addition, the reference range is in line with the laboratory requirements, and the detection results were consistent between the two modules.ConclusionThe main performance of the Cobas8000 detection system meets the requirements of the relevant standards, which can satisfy the clinical requirements.%目的对Cobas8000 e602电化学发光免疫分析仪模块检测促甲状腺激素(TSH)的性能进行验证和评估.方法参考美国临床和实验室标准协会(CLSI)的有关文件和相关文献,对Cobas8000免疫检测系统测定TSH的精密度、准确性、线性范围、参考区间及不同模块间检测结果的相关性进行验证分析.结果TSH低值、高值批内精密度的结果分别为1.9%、1.3%,均≤1/4 CLIA′88 TEa,批间精密度为2.2%、1.5%,≤1/3 CLIA′88 TEa;能力验证实验成绩80%,准确度合格;线性范围为0.446~89.76μIU/mL,与试剂盒线性范围相符;参考区间符合实验室要求;模块间结果比对R2≥0.95符合要求.结论 Cobas8000检测系统的主要性能均达到相关标准的要求,能够满足临床需求.【期刊名称】《标记免疫分析与临床》【年(卷),期】2017(024)005【总页数】4页(P584-586,590)【关键词】电化学发光免疫分析法;促甲状腺激素;性能验证【作者】张淑瑛;史伟峰【作者单位】苏州大学附属第三医院检验科,江苏常州 213003;苏州大学附属第三医院检验科,江苏常州 213003【正文语种】中文Cobas8000检测系统是一款生化免疫分析一体的检测设备,具有高效的分析能力。
促甲状腺激素(TSH)测定试剂盒(电化学发光免疫分析法)
组成:
适用范围:本试剂盒用于体外定量测定人体血清样本中促甲状腺激素(TSH)的含量。
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于0.01μIU/mL。
2.3 准确度
用TSH国家标准品(150530)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性
在[0.01,100.0]μIU/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度
2.5.1 分析内精密度
在试剂盒的线性范围内,浓度为(5.0±1.0μIU/mL)和(30.0±6.0μIU/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度
在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(5.0±1.0μIU/mL)和(30.0±6.0μIU/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 特异性
2.6.1 与促卵泡生成激素(FSH)
浓度不低于200mIU/mL促卵泡生成激素(FSH)样品,在本试剂盒测定结果应不大于0.01μIU/mL;
2.6.2 与促黄体生成素(LH)
浓度不低于200mIU/mL促黄体生成素(LH)样品,在本试剂盒测定结果应不大于0.01μIU/mL;
2.6.3 与人绒毛促性腺激素(HCG)
浓度不低于1000mIU/mL人绒毛膜促性腺激素(HCG)样品,在本试剂盒测定结果应不大于0.01μIU/mL。
2.7 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.8 溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至TSH国家标准品(编号150530)。