化学实验基本方法(混合物的分离与提纯)人教版
- 格式:ppt
- 大小:7.19 MB
- 文档页数:74
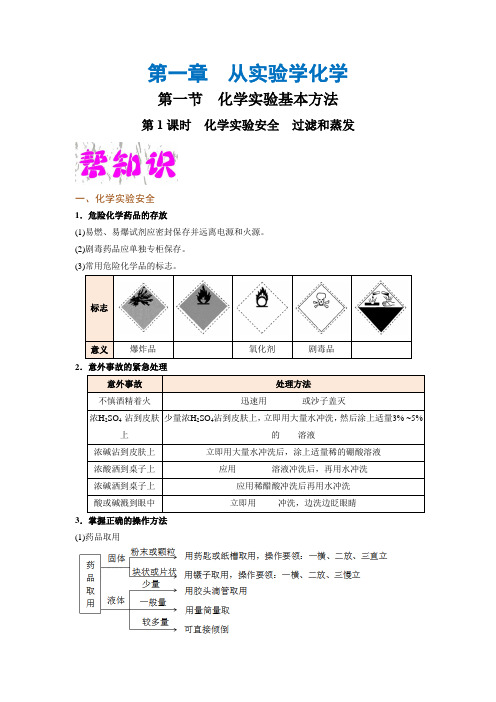
第一章 从实验学化学第一节 化学实验基本方法第1课时 化学实验安全 过滤和蒸发一、化学实验安全1.危险化学药品的存放(1)易燃、易爆试剂应密封保存并远离电源和火源。
(2)剧毒药品应单独专柜保存。
(3)常用危险化学品的标志。
2.意外事故的紧急处理3.掌握正确的操作方法 (1)药品取用(2)物质加热(3)收集气体的方法:排水法和排空气法(包括向上和向下)。
4.重视并逐步熟悉污染物和废弃物的处理方法(1)实验用剩的试剂一般不放回原试剂瓶,以防止污染试剂,应放到指定的容器中。
(2)实验后的废液用废液缸收集,集中处理。
二、过滤和蒸发三、粗盐的提纯1.不溶性杂质的除去粗盐中含有泥沙、氯化钙、氯化镁、硫酸盐等杂质,要通过________、________、________进行提纯。
以上操作都要用到玻璃棒,它们的作用依次是:(1)________溶解。
(2)引流。
(3)________________________。
注:若所得液体如仍浑浊则需再过滤一次。
2.可溶性杂质的除去3.加试剂的先后顺序为使杂质离子完全除去,要加入过量的试剂。
后续试剂要能够将前面所加过量的试剂除去,由此可知Na2CO3 溶液要在BaCl2溶液之后加入,通常加入试剂的几种顺序为:①BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;②NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸;③BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸。
四、盐中2SO-的检验方法4【答案】一、1.易燃品腐蚀品2.湿布NaHCO3Na2CO3水二、固体液体可溶性固体三、1.溶解过滤蒸发(1)加速(3)搅拌、防止液体溅出2.BaCl2BaSO4↓ +2NaCl NaOH Mg(OH)2↓+2NaCl Na2CO3CaCO3↓+2NaCl四、稀盐酸BaCl2溶液无明显现象白色沉淀一、化学实验安全1.判断化学实验是否存在安全隐患,可以从以下六个方面考虑。


混合物的分离和提纯方法—蒸馏一、教学目标1、知识与技能:(1)在巩固溶解、过滤等操作的基础上,学习蒸馏这种分离物质的实验技能(2)能根据混合物的性质选择不同的分离方法对物质进行分离。
2、过程与方法:能通过独立思考、探索,在对物质性质研究的同时设计实验方案。
3、情感态度与价值观:(1)体验科学探究的过程,学习运用以实验为基础的研究方法,提高科学素养。
(2)在合作交流中体验小组合作的乐趣,树立团队合作意识。
二、教学过程【引入】在前面的学习中我们利用不同溶质溶解性的差异对混合物实现了分离,学习了过滤,蒸发这两种方法,除此之外,我们还可以根据物质哪些性质的差异性来对混合物进行分离呢?【创设情境】假如你此刻独自在海上,没有水喝,你会怎样来获取饮用水呢?(学生思考)提示:我们取一些海水,利用太阳能对海水进行加热,水蒸气遇冷,就可以收集到较纯净的水。
想一想,这样能获得蒸馏水的原理是什么?【数据展示】提供数据引导学生分析物质沸点H2O:100 ℃ NaCl:1413 ℃ CaCl2:1600℃ MgCl2:1418 ℃ Na2SO4:1404 ℃【讲解】通过对数据的分析,我们可以知道水和盐的沸点差异很大,太阳提供的热能使水变成蒸气,冷凝之后就可以收集,从而与盐进行了分离。
在整个过程中我们利用了利用液态混合物(互溶)中各组分沸点的不同,加热使其某一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开,我们把这种方法叫做蒸馏。
【板书】蒸馏1.原理——利用液态混合物(互溶)中各组分沸点的不同,加热使其某一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开。
2.适用范围:提纯或分离沸点不同的液体混合物[多媒体展示]蒸馏装置[提问]请同学们观察,蒸馏装置由哪些仪器组成?可以分成哪几个部分?多媒体展示主要仪器名称【教师】在同学们完成蒸馏装置过程中,遇到了一些问题。
我们应该注意哪些注意事项呢?【多媒体展示】蒸馏操作时要注意:①溶液体积不超过烧瓶体积2/3②在蒸馏烧瓶中放少量沸石或碎瓷片,防止液体暴沸。


一、教材分析1.教学内容分析学生在初中的学习过程中已经接触到一些实验知识,本章第一节的内容是对初中已有的有关实验知识的拓宽和提升。
本节还结合实际操作引入物质检验的知识,这样由已知到未知,由简单到复杂,逐步深入。
二、教学目标1.知识目标(1)初步学会物质的分离和提纯的常见方法。
(2)初步学会常见物质的检验方法。
2.能力目标(1)通过设计粗盐进一步提纯的实验方案,体验科学探究的过程,学习运用以实验为基础的实证研究方法。
(2)通过物质的检验,混合物的分离、提纯等实验过程,学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳概括等方法对信息进行加工的方法。
(3)通过分组实验,交流讨论,养成实事求是的科学素养及合作意识。
三.教学重点难点教学重点:混合物的分离与离子的检验,分离与提纯过程的简单设计。
教学难点:物质检验试剂的选择,蒸馏的操作,分离与提纯过程的简单设计。
四.学情分析1.可以看到第一节中学生学习的重点是混合物的分离与离子的检验。
在分离提纯的学习过程中纯盐提纯有关的操作学生比较熟悉,其学习的难度不大。
但对于课本中提到的提纯后溶液依然存在的杂质如何设计简单的实验进行分离提纯,对学生而言涉及物质的性质,和对性质的灵活应用,需要一定分析和逻辑思维能力,是学生学习的难点。
2.学生尚未形成适合高中学习的学习方法五.教学方法1.学案导学:见导学案。
2.新授课教学基本环节:预习检查、总结疑惑情景导入、展示目标合作探究、精讲点拨反思总结、当堂检测发导学案、布置预习六.课前准备1.学生的学习准备:预习导学案,知道本节的学习重点2.教师的教学准备:制作多媒体课件,预习导学案,做到深度的延展七.课时设计共1课时八.教学过程(一)检查预习、总结疑惑检查落实了学生的预习情况并了解了学生的疑惑,使教学具有了针对性(二)情景导入、展示目标教师介绍粗盐的成分(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)复习:利用初中学过的方法提纯粗盐。

第一章从实验学化学第一节化学实验基本方法一、化学实验安全1.遵守实验室规则。
2.了解安全措施。
3.掌握正确的操作方法。
例如,掌握仪器和药品的使用、加热方法、气体收集方法等。
二、混合物的分离和提纯注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。
第二节化学计量在实验中的应用一、物质的量的单位――摩尔1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数: 把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量=物质所含微粒数目/阿伏加德罗常数n =N/N A5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或g..mol-1 (3) 数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量( n = m/M )二、气体摩尔体积1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/V m3.标准状况下, V m = 22.4 L/mol三、物质的量在化学实验中的应用1.物质的量浓度.(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L(3)物质的量浓度=溶质的物质的量/溶液的体积C B = n B/V2.一定物质的量浓度的配制(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.(2)主要操作a.检验是否漏水.b.配制溶液步骤:(查漏)计算→称量或量取→溶解或稀释→(降温)转移→洗涤→振荡→定容→摇匀→装瓶贴签.注意事项:A 选用与欲配制溶液体积相同的容量瓶. B 使用前必须检查是否漏水.C 不能在容量瓶内直接溶解.D 溶解完的溶液等冷却至室温时再转移.E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.3.溶液稀释:C(浓溶液)·V(浓溶液) =C(稀溶液)·V(稀溶液)4.溶液中溶质的质量分数(w%)与物质的量浓度(C B)之间的关系:5.物质的量在化学方程式计算中的应用。