羧酸的化学性质和制备
- 格式:doc
- 大小:1.38 MB
- 文档页数:6

羧酸的合成与反应羧酸是一类含有羧基(-COOH)的有机化合物,具有广泛的应用领域。
羧酸的合成方法多种多样,可以通过不同的反应途径来得到。
本文将介绍羧酸的几种合成方法,并讨论一些常见的羧酸反应。
一、羧酸的合成方法1. 羟基化反应:通过羟基化反应,可以将醇顺利转化为羧酸。
常用的羟基化试剂有高锰酸钾(KMnO4)、过氧化氢(H2O2)、过氧化苯甲酰(BPO)等。
这些试剂可以氧化醇分子中的C-H键形成羟基,然后经过进一步氧化反应生成羧酸。
2. 碳氧化反应:也是一种常见的羧酸合成方法。
碳氧化反应是将烯烃或炔烃与氧气在催化剂存在下反应,生成羧酸。
一种常用的碳氧化反应是醛酮碳氧化反应,通过将醛酮与氧气在金属催化剂(如铑催化剂)的作用下进行反应,生成羧酸。
3. 羧酸盐的水解:羧酸盐的水解反应是一种常见的羧酸合成方法。
当羧酸盐溶于水时,易被水解为羧酸和相应的阳离子。
例如,乙酸乙酯与水在酸催化剂的作用下反应,生成乙酸和醇。
二、羧酸的反应1. 酯化反应:羧酸可以与醇通过酯化反应生成酯。
酯化反应常常用于制备酯类化合物,具有重要的实际应用。
酯化反应一般需要催化剂的存在,如硫酸、氯化亚砜等。
例如,乙酸与乙醇通过酯化反应生成乙酸乙酯。
2. 酰氯化反应:羧酸可以与氯化亚砜(SOCl2)、氯化磷(PCl3)等反应生成酰氯。
酰氯是一类重要的有机化学中间体,可用于合成众多有机化合物。
3. 脱羧反应:羧酸的脱羧反应指的是羧酸分子失去羧基(-COOH)而形成其他化合物的反应。
常见的脱羧反应有热脱羧、酸催化脱羧和碱催化脱羧等。
脱羧反应通常需要高温和催化剂的存在。
4. 脱羧偶联反应:脱羧偶联反应通过羧酸在特定条件下失去羧基,并与其他化合物发生偶联反应,生成新的化合物。
脱羧偶联反应在有机合成中具有重要的应用价值。
总结:本文介绍了羧酸的合成方法以及常见的反应。
羧酸的合成方法主要包括羟基化反应、碳氧化反应和羧酸盐的水解等。
而羧酸的反应主要包括酯化反应、酰氯化反应、脱羧反应和脱羧偶联反应。


有机化学基础知识点整理羧酸的性质与反应羧酸是一类重要的有机化合物,在有机化学领域中起着至关重要的作用。
本文将对羧酸的性质及其常见的反应进行整理,并探讨其在化学反应中的应用。
1. 羧酸的性质羧酸是由羰基和羟基或氨基组成的一类化合物。
羰基的存在赋予了羧酸许多特殊的化学性质。
(1)酸性:羧酸具有较强的酸性,可以和碱反应生成相应的盐和水。
羧酸的酸性来源于羧基上的羟基或氨基,它们可以与碱中的氢离子发生酸碱中和反应。
(2)溶解性:羧酸可以溶于许多极性溶剂中,如水、醇和酮等。
但在非极性溶剂中溶解度较低。
(3)氢键:由于羧基上的氢原子和含氧的孤对电子形成氢键,羧酸分子之间存在较强的相互作用力。
这种氢键能增加羧酸的熔点和沸点,并影响其化学性质。
2. 羧酸的反应(1)酸碱反应:羧酸可以与碱发生酸碱反应,生成相应的盐和水。
反应的例子如下:RCOOH + NaOH → RCOONa + H2O(2)酯化反应:羧酸与醇反应可以生成相应的酯。
这是一种重要的羧酸衍生物合成方法。
反应的示例如下:RCOOH + R'OH → RCOOR' + H2O(3)酰氯化反应:羧酸可以和无水氯化物反应,生成相应的酰氯。
酰氯是一种活泼的羧酸衍生物,可进一步参与其他反应。
反应的表达式如下:RCOOH + SOCl2 → RCOCl + SO2 + HCl(4)酰亚胺化反应:羧酸与胺反应可以生成相应的酰亚胺。
这种反应在有机化学合成中非常常见。
反应的示例如下:RCOOH + NH2R' → RCONHR' + H2O(5)还原反应:羧酸可以在适当条件下被还原为醛或醇。
具体的还原剂取决于羧酸的结构及反应条件。
(6)烷化反应:羧酸可以与碳亲核试剂(如Grignard试剂)反应,生成相应的烷化产物。
反应的示例如下:RCOOH + RMgX → RCH2OH + MgXOR3. 羧酸的应用羧酸广泛应用于有机合成和材料科学等领域。

有机化学基础知识点羧酸的性质和反应羧酸是有机化学中的一类重要化合物,其具有独特的性质和反应。
本文将对羧酸的性质和反应进行分析,以帮助读者更好地理解有机化学中羧酸的基础知识点。
一、羧酸的基本结构和性质羧酸的化学式通常表示为R-COOH,其中R表示有机基团。
羧酸中的碳原子与一个羧基(-COOH)和一个有机基团R连接。
羧酸中的羧基是由一个碳氧化合物和一个羟基组成的。
羧酸具有一些基本的性质。
首先,羧酸是一类具有酸性的化合物。
其羧基上的氧原子带有负电荷,可以释放出质子(H+),从而使羧酸溶液具有酸性。
其次,羧酸中的羧基中的羟基(-OH)是极性的,使羧酸具有较高的溶解度。
此外,羧酸还可以形成氢键和其他分子进行相互作用,影响其物理性质。
二、羧酸的反应1. 羧酸与碱反应羧酸与碱反应会生成相应的盐和水。
这是因为碱可以中和羧酸中的质子,使羧酸中的羧基离子化,并与碱中的阳离子形成盐。
反应方程式如下所示:RCOOH + NaOH → RCOONa + H2O2. 羧酸与醇反应羧酸与醇反应会发生酯化反应,生成酯和水。
这是一种酸催化的反应,羧酸中的羧基与醇中的羟基发生缩合反应,并释放出水分子。
反应方程式如下所示:RCOOH + R'OH → RCOOR' + H2O3. 羧酸的脱羧反应羧酸的脱羧反应是指羧酸分子中的羧基失去碳原子,生成相应的酮或醛。
这是一种重要的羧酸反应,在实际有机合成中被广泛应用。
脱羧反应可以通过加热、用酸或碱催化来促进。
反应方程式如下所示:RCOOH → R'COR + CO24. 羧酸的酰氯化反应羧酸与反应的卤化酰可发生酰氯化反应,生成相应酰氯和HCl。
酰氯在有机合成中是一种重要的中间体,可以进一步参与其他反应。
反应方程式如下所示:RCOOH + SOCl2 → RCOCl + SO2 + HCl5. 羧酸与亲电试剂的反应羧酸可以与亲电试剂发生的有机反应,例如与醇、胺、卤代烷等反应,生成相应的酯、酰胺或酰化产物。

羧酸的化学知识点总结一、羧酸的结构和命名1. 结构:羧酸分子的基本结构是一个含有羧基的碳原子。
羧基通常连接在碳原子上,并且与氢原子取代原子或它们的共轭基。
2. 命名:羧酸通过在化学名词前面加上“酸”字作为后缀来命名。
例如甲酸、乙酸、苹果酸、柠檬酸等。
二、羧酸的物理性质1. 溶解性:大多数羧酸在水中溶解度较高,因为羧基上的氧原子能够与水形成氢键。
2. 气味:许多羧酸具有特殊的气味,如乙酸的发酵味、醋酸的芳香味等。
3. 沸点和熔点:羧酸的沸点和熔点因其分子结构而异,但大多数羧酸的沸点和熔点都较高。
三、羧酸的化学性质1. 酸性:羧酸中的羧基是一个弱酸基,可以脱去氢离子形成阴离子,导致其呈现酸性。
羧酸越理想,pKa值越小,酸性越弱。
2. 反应性:羧酸能够与醇、胺等进行酯化、酰胺化等反应,形成酯、酰胺等不同种类的化合物。
3. 氧化还原反应:羧酸可以与氢气发生还原反应,生成醇和二氧化碳;也可以与醇发生酯化反应,生成酯。
四、羧酸的生物活性1. 蛋白质合成:氨基酸中的羧酸与胺基在蛋白质合成过程中发生缩合反应,形成多肽链。
2. 新陈代谢:某些羧酸在生物体内是重要的代谢产物,如醋酸作为能量物质参与有氧呼吸过程。
3. 药物作用:某些羧酸具有抗菌、抗炎、抗氧化等生物活性,被广泛应用于医药领域。
五、羧酸的应用1. 化妆品:果酸可促进皮肤代谢,被广泛用于美容产品中。
2. 食品饮料:柠檬酸、乙酸等常作为食品酸味剂使用。
3. 农业:乙酸、丙酸等可作为农药原料,用于制备杀虫剂、杀菌剂等。
总结:羧酸作为一类具有羧基的有机酸,在自然界和人造环境中广泛存在,并且具有重要的生物活性和化学性质。
它们不仅被广泛应用于医药、农业、食品和工业领域,还对理解生命的起源和进化具有重要意义。
随着对羧酸的深入研究,相信其在各个领域中的应用将会更加广泛。

化学羧酸的知识点总结一、结构和命名1. 结构化学羧酸的结构由一个羧基和一个碳骨架组成。
其中羧基是一个碳氧双键和一个碳氢化合物基团连接而成的官能团,通常表示为-COOH。
在有机化合物中,羧基是一种常见的官能团,可以存在于碳链的末端或中间位置。
2. 命名对于简单的化学羧酸,其命名通常遵循通用命名法。
以甲酸(HCOOH)为例,其名称为methanoic acid。
由于羧酸是一种官能团,可以存在于许多有机分子中,因此在有机化合物命名中,羧酸官能团通常被标记为"-oic acid"。
二、性质1. 物理性质化学羧酸通常呈液体或固体状态,具有酸味和刺激性气味。
它们可以溶解于水和许多有机溶剂中,形成透明的溶液。
在固体状态下,化学羧酸通常呈白色或无色晶体。
2. 化学性质化学羧酸是一类弱酸,其羧基可以脱去质子而形成羧酸根离子。
这使得化学羧酸可以发生酸碱中和反应,并参与许多重要的有机合成反应。
此外,化学羧酸还可以与许多金属离子形成盐,这些盐通常被称为羧酸盐。
三、合成化学羧酸可以通过多种途径进行合成,其中最常见的方式包括氧化、羧化和羧酸衍生物的水解等方法。
1. 氧化许多有机化合物可以通过氧化反应而形成化学羧酸。
最常见的氧化剂是酸性高锰酸钾溶液(KMnO4)。
在此条件下,许多有机物质,如醇、醛、醛酸和酮等,可以氧化生成相应的羧酸。
2. 羧化许多有机化合物可以通过羧化反应而合成羧酸。
羧化反应通常以卤代烃和氢氧化物为原料,通过加成反应而生成羧酸。
例如,乙酸可以通过氯乙酸和氢氧化钠反应而合成。
3. 羧酸衍生物的水解许多羧酸衍生物,如酰氯和酯,可以通过水解反应而生成相应的羧酸。
例如,酰氯可以与水反应生成羧酸和盐酸。
四、反应化学羧酸具有多种重要的化学反应,包括酸碱中和、酯化、酯水解、酰胺合成和酸酐生成等。
1. 酸碱中和化学羧酸可以与碱反应生成相应的盐和水。
这是化学羧酸常见的反应之一,也是酸碱中和反应的一种特例。



一、实验目的1. 验证羧酸的主要化学性质,包括酸性、酯化反应、卤代反应等。
2. 掌握羧酸与碱反应的原理和操作方法。
3. 熟悉羧酸的鉴别方法,区分不同类型的羧酸。
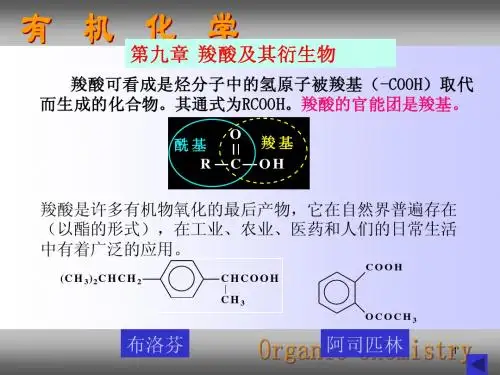
二、实验原理羧酸是一类含有羧基(-COOH)的有机化合物,具有酸性、酯化反应、卤代反应等性质。
本实验主要研究羧酸的酸性、酯化反应和卤代反应等性质。
三、实验材料与仪器1. 实验材料:乙酸、乙醇、氢氧化钠、氯化钠、溴化钠、无水乙醇、氢氧化钠溶液、溴水、碳酸钠溶液、氯化氢气体等。
2. 仪器:烧杯、试管、酒精灯、玻璃棒、滴定管、酸碱滴定仪、电热板等。
四、实验步骤1. 羧酸的酸性(1)取少量乙酸于试管中,加入几滴石蕊试液,观察溶液颜色变化,验证乙酸的酸性。
(2)取少量乙酸于试管中,加入少量碳酸钠固体,观察有无气泡产生,验证乙酸的酸性。
2. 羧酸的酯化反应(1)取少量乙醇于烧杯中,加入少量浓硫酸,加热至沸腾。
(2)向沸腾的乙醇溶液中加入少量乙酸,继续加热一段时间,观察溶液颜色变化。
(3)冷却后,向反应体系中加入少量饱和碳酸钠溶液,观察有无沉淀产生,验证酯化反应的生成。
3. 羧酸的卤代反应(1)取少量乙酸于烧杯中,加入少量溴化钠固体,加热至沸腾。
(2)观察溶液颜色变化,验证羧酸的卤代反应。
五、实验结果与分析1. 羧酸的酸性实验结果显示,乙酸溶液加入石蕊试液后,溶液颜色变为红色,说明乙酸具有酸性。
加入碳酸钠固体后,观察到气泡产生,进一步验证了乙酸的酸性。
2. 羧酸的酯化反应实验结果显示,在加热条件下,乙酸与乙醇发生酯化反应,生成乙酸乙酯。
加入饱和碳酸钠溶液后,观察到白色沉淀产生,说明酯化反应的生成。
3. 羧酸的卤代反应实验结果显示,在加热条件下,乙酸与溴化钠发生卤代反应,生成溴乙酸。
溶液颜色由无色变为棕色,进一步验证了羧酸的卤代反应。
六、实验结论1. 羧酸具有酸性,可与碱反应生成羧酸盐,可与碳酸钠反应产生气泡。
2. 羧酸可与醇发生酯化反应,生成酯类化合物。
羧酸的化学性质和制备羧酸的主要化性示意图:CHα-氢的反应亲核试剂进攻发生酯化等反应(羟基取代反应)酸性一、酸性和成盐RCOOH++NaOHNaHCORCOONa H2ORCOONa CO2RCOOH+++↑H2O注1:有机酸酸性强于碳酸,故用NaHCO3可以区分有机酸与醇或酚:石碳酸水杨酸NaHCO3( )注2:羧酸酸性的影响因素(1)一元酸酸性影响因素:①连有吸电子基,酸性↑;吸电子基数目↑、与羧基间距↓,酸性↑↑;②连有给电子基,酸性↓;给电子基数目↑、与羧基间距↓,酸性↓↓;③苯甲酸的特殊性:COOH,苯基对羧基的电子效应是弱-I和+C,+C>–I,因此,苯甲酸的酸性比甲酸弱,但比一般的羧酸强(R电子效应是+I和+C):R-COOH﹤Ph-COOH﹤HCOOH例如:1、PKa 2.86 1.26 0.64ClCH2COOH Cl2CHCOOH Cl3CCOOH解释:Cl的强吸电子作用使得酸性随着同位Cl原子个数的增多而增强。
2、HCOOH CH3COOH ClCH2COOH EtCOOH PhCOOH Pka 3.77 4.74 2.86 4.88 4.20解释:Cl 的强吸电子作用使氯乙酸的酸性最强;其次为甲酸(H 对酸性无影响);甲基和乙基都是给电子基团,使酸性下降(两者作用相差不多);苯甲酸由于苯基的+C 大于-I ,使酸性弱于甲酸而大于乙酸和丙酸。
(2)取代苯甲酸的酸性影响因素:COOHCOOHCOOHCOOHCOOHCOOHCOOHNO 2NO 2NO 2OHOHOHPka 4.202.213.493.422.984.084.57分析:①硝基是吸电子基,使硝基取代的苯甲酸酸性强于苯甲酸;间位时无共轭效应,因此间硝基苯甲酸酸性弱于邻对位;邻位诱导效应较强与对位,酸性应略强于对位,但数据显示邻位强于对位很多,原因在于邻位时硝基与羧基的空间位阻造成基团的扭转,破坏了共轭体系而削弱了苯环对羧基的给电子作用,使酸性增强,同时羧基负离子与硝基中显正电性的氮原子相互作用而稳定,使其酸性大大增强。
②羟基是给电子基,酸性应弱于苯甲酸,但只有对位符合,因为: 间位时无共轭,只有-I ,所以间位酸性反而强于苯甲酸;邻位时由于邻位基团间的空间位阻,削弱了共轭效应,使羟基的-I 效应起了主导作用,且邻位的羟基可与羧基负离子形成分子内内氢键,反而酸性大大增强。
C OOH OH-H+O COH O邻位效应——邻位基团对活性中心的影响,主要有两种:一是邻位的空间位阻使共轭减弱;二是邻位基团可起稳定化作用(如羟基与羧基负离子可形成内氢键)。
③邻位效应的影响使得邻羟基苯甲酸的酸性接近邻硝基苯甲酸,可见:邻位效应使邻位取代苯甲酸(吸电子基或给电子基,氨基/甲氧基除外)的酸性均↑↑。
COOHG2.21 2.98pka G= -NO 2 -OH(3)二元羧酸的酸性影响因素:一级电离时,要受到另一个羧基的影响,羧基是吸电子基,距离越近酸性增强越多,故二元酸中一级电离最大的是乙二酸(草酸)。
二级电离时要受到一级电离出的羧基负离子影响,后者是给电子基使酸性减弱,故二元酸的二级电离总是小于一级电离。
二、羧酸衍生物生成(-OH 取代反应)羧酸中羰基与羟基共轭,使C 上正电性下降,羰基亲核加成活性下降,反而易发生羟基的取代反应,生成一系列羧酸衍生物。
该反应由亲核试剂进攻酰基碳进行亲核加成形成四面体负离子,然后发生消除,最终羟基被亲核试剂取代。
总反应式:RCO OHNu-RCO NuRCNuO 亲核加成消除(Nu - = X, RCOO, RO, NH 2)一般都是酰氧断裂(叔醇除外):R C O OH HNu+R CONu +H 2O1、酰卤的生成(亚磷酸)RCOOH +PCl 3PCl 5SOCl 2RCOCl +H 3PO 3POCl 3SO 2HCl HCl ++↑↑↑(1)(2)(3)注:(1)共轭使反应不易进行,卤化条件 ,需要磷等参与催化(HX 不能反应); (2)根据产物物性选择相应的反应,一般常用反应(3),因其后处理便利。
2、酸酐的生成 ++ORCO CO R OH RCO HO C OR H 2OP 2O 5COOH C OCOOH C OO CH 2COOH CH 2CH 2COOHO OO-H 2O邻苯二甲酸酐(苯酐)2戊二酸酐注:两分子酸脱去一分子水即得到酸酐;分子间脱水形成链状酸酐,分子内脱水形成环酐。
3、酯的生成RCOOH HOR'+RCOOR'H 2O +注:(1)反应可逆,因此增加反应物浓度、蒸出生成物水,可使产率↑; (2)一般而言是酸脱羟基醇脱氢,但叔醇是脱羟基;H+R CO OH C +H 18OR'+OH R O +C18OR'+R COH 18OR'H +R CO 18OR'H 2+H 2O4、酰胺的生成+RCOOH +NH 3(NH 4)2CO 3RCOO -NH 42H 2O或()C 6H 5COOH +C 6H 5NH 2C 6H 5CONHC 6H 5H 2O+84%R C OH O3R C OHO ..NH3+R C OH 2O NH 2R C NH 2O H O三、羧基的还原 1、催化加氢还原法+H 2ORCOOH +H 2Cu RCH 2OH ,400℃注:(1)共轭使还原条件↑,产物为醇; (2)一般的催化加氢只还原C=C :+H 2PtCH 3CH 2CH 2COOH CH 2=CHCH 2COOH2、金属氢化物还原法CH 3CH 2CHCOOHCH 3LiAlH 4CH 3CH 2CHCH 2OHCH 3LiAlH 4CH 2=CHCH 2COOHCH 2=CHCH 2CH 2OH注:(1)可保留双键,还原产物为醇;(2)NaBH 4还原性弱,不能用来还原羧基、酯基、氰基。
3、乙硼烷还原法C 6H 5COOHC 6H 5CH 2OH HOOCCOOHHOH 2CCH 2OHB 2H 6B 2H 6注:可同时还原COOH 和C=C ,产物为醇。
四、α-H 的卤代+CH 3COOH Cl 2ClCH 2COOH P注:(1)羧酸的α-H 活性< 醛酮,使卤代条件↑,即使有3个α-H 也无卤仿反应; (2)产物为α-卤代酸,是一重要的合成中间体。
五、脱羧反应++CH 3COONa NaOH (S)CH 4Na 2CO 3热熔↑注:此为实验室制取少量甲烷的办法,实为脱羧反应。
+↑Cl 3CCOOH CHCl 3CH 3COCH 2COOH CH 3COCH 3CO2+↑CO2+↑CO 2C 6H 5C 6H 5CH=CH 2RCOOH+CO 2脱羧酶R-H ↑注:(1)甲酸以外的一元羧酸难直接脱羧; (2)α位有吸电子基、重键,易脱羧; (3)生物体内——脱羧酶作用下脱羧。
六、二元酸受热反应1、两个羧基间隔0~1个C ,脱羧→一元羧酸;2、两个羧基间隔2~3个C ,脱水→五、六元环酐;3、两个羧基间隔4~5个C ,脱羧+脱水→五、六元环酮;4、两个羧基间隔5个C 以上,分子间脱水→高分子链状酸酐。
↑CO 2+HOOC COOH HCOOH HOOC CH 2CH 3COOH ↑CO 2+OH+CH 2C O OH CH 2O C H 2OOOH+CH 2C O OH CH 2OOC O H 2OOHCH 3C H 3CO OOH+CH 2C OOH CH 2O C H 2O + CO 2CH 2CH 2OH+CH 2C OOH CH 2OC H 2O + CO 2H 2CCH 2CH 2七、羧酸的制备(详见P224~225)1、官能团转换法(1)醇、醛、芳基侧链氧化(2)烯炔氧化(3)卤仿反应、康尼扎罗反应等2、水解法(1)氰化物水解(2)油脂水解(3)羧酸衍生物水解(略,见第十章)3、有机金属化合物制备法(1)格氏试剂与二氧化碳的反应(2)烃基锂制备法4、乙酰乙酸乙酯、丙二酸二乙酯制备法(略,见第十章)。