乙烯直接水合制乙醇
- 格式:xls
- 大小:938.50 KB
- 文档页数:9

乙烯与水化学反应方程式
乙烯与水之间发生的化学反应是一个加成反应,生成乙醇的过程。
乙烯(化学式C2H4)与水(化学式H2O)在存在催化剂的条件下发生水合反应,生成乙醇(化学式C2H5OH)。
该反应的化学方程式如下所示:
C2H4 + H2O → C2H5OH.
在这个反应中,乙烯的双键被水分子的氢和氧原子加成,形成了乙醇分子。
这个反应通常需要催化剂的存在,如酸或碱催化剂,以促进反应的进行。
从另一个角度来看,乙烯与水的化学反应也可以用结构式来表示。
乙烯的结构式是CH2=CH2,水的结构式是H-O-H。
当它们发生水合反应时,乙烯的双键被水分子的氢和氧原子加成,形成乙醇的结构式CH3-CH2-OH。
总的来说,乙烯与水的化学反应是一个重要的工业过程,用来生产乙醇等化学品。
这个反应不仅在化工生产中有重要应用,也是
化学领域的一个重要研究课题。
希望这个回答能够全面地解答你的问题。

11 1234567水产品空气甲醇(F-T)合成。
第三章1.合成气是指一氧化碳和氢气的混合气2.合成气的生产方法主要有哪几种?1).以煤为原料生产合成气,主要有间歇法和连续法2).以天然气为原料生产合成气,主要有转化法和部分氧化法3).以重油或渣油为原料生产合成气,主要的方法为部分氧化法3.影响甲烷水蒸气转化反应平衡的主要因素有:A温度B水碳比C压力D空间速度4.天然气生产乙炔工艺甲烷在高温下的热裂解生成乙炔的反应式强吸热过程,其裂解反应复杂主要反应有:氧化反应+++CH4O2CO H2O H2热裂解反应:+2CH4C2H23H2水煤气反应:++CO H2O CO2H2乙炔分解:+C2H22C H25.天然气制乙炔的工艺中,影响乙炔收率的主要因素有:1).原料气中氧含量2).原料气中均匀混合与适当的高流速3).稳定的燃烧火焰4).适宜的反应时间和足够的反应温度5).良好的淬冷装置6.天然气部分氧化法制乙炔是目前生产乙炔的主要方法,部分氧化发的代表性工艺又可分为BASF工艺和SBA工艺。
BASF法的核心是在同一空间、同一时间使一部分烃和氧燃烧,放出热量,造成高温环境,另一部分烃在这高温环境中发生裂解反应生成乙炔。
7.裂解气的净化过程包括:裂解气的压缩、酸性气体的脱除、脱炔、脱一氧化碳、脱除水分等。
8.合成甲醇的影响因素:1)反应温度2)压力3)水碳比4)空速5)二氧化碳添加量9.甲醇的生产方法分为高压法、低压法和中压法。
10.ICI低压法合成甲醇得基本工艺过程为:1天然气脱硫2.蒸汽转化3.补碳及合成气压缩4.甲醇合成5.甲醇精制11.甲醛的生产原理:甲醇催化氧化生产甲醛是在空气量不足的条件下,进行氧化还原反应,并通过银催化进行选择性催化而实现的。
12.生产甲醛的影响因素:1).反应温度2).原料气的组成3).原料气的纯度13.甲醛的生产工艺主要有两种,即甲醇氧化法和天然气氧化法。
14.目前工业上以天然气为原料生产氢氰酸的方法主要有:1烃类的氨氧化法,以甲烷-氨-空气作为原料。


第二章化学反应速率与化学平衡(同步练习)一、单选题1.乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)⇌C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如图【起始时,n(H2O)=n(C2H4)=1mol,容器体积为2L】。
下列分析正确的是A.乙烯气相直接水合反应的ΔH>0B.图中压强的大小关系为p1>p2>p3C.图中a点对应的平衡常数K=58D.达到平衡状态a、b所需要的时间:a<b2.H2与ICl的反应分①、①两步进行,其能量曲线如图所示,下列有关说法错误的是A.反应①、反应①均为放热反应B.反应①、反应①均为氧化还原反应C.H2与ICl的总反应速率快慢取决于反应①D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-13.N2分子在催化剂的作用下发生的一系列转化如图所示。
下列叙述正确的是A.催化剂a的表面有极性键的断裂和非极性键的形成B.催化剂a能提高该反应的平衡转化率C.催化剂a、b增大了该历程中的最大能垒(活化能)D.催化剂b表面发生的反应为4NH3+5O2催化剂b4NO+6H2O4.下列叙述及解释正确的是A.2NO2(g)(红棕色)⇌N2O4(g)(无色)ΔH<0,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅B.H2(g)+I2(g)⇌2HI(g)ΔH<0,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变C.2C(s)+O2(g)⇌2CO(g),在达到平衡后,加入碳,平衡向正反应方向移动D.N2(g)+3H2(g)⇌2NH3(g),在达到平衡后,保持压强不变,充入O2,平衡向左移动5.下列实验操作能达到实验目的或得出相应结论的是A.A B.B C.C D.D6.我国学者采用量子力学法研究了钯基催化剂表面吸附CO和H2合成CH3OH的反应,其中某段反应的相对能量与历程的关系如图所示,图中的TS1~TS5为过渡态,吸附在钯催化剂表面上的物种用*标注。

化工设计:5×104t/a合成乙醇工艺设计班级:化学一班组长:分工:流程设计及厂址选择:马瑞雪2013437033陈斯2013437031物料衡算及能量衡算:李梦莹2013437025孙岩2013437029陈丹丹2013437039韩爱英2013437041贾玉婷2013437043PID图,PFD图设计:邱雨涵2013437035陈冠友2013437023刘冠豪2013437045张琳20134370375×104t/a合成乙醇工艺设计1.工艺方案的选择乙醇是重要的有机溶剂,又是医药、染料、涂料、香料、合成橡胶、洗涤剂等有机产品的基本原料或中间体。
在化学工业中主要用于制造乙醚,乙醛,醋酸,乙二醇醚、乙胺等。
本实验采取乙烯气相直接水合法来合成乙醇。
乙烯气相直接水合法制取乙醇的工艺流程叙述如下。
实验分为合成、精制和脱水三部分。
反应器的操作条件:反应温度325℃,反应压力6.9MPa,催化剂是磷酸-硅藻土催化剂。
转化率4%~5%,选择性95%~97%。
因反应液中含有磷酸,所以在工艺流程中设臵一个洗涤塔(又称中和塔)用碱水溶液或含碱稀乙醇溶液中和。
这一工序一定要放在换热器后,因高温易使磷酸因高温易使磷酸盐在换热器表面结垢,甚至会堵塞管道。
含乙醇10%~15%的粗乙醇水溶液,分别由洗涤塔和分离塔底进入乙醇精制部分。
精制部分的工序有:a.萃取分离出乙醚和乙醛,萃取剂为水(可增大乙醚和乙醛与乙醇的相对挥发度),两塔串联,第二萃取塔塔顶出乙醚、乙醛和水(萃取率达90%以上),经冷却冷凝分出油相(有机相)和水相,有机相中主要为乙醚,返回反应器,水相经蒸馏,塔顶得乙醛-乙醚共沸物,另行处理,塔釜为含乙醚的水,返回反应系统;b.乙醇的提浓和精制。
由萃取塔来的乙醇水溶液含少量乙醛,在精馏时加氢氧化钠溶液,可除去乙醛(碱能催化乙醛发生缩合反应,生成高沸点缩醛)。
精馏塔顶部出料乙醇中仍含有少量轻组分,返回萃取部分。

[0751]《化学反应工程》第一次作业[论述题]计算题反应A → B为n级不可逆反应。
已知在300K时要使A的转化率达到20% 需12.6分钟,而在340K时达到同样的转化率仅需3.20分钟,求该反应的活化能E。
参考答案:E=29.06kJ/mol,详细计算过程见附件1253762549155.doc[论述题]简述全混流模型的基本特征。
参考答案:全混流模型,亦称理想混合模型或连续搅拌糟式反应器模型,是一种返混程度为无穷大的理想化流动模型。
它假定反应物料以稳定流量流人反应器,在反应器中,刚进人反应器的新鲜物料与存留在反应器中的物料瞬间达到完全混合。
反应器中所有空间位置的物料参数都是均匀的,而且等于反应器出口处的物料性质,即反应器内物料浓度和温度均匀,与出口处物料浓度和温度相等。
物料质点在反应器中的停留时间参差不齐,有的很短,有的很长,形成一个停留时间分布。
搅拌十分强烈的连续搅拌槽式反应器中的流体流动可视为全混流。
[填空题]1. 化学反应工程中的"三传一反”中的三传是指。
2.气―固相催化反应的内扩散模数(Thiele模数)Φ=(V p/S p)(k v/D eff)1/2,它是表征内扩散影响的重要参数,数值平方的大小反映了与之比。
3.对于反应aA+bB-->pP+sS,则rP =__ ___(-rA)。
4. 平行反应A-->P(主),A-->S(副)均为一级不可逆反应,若E主>E副,选择性Sp与_______无关,仅是_______的函数。
5. 平推流反应器内返混为_______。
6. 全混流反应器t=0时,E(t)=_______。
7. 阶跃示踪法测定停留时间分布对应曲线为_______。
参考答案:1.传质、传热、动量传递2.表面反应速率、内扩散速率3.p/a4.浓度温度5.零6.1/t m7. F(t)曲线第二次作业[论述题]计算题乙烯直接水合制乙醇可视为对乙烯的一级不可逆反应,在300℃,7.09Mpa下,k=0.09s-1,D eff=7.04�10-4cm2/s,采用直径与高均为5mm的圆柱形催化剂,求内扩散有效因子。

专题2《化学反应速率与化学平衡》测试卷一、单选题1.甲苯(用C7H8表示)是一种挥发性的大气污染物。
热催化氧化消除技术是指在Mn2O3作催化剂时,用O2将甲苯氧化分解为CO2和H2O。
热催化氧化消除技术的装置及反应机理如图所示,下列说法中错误的是C H+36MnO=7CO+4H O+18Mn OA.反应Ⅱ的方程式为7822223B.反应Ⅱ中Mn元素的化合价升高C.反应Ⅱ中O-H键的形成会释放能量C H(g)+9O(g)=7CO(g)+4H O(g)的焓变D.Mn2O3作催化剂可降低总反应782222.目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。
下列说法错误的是A.第Ⅱ、Ⅱ步反应均释放能量B.该反应进程中有二个过渡态C.酸催化剂能同时降低正、逆反应的活化能D.总反应速率由第Ⅱ步反应决定CH OH的反应,3.我国学者采用量子力学法研究了钯基催化剂表面吸附CO和2H合成3其中某段反应的相对能量与历程的关系如图所示,图中的TS1~TS5为过渡态,吸附在钯催化剂表面上的物种用*标注。
下列说法正确的是A .总反应的热化学方程式是23(g)(g)催化剂2H +CO CH OH(g) -1ΔH=-65.7kJ molB .图中决速步骤的能垒(活化能)为91.5kJ/molC .催化剂在该历程中参与反应并降低了反应的活化能D .该历程中经过TS3时的反应速率比经过TS5时的反应速率慢4.在一定条件下的1L 密闭容器中,X 、Y 、C 三种气体的物质的量随时间的变化如图所示。
下列说法不正确...的是A .0~15min ,消耗C 的平均速率约为0.033mol•L -1•min -1B .X 、Y 、C 三种气体发生反应的化学方程式为:Y(g)+3X(g)2C(g)C .反应开始到25min ,X 的转化率为25%D .25min 时改变的一个条件可能是缩小容器体积5.某温度下,在体积为2L 的刚性容器中加入1mol 环戊烯()和2molI2发生可逆反应(g)+I2(g)(g)+2HI(g)△H>0,实验测定容器内压强随时间变化关系如图所示。

酒精的化学方程1. 引言酒精是一种常见的有机化合物,其化学式为C2H5OH。
它是许多饮料和溶剂中的主要成分之一,同时也被广泛用于医药、工业和能源等领域。
了解酒精的化学方程对于理解其性质和用途至关重要。
本文将详细介绍酒精的化学方程及其相关知识。
2. 酒精的结构和命名酒精的分子式为C2H5OH,它由一个乙基基团(C2H5)和一个羟基(OH)组成。
乙基基团是由两个碳原子和五个氢原子组成的烷基基团,而羟基则是一个氧原子与一个氢原子形成的羟基团。
根据IUPAC命名规则,酒精可以被称为乙醇。
乙代表含有两个碳原子,而醇表示它是一个羟基取代了烷烃中一个氢原子的化合物。
3. 酒精的制备3.1 发酵法制备乙醇发酵法是制备乙醇的一种常用方法,主要用于酿造酒类饮品。
其化学方程如下:C6H12O6 → 2 C2H5OH + 2 CO2发酵法利用葡萄糖(C6H12O6)作为原料,通过酵母菌的作用将葡萄糖分解为乙醇和二氧化碳。
这个过程通常需要在适宜的温度和湿度条件下进行。
3.2 合成法制备乙醇除了发酵法外,还可以通过合成方法制备乙醇。
其中一种常用的方法是通过乙烯(C2H4)的水合反应得到乙醇,反应方程式如下:C2H4 + H2O → C2H5OH这个反应需要催化剂存在,并且在适宜的温度和压力条件下进行。
4. 酒精的性质4.1 物理性质乙醇是一种无色、挥发性液体,在室温下呈现出特殊的气味。
它具有较低的沸点(78.37摄氏度)和冰点(-114.1摄氏度),因此在常温下易于挥发和冷却。
乙醇可以与水混溶,在一定比例下形成可燃的气体。
4.2 化学性质乙醇是一种亲水性有机溶剂,具有良好的溶解能力。
它可以与许多有机和无机物质反应,产生各种化学变化。
4.2.1 氧化反应乙醇可以被氧化为乙醛(C2H4O)和乙酸(C2H4O2)。
其中,乙醛是乙醇的部分氧化产物,其反应方程式如下:C2H5OH + [O] → CH3CHO + H2O而乙酸则是完全氧化后的产物,反应方程式如下:C2H5OH + 2[O] → CH3COOH + H2O4.2.2 脱水反应在适当的条件下,乙醇可以发生脱水反应生成乙烯。

第二章 化学反应速率与化学平衡 测试题一、单选题(共15题)1.不能用勒夏特列原理来解释的选项是 A .氨水应密闭保存,放置在低温处 B .用排饱和食盐水的方法收集氯气C .对H 2(g)+I 2(g)⇌2HI(g)平衡体系加压,混合气体颜色加深D .饱和硫酸铜溶液投入CuSO 4晶体,析出CuSO 4•5H 2O2.一定条件下,反应()()()22H g Cl g 2HCl g +=的速率方程为()()n m22v=kc H c Cl ⋅,k为速率常数(只与温度、催化剂、接触面积有关,与浓度无关),m 、n 是反应级数,可以是整数、分数。
实验测得速率与浓度关系如表所示:下列说法错误的是A .其他条件相同,升高温度,速率常数(k)增大B .其他条件相同,加入催化剂,速率常数(k)增大C .根据实验结果,()()22v=kc H c Cl ⋅D .表格中,a=0.93.乙烯气相直接水合反应制备乙醇:24225C H (g)+H O(g)C H OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如图【起始时,()()224n H O =n C H =1mol ,容器体积为2L 】。
下列分析正确的是A.乙烯气相直接水合反应的H0∆>B.图中压强的大小关系为123p>p>pC.图中a点对应的平衡常数5 K=8D.达到平衡状态a、b所需要的时间:a b<4.H2与ICl的反应分①、①两步进行,其能量曲线如图所示,下列有关说法错误的是A.反应①、反应①均为放热反应B.反应①、反应①均为氧化还原反应C.H2与ICl的总反应速率快慢取决于反应①D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-15.某温度下,在体积为2L的刚性容器中加入1mol环戊烯()和2molI2发生可逆反应(g)+I2(g)(g)+2HI(g)△H>0,实验测定容器内压强随时间变化关系如图所示。
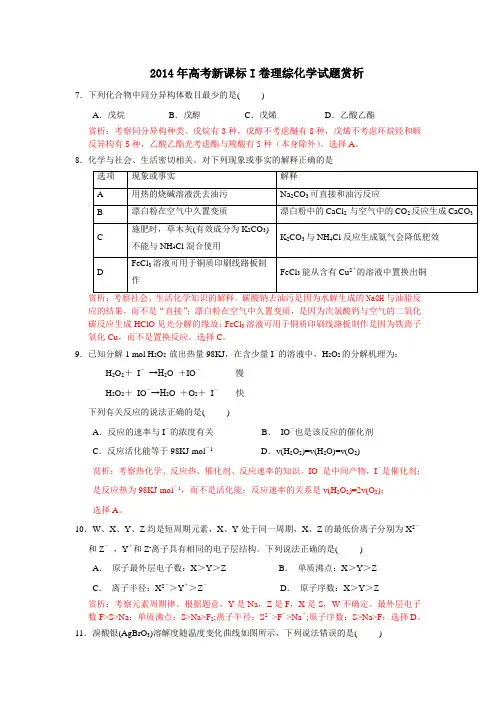
2014年高考新课标I卷理综化学试题赏析7.下列化合物中同分异构体数目最少的是( )A.戊烷B.戊醇C.戊烯D.乙酸乙酯赏析:考察同分异构种类。
戊烷有3种,戊醇不考虑醚有8种,戊烯不考虑环烷烃和顺反异构有5种,乙酸乙酯光考虑酯与羧酸有5种(本身除外)。
选择A。
8.化学与社会、生活密切相关。
对下列现象或事实的解释正确的是应的结果,而不是“直接”;漂白粉在空气中久置变质,是因为次氯酸钙与空气的二氧化碳反应生成HClO见光分解的缘故;FeCl3溶液可用于铜质印刷线路板制作是因为铁离子氧化Cu,而不是置换反应。
选择C。
9.已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O +IO-慢H2O2+IO-→H2O +O2+I-快下列有关反应的说法正确的是( )A.反应的速率与I-的浓度有关B.IO-也是该反应的催化剂C.反应活化能等于98KJ·mol-1D.v(H2O2)=v(H2O)=v(O2)赏析:考察热化学、反应热、催化剂、反应速率的知识。
IO-是中间产物,I-是催化剂;是反应热为98KJ·mol-1,而不是活化能;反应速率的关系是v(H2O2)=2v(O2);选择A。
10.W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。
下列说法正确的是( )A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>ZC.离子半径:X2->Y+>Z-D.原子序数:X>Y>Z赏析:考察元素周期律。
根据题意,Y是Na,Z是F,X是S,W不确定。
最外层电子数F>S>Na;单质沸点:S>Na>F2;离子半径:S2->F->Na+;原子序数:S>Na>F;选择D。
11.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )A .溴酸银的溶解时放热过程B .温度升高时溴酸银溶解速度加快C .60 ℃时溴酸银的K sp 约等于6×10-4D .若硝酸钾中含有少量溴酸银,可用重结晶方法提纯赏析:以溴酸银为材料考察沉淀溶解平衡。

试卷第1页,共9页第二章《化学反应的方向、限度与速率》测试题一、单选题1.H 2与ICl 的反应分①、①两步进行,其能量曲线如图所示,下列有关说法错误的是A .反应①、反应①均为放热反应B .反应①、反应①均为氧化还原反应C .H 2与ICl 的总反应速率快慢取决于反应①D .反应H 2(g)+2ICl(g)=I 2(g)+2HCl(g)的ΔH =-218kJ·mol -12.3.25 g 锌与100 mL 1 mol·L -1的稀硫酸反应,为了加快反应速率而不改变H 2的产量,可采取的措施是 A .滴加几滴浓盐酸 B .滴加几滴浓硝酸 C .滴加几滴硫酸铜溶液D .加入少量锌粒3.日常生活中的下列做法,与调控化学反应速率无关的是 A .燃煤时将煤块粉碎为煤粉B .制作绿豆糕时添加适量的食品防腐剂C .空运水果时在包装箱中放入冰袋D .炼铁时采用增加炉子高度的方法减少尾气排放 4.乙烯气相直接水合反应制备乙醇:24225C H (g)+H O(g)C H OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如图【起始时,()()224n H O =n C H =1mol ,容器体积为2L 】。
下列分析正确的是A .乙烯气相直接水合反应的H 0∆>试卷第2页,共9页B .图中压强的大小关系为123p >p >pC .图中a 点对应的平衡常数5K=8D .达到平衡状态a 、b 所需要的时间:a b < 5.下列叙述及解释正确的是 A .2242NO (g)(红棕色)N O (g)(无色) 0H ∆<,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 B .22H (g)+I (g)2HI(g) 0H ∆<,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 C .22C(s)+O (g)2CO(g),在达到平衡后,加入碳,平衡向正反应方向移动D .223N (g)+3H (g)2NH (g),在达到平衡后,保持压强不变,充入2O ,平衡向左移动6.在 3 个初始温度均为 T ①的容器中发生反应:2SO 2(g) + O 2(g) ⇌ 2SO 3(g) ΔH < 0。
4、某可逆反应:的均匀表面吸附机理动力学方程式为:)1()1()/(2R R B B S S A A R S B A A P b P b P b P b K P P P P k r ++++-=试写出反应机理及控制步骤,并证明之。
〖解〗22211112211212122121122(222σσσσσσσσσσσσσ+⇔+⇔++⇔+⇔+⇔+R R S S R S B A B B A A 控制步骤)BB R R V SS A A V V R S B A A P b P b P b P b k k r ++=++=-=1111211221θθθθθθθ,BB R R RR R BB R R BB B SS A A SS S SS A A AA A P b P b P b P b P b P b P b P b P b P b P b P b ++=++=++=++=1111θθθθ,,)1()1()(2B B R R S S A A R S B A A P b P b P b P b K P P P P k r ++++-=5、丁烯在某催化剂上制取丁二烯的总反应方程式为2648412H H C H C k k +↔,假设丁烯脱氢化学反应按如下步骤进行:(a)()()8484H C H C ↔+σσA A ⇔+(b) C B A +⇔σσ (c)σσ+⇔B B写出(b)为控制步骤的均匀吸附动力学方程,若反应物和产物的吸附都很若,问此时反应对丁烯是几级反应。
解〗V B B B V A A A P b P b θθθθ==,BB A A V CB A A P b P b P k k r ++=-=1121θθθBB A A BB B B B A A A A A P b P b P b P b P b P b ++=++=11θθ,BB A A CB A A A P b P b P P k P b k r ++-=121当反应物与产物吸附都很若时,即当11≈++B B A A P b P b 时,动力学方程可写为:P P k P b k r B A A A 21-= 所以此时对丁烯是一级反应。
乙烯的制备方法有哪些?一、直接蒸馏法通过直接蒸馏法进行乙烯的制备是一种常用的方法。
采用此法可以利用石油、天然气、煤、矿石等作为原料,通过高温蒸馏的过程,将乙烷转化成乙烯。
在蒸馏过程中,可以利用催化剂来促进反应速度,提高乙烯的产率。
二、石油裂解法石油裂解法是一种常见的乙烯制备方法。
利用此方法可以将石油中的长链烃分子分解成较短链分子,并进一步转化成乙烯。
裂解反应通常在高温和高压的条件下进行,利用催化剂可以提高反应效率和产率。
石油裂解法具有反应速度快、产率高的特点。
三、乙烯水合物法乙烯水合物法是一种利用乙烯和水直接反应生成乙醇的方法。
在此过程中,乙烯与水在特定催化剂的存在下进行氧化反应,生成乙醇。
乙烯水合物法是一种环保的制备方法,由于其通过水来制备乙烯醇,可以有效减少对环境的污染。
四、烷基化法烷基化法是一种利用乙酸酯与甲醇在催化剂的存在下反应生成乙酸甲酯,然后再将乙酸甲酯进行分解得到乙烯的方法。
烷基化法具有操作简便、产率高的特点,在工业生产中得到广泛应用。
五、乙醇脱水法乙醇脱水法是一种将乙醇脱水生成乙烯的方法。
在此过程中,乙醇经过蒸馏分离得到纯乙醇后,通过高温或催化剂的存在下进行脱水反应,生成乙烯。
乙醇脱水法是一种简便易行的制备乙烯的方法,但由于乙醇的来源有限,制备规模相对较小。
总结起来,乙烯的制备方法主要包括直接蒸馏法、石油裂解法、乙烯水合物法、烷基化法和乙醇脱水法。
这些方法各有其特点和适用范围,可以根据实际需要选择合适的方法进行乙烯的制备。
在未来,随着科学技术的不断发展,可能会出现更多的制备方法,为乙烯工业生产带来更多的选择和发展机会。
化工设计:5x104t/a合成乙醇工艺设计2013437033201343703100皿皿皿2013437025201343702900201343703920134370412013437043 PID叩PFD叮皿20134370352013437023201343704520134370375x104t/a 合成乙醇工艺设计1■工艺方案的选择乙醇是重要的有机溶剂,又是医药、染料、涂料、香料、合成橡胶、洗涤剂等有机产品的基本原料或中间体。
在化学工业中主要用于制造乙醚,乙醛,醋酸,乙二醇醚、乙胺等。
本实验采取乙烯气相直接水合法来合成乙醇。
乙烯气相直接水合法制取乙醇的工艺流程叙述如下。
实验分为合成、精制和脱水三咅盼。
反应器的操作条件:反应温度325°C ,反应压力6.9MPa,催化剂是磷酸-硅藻土催化剂。
转化率4%~5%,选择性95%-97%。
因反应液中含有磷酸,所以在工艺流程中设臵一个洗涤塔(又称中和塔)用碱水溶液或含碱稀乙醇溶液中和。
这一工序一定要放在换热器后,因高温易使磷酸因高温易使磷酸盐在换热器表面结垢,甚至会堵塞管道。
含乙醇10%~15%的粗乙醇水溶液,分别由洗涤塔和分离塔底进入乙醇精制部分。
精制部分的工序有a 萃取分离出乙醚和乙醛,萃取剂为水(可增大乙醚和乙醛与乙醇的相对挥发度),两塔串联,第二萃取塔塔顶出乙醚、乙醛和水(萃取率达90%以上),经冷却冷凝分出油相(有机相)和水相,有机相中主要为乙醚,返回反应器,水相经蒸馏,塔顶得乙醛-乙醚共沸物,另行处理,塔釜为含乙醚的水,返回反应系统;b ■乙醇的提浓和精制。
由萃取塔来的乙醇水溶液含少量乙醛,在精馏时加氢氧化钠溶液,可除去乙醛(碱能催化乙醛发生缩合反应住成高沸点缩醛)。
精馏塔顶部出料乙醇中仍含有少量轻组分,返回萃取部分。
由塔上部引出乙醇流股,即为成品乙醇(95%),乙醛含量小于20~40ppm 。
2■流程方块图3■厂址选择厂址选择在山东省东营垦利双河镇集贤村,占地200亩。
有机化学小结小结题目:醇的制备方法前言本次课题我们小组主要是研究醇的制备方法小结。
此次专题论文一是作为化学科学研究的一个重要环节,为我们毕业论文写作的重要保证;二是提升文献综述的写作能力,掌握文献查询方法。
当今社会日益严重的全球性能源和环境问题促使开发利用可再生的生物质资源成为当前研究的一个热点。
工业上,一些简单的醇,例如乙醇,以前是用粮食发酵的方法生产。
但因要耗费大量的粮食,已逐渐被淘汰。
尤其是随着石油工业的飞速发展,醇的来源越来越丰富,以醇为原料生产各种有机胺愈显出其优越性。
乙醇用作发动机燃料始于20世纪30年代,但是自上个世纪70年代开始,石油价格上升以及近年低碳经济对二氧化碳排放的限制,燃料乙醇越来越受到重视。
醇作为化学研究领域一个必不可少的项目,在很多产业都有重要的地位,各类科学学者和企业研究人员将一直致力于醇的研究和应用。
醇,有机化合物的一大类,是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物。
一般所指的醇,羟基是与一个饱和的,sp3杂化的碳原子相连。
若羟基与苯环相连,则是酚;若羟基与sp2杂化的烯类碳相连,则是烯醇。
酚与烯醇与一般的醇性质上有较大差异。
多元醇包括甘油、乙二醇、山梨醇、木糖醇、甘露醇、麦芽糖醇等。
长久以来,多元醇在化学化工行业有着非常重要的意义。
如乙二醇不仅是生产涤纶和炸药的原料,在食品和医药行业也应用广泛。
本次专题论文就有关醇的制备方法参考了大学有机化学教科书和大量权威资料文献,从常见醇的制备和工业上的制备两方面着手对其进行了归类总结。
考虑到醇是一个广义的概念,涉及的醇类涵盖了很多方面,本小组时间以及水平有限,就只对一些有普遍性、实质性的制备方法做了归类小结,论文不足欠缺之处,敬请广大读者批评指正。
醇的制备一种制备醇的方法,即从包含任意比例的碳数为n(其中n=3-6)的直链醛和碳数为n(其中n=3-6)的支链醛的混合醛获得碳数为n(其中n=3-6)的直链醇,碳数为n(其中n=3-6)的支链醇和碳数为2n(其中n=3-6)的支链醇的方法,该方法包括将混合醛送入蒸馏塔,从塔的底部取出富含直链醛的醛,使直链醛二聚化,随后氢化,获得碳数为2n的支链醇;同时,获得作为来自塔顶部的馏分的富含支链醛并且直链醛在馏分中的浓度至少为30重量%的醛,将该馏分氢化,提纯并分离所得的直链和支链混合醇,分别获得碳数为n的直链醇和碳数为n的支链醇。