最强ELISA工艺流程图
- 格式:pdf
- 大小:445.02 KB
- 文档页数:1


一、ELISA的原理ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。
结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。
在测定时,受检标本(测定其中的抗体或抗原)与固相载体表面的抗原或抗体起反应。
用洗涤的方法使固相载体上形成的抗原抗体复合物与液体中的其他物质分开。
再加入酶标记的抗原或抗体,也通过反应而结合在固相载体上。
此时固相上的酶量与标本中受检物质的量呈一定的比例。
加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。
由于酶的催化效率很高,间接地放大了免疫反应的结果,使测定方法达到很高的敏感度。
二、ELISA的类型ELISA可用于测定抗原,也可用于测定抗体。
在这种测定方法中有三个必要的试剂:(1)固相的抗原或抗体,即"免疫吸附剂"(immunosorbent);(2)酶标记的抗原或抗体,称为“酶联物”、“结合物”(conjugate);(3)酶反应的底物。
根据试剂的来源和标本的情况以及检测的具体条件,可设计出各种不同类型的检测方法。
用于临床检验的ELISA主要有以下几种类型:(一)双抗体夹心法测抗原双抗体夹心法是检测抗原最常用的方法,操作步骤如下:(1)将特异性抗体与固相载体联结,形成固相抗体。
洗涤除去未结合的抗体及杂质。
(2)加受检标本,保温反应。
标本中的抗原与固相抗体结合,形成固相抗原抗体复合物。
洗涤除去其他未结合物质。
(3)加酶标抗体,保温反应。
固相免疫复合物上的抗原与酶标抗体结合。
彻底洗涤未结合的酶标抗体。
此时固相载体上带有的酶量与标本中受检抗原的量相关。
(4)加底物显色。
固相上的酶催化底物成为有色产物。
通过比色,测知标本中抗原的量。
在临床检验中,此法适用于检验各种蛋白质等大分子抗原,例如HBsAg、HBeAg、AFP、hCG等。
只要获得针对受检抗原的异性抗体,就可用于包被固相载体和制备酶结合物而建立此法。

E L I S A试剂配制及实验流程—B D YThe document was finally revised on 2021ELISA试剂配制及实验流程ELISA是酶联接免疫吸附剂测定(( Enzyme-Linked Immunosorbnent Assay )的简称。
以双抗体夹心法举例说明。
试剂配制:(1) 包被缓冲液 + 碳酸盐缓冲液):Na2CO3NaHCO3加蒸馏水至1000ml。
(用时稀释成1x,加%BSA)(2) 洗涤缓冲液 0.15M PBST):%Tween-20加在PBS缓冲液1000ml中。
PBS缓冲液:KH2PO40.27gNa2HPO4·12H2O 3.58gNaCl 8gKCl加蒸馏水至1000ml。
(3) 封闭缓冲液:牛血清白蛋白(BSA) 2% 2g(或5%脱脂奶粉)加洗涤缓冲液100ml。
(4) 稀释液:牛血清白蛋白 %加PBS 缓冲液100ml。
(5) 底物缓冲液:Na2HPO4(无水L,带12结晶水L) 取柠檬酸(无水L,带1结晶水L) 取加蒸馏水至100ml。
(或Na2HPO4·12H2O 1.84g柠檬酸·H2O 0.51g加蒸馏水至100ml)(6) TMB(四甲基联苯胺)显色液(显蓝色):HRP-TMB(2mg/ml水)底物缓冲液30% H2O 2总体积1ml。
TMB, 1mg/ml-DMSO溶解(7) 或配OPD(邻苯二胺)显色液(显黄棕色)(现配避光):OPD(干粉) 0.004g底物缓冲液 10ml30% H2O2总体积10ml。
(8) 终止液(2M H2SO4):在水中,逐滴加入浓硫酸(18M,约98%),边加边摇。
操作步骤:1. 包被:用包被液将抗体(一抗)稀释至蛋白质含量为1~10μg/ml。
在每板的反应孔中加,4℃过夜(或37℃温育2~3小时)。
次日,弃去孔内溶液,用洗涤液冲洗3次,中间振荡。
(简称洗涤,下同)。
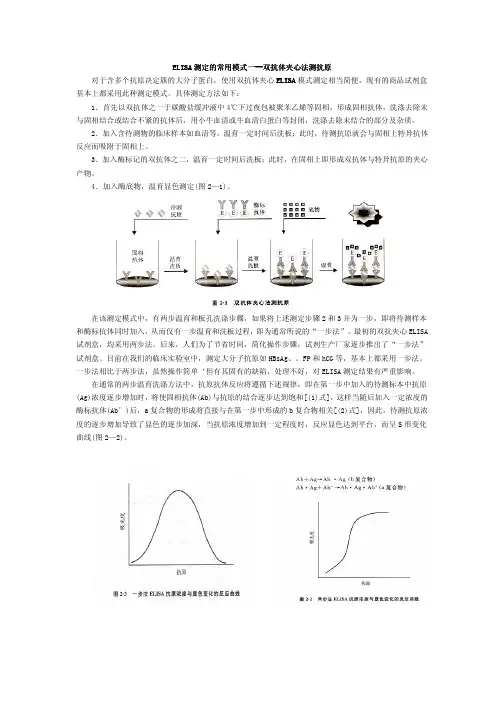
ELISA 测定的常用模式一测定的常用模式一------双抗体夹心法测抗原双抗体夹心法测抗原双抗体夹心法测抗原 对于含多个抗原决定簇的大分子蛋白,使用双抗体夹心ELISA 模式测定相当简便,现有的商品试剂盒基本上都采用此种测定模式。
具体测定方法如下:1.首先以双抗体之一于碳酸盐缓冲液中4℃下过夜包被聚苯乙烯等固相,形成固相抗体,洗涤去除未与固相结合或结合不紧的抗体后,用小牛血清或牛血清白蛋白等封闭,洗涤去除未结合的部分及杂质。
2.加入含待测物的临床样本如血清等,温育一定时间后洗板;此时,待测抗原就会与固相上特异抗体反应而吸附于固相上。
3.加入酶标记的双抗体之二,温育一定时间后洗板;此时,在固相上即形成双抗体与特异抗原的夹心产物。
4.加入酶底物,温育显色测定(图2—1)。
在该测定模式中,有两步温育和板孔洗涤步骤,如果将上述测定步骤2和3并为一步,即将待测样本和酶标抗体同时加入,从而仅有一步温育和洗板过程,即为通常所说的“一步法”。
最初的双抗夹心ELISA 试剂盒,均采用两步法。
后来,人们为了节省时间,简化操作步骤,试剂生产厂家逐步推出了“一步法”试剂盒。
目前在我们的临床实验室中,测定大分子抗原如HBsAg、。
FP 和hCG 等,基本上都采用一步法。
一步法相比于两步法,虽然操作简单‘但有其固有的缺陷,处理不好,对ELISA 测定结果有严重影响。
在通常的两步温育洗涤方法中,抗原抗体反应将遵循下述规律,即在第一步中加入的待测标本中抗原(Ag)浓度逐步增加时,将使固相抗体(Ab)与抗原的结合逐步达到饱和[(1)式],这样当随后加入一定浓度的酶标抗体(Ab’)后,a 复合物的形成将直接与在第一步中形成的b 复合物相关[(2)式],因此,待测抗原浓度的逐步增加导致了显色的逐步加深,当抗原浓度增加到一定程度时,反应显色达到平台,而呈S 形变化曲线(图2—2)。
而一步法双抗夹心ELISA 的反应曲线则为钟形曲线(图2—3)。


1溶液配制1.1PBS:磷酸盐缓冲呀(10X)加入双蒸水900ml左右,调节PH7.4,定容至1000ml。
1.2PBST:磷酸盐吐温缓冲液Tween-20为一种非离子表面活性剂,一种去污剂,能够在不破坏蛋白质的情况下,洗脱非特异性结合的抗体。
Tween-20既含亲水基团,也含疏水基团,其在洗涤中的作用机理是:借助其疏水基团与经疏水性相互作用被动吸附于聚苯乙烯固相上蛋白的疏水基团形成疏水键,从而削弱蛋白与固相的吸附,同时在其亲水基团与液相中水分子的结合作用下,促使蛋白质脱离固相而进入液相,这样就可达到去掉非特异吸附物的目的。
洗涤缓冲液:含0.05% Tween-20 的中性PBS(即1*PBST)配置:100ml 10*PBS; 2.5ml 20% Tween-20,定容至1L调节PH7.41.320% Tween-2010g Tween-20, 加蒸馏水约30ml, 可4℃过夜,溶解均匀后定容至50ml。
1.4包被缓冲液0.05mol/L碳酸缓冲液(PH9.6)配制:碳酸钠0.75g,碳酸氢钠1.46g,定容至500ml,测PH9.6.1.5封闭液要求:用4℃预冷的1*PBST配置成2%的BSA溶液配制:10ml 2%BSA封闭液:0.2g BSA粉末,溶解于10ml PBST中,摇晃溶解,后放入4℃冰箱(最好提前一天配制,防止泡沫过多)。
保存:4℃1.6Tris稀释液1.7血样稀释液A.小肽标签稀释液母液:60mg/ml(-80℃保存)配制:1ml 60ug/ml的小肽:1ml 4℃2% BSA 1*PBST+1ul小肽母液,混匀,4℃保存B.血清稀释液血清稀释液:5ug/ml(溶质是小肽,溶剂是封闭液)一块96孔板需要12ml血清稀释液,即11ml的封闭液,1ml 60ug/ml的小肽1.8显色液TMB,是辣根过氧化物酶的常用底物。
在辣根过氧化物酶或其他适当过氧化物酶的催化下,TMB会产生蓝色产物。


ELISA干货实验原理+实验步骤+注意事项ELISA是酶联接免疫吸附剂测定( Enzyme-Linked Immunosorbnent Assay )的简称。
它是继免疫荧光和放射免疫技术之后发展起来的一种免疫酶技术。
在检测时,受检标本(测定其中的抗原)与固相载体表面的抗体反应。
洗涤后加入酶标记的抗体,通过反应结合在固相载体上。
加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,可根据呈色的深浅进行定性或定量分析。
一、ELISA样本的处理ELISA的检测目的是为了实验提供准确的实验依据,为了保证实验数据的可靠性,在实验过程中必须坚持全面的质量控制和全过程质量控制,在收集标本前都必须有一个完整的计划注意事项1、每个样本量收集体积=100ulx检测种类,如果要做复孔,标本量收集体积=100ulx检测种类x22、样本收集后若在一周内进行检测可保存于2-8°C,若不及时检测,请进行分装,冻存于-20°或-80°C,避免反复冻融3、试剂盒的检测范围不等同于样本中待测物的浓度范围,建议实验前通过相关文献预估样本中待测物的浓度并通过预实验确定样本。
4、血清标本采集是应注意避免溶血,红细胞溶解是会释放出具有过氧化物酶活性的物质,溶血标本可能会增加非特异性显色5、为了保证尿液检测的准确性,必须正确收集尿液标本和保存,收集尿液的容器必须要清洁干燥,最好使用一次性的容器,避免因用药并清洁不到而造成的污染,尿液样本必须新鲜,留取后,应及时检测或保存6、标本宜在新鲜是检测如有细菌污染,菌体中可能含有内源性HRP,也会产生假阳性反应。
如在冰箱中保存过久,其中可能发生聚合,间接法ELISA中乐视本底加深,7、反复冻融会使蛋白效价降低,所以待测样本如需多次检测,宜少量分装冻存二、标本类型01、ELISA的常见标本液体类标本:血清、血浆、尿液、细胞上清、脑脊液等培养细胞组织标本02、ELISA标本的保存一般来说,再5天内测定的血清标本可放置于4°C,标本再冰箱中保存时间过长会导致血清IgG聚合,是间接法的试剂本底加深,超过一周测定的需-20°C保存,冻结血清溶解后,蛋白质局部浓缩,分不均,应充分混匀并避免产生气泡,浑浊或有沉淀的血清标本应先离心或过滤,澄清后再检测。


ELISA方法详细过程及步骤ELISA是酶联接免疫吸附剂测定( Enzyme-Linked Immuno sorbn ent Assay)的简称。
它是继免疫荧光和放射免疫技术之后发展起来的一种免疫酶技术。
此项技术自70年代初问世以来,发展十分迅速,目前已被广泛用于生物学和医学科学的许多领域。
(一) 原理ELISA是以免疫学反应为基础,将抗原、抗体的特异性反应与酶对底物的高效催化作用相结合起来的一种敏感性很高的试验技术。
由于抗原、抗体的反应在一种固相载体──聚苯乙烯微量滴定板的孔中进行,每加入一种试剂孵育后,可通过洗涤除去多余的游离反应物,从而保证试验结果的特异性与稳定性。
在实际应用中,通过不同的设计,具体的方法步骤可有多种。
即:用于检测抗体的间接法(图a)、用于检测抗原的双抗体夹心法(图b)以及用于检测小分子抗原或半抗原的抗原竞争法等等。
比较常用的是ELISA双抗体夹心法及ELI SA间接法。
(二) 操作步骤方法一用于检测未知抗原的双抗体夹心法:1. 包被:用0.05M PH9.6碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1~10μg/ml。
在每个聚苯乙烯板的反应孔中加0.1ml,4℃过夜。
次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3分钟。
(简称洗涤,下同)。
2. 加样:加一定稀释的待检样品0.1ml于上述已包被之反应孔中,置37℃孵育1小时。
然后洗涤。
(同时做空白孔,阴性对照孔及阳性对照孔)。
3. 加酶标抗体:于各反应孔中,加入新鲜稀释的酶标抗体(经滴定后的稀释度)0.1ml。
37℃孵育0.5~1小时,洗涤。
4. 加底物液显色:于各反应孔中加入临时配制的TMB底物溶液0.1ml,37℃10~30分钟。
5. 终止反应:于各反应孔中加入2M硫酸0.05ml。

抗原和抗体最佳工作浓度的确定抗原抗体反应要求在最适比例条件下进行,ELISA反应试剂多,其工作浓度不同对结果影响较大,因此必须对包被抗原(抗体)和酶标抗体(抗原)进行最佳工作浓度的滴定和选择,以达到最佳的测定条件。
1)方阵(棋盘)滴定法选择包被抗原的工作浓度用包被液将抗原作一系列稀释(1:50~l:800)后,按行进行包被、洗涤。
按列分别加入用稀释液1:100稀释的强阳性、弱阳性、阴性参考血清及稀释液(作空白对照),保温,洗涤。
加工作浓度酶标抗体,洗涤,加底物显色,加酸终止反应后读取A值。
选择强阳性参考血清A值;为0.8左右,阴性参考血清A值<0.1的包被抗原稀释度为工作浓度。
方阵(棋盘)法选择包被抗体和酶标抗体的工作浓度将抗体用包被液稀释为10mg/L、lmg/L、0.1mg/L三个浓度按行包被,每一个浓度包被三行(每行3孔),分别在每个浓度包被的第一、二、三行中分别加入强阳性抗原,弱阳性抗原和阴性对照,将酶标抗抗体用稀释液稀释为1:l 000、l:5000、l:10000三个浓度,分别加入每个浓度包被的第一、二、三列中。
加底物显色,加酸终止反应,分别读取A 值。
以强阳性抗原液A值在0.8左右,阴性参考A值<0.1的条件为最适条件。
据此选择包被抗体和酶标抗体的最佳工作浓度。
抗体的稀释度稀释液及稀释度的测定方法抗体的稀释度包括特异性抗体,中间抗体及标记抗体。
任何一种免疫组化方法要想得到令人满意的染色效果,必须将抗体进行最佳稀释。
一般来说,抗体的稀释度取决于下列因素。
(一)抗体的浓度(亦称滴度)每毫升溶液内所含抗体分子越多,滴度就越高,该抗体可高度稀释,尤其是特异性一抗的稀释度。
一般商品化抗体只知道每毫升含多少抗体蛋白量,不知道所含抗体分子。
自己制备抗体可通过琼脂糖双扩散或放射免疫法进行测定。
商品化抗体一般告知大约的稀释度,例如用PAP法可1:100~1:200稀释。
但往往购买到一种新抗体后,需要利用组织切片进行最佳稀释度的测定。
标准化操作规程--------ELISA试剂盒的生产本着进一步提高ELISA(含化学发光)试剂盒生产质量的目的,同时便于本部门更好的实施精细化管理,特制订以下标准化操作规程。
单就ELISA试剂盒的生产而言,此过程相对比较简单,生产的关键在于做好预实验和生产完成之后的质检。
预实验(此实验的实质是ELISA实验操作流程):1.包被抗体经过特殊处理了的采用间接包被法,即先包被浓度为1.6ug/ml的打底物(方阵法摸索出的最佳包被浓度)37℃放置2h 或者4℃过夜,然后用无关蛋白(一般为1%BSA)进行非特异性的封闭(37℃ 1h或4℃过夜),接着加入经过特殊处理了的包被抗体(通过方阵法摸索出最佳浓度,通常为0.1ug/ml或0.05ug/ml)。
没有经过特殊处理的包被抗体采用直接包被法,采用方阵法确定最佳包被浓度(包被浓度通常为0.5ug/ml---4ug/ml之间),封闭条件同间接包被法。
目前ELISA(含化学发光)试剂盒的检测方法一般为双抗体夹心法和竞争抑制法(直接竞争法和间接竞争法)。
a.双抗体夹心法:2.包被完成之后,加入与包被抗体相对应的经倍比稀释的标准品(一般我们可以通过查阅文献得知该指标的检测范围),每孔100ul,37℃放置2h 或者4℃过夜3.加入与包被抗体配对且浓度不同的生物素化的或者未经生物素化的抗体,每孔100ul,37℃放置1h,确定该检测抗体的最佳检测浓度3.用0.01M TBS 洗涤3次,每孔270ul,静置1-2min/次,加入不同浓度的HRP标记的亲和素或者相对应的HRP标记的第二抗体,每孔100ul,37℃放置1h,确定最佳检测浓度4.用0.01M TBS 洗涤5次,每孔270ul,静置1-2min/次,加入TMB 90ul/孔(或化学发光底物),37℃放置5-30min(化学发光实验为10min),根据颜色的深浅决定终止(2NH2SO4)的时间5.将酶标板置于酶标仪中于450nm处读取OD值,化学发光实验采用化学发光仪读取。
酶联产品主要生产工艺一、原理ELISA是酶联接免疫吸附剂测定(Enzyme-Linked Immunosorbnent Assay)的简称。
ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。
结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。
在测定时,受检标本(测定其中的抗体或抗原)与固相载体表面的抗原或抗体反应。
用洗涤的方法使固相载体上形成的抗原-抗体复合物与液体中的其他物质分开。
再加入酶标记的抗原或抗体,也通过反应结合在固相载体上。
此时固相上的酶量与标本中受检物质的量呈一定的比例。
加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。
由于酶的催化效率很高,间接地放大了免疫反应的结果,使测定方法达到很高的敏感度。
二、主要生产工艺(一)酶标板的制备:1.工艺流程(B)封闭液的配制↓(A)包被液的配制→(C)酶标板的包被→(D)酶标板封闭→(E)酶标板的干燥、包装(有些产品封闭前需先洗板)2.关键点控制(1)包被:1)确认包被液的相关信息(名称、浓度、批号、批量等);2)包被液量控制在要求范围内;3)温育或冷育的温度、时间在要求范围内。
关键设备:包被机、天平、加样器。
(2)封闭:1)确认洗板的次数(如有洗板);2)确认配制封闭液的相关信息(名称、浓度、批号、批量等);3)封闭液量控制在要求范围内;4)温育或冷育的温度、时间在要求范围内。
关键设备:包被机、洗板机、天平、加样器。
(3)干燥、包装:1)干燥的温湿度在要求范围内;2)干燥结束的酶标板逐一装入铝箔袋中同时放入一袋干燥剂,装袋同时要将酶标板标识不清楚的、板孔有缺损的挑出报废。
关键设备:包装机。
(二)酶标试剂的制备:1.工艺流程(A)液体的配制→(B)液体的分装2.关键点控制(1)液体配制过程物料量取准确;(2)确认配制溶液的外观符合要求;(3)确认配制试剂的相关信息(名称、浓度、批号、批量等);(4)控制液体分装量范围,应满足要求。
ELISA方法详细过程及步骤ELISA是酶联接免疫吸附剂测定( Enzyme-Linked Immunosorbnent Assay )的简称。
它是继免疫荧光和放射免疫技术之后发展起来的一种免疫酶技术。
此项技术自70年代初问世以来,发展十分迅速,目前已被广泛用于生物学和医学科学的许多领域。
(一) 原理ELISA是以免疫学反应为基础,将抗原、抗体的特异性反应与酶对底物的高效催化作用相结合起来的一种敏感性很高的试验技术。
由于抗原、抗体的反应在一种固相载体──聚苯乙烯微量滴定板的孔中进行,每加入一种试剂孵育后,可通过洗涤除去多余的游离反应物,从而保证试验结果的特异性与稳定性。
在实际应用中,通过不同的设计,具体的方法步骤可有多种。
即:用于检测抗体的间接法(图a)、用于检测抗原的双抗体夹心法(图b)以及用于检测小分子抗原或半抗原的抗原竞争法等等。
比较常用的是ELISA双抗体夹心法及ELISA间接法。
(二) 操作步骤方法一用于检测未知抗原的双抗体夹心法:1. 包被:用0.05M PH9.6碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1~10μg/ml。
在每个聚苯乙烯板的反应孔中加0.1ml,4℃过夜。
次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3分钟。
(简称洗涤,下同)。
2. 加样:加一定稀释的待检样品0.1ml于上述已包被之反应孔中,置37℃孵育1小时。
然后洗涤。
(同时做空白孔,阴性对照孔及阳性对照孔)。
3. 加酶标抗体:于各反应孔中,加入新鲜稀释的酶标抗体(经滴定后的稀释度)0.1ml。
37℃孵育0.5~1小时,洗涤。
4. 加底物液显色:于各反应孔中加入临时配制的TMB底物溶液0.1ml,37℃10~30分钟。
5. 终止反应:于各反应孔中加入2M硫酸0.05ml。
6. 结果判定:可于白色背景上,直接用肉眼观察结果:反应孔内颜色越深,阳性程度越强,阴性反应为无色或极浅,依据所呈颜色的深浅,以“+ ”、“-”号表示。