2012年FDA批准新药简介
- 格式:ppt
- 大小:1.27 MB
- 文档页数:36
![抗凝血新药替格瑞洛专利工艺简介[整理]](https://uimg.taocdn.com/6966f84d52d380eb62946d69.webp)
抗凝血新药替格瑞洛专利工艺简介[整理] 替格瑞洛替格瑞洛是一种新型的、具有选择性的小分子抗凝血药,是第一个可逆的结合型口服P2Y12腺苷二磷酸受体拮抗剂。
是最近几年比较受关注的抗血小板凝聚药物,关于合成替格瑞洛的合成工艺也越发成熟。
对此我们进行关注了一下。
替卡格雷(Ticagrelor;也有翻译为替格瑞洛),属于环戊基三唑并嘧啶类化合物,化学名为(1S,2S,3R,5S)-3-[7-[(1R,2S)-2-(3,4-二氟苯基)环丙氨基]-5-(硫丙基)-3H-[1,2,3]三唑[4,5-d]嘧]-5-(2-羟基乙氧基)环戊烷-1,2-二醇,分子式:CHFNOS;分子量:522.574;CAS啶-3-基2328264登记号:274693-27-5,结构式如下。
是由英国阿斯利康制药公司(AstraZeneca)研制开发的一种新的治疗急性冠状动脉综合征的药物,该药于2011年7月20日被美国FDA批准上市,2012年11月,国家食品药品监督管理局( SFDA) 获准其在中国上市。
商品名为Brilinta。
原研厂家阿斯利康公司的专利WO9905143中涉及到了一条化合物I的制备路线该条路线步骤长,且其中涉及锇酸氧化,DIBAL-H还原,铁粉还原等有剧毒或者容易造成大量工业三废的反应,同时该路线总收率低,生产成本高,因此并不能作为合成化合物I的首选路线。
其后该公司又对该工艺进行了改进提出了另一种合成工艺,路线如下:该路线同样存在路线较长,总收率偏低的缺点,因此也不适宜作为大规模工业化生产的最优路线。
后来有文献提出了一个工艺,即以 2-丙硫基-4,6-二氯-5-硝基嘧啶( 2) 为原料,与( 3a,,4S,6,,6aS) -6-氨基-2,2-二甲基四氢-3aH-环戊〔d〕〔1,3〕二氧杂-4-醇偶联后,经还原、重氮化成环、胺化、亲核取代、溴化五步反应得 2-( ( ( 3a,,4S,6,,6aS) -6-( 7-溴-5-(丙硫基) -3H-〔1,2,3〕三唑〔4,5-d〕嘧啶-3-基) -2,2-二甲基四氢-3aH-环戊〔d〕〔1,3〕二氧杂-4-( 7) 反应后,经还原及脱丙基) 氧基) 乙酸甲酯,再与( 1,,2,) -2-( 3,4-二氟苯基) 环丙胺叉基保护得到1。



2012年10大处于晚期临床阶段的癌症药物今天,数以万计的实验药物正在进行各个阶段的临床试验,其中最大的一类是癌症治疗药物。
FierceBiotech的数据表明,目前有近千个癌症药物项目在进行中,FierceBiotech从中选取了最有希望的10个项目进行详细阐述。
FierceBiotech欢迎大家对此提出不同的看法。
不过,去年FierceBiotech选取的10个晚期临床阶段药物中有4个最终获得了FDA的批准:西雅图遗传学(Seattle Genetics)的Adcetris(brentuximab vedotin)、辉瑞(Pfizer)的Xalkori(克唑替尼,crizotinib)、Plexxikon的Zelboraf(vemurafenib,之前的代号名为PLX4032)和罗氏(Roche)的Erivedge(vismodegib)。
其余6个药物正在寻求监管部门的批准之中,而它们中的多数FierceBiotech也将其包括在今年的列表中。
和去年一样,FierceBiotech所选择的药物都是进入晚期临床阶段的药物,其中的绝大多数已经提交了具有说服力的安全性和有效性数据。
不过FierceBiotech的编辑们也选取了一些鲜为人知的药物如BBI608,因为这是个很好的例子,说明癌症干细胞靶向药物已经成熟。
大日本住友制药(Dainippon Sumitomo)以26多亿美元收购了波士顿生物技术(Boston Biomedical),籍此获得了这个在研药物,并对此寄予厚望。
1、药物名:BBI608开发商:大日本住友(Dainippon Sumitomo)和波士顿生物医学(Boston Biomedical)主要适应症:大肠癌关键日期:2012年2月29日,大日本住友宣布收购波士顿生物医学在癌症药物开发中,一个新兴的领域是靶向癌症干细胞(CSC)的药物。
癌症干细胞可以逃避化疗的攻击并演化成肿瘤细胞。
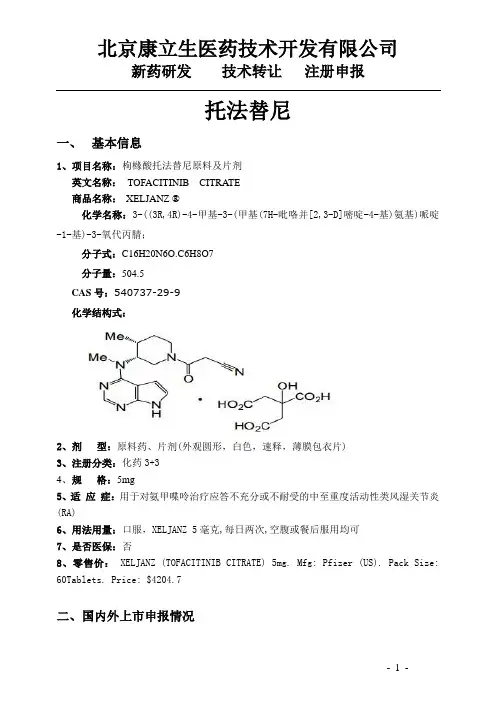
托法替尼一、基本信息1、项目名称:枸橼酸托法替尼原料及片剂英文名称:TOFACITINIB CITRATE商品名称:XELJANZ ®化学名称:3-((3R,4R)-4-甲基-3-(甲基(7H-吡咯并[2,3-D]嘧啶-4-基)氨基)哌啶-1-基)-3-氧代丙腈;分子式:C16H20N6O.C6H8O7分子量:504.5CAS号:540737-29-9化学结构式:2、剂型:原料药、片剂(外观圆形,白色,速释,薄膜包衣片)3、注册分类:化药3+34、规格:5mg5、适应症:用于对氨甲喋呤治疗应答不充分或不耐受的中至重度活动性类风湿关节炎(RA)6、用法用量:口服,XELJANZ 5毫克,每日两次,空腹或餐后服用均可7、是否医保:否8、零售价:XELJANZ (TOFACITINIB CITRATE) 5mg. Mfg: Pfizer (US). Pack Size: 60Tablets. Price: $4204.7二、国内外上市申报情况国外上市情况枸橼酸托法替尼由辉瑞公司研发,2012年11月6日,美国FDA批准tofacitinib(商品名Xeljanz)治疗对氨甲喋呤(methotrexate)无足够应答或不能耐受的成人中度至重度活动性类风湿关节炎。
国内上市情况国内注册申报情况三、政策法规行政保护:无新药监测期:无专利保护:本品化合物专利于2020年到期,晶型专利于2022年到期,按目前药品审评的进度判断上述专利对本品的开发基本没有影响;新用途专利不影响本品在现有适应症方面的应用;而工艺专利可通过一些制备方法手段避开专利的限制。
四、产品特点Xeljanz通过抑制JAK通路-细胞内在类风湿关节炎中发挥显著的作用的信号转导通路。
JAKs是胞内酶传递信号,产生细胞因子或与细胞膜上生长因子受体相互作用。
五、临床疗效Tofacitinib的III期临床试验(开发代码:CP-690,550)ORALStandard(A3921064)和ORALStep(A3921032)获得喜人的研究结果,该药是一种新型的在研口服蛋白酪氨酸激酶(JAK)抑制剂。


医药项目创业商业计划书范文案例怎么写商业计划书?医药项目的商业计划书怎么写?今天方案网小编给大家带来一份商业计划书范文,以供大家参考。
希望这篇药品项目的商业计划书例文,可以给您一些帮助。
下面让我们一起来看一下吧。
第一章执行摘要1.1公司简介1.2项目简介1.3市场容量1.4融资方案1.5经济效益第二章市场分析2.1生物制药行业分析2.1.1行业现状1.行业总体业绩目前,生物医药产品广泛应用于慢性疾病和传染疾病。
随着群体心理压力的加大、生活环境污染的加重及人口老龄化加速,近年来心脑血管疾病、恶性肿瘤和糖尿病等慢性疾病发病率大幅上升,产品市场需求广阔,产品销售收入保持较快增长。
根据国家统计局统计,2011年生物制药行业实现工业总产值1781.33亿元,实现销售收入1775.43亿元,同比增长17.15%;实现利润总额230.13亿元,同比增长11.34%。
2011年~2014年生物医药行业总销售收入入下图所示:2.行业规模根据国家统计局统计,2008年生物制药行业规模以上企业数量仅有661家,至2013年生物制药行业规模以上企业数量有753家。
行业企业保持着平稳的持续增长。
3.竞争格局国内的生物制药企业总数约700余家,但真正涉及到生物制药尖端领域的企业只有97家,已经取得生产生物基因工程药物试产或生产批文的制药企业仅为52家。
总销售额超过1亿元的不超过15家,过千万元的也只有30多家。
企业市场份额升华集团1.74% 诚志股份1.06% 健特生物0.67% 新亚药业0.66% 山松生物0.62% 其他95.25%行业竞争处于小、散的情况,行业巨头尚未出现。
排名前30位的企业销售收入均不超过5亿,差距不大,所占市场份额均不高。
4.生命周期从上节数据可以看出,行业整体产值增长速度较快、企业数量也呈平稳增长,市场还未形成寡头出现,行业还处于初创期向成长期过渡阶段,行业发展潜力巨大。
2.1.2行业发展趋势1.产业发展趋势1)生物制药产业呈现集群式发展。
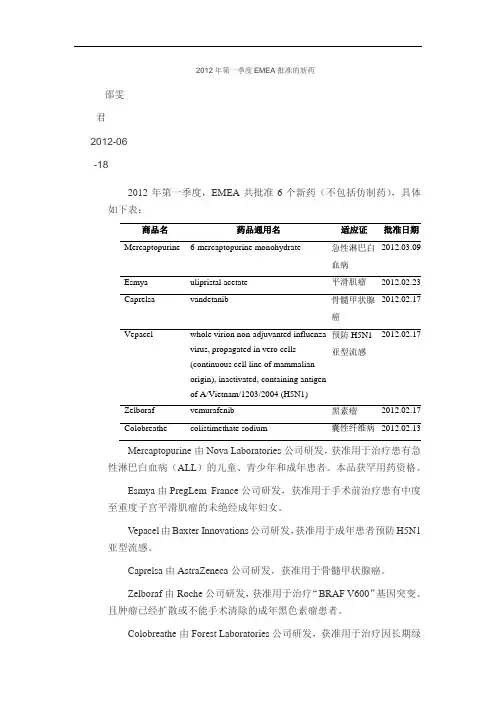
2012年第一季度EMEA批准的新药邵雯君2012-06-182012年第一季度,EMEA共批准6个新药(不包括仿制药),具体如下表:商品名药品通用名适应证批准日期Mercaptopurine 6-mercaptopurine monohydrate 急性淋巴白血病2012.03.09 Esmya ulipristal acetate 平滑肌瘤2012.02.23Caprelsa vandetanib 骨髓甲状腺癌2012.02.17Vepacel whole virion non-adjuvanted influenzavirus, propagated in vero cells(continuous cell line of mammalianorigin), inactivated, containing antigenof A/Vietnam/1203/2004 (H5N1) 预防H5N1亚型流感2012.02.17Zelboraf vemurafenib 黑素瘤2012.02.17 Colobreathe colistimethate sodium 囊性纤维病2012.02.13Mercaptopurine由Nova Laboratories公司研发,获准用于治疗患有急性淋巴白血病(ALL)的儿童、青少年和成年患者。
本品获罕用药资格。
Esmya由PregLem France公司研发,获准用于手术前治疗患有中度至重度子宫平滑肌瘤的未绝经成年妇女。
V epacel由Baxter Innovations公司研发,获准用于成年患者预防H5N1亚型流感。
Caprelsa由AstraZeneca公司研发,获准用于骨髓甲状腺癌。
Zelboraf由Roche公司研发,获准用于治疗“BRAF V600”基因突变、且肿瘤已经扩散或不能手术清除的成年黑色素瘤患者。
Colobreathe由Forest Laboratories公司研发,获准用于治疗因长期绿脓假单胞菌肺部感染所引起的囊性纤维病患者。

2020年12月 第17卷 第23期复方氨基酸注射液(18AA)是含有多种氨基酸的肠外营养制剂,属于营养用氨基酸注射液[1],包含8种必须和10种非必须氨基酸,2012年被列为国家基本药物。
该品种临床上应用广泛,常用于创伤、烧伤、术后患者蛋白质及营养缺乏,改善肠道功能失调引起的蛋白质消化和吸收障碍,蛋白质合成紊乱,治疗肝昏迷,提供慢性、消耗性疾病、恶性肿瘤及体质虚弱不能正常进食或超高代谢、病情危重患者的静脉营养。
该品种最早由广州侨光制药厂于20世纪90年代初研制,采用日本进口氨基酸原料,以异亮氨酸等18种氨基酸与山梨醇配制而成的灭菌水溶液,目前该品种在我国均采用国内生产的氨基酸原料生产该制剂。
在市售复方氨基酸注射液类中,获得国家药监局批准文号共计121个,共有62家生产企业。
包装有玻璃瓶与非PVC软袋包装,共三个规格:250 mL∶30 g(总氨基酸)、250 mL∶12.5 g(总氨基酸)、500 mL∶25 g(总氨基酸)。
本次研究共涉及市售的6家生产企业,29批次样品,两个规格:250 mL∶12.5 g(总氨基酸)28批次、500 mL∶25 g(总氨基酸)1批次。
1 现行标准检验复方氨基酸注射液(18AA)标准收载于中国药典2015年版二部,国外无收载。
标准包括主要性状、检查项与含量测定,根据现有标准对样品进行检验,均符合药典标准规定,但结果差异较大(详见表1)。
结果提示可能存在以下的问题需进一步分析与研究。
1.1 颜色不同批次间注射液颜色差异较明显,现行标准中规定为无色至微黄色,而不同生产厂家不同批次注射液颜色呈现不同程度的黄色。
标准规定为无色至微黄色,颜色差异虽然可以直接反映游离氨基酸氧化程度,但主观判定颜色差异极大。
变色原因主要与注射液中色氨酸有关[2,3]。
色氨酸生产使用的合成法和酶法均以吲哚为原料,但在分离纯化过程中吲哚和色氨酸不易分离,由于吲哚环容易发生氧化反应[4],这种氧化反应属自氧化反应,是个很缓慢的过程,影响的因素较多:氧气、重金属离子、pH、光照、加热均会加速氧化反应。

【药物名】Regorafenib【商品名】Stivarga【通用名】瑞格非尼【初次获批时间】2012年【类别】小分子抑制剂【靶点】VEGFR【分子结构】分子式:C21H15ClF4N4O3•H2O分子量为:500.83【生产公司】拜耳医疗保健制药有限公司【适应症】 Stivarga 是一种激酶抑制剂适用于既往曾用基于氟嘧啶、奥沙利铂和伊立替康化疗方案(抗VEGF疗法)以及如果是KRAS野生型(抗EGFR 疗法)的转移结肠直肠癌(CRC)患者的治疗。
Stivarga还可以用于治疗曾接受甲磺酸伊马替尼和苹果酸舒尼替治疗的局部晚期、不可移除的或转移性胃肠道间质瘤患者的治疗。
【剂量和药物管理】推荐剂量: 28天为一个周期,每个周期的前21天,每天一次性口服160毫克Regorafenib。
持续治疗直到出现疾病进展或不可耐受的药物毒性。
每天的同一时间服药,用药前用低脂餐(热量少于60卡路里,脂肪少于30%)。
不要再同一天服用两剂Stivarga。
剂量调整:出现以下情况,中断用药:出现2级的手足皮肤反应,且反复发作,即使减少用药量也无法在7天内缓解。
若出现3级的手足皮肤反应,至少停药7天;出现症状的2级高血压;3级或4级副反应。
将剂量减少到120毫克: 2级的手足皮肤反应首次复发;3级或4级副反应缓解后;3级天冬氨酸转氨酶(AST)/丙氨酸转氨酶(ALT)升高,且用药获益大于潜在风险。
将剂量减少到80毫克: 120毫克剂量时,2级的手足皮肤反应复发;120毫克时,3级或4级副反应恢复后;永久停药:无法耐受80毫克剂量;AST或ALT超过20倍的正常上限值;AST或ALT超过3倍的正常上限值,伴随着胆红素超过2倍的正常上限值;剂量减少到120毫克后,AST或ALT超过5倍的正常上限值;任何4级不良反应。
【剂型和规格】40毫克、淡粉色、椭圆形、有薄膜包衣,两边分别写有“BAYER”和‘40’。
【禁忌症】无。
【警告和注意事项】(1)出血:对严重或威胁生命出血永久终止Stivarga。

2012年FDA批准的39个新药1. 谷卡匹酶(Glucarpidase)——BTG International Inc (2)2. 巨大戟醇甲基丁烯酸酯(Ingenol Mebutate)——LEO Pharma AS (2)4. 中文名未知(Vismodegib)——Genentech Inc. (Roche Group) (3)5. 中文名未知(Ivacaftor)——Vertex Pharmaceuticals Inc (3)6. 他氟前列腺素(Tafluprost)——Merck & Co. Inc (3)7. 中文名未知(Lucinactant)——Discovery Laboratories Inc (3)8. 中文名未知(Peginesatide)——Affymax Inc (4)9. 中文名未知(Florbetapir F18)——Avid Radiopharmaceuticals(Eli Lilly) (4)10. 阿伐那非(Avanafil)——VIVUS Inc (4)11. 中文名未知(Taliglucerase alfa)——Protalix BioTherapeutics Inc. & Pfizer Inc. (5)12. 帕妥珠单抗(Pertuzumab)——Genentech Inc. (Roche Group) (5)13. 氯卡色林(Lorcaserin)——Arena Pharmaceuticals (5)14. 米拉贝隆(Mirabegron)——Astellas Pharma US, Inc (5)15. 中文名未知(Prepopik)——Ferring Pharmaceuticals (6)16. 中文名未知(Carfilzomib)——Onyx Pharmaceuticals (6)17. 阿地溴铵(Aclidinium Bromide)——Forest Pharmaceuticals (6)18. 阿柏西普(ziv-Aflibercept)——Sanofi-Aventis (6)19. 中文名未知(Stribild)——Gilead Sciences (6)20. 中文名未知(Tbo-filgrastim)——Sicor Biotech UAB (Teva Corporation) (7)21.利那洛肽(Linaclotide)——Ironwood Pharmaceuticals Inc. & Forest Pharmaceuticals Inc (7)22.中文名未知(Enzalutamide)——Astellas Pharma US, Inc. & Medivation, Inc (7)23.博舒替尼(Bosutinib)——Pfizer Inc (8)24.特立氟胺(Teriflunomide)——Sanofi Aventis (8)25.胆碱C11(Choline C11)——Mayo Clinic PET Radiochemistry Facility (8)26.中文名未知(Regorafenib)——Bayer HealthCare Pharmaceuticals (8)27.中文名未知(Ocriplasmin)——ThromboGenics Inc (9)28.吡仑帕奈(Perampanel)——Eisai Inc (9)29.高三尖杉酯碱(Omacetaxine Mepesuccinate)——Teva Pharmaceuticals (9)30.托法替尼(Tofacitinib)——Pfizer Inc (9)31.中文名未知(Cabozantinib)——Exelixis (9)32.帕纳替尼(Ponatinib)——ARIAD Pharmaceuticals (10)33.瑞西巴库(Raxibacumab)——Human Genome Sciences (GlaxoSmithKline) (10)34.帕瑞肽(Pasireotide)——Novartis Pharma Stein AG (10)35.替度鲁肽(Teduglutide)——NPS Pharmaceuticals (10)36.洛美他派(Lomitapide)——Aegerion Pharmaceuticals Inc (11)37.阿哌沙班(Apixaban)——Bristol-Myers Squibb & Pfizer Inc (11)38.中文名未知(Bedaquiline)——Janssen Therapeutics (Johnson & Johnson) (11)39.中文名未知(Crofelemer)——Salix Pharmaceuticals & Napo Pharmaceuticals, Inc (12)1. 谷卡匹酶(Glucarpidase)——BTG International Inc.甲氨蝶呤解毒药。
2019年9—10月FDA批准新药概况2019年9—10月,美国食品和药物管理局(FDA)批准了多个新的药物上市,这些新药的批准意味着更多的治疗选择和希望将带给患者。
下面是2019年9—10月FDA批准新药的概况。
1. Erdafitinib(红带非替尼)Erdafitinib是首个用于治疗特定类型的晚期尿路上皮癌(UC)的口服靶向治疗药物。
它适用于接受了化疗并且在FGFR阴性的患者中,癌症仍然进展的情况。
该药物的批准是基于临床试验数据,数据显示患者的整体反应率为40%,平均持续时间为5.4个月。
2. Trikafta(伊瓦卡夫托)Trikafta是一种用于治疗囊性纤维化(CF)的三联疗法。
它适用于年龄为12岁及以上,拥有两个F508del突变的CF患者。
Trikafta的批准是基于两个关键临床试验的数据,这些数据显示该药物在患者中显著改善肺功能。
3. Reblozyl(利保替哌普)Reblozyl是一种用于治疗成年患者的贫血型β-地中海贫血或依赖性β地中海贫血(TDT)的药物。
这是一种注射给药,适用于患者在不再依赖于红细胞输血的情况下,提高了血红蛋白水平。
该药物的批准是基于一项关键临床试验,数据显示患者血红蛋白水平得到长期维持。
4. Pretomanid Tablets(前曼尼片剂)Pretomanid Tablets是一种用于与质子泵抑制剂和多药联合治疗(PMDT)一起治疗多耐药结核病和极耐药结核病的药物。
该药物是唯一获得批准的,用于这种疾病的三联疗法之一,批准是基于临床试验数据,数据显示PMDT的治疗成功率接近90%。
5. Wakix(瓦克希片)Wakix是一种用于治疗成人的强迫性睡眠癖(OSA)的药物。
这是一种新的口服非优势性选择性肌动蛋白2/4(HAR2/4)受体拮抗剂,用于调节清醒和睡眠状态。
该药物的批准是基于两个临床试验的数据,数据显示Wakix显著缩短了OSA患者的睡眠时间。
6. Vyndaqel and Vyndamax (tafamidis)(俾迪拉、维达马)Vyndaqel and Vyndamax是一种用于治疗心脏淀粉样形态决性心脏病(ATTR-CM)的药物。
2012年美国食品药品管理局(FDA)批准新药回顾2012年,美国食品药品管理局(FDA)共批准了39种新药,这一数字成为该机构自1996年以来批准新药数量的第二高——1996年FDA共批准53种新药,为历史之最,包括阿托伐他汀(立普妥)这样的“重磅炸弹”级药物。
对于制药行业和患者来说,这足以令人感到意外和惊喜,因为在2011年和2010年,FDA分别只批准了30和21种新药,2002~2011年年平均批准数为23种。
对于2012年有39种新药获批,有人认为系原研药企业正蓄势待发,以应对近年来由于专利到期、仿制药竞争带来的销售损失。
分析师预计,2012年批准的药物中有一些将获得数十亿美元的销售额,不过,FDA发言人、药学博士Li sa Kubaska表示:“FDA在2012年批准的新分子实体不断增加令人鼓舞,但现在就说FDA批准新药增加进入到一个长期的趋势还为时过早。
”1 1月17日,BTG制药公司的Voraxaze(Glucarpidase,羧肽酶)注射剂获得批准,用于治疗因肾功能衰竭而导致的甲氨蝶呤中毒(血液中甲氨蝶呤水平过高)。
Voraxaze是一种酶,可将甲氨蝶呤分解成可排出体外的成分,从而迅速降低其血液水平。
2 1月23日,LEO Pharma AS公司的外用凝胶PICATO(Ingenol mebutate,巨大戟醇甲基丁烯酸酯)获得批准,用于治疗光化性角化病。
光化性角化病是一种由累积日光暴露导致的癌前病变,可能进展为鳞状细胞癌。
该药是从澳大利亚植物Euphorbia peplus的汁液中提取的活性成分,母核为巨大戟醇,可诱导细胞凋亡,但其治疗的具体作用机制尚不明确。
3 1月27日,辉瑞公司的Inlyta(Axitinib,阿西替尼)获得批准,用于治疗其他药物治疗无效的晚期肾癌(肾细胞癌)。
Inlyta是一种小分子酪氨酸激酶抑制剂,对多个靶点有效,包括VEGF受体1、2和3。
4 1月30日,基因泰克公司的Erivedge(Vismodegib,维莫德吉)获得批准,用于治疗成人最常见的皮肤癌——基底细胞癌。