中和滴定小结及误差分析
- 格式:ppt
- 大小:836.50 KB
- 文档页数:13



中和滴定误差分析1.试剂纯度误差:试剂的纯度是影响滴定结果准确性的重要因素。
试剂的纯度不高会引入实验误差,并导致滴定结果的偏差。
因此,在中和滴定实验中,最好使用纯度较高的试剂。
2.试剂稀释误差:在中和滴定实验中,试剂的浓度往往需要进行稀释。
试剂稀释误差引入的主要是试剂的体积变化误差和稀释过程中产生的副反应误差。
3.试剂滴定量误差:滴定过程中试剂的滴定量是影响滴定结果准确性的重要因素。
试液滴定量的误差主要由滴定管刻度的不准确性、人为操作失误等因素引起。
4.酸碱指示剂误差:酸碱指示剂在滴定实验中起到了指示终点的作用。
但是,酸碱指示剂的颜色变化对光的敏感度不同,因此在不同的光线条件下可能会产生误差。
在中和滴定实验中,误差的大小受多个因素的影响。
重要的影响因素包括:1.温度:温度的变化会导致试剂浓度的变化,进而影响滴定结果的准确性。
因此,在中和滴定实验中,应尽量控制实验室的温度稳定。
2.滴定过程中的氧气浓度:氧气的存在可能会影响试剂的浓度,进而影响滴定结果的准确性。
为了减少氧气对滴定结果的影响,可以在滴定过程中用氮气气氛代替空气。
3.操作技巧:由于滴定是一种比较精细的实验操作,操作技巧的高低也会对滴定结果产生影响。
正确的滴定操作应准确控制试剂的滴定速度、垂直滴定管以避免液滴凝结在玻璃管壁上等。
进行中和滴定误差分析的方法主要有以下几个步骤:1.收集数据:记录滴定实验中的相关数据,包括试剂的浓度、滴定体积等。
2.数据处理:对滴定实验中获得的数据进行计算、求平均值等处理,得到滴定结果。
3.误差分析:将滴定结果与理论值或其他准确测定方法的结果进行对比,计算出误差。

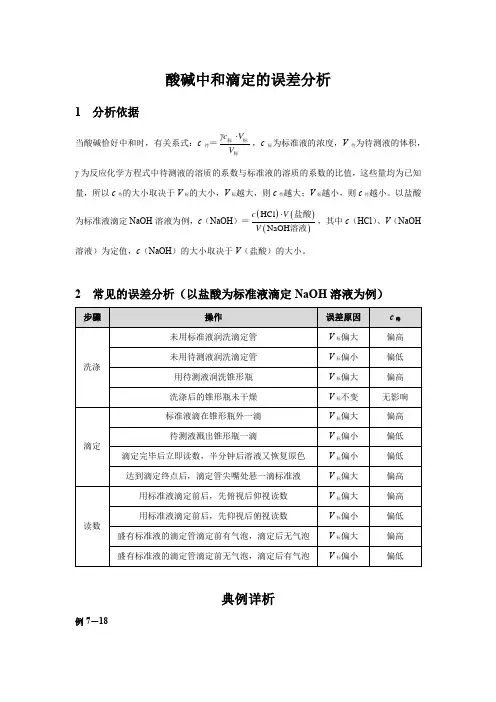
酸碱中和滴定的误差分析1 分析依据当酸碱恰好中和时,有关系式:c 待=,c 标为标准液的浓度,V 待为待测液的体积,γ为反应化学方程式中待测液的溶质的系数与标准液的溶质的系数的比值,这些量均为已知量,所以c 待的大小取决于V 标的大小,V 标越大,则c 待越大;V 标越小,则c 待越小。
以盐酸为标准液滴定NaOH 溶液为例,c (NaOH )=,其中c (HCl )、V (NaOH溶液)为定值,c (NaOH )的大小取决于V (盐酸)的大小。
2 常见的误差分析(以盐酸为标准液滴定NaOH 溶液为例)典例详析例7-18γc V V ⋅标标标()()()HCl NaOH c V V ⋅盐酸溶液某化学兴趣小组采用以下方法测定绿矾(FeSO 4·7H 2O )样品的纯度。
a .称取2.850 g 绿矾样品,溶解,在250 mL 容量瓶中定容配成待测液;b .量取25.00 mL 待测液于锥形瓶中;c .用硫酸酸化的0.010 0 mol ·L -1 KMnO 4溶液滴定待测液至终点,消耗KMnO 4溶液的平均体积为20.00 mL 。
下列说法不正确的是( ) A .a 步骤中定容时仰视,会使所配溶液浓度偏低 B .滴定时盛放KMnO 4溶液的仪器为酸式滴定管C .滴加最后半滴KMnO 4溶液时,溶液变为粉红色,即达到滴定终点D .样品中FeSO 4·7H 2O 的质量分数约为97.5%解析◆a 步骤中定容时仰视,会使配制溶液的体积偏大,浓度偏低,A 项正确。
酸性KMnO 4溶液具有强氧化性,应盛放在酸式滴定管中,B 项正确。
滴定终点的现象为滴入最后半滴KMnO 4溶液时,溶液变为粉红色且半分钟内不褪色,C 项错误。
n (MnO - 4)=20×10-3L ×0.010 0 mol ·L -1=2.0×10-4 mol ,根据滴定时的离子方程式5Fe 2++MnO - 4+8H +===5Fe 3++Mn 2++4H 2O 可得,25.00 mL 待测液中n (Fe 2+)=5×2.0×10-4 mol =1.0×10-3 mol ,则样品中n (Fe 2+)=10×1.0×10-3 mol =1.0×10-2 mol ,m (FeSO 4·7H 2O )=278 g ·mol -1×1.0×10-2 mol =2.780 g ,w (FeSO 4·7H 2O )=×100%≈97.5%,D 项正确。
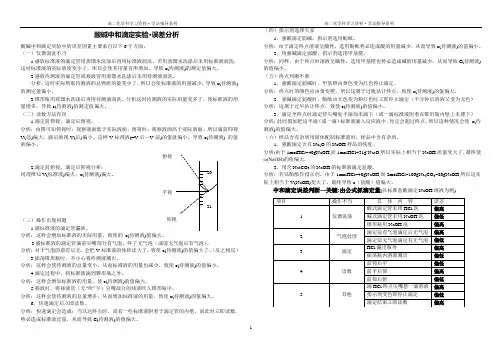
高二化学科学习资料·学法指导系列 高二化学科学习资料·学法指导系列1酸碱中和滴定实验·误差分析酸碱中和滴定实验中的误差因素主要来自以下6个方面: (一)仪器润洗不当1.盛放标准液的滴定管用蒸馏水洗涤后再用标准液润洗。
若用蒸馏水洗涤后未用标准液润洗,这时标准液的实际浓度变小了,所以会使其用量有所增加,导致c(待测液)的测定值偏大。
2.盛放待测液的滴定管或移液管用蒸馏水洗涤后未用待测液润洗。
分析:这时实际所取待测液的总物质的量变少了,所以会使标准液的用量减少,导致c(待测液)的测定值偏小。
3.锥形瓶用蒸馏水洗涤后再用待测液润洗。
分析这时待测液的实际用量变多了,使标准液的用量增多,导致c(待测液)的测定值偏大。
(二)读数方法有误1.滴定前仰视,滴定后俯视。
分析:由图可知仰视时:观察液面低于实际液面。
俯视时:观察液面高于实际液面。
所以滴前仰视V(前)偏大,滴后俯视V(后)偏小。
这样V 标准液(=V 后—V 前)的值就偏小,导致c(待测液) 的值就偏小。
2.滴定前俯视,滴定后仰视分析:同理推知V(标准液)偏大,c(待测液)偏大。
(三)操作出现问题1.盛标准液的滴定管漏液。
分析:这样会增加标准液的实际用量,致使的 c(待测液)值偏大。
2.盛标准液的滴定管滴前尖嘴部分有气泡,终了无气泡(或前无气泡后有气泡)。
分析:对于气泡的前有后无,会把V 标准液的体积读大了,致使c(待测液)的值偏大了。
(反之相反)3.振荡锥形瓶时,不小心将待测液溅出。
分析:这样会使待测液的总量变小,从而标准液的用量也减少,致使c(待测液)的值偏小。
4.滴定过程中,将标准液滴到锥形瓶之外。
分析:这样会增加标准液的用量,使c(待测液)的值偏大。
5.移液时,将移液管(无“吹”字)尖嘴部分的残液吹入锥形瓶中。
分析:这样会使待测液的总量增多,从而增加标准液的用量,致使c(待测液)的值偏大。
6.快速滴定后立即读数。

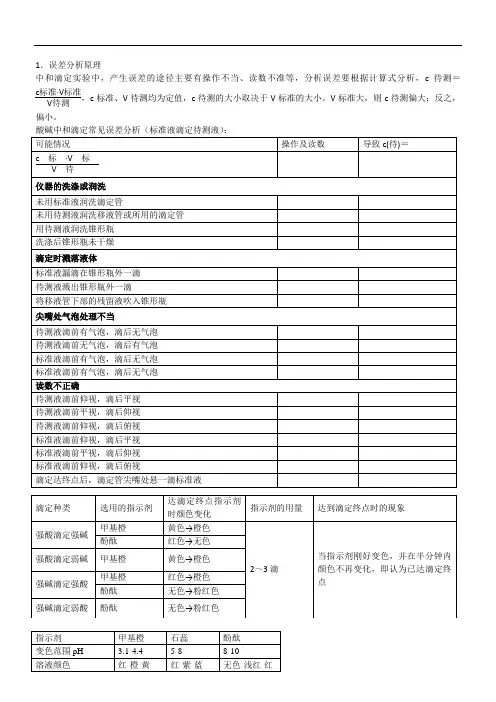
中和滴定的误差分析中和滴定的误差分析、滴定法测定待测液的浓度时,消耗标准溶液多,则结果偏 高,消耗标准溶液少,则结果偏低。
从计算公式分析,当酸碱恰好中和时,有如下关 系: c (标)V (标)x (标)=c (待)V (待)x (待) 其中c 、V 、x 分别表示溶液的物质的量浓度、溶液体积、酸或碱的元数。
因此,c (待 )= 口匚 " 汀:「 。
因。
(标卜V (待)、x (标)、x (待)均为定值,所 卩絢x (待) 以c (待)的大小取决于 V (标)的大小,V (标)大则c (待)大, 能引起误差的主要因素:1、来自滴定管产生的误差:(1)滴定管用蒸馏水洗后,未用标准液润洗 (2 )滴定管未用待测液润洗(3)盛标准液的滴定管滴定前有气泡,滴定后无气泡 盛标准液的滴定管滴定前有无气泡,滴定后有气泡 盛待测液的滴定管滴定前有气泡,滴定后无气泡 盛待测液的滴定管滴定前无气泡,滴定后有气泡 2、 来自锥形瓶中产生的误差: (1) 锥形瓶用蒸馏水洗后又用待测液洗。
(2) 锥形瓶未洗净,残留有与待测液中溶质反应的少量物质。
(3) 待测液加水稀释3、 读数带来的误差: (1) 用滴定管量取待测液: ①先俯视后仰视 (2) 标准液: ①先俯视后仰视V (标)小则c (待)小。
偏咼 偏低 偏咼 偏低 偏低 偏咼偏咼 偏低 无影响偏低②先仰视后俯视 偏咼 偏咼②先仰视后俯视 偏低4、 来自配制标准液产生的误差 配制0.1mol/L 的NaOH 溶液500mL ,需要(1) NaOH 已部分潮解 (2) NaOH 中含有杂质: ① 杂质不与盐酸反应② 所含杂质消耗1mol 盐酸需质量大于40g ③ 所需杂质消耗1mol 盐酸需质量小于40g(3) 砝码有油污NaOH 质量 2.0g偏咼 偏咼偏高(例如: 偏低(例如:Na 2O ) 偏低Na 2CO 3、NaHCO 3)。

1.误差分析原理中和滴定实验中,产生误差的途径主要有操作不当、读数不准等,分析误差要根据计算式分析,c待测=c标准·V标准V待测,c标准、V待测均为定值,c待测的大小取决于V标准的大小。
V标准大,则c待测偏大;反之,偏小。
标标待二、关于pH值的计算1、酸性溶液:按C→C H+→pH2、碱性溶液:按C→C OH-→C H+→pH3、强酸、强碱溶液的稀释后的溶液:对于酸溶液中的C H+,每稀释10n倍,pH增大n个单位,但增大后不超过7,酸仍为酸!对于碱溶液中的C OH-,每稀释10 n倍,pH减少n个单位,但减少后不小于7,碱仍为碱!PH值相同的强酸与弱酸(或强碱与弱碱),稀释相同的倍数,pH变化为强酸变化大,弱酸变化小。
极稀溶液中的pH值的计算,应考虑水的电离。
4、强酸与强弱溶液混合的计算:反应的实质:H++OH-=H2O三种情况:(1)恰好中和,pH=7(2)若余酸,先求中和后的C H+,再求pH。
(3)若余碱,先求中和后的C OH-,再通过K W求出C H+,最后求pH。
或先求pOH,再由pH=14-pOH。
5、已知酸和碱溶液的pH之和,判断等体积混合后的溶液的p H(1)若强酸与强碱溶液的pH之和大于14,则混合后显碱性,pH大于7。
(2)若强酸与强碱溶液的pH之和等于14,则混合后显中性,pH等于7。
(3)若强酸与强碱溶液的pH之和小于14,则混合后显酸性,pH小于7。
(4)若酸与碱溶液的pH之和等于14,强、碱中有一强、一弱,则酸、碱溶液混合后,谁弱显谁性。
这是因为酸和碱已电离的H+ 和OH- 恰好中和,谁弱谁的H+ 或OH- 有储备,中和后还能电离,显出酸、碱性来。
练习:1、把1mL0﹒05mol/L的H2SO4加水稀释制成100mL溶液,求稀释前和稀释后溶液的pH. 以及由水电离产生的C H+. 答案:4 6 10-1010-82、等体积混合0﹒1mol/L的盐酸和0﹒06mol/L的Ba(OH)2溶液后,溶液的pH等于多少?答案:123、室温时,将pH=5的H2SO4稀释10倍,则C H+:C(SO42-) =?将稀释后的溶液再稀释100倍,C H+:C(SO42-) =?答案:2:1 20:14、将10mL0﹒1mol/L的盐酸和10mL0﹒1mol/L Ba(OH)2溶液混合求pH?。

酸碱中和滴定实验误差分析以一元酸和一元碱的中的滴定为例因C标、V定分别代表标准液浓度、所取待测液体积,均为定值,代入上式计算。
但是实际中C标、V定都可能引起误差,一般可把各因素引起的误差转嫁到V读上,若V读偏大,则测定结果偏大;若V读偏小,则测定结果偏小,故通过分析V读的变化情况,可分析滴定的误差。
引起误差可能因素有以下几种:(1)视(读数)注意:①滴定管中液体读数时精确到0.01mL ②一般需滴定2-3次,取其平均值(2)洗(仪器洗涤)正确洗法:二管二洗——酸式滴定管和碱式滴定管先用蒸馏水清洗多次,再用待装液润洗几次。
一瓶一洗——锥形瓶只能用蒸馏水洗。
注意:一般滴定管装标准液,锥形瓶里装待测液。
错误洗法导致结果:①滴定管仅用水洗,使标准液变稀,故消耗标准液体积一定变大,V读变大,结果偏大。
②移液管仅用水洗,则待测液变稀,所取待测液溶质物质的量变少,V读变小,结果偏小。
③锥形瓶用待测液洗过,则瓶待测液的溶质量偏多,V读偏大,结果偏大。
④第一次滴定完后,锥形瓶液体倒去后,尚未清洗,接着第二次滴定,滴定结果如何,取决于上次滴定情况如何。
(3)漏(液体溅漏)①滴定过程中锥形瓶液体溅出,则结果偏小。
②终点已到,滴定管下端尖嘴中有液滴,则V读偏大,测定结果偏大。
(4)泡(滴定管尖嘴气泡)正确操作应在滴定前把尖嘴管中的气泡赶尽,最后也不能出现气泡。
如滴定开始有气泡,后气泡消失,则结果偏大。
若先无气泡,后有气泡,则结果偏小。
(5)色(指示剂变色控制与选择)滴定时,眼睛应紧盯着锥形瓶溶液的颜色变化。
指示剂变色后应半分钟不复原。
如变色后立即复原,则结果偏小。
另外,同一种滴定,选择的指示剂不同,测定结果不同。
(6)杂(标准物含杂质)用于配制标准液的固体应该是纯净物。
但其中有可能混有杂质,称量时又按需标准物固体质量来称取的,帮一般均会产生误差,在此杂质又分两种情况:①杂质与待测液不反应如NaOH中含NaCl,所配的NaOH溶液浓度变小,滴定盐酸时,NaCl不参与反应,所需标准液的体积偏大,故测定结果偏大。
酸碱中和滴定实验误差分析及原因
酸碱中和滴定实验是化学课堂中经常进行的一种实验,它能用来确定一种溶液中某一特定元素或离子的含量,是一种相当精确的实验方法。
一般情况下,酸碱中和滴定实验很少会出现误差,但实验者也无法避免这种情况,因此,有必要对误差进行分析,以便知晓其原因并进行相应的修正。
首先,要进行误差分析,需要了解酸碱中和滴定实验的原理。
根据实验步骤,溶液会经历中和反应,即酸和碱会相互抵消,从而形成稳定的盐和水,使电导率发生变化,这时可以测定溶液中某一特定元素或离子的含量。
而实验中可能出现的误差,一般可以归结于量等因素。
首先,在实验准备过程中,我们要用到酸、碱和滴定液,误差的可能性存在于量的控制,如果把量控制的不准确,计算出来的数据就会存在偏差,进而影响结果的准确性。
此外,如果量控制不准确,还会给滴定溶液带来误差,这是由于在稀释时,溶液的比容会受到影响,从而导致测量结果的不准确。
其次,在实验过程中,环境条件应该稳定,如温度会影响溶液的滴定过程,如果温度波动过大,滴定溶液则很可能会受到影响,从而导致测量结果的误差。
另外,在数据处理过程中,也可能会出现误差,由于实验者可能控制不到住所有的变量,差错也可能由子出现。
此外,在数据分析中,亦有可能出现误差,实验者可能在数据分析过程中出现失误,从而导致最终结果的偏差。
因此,在实验过程中,
记录严格合理,力求结果准确,有利于减少误差。
以上是酸碱中和滴定实验中可能出现的误差分析及原因,通过此次实验,可以了解到会出现误差的原因,从而采取相应的措施来修正,以便达到精确结果。