2016环境化学期末考试复习资料全解
- 格式:doc
- 大小:158.00 KB
- 文档页数:15

1.环境污染物:主要是人类生产和生活活动中产生的各种化学物质,也有自然界释放的物质。
2.优先污染物:也叫优控污染物,由于化学污染物种类繁多,世界各国都筛选出了一些毒性强、难降解、残留时间长、在环境中分布广的污染物优先进行控制,称为优先污染物。
3.逆温现象:在一定条件下,对流层中出现气温随高度增加而上升的现象。
4.光化学烟雾:参与光化学反应过程的一次污染物和二次污染物的混合物所形成浅蓝色有刺激性的烟雾污染现象。
5.水体富营养化:指在人类活动的影响下,生物所需的N、P等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,水质恶化,鱼类及其他生物大量死亡的现象。
6.环境效应:指由环境变化而产生的环境效果。
环境变化可以是自然过程,也可以是人为活动影响所引起环境系统结构和功能的变异。
7.温室效应:太阳短波辐射可以透过大气射入地面,而地面增暖后放出的长波辐射却被大气中的CO2等温室气体所吸收,从而产生大气变暖的效应。
8.电子活度:电极上电子有效浓度为电子活度。
9.天然水的碱度:碱度是表征水吸收质子的能力的参数,通常用天然水中所含能与强酸定量作用的物质总量来标定。
10.生物浓缩因子:有机毒物在生物体内浓度与水中该有机物浓度之比。
11.域剂量(浓度):阈剂量是指化学物质引起受试对象开始发生效应的剂量,可分为有害阈剂量和非有害阈剂量。
12.土壤活性酸度:由土壤溶液中的H+所引起的酸度,是土壤溶液的直接反映,又称有效酸度,通常用pH表示。
13.微生物修复技术:指通过微生物的作用清除土壤和水体中的污染物,或是使污染物无害化的过程。
14.总碱度:指水中所含能与强酸发生中和作用的全部物质,即能接受质子H+的物质的总量。
15.土壤盐基饱和度:土壤胶体上的交换性盐基离子占全部交换性阳离子的百分比。
16.协同作用:各种分散的作用在联合中使总效果优于单独的效果之和的相互作用。
17.绿色化学:利用化学原理从源头上减少和消除工业生产对环境的污染,反应物的原子全部转化为期望的最终产物。

第 1 页 共 4 页1、分配系数:非离子性有机化合物可以通过溶解作用分配到土壤有机质中,并经过一段时间达到分配平衡,此时有机化合物在土壤有机质和水中的含量的比值称为分配系数。
为分配系数。
2、标化分配系数:达分配平衡后,有机毒物在沉积物中和水中的平衡浓度之比称为标化分配系数。
称为标化分配系数。
3、辛醇-水分配系数:达分配平衡时,达分配平衡时,有有机物在辛醇中的浓度和在水中的浓度之比称为有机物的辛醇比称为有机物的辛醇--水分配系数。
水分配系数。
4、生物浓缩因子:某种元素或难降解物质在机体中的浓度与其在机体周围环境中的浓度之比称为生物浓缩因子。
中的浓度之比称为生物浓缩因子。
5、亨利定律常数:化学物质在气——液相达平衡时,该化学物质在水面大气中的平衡分压和其在水中的平衡浓度之比。
平衡分压和其在水中的平衡浓度之比。
6、水解常数:有机物在水中水解速率与其在水中浓度之比称为水解常数。
其在水中浓度之比称为水解常数。
7、直接光解:有机物直接吸收太阳能进行的分解反应行的分解反应8、敏化光解:水体中天然有机物质(腐殖质、微生物等),吸收太阳光后,被太阳光激发,又将其激发态的过剩能量转移给接受体分子,导致接受体分子的分解反应,称为敏化光解,也称间接光解。
应,称为敏化光解,也称间接光解。
9、光量子产率:进行光化学反应的光子占吸收总光子数之比称为光量子产率。
10、生长代谢:有机毒物作为微生物培养的唯一碳源,使有机毒物进行彻底的降解或矿化的过程。
或矿化的过程。
11、共代谢:某些有机物不能作为微生物培养的唯一碳源,必须有另外的化合物提供微生物培养的碳源或能源时,该有机物才能降解,这类现象称为共代谢才能降解,这类现象称为共代谢12、生物富集:指生物通过非吞食方式(吸收、吸附等),从周围环境中蓄积某种元素或难降解的物质,使其在机体内的浓度超过周围环境中浓度的现象。
又称为生物浓缩。
浓缩。
13、生物放大:同一食物链上的高营养级生物,通过吞食低营养级生物富集某种元素或难降解物质,使其在机体内的浓度随营养级数提高而增大的现象。
环境化学期末复习资料第⼆章⼤⽓环境化学1.⼤⽓主要成分N2(78.08%)、 O2(20.95%)、 Ar(0.943%)和CO2(0.0314%)。
⼏种惰性⽓体:He、Ne、Kr和Xe的含量相对⽐较⾼。
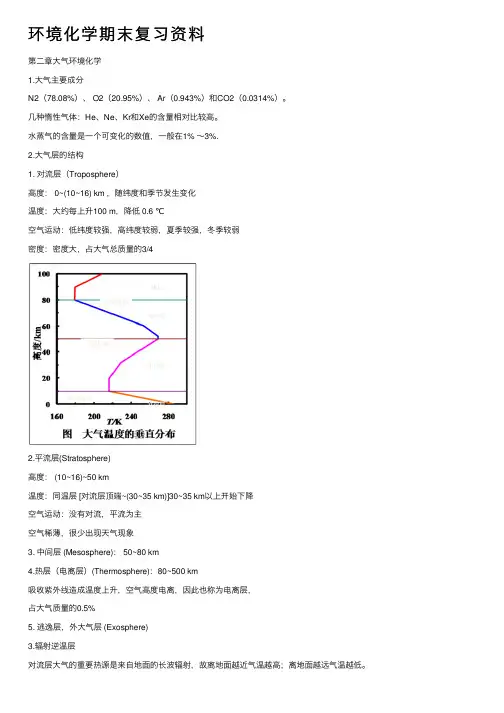
⽔蒸⽓的含量是⼀个可变化的数值,⼀般在1% ~3%.2.⼤⽓层的结构1. 对流层(Troposphere)⾼度: 0~(10~16) km ,随纬度和季节发⽣变化温度:⼤约每上升100 m,降低 0.6 ℃空⽓运动:低纬度较强,⾼纬度较弱,夏季较强,冬季较弱密度:密度⼤,占⼤⽓总质量的3/42.平流层(Stratosphere)⾼度: (10~16)~50 km温度:同温层 [对流层顶端~(30~35 km)]30~35 km以上开始下降空⽓运动:没有对流,平流为主空⽓稀薄,很少出现天⽓现象3. 中间层 (Mesosphere): 50~80 km4.热层(电离层)(Thermosphere):80~500 km吸收紫外线造成温度上升,空⽓⾼度电离,因此也称为电离层,占⼤⽓质量的0.5%5. 逃逸层,外⼤⽓层 (Exosphere)3.辐射逆温层对流层⼤⽓的重要热源是来⾃地⾯的长波辐射,故离地⾯越近⽓温越⾼;离地⾯越远⽓温越低。
随⾼度升⾼⽓温的降低率称为⼤⽓垂直递减率:Γ=-dT/dz式中:T——热⼒学温度,K;z——⾼度。
在对流层中,dT/dz<0,Γ = 0.6 K · (100m)-1,即每升⾼100 m ⽓温降低0.6 ℃。
⼀定条件下出现反常现象当Γ=0 时,称为等温层;当Γ<0 时,称为逆温层。
这时⽓层稳定性强,对⼤⽓的垂直运动的发展起着阻碍作⽤。
辐射逆温产⽣特点●是地⾯因强烈辐射⽽冷却降温所形成的。
●这种逆温层多发⽣在距地⾯ 100~150 m ⾼度内。
●最有利于辐射逆温发展的条件是平静⽽晴朗的夜晚。
●有云和有风都能减弱逆温。
●风速超过 2~3 m · s-1,逆温就不易形成4.主要⾃由基及其来源HO ?和HO2 ?来源1) HO ?来源清洁⼤⽓:O3 的光解是清洁⼤⽓中HO ?的重要来源O3 + h→ O ? + O2O ? + H2O → 2HO ?污染⼤⽓,如存在HNO2,H2O2 (HNO2 的光解是⼤⽓中HO ?的重要来源)HNO2 + h→ HO ? + NOH2O2 + h→ 2HO ?2)HO2 ?来源①主要来⾃醛类的光解,尤其是甲醛的光解H2CO + h→ H ? + HCO ?H ? + O2 + M → HO2 ? + MHCO ? + O2 → HO2 ? + CO②只要有 H ?和 HCO ?存在,均可与 O2 反应⽣成 HO2 ?③亚硝酸酯和 H2O2 光解CH3ONO + hv → CH3O ? + NOCH3O ? +O2 → HO2 ? + H2COH2O2 + hv → 2HO ?HO ? + H2O2 → H2O + HO2 ?④若有CO存在,则:HO ? + CO → CO2 + H ?H ? + O2 → HO2 ?R ?,RO ?,RO2 ?来源1) R ?烷基⾃由基来源:⼤⽓中存在最多的烷基是甲基,它的主要来源是⼄醛和丙酮的光解。

环境化学复习题库(含答案)环境化学复习题库第一章绪论一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占__80%-90%_。
2、环境化学研究的对象是: 环境污染物。
3、环境中污染物的迁移主要有机械、物理-化学和生物迁移三种方式。
4、人为污染源可分为_工业_、__农业_、__交通_、和__生活_。
5、如按环境变化的性质划分,环境效应可分为环境物理、环境化学、环境生物三种。
二、选择题1、属于环境化学效应的是 AA热岛效应 B温室效应 C土壤的盐碱化 D噪声A _污染水体后引起的 2、五十年代日本出现的痛痛病是由___A CdB HgC PbD As 3、五十年代日本出现的水俣病是由_B__污染水体后引起的A CdB HgC PbD As 三、问答题1、举例说明环境效应分为哪几类,2、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学一、填空题1、写出下列物质的光离解反应方程式:(1)NO + hν NO + O 2(2)HNO+ hν HO + NO 或HNO+ hν H + NO 2 2 2(3)HNO+ hν HO + NO 3 2(4)HCO + hν H + HCO 或HCO + hν H + CO 222(5)CHX + hν CH + X 332、大气中的NO可以转化成 HNO 、 NO和 HNO 等物质。
23333、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
4、乙烯在大气中与O的反应机理如下: 3CH(O)CH 232第 1 页共 10 页环境化学复习题库+ CH == CH HCO+HCOO O322225、大气颗粒物的去除与颗粒物的粒度、化学组成和性质有关,去除方式有和湿沉降两种。
干沉降6、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln-1 + ClCl + O O + ClO 32ClO +O O + Cl 27、当今世界上最引人瞩目的几个环境问题中的____温室效应_____、___臭氧层破坏_______、光化学烟雾___等是由大气污染所引起的。

二、简答题:1、持久性有机污染物(POPs)的重要特性是什么?答:(1)能在环境中持久存在;(2)能蓄积在食物链中对较高营养等级的生物造成影响;(3)能够经过长距离迁移到达偏远的极地地区;(4)在相应环境浓度下会对接触该物质的生物造成有害或有害效应。
2、简述多氯联苯(PCBs)在环境中的主要分布、迁移与转化规律。
答:分布:多氯联苯在大气和水中含量极少。
因其易被沉积物所吸附,所以在废水流入河口附近的沉积物中,含量较高。
迁移:水生植物通常可从水中快速吸收PCBs,并发生富集,通过食物链的传递,可到达水生生物和人体。
PCBs在使用和处理过程中,主要通过挥发进入大气,然后经干湿沉降转入湖泊、海洋;转入水体后被沉积物吸附,因此沉积物中的多氯联苯仍是今后若干年内食物链污染的主要来源。
转化:PCBs属于环境中的持久性污染物,其在环境中的转化途径主要是光化学分解和生物降解。
3、简述多环芳烃(PAH)的污染来源及在环境中的迁移与转化。
答:来源:天然来源:陆地和水生植物、微生物的生物合成;森林、草原的天然火灾,火山活动等。
人为来源:主要是矿物燃料、木材、纸张等含碳氢化合物的不完全燃烧或在还原气氛中的热解;工业锅炉和家用炉灶排放的烟气;垃圾焚烧;烟草焦油中;机动车辆尾气;此外,食品经炸、烟熏、烘烤等加工后也会生成PAH 。
迁移与转化:由不完全燃烧、热解等高温过程产生的PAH大多数随烟尘、废气排放到大气中,而释放到大气中的PAH 存在于固体颗粒物和气溶胶中。
大气中的PAH通过干、湿沉降进入土壤和水体及沉积物中,并进入生物圈。
进入水体或土壤中的PAH 可被光化学降解和微生物降解。
PAH在沉积物中的消除途径主要靠微生物降解。
4、简述汞在环境中的分布、迁移转化及其生物学效应。
答:分布:汞在自然界的丰度不大,但是分布很广,分布于环境各圈层中。
迁移:大气中的汞就是由汞的化合物挥发产生的,并且大部分吸附在颗粒物上。
气相汞的最终归趋是进入土壤和海底沉积物中。

环境化学复习资料资料讲解以下仅供参考,计算题什么的没有就不要在意啦......重要概念1.环境污染:由于⼈为因素使环境的构成或状态发⽣变化,环境素质下降,从⽽扰乱和破坏了⽣态系统和⼈们的正常⽣活和⽣产条件。
2.优先污染物:由于化学污染物种类繁多,世界各国都筛选⼀些毒性强、难降解、残留时间长、在环境中分布⼴的污染物优先进⾏控制,称为优先污染物。
3.污染物的转化:指污染物在环境中通过物理、化学或⽣物的作⽤改变存在形态或转变为另⼀种物质的过程。
4.环境效应:⾃然过程或⼈类的⽣产和⽣活活动会对环境造成污染和破坏,从⽽导致环境系统的结构和功能发⽣变化,谓之环境效应。
5.污染物的迁移:污染物在环境中所发⽣的空间位移及其所引起的富集、分散和消失的过程。
6.光化学烟雾(洛杉矶烟雾):含有氮氧化合物和碳氢化合物等⼀次污染物的⼤⽓,在阳光照射下发⽣光化学反应⽽产⽣⼆次污染物,这种由⼀次污染物和⼆次污染物的混合物所形成的烟雾污染现象。
7.伦敦烟雾(硫酸型烟雾):由于燃煤⽽排放出来的SO2,颗粒物以及由SO2氧化所形成的硫酸盐颗粒物所造成的⼤⽓污染现象。
8.酸⾬:指通过降⽔,如⾬、雪、雾、冰雹等将⼤⽓中的酸性物质迁移到地⾯的过程。
9.温室效应:⼤⽓中的CO2吸收了地⾯幅射出来的红外光,把能量截留于⼤⽓之中,从⽽使⼤⽓温度升⾼,这种现象叫做温室效应。
10.光化学反应:分⼦、原⼦、⾃由基或离⼦吸收光⼦⽽发⽣的化学反应。
11.⽔体富营养化:指⽣物所需的氮、磷等营养物质⼤量进⼊湖泊、河⼝、海湾等缓流⽔体,引起藻类及其他浮游⽣物迅速繁殖,⽔体溶解氧含量下降,鱼类及其他⽣物⼤量死亡的现象。
12.⾟醇-⽔分配系数:化学物质在⾟醇中质量和在⽔中质量的⽐例。
13.凝聚:胶体颗粒由电介质促成的聚集。
14.絮凝:胶体颗粒由聚合物促成的聚集。
15.决定电位:若某个单体系中的含量⽐其他体系⾼得多,则此时该单体系电位⼏乎等于混合复杂体系的PE,称之为“决定电位”。

《环境化学》复习资料1、过氧乙酰基硝酸酯(PAN)的生成1.乙醛光解产生乙酸基2.乙酰基与空气中O2结合形成过氧乙酰基.3.过氧乙酰基与No2化合生成PANps:PAN具有热不稳定性,遇热会分解而回到过氧乙.基和NO2,因而PAN的分解和合成之间存在着平衡.2、温室效应、气体概念大气中的co2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高,这种现象称为温室效应,能够引起温室效应的气体,称为温室气体.3、大气颗粒物消除方式并解释/(机制)①干沉降指颗粒物在重力作用下沉降或与其他物体碰撞后发生的沉降。
机制i通重力对颗粒物作用,使其降落在土、水等物体上 ii 粒径小于0.1um 靠布朗运动扩散相互碰撞成较大颗粒随大气湍流到地面去除。
②湿沉降.指通过阵雨,降雪等使颗粒物从大气中去除.机制 i 雨除:半径小于1um ii 冲刷:半径大于4um4、水中无机物的迁移转化方式:沉淀一溶解、氧化还原、配合作用、胶体形成、吸附一解吸.5、水环境中颗粒物的吸附作用.①表面吸附:胶体具有巨大的比表面和表面能..物理吸附②离子交换吸附:静电作用,胶体每吸附一部分阳离子,同时也放出等量其他阳离子,属于物理化学吸附,不受温度影响,可逆反应③专属吸附:除化学键外,尚有加强的憎水键、范德华力、氢键在起作用.在中性表面甚至在与吸附离子带相同电荷符号的表面也可吸~6、沉积物中重金属诱发适当的因素盐浓度升高。
氧化还原条件变化。
降低ph。
增加水中配合剂的含量7、腐殖质分为腐殖酸(不碱可酸)、富里酸(可可)、腐黑物(不不)8、光解过程分三类:直接光解、敏化光解、氧化反应敏化光解:水体中存在的天然物质腐殖质被阳光激发,又将其激发态的能量转移给化合物而导致的分解。
9、有机物在土壤中的吸着在在两种机理(只适用于非离子型农药)1.分配作用:即在水溶液中,土壤有机质对有机物的溶解作用.而且在溶质的整个溶解范围内,吸附等温线都是线性的,与表面吸附位无关,只与有机物的溶解度相关(因而放出热量小)2.吸附作用:即在非极性的有机溶剂中.即在非极性有机溶剂中,土壤、矿物质对有机物表面的吸附作用或干土壤矿物质对有机物…作用.10、生物降解作用→两种代谢模式区别①生长代谢:许多有毒物质可以像天然有机污染物作为微生物的生长基质:作为微生物唯碳源有滞后期②共代谢:某些有机污染物不能作为微生物的唯一碳源和能源,必须有另外的化合物存在提供微生物碳源和能源时,该有机物才能被降解.这是共代谢无滞后期11、重金属在土壤一植物体系中的迁移及其机制,从三大类(土壤、植物、重金属分析) 1.土壤理化性质:~PH越低,H+越多,活动性越强,加大了土壤中重金属向生物体迁移的数量.~土壤质地黏重,对重金属的吸附力强,降低了重金属的迁移转化能力~土壤中有机质含量高.对重金属吸附力强.降低了重金属转化能力.~还原条件下能力弱、氧化条件下能力强。

《环境化学》课程综合复习资料一、填空题1. 由可见光(400nm<λ<780nm)引起光化学离解的物质键能是(c=3.0×108m/s,h=6.626×10-34J.s/光量子)。
2. 大气颗粒物有三种重要的表面性质:、和。
雨滴的形成就属于。
3. 水环境中的有机污染物一般通过、、、、生物富集和生物降解等过程进行迁移转化。
4. 根据土壤中H+离子的存在方式,土壤酸度可分为和潜在酸度,根据提取液的不同,潜在酸度分为和。
代换性是矿物质土壤潜在酸度的主要来源。
8. 由电介质促成的聚集称作,而由聚合物促成的聚集称作;根据DLVO理论把和考虑为仅有的作用因素。
12. 根据温度层结、密度层结和运动规律,可将大气划分为对流层、平流层、中间层和热层,其中随高度的增加气温升高的是和;随高度的增加气温降低的是和;臭氧主要分布在中;风、雨、雷电等天气现象发生在大气的中;内的空气处于高度电离状态,该层也称为电离层。
二、单项选择题1. 宣告一部分环境问题是由于贫穷造成的,并明确提出发展中国家要在发展中解决环境问题。
这是联合国组织第一次把环境问题与社会因素联系起来。
A.《里约环境与发展宣言》B.1987年发表的《我们的未来》C.《21世纪议程》D.1972年斯德哥尔摩人类环境会议2. 是无色气体,是低层大气中含量最高的含氮化合物。
A.NO2B. N2OC. NOD.NH33. 是大气中含量最高的碳氢化合物,约占碳氢化合物排放量的80%以上。
A.甲烷B.石油烃C.芳香烃D.萜类4. Fenton试剂的氧化机理是在酸性条件下,利用作为过氧化氢的催化剂,生成氢氧自由基。
A. Zn2+B. Cd2+C. Fe2+D. Fe3+5. 水体中常见的吸附等温线有三类,能给出饱和吸附量的等温线是。
A.F型B.L型C.H型D.W型6. 在我国的酸性降水中,含量最多的阴离子是。
A.SO42-B.NO3-C.Cl-D.HCO3-7. 天然水中常见主要离子总量作为水的总含盐量(TSD),而总含盐量不包括下列离子含量。

《环境化学》总复习题第一章绪论一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占80%-90%。
2、污染物的性质和环境化学行为取决于它们的化学性质和在环境中的迁移。
3、环境中污染物的迁移主要有机械、物理化学和生物三种方式。
4、人为污染源可分为工业、农业、交通运输和生活。
二、选择题1、属于环境化学效应的是CA热岛效应 B温室效应 C土壤的盐碱化 D噪声2、五十年代日本出现的痛痛病是由A污染水体后引起的。
A CdB HgC PbD As3、五十年代日本出现的水俣病是由B污染水体后引起的。
A CdB HgC PbD As三、问答题1、环境中主要的化学污染物有哪些?2、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学一、填空1、写出下列物质的光离解反应方程式(1)NO2 + hνNO + O·(2)HNO2 + hνHO·+ NO 或HNO2 + hνH·+ NO2(3)HNO3 + hνHO·+ NO2(4)H2CO + hνH· + HCO·或H2CO + hνH2+ CO2、大气中的NO2可以转化为HNO3、N2O5和N2O3。
3、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
4、乙烯在大气中与O3的的反应机理如下:O3 + CH2 == CH2H2CO+H2COOCH2(O3)CH25、大气颗粒物的去除与颗粒物的粒度和_化学性质_有关,去除方式有干沉降和湿沉降。
6、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln-1 + Cl·Cl·+ O3O2 + ClO·ClO·+O O2 + Cl7、当今世界上最引人瞩目的几个环境问题_温室效应_、_臭氧层破坏_、_光化学烟雾_等是由大气污染所引起的。
8、许多大气污染事件都与逆温现象有关,逆温可分为_辐射逆温_、_平流逆温_、_融雪逆温和地形逆温_。

环境化学复习资料12、13级环境化学讲课稿(十一)〈1次课〉环境化学总复习共讲了八章:第一章绪论,两节:环境化学、环境污染物。
主要概念:环境化学、环境污染物、优先污染物、迁移、转化。
知识要点:1.环境化学的任务主要研究有害化学物质在环境介质中的存在、化学特性、行为、效应及其控制的化学原理和方法。
内容主要涉及:有害物质在环境介质中存在的浓度水平和形态;潜在有害物质的来源,在个别环境介质中不同介质间的化学行为;有害物质对环境、生态系统、人体健康产生效应的机制和风险性;有害物质已造成影响的缓解、消除、防止产生危害的方法和途径。
2.特点有①从原子、分子水平研究宏观的环境现象与变化的化学机制、防治途径;②环境是一个多因素的开放体系,变量多、条件复杂,许多化学原理和方法不易直接运用;③化学污染物在环境中的含量很低;④样品组成比较复杂,会发生存在形态的变化;⑤污染物分布广泛,迁移转化速度快,在不同时空条件下有明显的动态变化。
3.发展动向有①环境分析化学突出联用仪器技术、连续自动分析和遥感分析;②与人生活和健康密切的酸沉降、臭氧耗损、全球气候变暖等重要问题;③污染控制发展绿色化学。
4.环境污染物的类别。
按人类社会活动不同功能产生的污染物分为工业、农业、交通运输、生活四方面。
按化学可分九类:元素、无机物、有机化合物和烃类、金属或准金属有机化合物、含氧有机化合物、有机氮化物、有机卤化物、有机硫化合物、有机磷化合物。
当前世界最关注的是持久性有机污染物,具有致突变、致癌变、致畸变作用化学污染物,环境内分泌干扰物。
第二章大气环境化学,四节:大气的组成及其主要污染物、大气中污染物的迁移、大气中污染物的转化、大气颗粒物。
主要概念:污染物在大气中的迁移、转化、逆温(辐射逆温、下沉逆温)、最大混合层高度、自由基、稳定性、活性、光化学反应、光化学烟雾、硫酸烟雾、温室效应、温室气体、大气颗粒物。
2知识要点:1.地表大气平均压力101.3kPa,相当于1.034g/cm的空气,随距地表高度的增加逐渐稀薄,质量的99.9%集中在50km以下。

环境化学参考答案一、名词解释气温垂直递减率:气温随高度地变化通常以气温垂直递减率(Г)表示,即每垂直升高,气温地变化值:-绝对温度,;-高度.光化学反应:光化学反应:一个原子、分子、自由基或离子吸收一个光子所引发地反应,称为光化学反应.吸附等温线:在恒温等条件下,吸附量与吸附物平衡浓度地关系曲线称为吸附等温线,其相应地数学方程式称为吸附等温式.适用于水体颗粒物对污染物地吸附等温式有型、弗莱特利希()和朗格缪尔()三种等温式.盐基饱和度:盐基饱和度(%)=交换性盐基总量阳离子交换量%生物放大:同一食物链上地高营养级生物,通过吞噬低营养级生物蓄积某种元素或难降解物质,使其在机体内地浓度随营养级数提高而增大地现象天然水地碱度:指水中能与强酸发生中和作用地全部物质,亦即能接受质子地物质总量.:辛醇水分配系数,既化学物质在辛醇中浓度和在水中浓度地比例.标化分配系数:表示有机毒物在沉积物(或土壤)与水之间地分配系数,以有机碳为基础..二、回答下列问题过氧自由基?地主要来源有哪些??地主要来源是大气中甲醛()地光分解:→?→?简述大气污染物地汇地机制重力沉降,与植物、建筑物或地面(土壤)相碰撞而被捕获(被表面吸附或吸收)地过程,统称为干沉降.大气中地物质通过降水而落到地面地过程称为湿沉降.污染物在大气中通过化学反应生成其他气体或粒子而使原污染物在大气中消失地过程,称为化学去除简述环境污染物地三致作用.三致作用定义;致突变作用;致癌作用;致畸作用.简述土壤地缓冲性能及其原理.答:定义:土壤缓冲性能是指土壤具有缓和其酸碱度发生激烈变化地能力,它可以保持土壤反应地相对稳定,为植物生长和土壤生物地活动创造比较稳定地生活环境.溶液地缓冲作用:无机酸(碳酸等)有机酸(腐殖酸、其他)酸酸和碱胶体地缓冲作用:对酸地缓冲作用:胶体胶体对碱地缓冲作用:胶体胶体离子对碱地缓冲作用:<水中有机污染程度地指标是什么?并分别加以说明.答:水体中有机污染物地种类繁多、组成复杂,现代分析技术难以分别测定它们地含量.因此,只能利用它们共同地特点,用一些指标间接反映水体中有机物地污染程度.常见地指标有:溶解氧、生化需氧量、化学需氧量、总有机碳和总需氧量.简要回答河流中地泥沙对重金属地迁移转化地影响,并举例加以说明.答:()河流泥沙中主要有蒙脱石、高岭石、伊利石等,其中粒径小于μ地占;研究表明,泥沙地粒径越小,比表面越大,吸附重金属地量也越大;当重金属浓度不变时,随着河流泥沙量增大,对重金属地吸附量增大;河流泥沙对重金属离子地吸附符合弗莱特利希等温线;()泥沙对重金属离子地吸附量随地升高而增大;河水左右,重金属离子在此条件下有不同程度地水解、沉淀、配合和被悬浮物吸附,控制了河水中可溶性重金属离子地浓度;()泥沙中有机质含量随季节而变化,悬浮物中有机质大于沉积物中有机质地含量,泥沙中重金属地吸附量与有机质地含量呈正相关;重金属在河水、悬浮物、沉积物中地分配比是:悬浮物大于沉积物,而沉积物和悬浮物远远大于河水中重金属含量.由此可见,河流中泥沙对重金属地迁移转化有很大地影响.三、计算题有如下两个单体系,其中一个是、(,[],[]),另一个是、(,[],).如果各取升,将其成为一个混合体系,并假定被还原完全,试计算哪个体系是决定电位?解:有两个单体系当[],[]时,当[],时,如果各取升,将其成为一个混合体系,并假定被还原完全,则有[]()×[]()×混合体系地电位为:混合[][](××由上可知,混合体系地处在铜单体系与铁单体系电位之间,并与含量较高地铁单体系地电位相近.所以铁体系为决定电位.四、分析论述题.某市一家铅锌冶炼厂地含铅废水经化学处理后排入水体中,排污口水中铅地含量为~,而在下流处水中铅地含量只有~μ,试分析其原因?()含铅废水地稀释、扩散;()水体中胶体物质对重金属地吸附作用:无机胶体:次生黏土矿物;铁、铝、硅、锰等水合氧化物;有机胶体:蛋白质、腐殖质.()氧化-还原转化:各价态之间地相互转化;()溶解和沉淀反应:()配合反应:无机配体:有机配体:氨基酸、糖、腐殖酸生活废水中地洗涤剂、清洁剂、、、农药等()生物甲基化作用.()生物富集作用.确定酸雨界限地依据是什麽?()酸雨是最常见酸性降水,酸性降水是指通过降水,如雨、雪、雾、冰雹等将大气中地酸性物质迁移到地面地过程.这种降水过程称湿沉降.()降水主要推导方程式.()多年来国际上一直把值为作为判断酸雨地界限,值小于地降雨称为酸雨.()通过对降水多年观察,对值为作为酸性降水地界限以及判别人为污染界限有了不同观点,主要因为:,在清洁大气中,除有外还存在各种酸、碱性气态和气溶胶物质,它们通过成云和降水冲刷进入雨水中,降水酸度是各物质综合作用地结果;,硝酸和硫酸并不都是人为源;天然源产生地等都可进入雨水;,空气中碱性物质中和用,使得空气中酸性污染严重地地区并不表现出来酸雨;,其他离子污染严重地降水并不一定表现强酸性..下图是、、空气(、)混合物经紫外线照射后地时间成分关系图.从图中可知,随和等初始反应物地氧化消耗,和醛量增加;当耗尽时,出现最大值.此后,随着地消耗(浓度下降),和其他氧化剂如过氧乙酰硝酸酯()产生了.试利用大气环境化学原理分析可能发生地环境现象,并阐述其机制.答:光化学烟雾:汽车、工厂等污染源排入大气地碳氢化合物()和氮氧化物()等一次污染物在阳光中紫外线照射下发生光化学反应生成一些氧化性很强地、醛类、、等二次污染物.人们把参与光化学反应过程地一次污染物和二次污染物地混合物(其中有气体和颗粒物)所形成地烟雾,称为光化学烟雾.可以认为上述反应是大大简化了地光化学烟雾形成地基本反应.年用个化学反应概括了光化学烟雾形成地整个过程:引发反应:ν→→→链传递反应:→→()ν→→→′?()→终止反应:→()→()()→()。
环境化学复习题库及答案环境化学是一门研究化学物质在环境中的分布、迁移、转化和影响的学科。
以下是环境化学的复习题库及答案,供学习者参考:一、选择题1. 环境化学主要研究的是以下哪个方面?A. 化学物质的合成B. 化学物质在环境中的分布和影响C. 化学实验技术D. 化学工业生产答案:B2. 以下哪个不是环境化学的研究内容?A. 大气污染B. 水体污染C. 土壤污染D. 有机合成反应答案:D3. 环境化学中,下列哪个术语与大气污染无关?A. 温室效应B. 酸雨C. 光化学烟雾D. 核磁共振答案:D二、填空题4. 环境化学中的“三废”指的是废水、废气和______。
答案:废渣5. 环境化学中,大气中的污染物可以通过______作用进入土壤和水体。
答案:沉降三、简答题6. 简述环境化学中重金属污染的特点。
答案:重金属污染具有持久性、生物可积累性、毒性强等特点。
重金属一旦进入环境,很难被分解,容易通过食物链累积在生物体内,对生态系统和人类健康构成威胁。
7. 描述环境化学中水体污染的主要来源。
答案:水体污染的主要来源包括工业废水排放、农业面源污染、生活污水排放、大气沉降以及土壤流失等。
四、计算题8. 如果一个工厂每天排放含铅废水100立方米,废水中铅的浓度为0.5mg/L,计算一个月(30天)该工厂排放到环境中的铅总量。
答案:首先计算每天排放的铅量:100立方米 * 0.5mg/L = 50mg。
然后计算一个月的总量:50mg * 30天 = 1500mg。
五、论述题9. 论述环境化学在现代环境保护中的作用和重要性。
答案:环境化学在现代环境保护中起着至关重要的作用。
它不仅帮助我们理解化学物质在环境中的行为和影响,还为污染控制和环境修复提供了科学依据。
通过环境化学的研究,我们可以更好地监测和评估环境质量,制定有效的污染防治措施,保护生态系统和人类健康。
六、案例分析题10. 某地区发生严重的土壤污染事件,土壤中重金属含量超标。
1.循环经济中3R 原则的三个英文单词是 , , 。
2.环境因素变化导致生态系统变异而产生的后果称为 。
3.产生氧化性光化学烟雾的两种主要物质是 , 。
4.全球变暖问题除CO 2外,还应考虑具有温室效应的 和 的作用。
5.水环境中胶体颗粒的吸附作用大体可分为表面吸附、 和 。
6.水环境中促成颗粒物相互碰撞产生凝聚作用的三种机理分别是 , , 。
7.如果土壤胶体上吸附的阳离子有一部分为致酸离子,则这种土壤为 土壤。
8.污染物由土壤向植物体内迁移的方式主要包括 和 两种。
9.物质在生物作用下经受的化学变化,称为 。
10.受氢体如果为细胞内的分子氧,则生物氧化中有机物的氧化类型为 ,若为非分子氧的化合物就是 。
11.毒理学把毒物剂量(浓度)与引起个体生物学的变化,如脑电、心电、血象、免疫功能、酶活性等的变化称为 ; 一、 回答下列问题(每题6分,共30分) 1.影响大气中污染物质迁移的主要因素是什么? 2.什么是电子活度pE ?它和pH 的区别是什么?3.影响重金属在土壤-植物体系中转移的主要因素是什么?举例说明。
4.请详细说明污染物质在肌体内有哪些转运过程。
5.1953年发生在日本熊本县的水俣病的致病的烷基汞物质有哪些?从化合物结构看,有什么特征?三、下列是光化学烟雾形成的一个简化机制,按序号分别写出哪几个属于引发反应、自由基传递反应和终止反应,在该机制中,控制光化学烟雾形成速率的是哪一类?(15分)序号 反应速率常数(min -1) 1 NO 2 + hv NO+O 0.533(假设) 2 NO + O 3 NO 2 + O 2 2.659×10-5 3 RC(O)O 2NO 2 RC(O)O 2 + NO 22.143×10-8 4 O H RO HO RH O 222+−→−+3.775×10-3 5 O H O O RC HO RCHO O 22)(2+−→−+2.341×10-2 6 O + O 2 +M O 3 + M 2.183×10-11 7 HO 2 + NO NO 2 + HO1.214×10-2 8 CO HO RO hv RHCO O ++−−→−+22221.91×10-10 9 222`2HO CHO R NO NO RO O ++−→−+1.127×10-2 10 22222)(CO RO NO NO O O RC O ++−→−+1.127×10-2 11 HO + NO 2 HNO 3 1.613×10-2 12RC(O)O 2 + NO 2 RC(O)O 2NO 26.893×10-2四、下图是水解速率与pH 的关系,Mabey 等把水解速率归纳为由酸性或碱性催化和中性过程,因而水解速率可表示为:{}][][][][c OH K K H K c K B N A h -+++=在以一种催化为主时,其它两种催化可忽略不计,试证明:(a)lgK h =lgK A —pH ; (b)lgK h =lgK N ;(c)lgK h =lgK B K W +Ph 。
环境化学复习资料《环境化学》综合复习资料一、填空题1.污染物在环境中的迁移主要有、和三种方式。
2. 、、以及,是目前世界上公认的主要环境问题。
3.大气的温度随地面的高度而变化,这构成了大气分层的基础。
大气圈按高度自下而上分成、、和。
4.大气颗粒物有三种重要的表面性质:、和。
大气颗粒物在雨滴形成的过程就属。
5.研究酸雨必须进行雨水样品的化学分析,通常分析的主要阳离子有;阴离子有。
6.用一个强碱标准溶液滴水样,以酚酞作为指示剂,此时所得的结果称为,其化学反应计量式为。
7.水中颗粒物的吸附作用可分为、和;其中属于物理吸附的是。
8.当向天然水体中加入有机物后可得到一氧下垂曲线。
碳元素在清洁区和腐败区内的分解产物分别是和。
9.当向天然水体中加入有机物后可得到一氧下垂曲线,它把河流分为相应的几个区段,在清洁区内决定电位物质是;在腐败区内决定电位物质是。
10.腐殖质的组成非常复杂,根据它在溶液中的溶解度不同划分为、和三类。
11.天然水P E越小,提供电子倾向,水中污染物还原态相对浓度。
12.有机污染物一般通过、、、和等过程进行迁移转化。
13.典型土壤随深度呈现不同的层次,是生物最活跃的一层,有机质大部分在这一层,金属离子和粘土颗粒在此层中被淋溶得最显著。
14.岩石的化学风化分为三个历程,即、和。
15.汞及其化合物的挥发程度与化合物的形态及、、等因素密切相关。
无机汞化合物挥发度最大的是,最小的是。
16.砷的甲基化在厌氧菌作用下主要产生,在水溶液中继续氧化成为;而汞的甲基化在厌氧菌作用下主要产生;与无机砷相比,有机砷的毒性。
17. 是金属甲基化过程中甲基基团的重要生物来源。
砷的甲基化在厌氧菌作用下主要产生,在水溶液中继续氧化成为;而好氧的甲基化反应则产生,在水溶液中继续氧化成为,它可与巯基发生的应。
18.日本西部地区发生的米糠油中毒事件是由引起的,而该物质目前唯一的处理方法是。
痛痛病是由于长期食用含量高的稻米引起的中毒。
环境化学期末测试复习资料一、名词解释:1、环境问题:人类各种活动或自然因素作用于环境而使环境质量发生变化,由此对人类的生产、生活、生存与持续开展造成不利影响的问题称为环境问题.2、环境污染:由于人为因素使环境的构成或状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件,叫做环境污染.3、富营养化:是指在人类活动的影响下,生物所需的氮、磷等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其它浮游生物迅速繁殖,水体溶解氧量下降,水质恶化, 鱼类及其它生物大量死亡的现象.4、分配系数:非离子性有机化合物可以通过溶解作用分配到土壤有机质中,并经过一段时间到达分配平衡,此时有机化合物在土壤有机质和水中的含量的比值称为分配系数.5、标化分配系数:达分配平衡后,有机毒物在沉积物中和水中的平衡浓度之比称为标化分配系数.6、辛醇-水分配系数:达分配平衡时,有机物在辛醇中的浓度和在水中的浓度之比称为有机物的辛醇-水分配系数.7、生物浓缩因子:有机毒物在生物体内浓度与水中该有机物浓度之比.8、亨利定律常数:化学物质在气一一液相达平衡时,该化学物质在在水中的平衡浓度和其水面大气中的平衡分压之比.9、水解常数:有机物在水中水解速率与其在水中浓度之比称为水解常数.10、直接光解:有机化合物本身直接吸收太阳光而进行分解反响.11、敏化光解:腐殖质等天然物质被光激发后, 将激发的能量转移给有机化合物而导致分解反响.12、光量子产率:进行光化学反响的光子占吸收总光子数之比称为光量子产率.13、生长代谢:微生物可用有机化合物〔有机污染物〕作唯一碳源和能源从而使该化合物降解的代谢.14、共代谢:某些有机污染物不能作为微生物的唯一用碳源和能源, 须有另外的化合物提供微生物的碳源和能源,该化合物才能降解.15、生物富集〔Bio-enrichment 〕:指生物通过非吞食方式〔吸收、吸附等〕,从周围环境〔水、土壤、大气〕中蓄积某种元素或难降解的物质, 使其在机体内的浓度超过周围环境中浓度的现象.16、生物放大〔Bio-magnification〕:同一食物链上的高营养级生物,通过吞食低营养级生物富集某种元素或难降解物质,使其在机体内的浓度随营养级数提升而增大的现象.17、生物积累〔Bio-accumulation〕:指生物从周围环境〔水、土壤、大气〕和食物链蓄积某种元素或难降解物质,使其在机体中的浓度超过周围环境中浓度的现象.18、半数有效剂量〔ED50〕和半数有效浓度〔EC50〕:毒物引起一群受试生物的半数产生同一毒作用所需的毒物剂量和毒物浓度.19、阈剂量:是指长期暴露在毒物下,引起机体受损害的最低剂量.20、最高允许剂量:是指长期暴露在毒物下,不引起引起机体受损害的最高剂量.15、基因突变:指DNA 中碱基对的排列顺序发生改变.包括碱基对的转换、颠换、插入和缺失四种类型.16、遗传致癌物:1 〕直接致癌物:直接与DNA 反响引起DNA 基因突变的致癌物,如双氯甲醚.2〕间接致癌物〔前致癌物〕:不能直接与DNA 反响,需要机体代谢活化转变后才能与DNA反响导致遗传密码改变.如二甲基亚硝胺、苯并〔a〕花等.17、半数有效剂量:ED50 和EC50 分别是毒物引起一群受试生物的半数产生同一毒作用所需的毒物剂量和毒物浓度.18、阈剂量:是指长期暴露在毒物下,引起机体受损害的最低剂量.19、汞的甲基化:在好氧或厌氧条件下, 某些微生物将二价无机汞盐转变为一甲基汞和二甲基汞的过程称汞的甲基化.20、促癌物:可使已经癌变细胞不断增殖而形成瘤块的物质.如巴豆油中的巴豆醇二酯、雌性激素乙烯雌酚,免疫抑制剂硝基咪唑硫嘌呤等.21、助致癌物:可加速细胞癌变和已癌变细胞增殖成瘤块的物质.如二氧化硫、乙醇、儿茶酚、十二烷等,促癌物巴豆醇二酯同时也是助致癌物.22、 POPs〔Persistent organic pollutants 〕:持久性有机污染物, 是一类具有环境持久性、生物累积性、长距离迁移水平和高生物毒性的特殊污染物.23、 PTS〔Persistent Toxic Substances〕:持久性毒害污染物,是指一类具有很强的毒性,在环境中难降解,可远距离传输,并随食物链在动物和人体中累积、放大, 具有内分泌干扰特性的污染物,包括POPs和某些重金属污染物.24、 PP〔priority pollutants 〕:优先污染物,是指毒性强、难降解、残留时间长、在环境中分布广的污染物优先进行限制.25、PCBs:多氯联苯26、 PCDDs/PCDFs :二恶英和呋喃类PCDD :多氯代二苯并二恶英PCDF :多氯代二苯并呋喃TCDD :2,3,7,8-四氯二苯并二恶英,是目前的有机物中毒性最强的物质.27、EDCs (Endocrine disrupting compounds ):环境内分泌干扰物, 对天然激素的合成、分泌、传输、结合和去除功能起干扰作用的外源物质.28、PAEs (Phthalate Esters ):邻苯二甲酸酯.29、PBDEs ( Polybrominated Diphenyl Ethers ):多澳代联苯醒30、CFCs:氟氯煌类31、PAH :多环芳烧,是指两个以上苯环连在一起的化合物.32、PAN:过氧乙酰基硝酸酯33、TSP (total suspended particulates):总悬浮颗粒物34、SPM (suspended particulate matters):飘尘35、IP (inhalable particles ):可吸入粒子36、POM ( Particulate organic matter):有机颗粒物37、BaP:苯并[a]花二、填空题:1、常见持久性有机污染物:艾氏剂(Aldrin )、狄氏剂(Dieldrin )、异狄氏剂(Endrin)、滴滴涕(DDT )、氯丹(Chlordane)毒杀芬(Toxaphene)、六氯苯(Hexachlobenzene)、灭蚁灵(Mirex)、七氯(Heptachlor)、多氯联苯(PCBs)、二恶英和吠喃类(PCDDs/PCDFs).2、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占__80%-90%_.3、环境化学研究的对象是:环境污染物.4、环境中污染物的迁移主要有机械、物理-化学和牛物迁移三种方式.5、人为污染源可分为工业、农业、交通、和牛活.6、如按环境变化的性质划分,环境效应可分为环境物理、环境化学、环境牛物三种.7、属于环境化学效应的是_CA热岛效应B温室效应 C 土壤的盐碱化D噪声8、五十年代日本出现的痛痛病是由A—污染水体后引起的A CdB HgC PbD As9、五十年代日本出现的水俣病是由_B__污染水体后引起的A CdB HgC PbD As10、对颗粒物性质最为关注的是其拉径L,其次是它携带的化学物质.11、写出以下物质的光离解反响方程式:(1) NO2+ h Y--------- > NO + O(2) HNO2+ h Y------- * HO + NO 或HNO 2+ h v- H + NO2(3) HNO 3 + h Y --------- +HO + NO2(4) H2CO + h Y ------- / H + HCO 或H2CO + h 、----- > H2 + CO⑸CH3X + h Y -------- ,CH3 + X12、大气中的NO2可以转化成HNO2、NO'和HNO3 等物质.13、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者.14、乙烯在大气中与03的反响机理如下:CH2(O3)CH203 + CH 2 == CH 2 ---------------- % * H2CO+H2COO15、大气颗粒物的去除与颗粒物的粒度、化学组成和性质有关,去除方式有干沉降和湿沉降两种.16、制冷剂氯氟燃破坏臭氧层的反响机制是:CFmCln + hv ---------- > CFmCln-1 + ClCl + 03 ------------------- > 02 + ClOClO +0 ---------- 乎 02 + Cl17、当今世界上最引人瞩目的几个环境问题中的温室效应、—臭氧层破坏、光化学烟雾等是由大气污染所弓I起的.18、大气颗粒物的三模态为爱根核模、积聚模、粗粒子模.19、大气中最重要的自由基为H0 .20、能引起温室效应的气体主要有CO2 > CH, 、N_2 0 、氯氟煌等.21、CFC-11 和Halon1211 的分子式分别为__CFCl3 和_CF2ClBr.22、大气的扩散水平主要受风和湍流的影响.23、大气颗粒物按粒径大小可分为总悬浮颗粒物、飘尘一、降半、可吸入颗粒物 .24、根据温度垂直分布可将大气圈分为对流层、平流层、中间层、热层和逸散层.25、伦敦烟雾事件是由SO_ 颗粒物、硫酸盐颗粒物等污染物所造成的大气污染现象.26、大气中CH4主要来自有机物的厌氧发酵、动物呼吸作用、_原油及天然气的泄漏的排放.27、降水中主要阴离子有SO42:、NQa-、__Q:_、__HCO3__.28、由于通常化学键的键能大于167.4Kj/mol ,所以波长大于700nm的光往往不能引起化学离解.29、我国酸雨中关键性离子组分是SO42-、Ca2+、NH4+ .30、大气中H0自由基的来源有一A C D—的光离解.A O3B HCHOC H2O2D HNO 231、烷烧与大气中的HO自由基发生氢原子摘除反响,生成B C .A ROB R 自由基C H2OD HO232、酸雨是指pH―C—的雨、雪或其它形式的降水.A <6.0B <7.0C <5.6D <5.033、辐射一定时间产生的 A B量可以衡量光化学烟雾的严重程度.A 03B NO2 C碳氢化合物 D SO234、大气逆温现象主要出现在 D QA严寒的夜间B多云的冬季C严寒而晴朗的冬天D严寒而晴朗的夜间35、大气中复原态气体(如H2S)主要被B氧化.A O2B HOC 03 D高价金属离子36、根据Whittby的三模态模型,粒径小于 A nm的粒子称为爱根核模.A 0.05B 0.1C 1D 237、随高度的增加气温 A 的现象,称为逆温.A升高B 降低C不变38、气溶胶中粒径 D 「m的颗粒,称为可吸入颗粒物.A >10B <5C >15D <1039、我国酸雨中关键性离子组分中, SO42-作为酸的指标.A Ca2+B SO42-C NH4+40、天然水中的总碱度= [HCO 3-] +2 [CO 32-] + [OH-] —[H +]41、水环境中胶体颗粒物的吸附作用分为外表吸附、离子交换吸附和专属吸附<42、天然水的PE随水中溶解氧的减少而降低,因而表层水呈氧化性环境.43、有机污染物一般通过吸附、挥发、水解、光解、生物富集和降解等过程进行迁移转化.44、许多研究说明,重金属在天然水体中主要以腐殖酸配合物的形式存在.45、PH=6-9的通常水体中,Fe的主要存在形态为Fe(OH)3(s)、Fe2+ .当水体高度缺氧时,Fe2+是主要形态.当水体富氧时,会出现Fe(OH)3(s).46、正常水体中其决定电位作用的物质是溶解氧;厌氧水体中决定电位作用的物质是有机物.47、有机物生物降解存在牛长代谢和共代谢两种代谢模式.48、有机物的光解过程公为直接并解、敏化并解、氧化反响二类.49、总氮、总磷和溶解氧常作为衡量水体富营养化的指标.50、天然水体中假设仅考虑碳酸平衡,那么在碳酸开放体系中,[HCO3-]、[CO32-]、C T是变化的,而[H2CO3 *]不变;在碳酸封闭体系中, [H2CO3 *]、[HCO3-]、[CO32-]是变化的,而C T不变.51、当水体pH处于偏酸性条件下,汞的甲基化产物主要是一甲基汞 .52、达分配平衡时,有机物在辛醇中的浓度和在水中的浓度之比称为有机物的辛醇-水分配系数.53、PE的定义式为:PE= - log a e ,它用于衡量溶液接受或给出电子的相对趋势.54、诱发重金属从水体悬浮物或沉积物中重新释放的主要因素有:盐浓度、氧化还原条件的变化、降低PH值、增加水中配合剂的含量 .55、天然水体中存在的颗粒物的类别有:矿物微粒和粘土矿物、金属水合氧化物、腐殖质、水中悬浮沉积物等.56、进行光化学反响的光子数占吸收的总光子数之比称为光量子产率;直接光解的光量子产率与所吸收光子的波长无关.57、胶体颗粒物的聚集也可称为凝聚或絮凝, 通常把由电解质促成的聚集称为凝聚; 把由聚合物促成的聚集称为絮凝.58、PE与E的关系为:E=(2.303RT/F)*pE : 一水体PE或E越大,那么该水体的氧化性越强.59、海水中Hg2+主要以C 的形式存在.A Hg(OH) 2, HgCl 2B HgCl 2, HgCl 3-C HgCl 42-D HgCl 3-, HgCl 42-60、某一氧化复原体系的标准电极电位为E0=0.80,其pE o为 A .A 13.50B 13.35C 13.05D 12.8061、以下各种形态的汞化物,毒性最大的是 A .A Hg(CH 3)2B HgOC HgD Hg 2cl262、影响水环境中颗粒物吸附作用的因素有BCD.A溶解氧含量B颗粒物粒度C温度D pH63、C2H4cl2(M=99)的饱和蒸汽压为2.4 104pa, 20c时在水中溶解度为5500mg/L ,那么其亨利常数kH=_A_ pa m3/molA 432B 234C 325D 12364、腐殖质在以下哪种情况下在水中是以溶解态存在:AA PH高的碱性溶液中或金属离子浓度低;B PH低的酸性溶液中或金属离子浓度较高;C PH高的碱性溶液中或金属离子浓度高;D PH低的酸性溶液中或金属离子浓度低.65、假设水体的pE值高,有利于以下 D 组在水体中迁移.A Fe、MnB Cr、FeC Cr、MnD Cr、V66、有机物的辛醇-水分配系数常用 B 表示.A K ocB K owC K omD K d67、一般情况下,当水体DO B 时,鱼类会死亡.A >8.0mg/LB <4.0 mg/LC >0D >4.0 mg/L68、对于转移2个电子的氧化复原反响,其pE°=13.5,那么其平衡常数log K= BA 13.5B 27.0C 6.75D 54.069、重金属在土壤一植物体系中的迁移过程与重金属的种类、价态、存在形态及土壤和植物—的种类、特性有关.70、Cr(VI)与Cr(ni)比拟,Cr(VI)的迁移水平强,Cr(VI)的毒性和危害大.71、土壤处于淹水复原状态时,神对植物的危害程度大—.72、土壤淹水条件下,镉的迁移水平降低.73、农药在土壤中的迁移主要通过扩散和质体流动两个过程进行.74、土壤中农药的扩散可以气态和非气态两种形式进行.75、土壤有机质含量增加,农药在土壤中的渗透深度减小.76、水溶性低的农药,吸附力工,其质体流动距离二.77、重金属污染土壤的特点:不被土壤微生物降解,可在土壤中不断积累,可以为生物所富堡,一旦进入土壤就很难予以彻底的去除.78、腐殖质对重金属的吸附和配合作用同时存在,当金属离子浓度高时吸附作用为主,重金属存在于土壤表层;当金属离子浓度低时配合作用为主,重金属可能渗入地下.79、土壤有机质的来源有 A B C .A树脂B腐殖酸C腐黑物D矿物质80、以下 A 土壤缓冲水平最大.A腐殖质土B砂土C粘土D壤土81、影响土壤氧化复原状况的主要因素有:ABCA 土壤通气状况B 土壤有机质状况C 土壤无机物状况D 土壤的吸附状况82、DDT属于持久性农药,在土壤中的移动速度和分解速度都很慢,土壤中DDT的降解主要靠C—作用进行.A光化学B化学C微生物D光化学和微生物83、土壤中重点关注的重金属有: A B C D E ___________A AsB CdC CrD HgE Pb84、苯并花〔a 〕的致癌机理主要是形成相应的芳基正碳离子,与DNA 碱基中的氮或氧结合,使之芳基化,导致 DNA 基因突变.85、生物富集是指生物通过 非吞食 方式,从周围环境蓄积某种元素或难降解的物质,使其在 机体内的浓度超过周围环境中浓度的现象.86、在好氧或厌氧条件下, 某些微生物将二价无机汞盐转变为一甲基汞和二甲基汞的过程称 汞的甲基化. 87、微生物参与汞形态转化的主要方式为: 汞的甲基化作用 和 将汞的化合物复原为金属汞 的复原作用.88、目前的有机毒物中毒性最强的化合物是: 2,3,7,8-四氯二苯并二恶英 〔TCDD 〕.89、毒物的联合作用分为: 协同作用、相加作用、独立作用、拮抗作用 四类.90、汞的毒性大小顺序为: B .A 有机汞〈无机汞 <金属汞B 无机汞〈金属汞〈有机汞C 金属汞〈有机汞〈无机汞91、神的毒性很强,一般地:92、LD 50表示的是C oA 半数有效剂量B 半数有效浓度C 半数致死剂量D 半数致死浓度93、两种毒物死亡率分别是M I 和M 2,其联合作用的死亡率 M<M I +M 2,这种联合作用属于 D ―. A 协同作用B 相加作用C 独立作用D 拮抗作用三、简做题:1A As 3+>As 5+ 〉一甲基月申〉二甲基月申 C 一甲基肿〉二甲基肿〉 As 3+〉As 5+B As 5+ >一甲基肿〉二甲基肿〉 As 3+D 二甲基肿〉As 3+> As 5+> 一甲基肿23、大气中有哪些重要自由基 ?其来源如何?大气中主要自由基有: HO 、HO 2、R 、RO 2(1) HO 的来源:①对于清洁大气,.3的光离解是大气中 HO •的重要来源O H 2O 2 OH②对于污染大气,如有HNO 2和H 2O 2存在,它们的光离解也可产生 HO oHNO 2 的光解: HNO 2 + h r --------------- - HO +NO H 2O 2 的光解:H 2O 2 + h r ---------------- 2HO(2) HO 2的来源:主要来自醛,特别是甲醛的光解H 2CO + h r ---------------- H + HCO H + O 2 + M -------------- * HO 2 + M HCO + O2 --------------- +MHO2 + CO + M(3) R 的来源:RH + O ---------------- ► R + HO RH + ---------------- H OR + H 2O(4) RO 2 的来源:R + O 2 --------------------------- — RO 2 4、光化学第一定律和第二定律.(1)光化学第一定律(Grotthus-Draper 定律):只有被分子吸收的光,才能有效地引起分子 的化学变化. 〔2〕光化学第二定律〔Stark-Einstein 定律〕:分子吸收光的过程是单分子过程,或者说在光化学反响的初级过程,被吸收的一个光子,只能激活一个分子O 3320 nmO 2O〔不适用于激光化学〕5、光化学烟雾〔1〕现象:汽车、工厂等污染源排入大气的碳氢化合物〔HC〕和氮氧化物〔NO x〕等一次污染物在阳光中紫外线照射下发生光化学反响生成一些氧化性很强的.3、醛类、PAN、H2O2等二次污染物.这种由一次污染物和二次污染物的混合物〔其中有气体和颗粒物〕所形成的烟雾,称为光化学烟雾.〔2〕特征:蓝色烟雾,强氧化性,具有强刺激性,使大气能见度降低,在白天生成黄昏消失,顶峰在中午或午后,污染区域往往在污染的下风向几十至几百公里处.〔3〕形成条件:氮氧化物与碳氢化物的存在;大气湿度较低;强的阳光辐射;易发生在温度较高〔24~32C〕的夏秋季晴天.〔4〕污染物与产物的日变化曲线:清晨,大气中有固定源及汽车排放的NOx和煌类化合物,强光照射后NO2光解产生O.,随后一系列反响相继发生,产生O3及HO.,而HO.可以使嫌类氧化为新的自由基,大局部生成RO2.、HO2.、RC〔O〕O2.,这些具有强氧化性的自由基将NO氧化为NO2,代替了O3的氧化,这样O3愈积愈多,同时在反响过程中,生成了一系列二次污染物如醛类、PAN等,与一次污染物NOx、烧类化合物混合形成了光化学烟雾.下午,随着日光的减弱, NO2光解受到抑制,光化学反响趋于缓慢,产物浓度相继下降,光化学烟雾现象消失.〔5〕限制对策:改良技术限制汽车尾气;改善能源结构;增强监测与治理.7、说明酸雨形成的原因.SO2和NO x进入大气,经氧化后溶于水形成硫酸、硝酸和亚硝酸SOi+ [.]-so3 + H2O—*H2SO4SO;+H2O--H2SO3HSO3+[OJ->H£SO4NO+fO]一>Nd2NO2 + H2O —*HNOj + HNQa8、说明影响酸雨形成的因素(1) 酸性污染物的排放及其转化条件.(2)大气中NH 3的含量及其对酸性物质的中和性.(2) 大气颗粒物的碱度及其缓冲水平.(3) 气象条件的影响.9、酸雨的环境影响及对策.影响(1)对土壤生态的危害.土壤日益酸化、贫瘠化,影响植物的生长;另一方面酸化的土壤影响微生物的活性.(2)对水生生态的危害.湖泊、河流等地表水酸化,污染饮用水源;鱼类死亡(3)对植物的危害.叶绿素含量降低,由于光合作用受阻,使农作物产量降低,也可使森林生长速度降低.(4)对材料和古迹的影响.腐蚀材料、建筑(5)对人体健康的影响.对策:限制酸雨的根本举措是减少二氧化硫和氮氧化物的排放.(1)调整能源结构,尽量减少煤的燃烧,开发无污染的新能源(水力、太阳能等)(2)合理规划工业开展和城市建设布局:工业区应该建设在城市主导风的下风口,居民区采取集中供热;(4) 运用各种防治污染的技术(煤的脱硫、汽车尾气的处理等) .10、试述大气中CO2等气体浓度上升,引起温室效应的原因.大气中的CO2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高.如果大气中温室气体增多,便有过多的能量保存在大气中而不能正常地向外空间辐射, 这样就会使地外表和大气的平衡温度升高,对整个地球的生态平衡会有巨大的影响.11、减少温室气体排放的举措〔1〕提升能源的利用率和减少高强温室气体排放〔如NO x、CH4、CFCs〕〔2〕燃料的改变:煤、石油改为天然气和氢气(3)可再生能源的使用:水,风,太阳,生物(4)核能的平安使用(5)CO2吸收与存储(6)植树造林,逐渐恢复草原的植被12、说明臭氧层破坏的原因和机理.由于人类活动的影响,水蒸气、氮氧化物、氟氯燃等污染物进入了平流层, 在平流层形成了HOx, NOx,和ClOx等活性基团,从而加速了臭氧的消除过程, 破坏了臭氧层的稳定状态.臭氧分解的催化机制:Y +.3 一YO + O2YO + O- -> Y + O2总反响;O3+O,T 2O2Y =含旗氧化物NO* 〔NO. N.〞.含氢自由基HOj< H* > HO、HO2* 〕, 含卤自由基CIO/ 〔CI-.CIO*〕- BrO x* 〔曰r*、BrO* 〕13、为什么排放到大气中的CFCs能破坏臭氧层,写出有关化学反响式.〔1〕氟氯煌的光解:CFCI3+ 爪—* CFCI2+ CPCF2c I? + hv—> ♦CFjCI + Cl*〔2〕破坏臭氧:Cl* + O3—> CIO* + O2CIO* + O —> Cl* + O2Og + O ―►14、臭氧层破坏的危害〔1〕皮肤癌发病率上升;〔2〕对眼睛造成各种伤害:如引起白内障,眼球晶体变形等;〔3〕人体免疫力下降;〔4〕对植物生长的影响:研究说明 ,在已经研究过的植物品种中,超过50% 的植物有来自UV-B的负影响,比方豆类,瓜类等作物,另外某些作物如土豆,番茄,甜菜等的质量将会下降;〔5〕危害海洋生物;〔6〕对材料的破坏;〔7〕加剧城市光化学烟雾污染.15、PM 2.5(1)来源:土壤扬尘、海洋气溶胶和车辆尾气.(2)影响因素:排放源的特征和气象条件.(3)危害:人类活动所释放污染物的主要载体,携带有大量的重金属和有机污染物.16、诱发水体沉积物中重金属释放的因素有哪些?(1)盐浓度升高:碱金属和碱土金属阳离子可将吸附在固体颗粒物上的重金属离子交换出来.(2)氧化复原条件的变化:复原条件下, 一些已沉淀的重金属可被溶解,重新进入水体中.(3)降低pH值:导致重金属的碳酸盐和氢氧化物溶解.(4)增加水中配合剂的含量:与重金属形成可溶性的配合物.17、pE-DO的关系(1) 水的氧化复原限度边界条件:氧化限度1.0130X 105Pa氧分压;复原限度1.0130X 105Pa氢分压氧化限度:102 H e -H2O pE020.75 pE = pE^+ log[,.;" [//+]}pE = 20, 75-pll复原限度:H e 1H2 pE00.002pE pE0 log HpE pH(2)天然水中溶解氧是决定电位根据水的氧化反I电1/4 d + H* + e === I/2 HO pE a =20.75pE = pF0 + lg|pO?]1/4(H+]pO2 = 0.21atrnil ] *pE = 20.58-pH (a)如水体呈中性.pE=13.58 ,显然.水体呈一氧化竹二当水体无溶解氧花机物含量「富时,有机物喷的电位为诀定电位.在凤轨条件下.有机物分能f成为CH;.采用以下半反响计算决定电位:1/8CO2 + H* + e == 1/ 8 CH4 + 1/4 HQp£° - 2.87pE = pE° + Ig [pCOj 1 /8[H+l/[pCH J1 /83 , pOOinpCHj,pE = 2 87 - pH (b)如水体pH为7, pE为T43,说明水体处于坯原状态.18、试述水体中有机污染物的迁移转化途径.吸附作用、挥发作用、水解作用、光解作用、生物富集和生物降解.19、在受纳酸性废水排放的水体中,水中金属离子的浓度为什么往往较高?pH降低,导致碳酸盐和氢氧化物的溶解,其原因既有H+离子的竞争吸附作用,也有金属在低pH条件下致使金属难溶盐类及其配合物的溶解.212223、好氧有机污染物的微生物降解(1)糖类的微生物降解糖类通式为C x(H2O)y,分为单糖、二糖和多糖.①多糖水解成单糖多糖在胞外水解酶催化下水解成二糖和单糖, 才能摄入胞内.二糖在胞内水解酶催化作用下变为单糖.c12H li0“+ 40---------- C&O.蔗糖葡萄糖果糖②单糖酵解成丙酮酸细胞内单糖不管在有氧氧化或在无氧氧化条件下,都可经过相应的一系列酶促反响形成丙酮酸.此过程称为单糖酵解.葡萄糖酵解的总反响式:C6H12O6+2NAD + 2CH3COCOOH+ 2NADH+2H +③丙酮酸的转化在有氧的条件下,三竣酸循环(P322),总反响为:CH3COCOOH + 5/2O 2 3CO2+ 2H 2.三竣酸循环:无氧条件下丙酮酸的转化:CH 3COCOOH+2[H]CH 3COCOOH CH 3CHO+2[H] CH 3COCOOH+2[H] (2)脂肪的微生物降解①脂肪水解成脂肪酸和甘油CH 2OOCR d CH 2OHR.COOH 2HOOCR2 + 3H 2O+ R 2COOH占 H2QGR36H 2OH R J COOH②甘油的转化:有氧和无氧条件下, 经一系列酶促反响转变成丙酮酸. 在有氧条件下,丙酮酸转化为二氧化碳和水,无氧条件下,转变为简单有机酸、醇和二氧化碳.CH.OHI CHOH -------------- CH3coe00H + 4[H] ICH20H③脂肪的转化:①在有氧氧化条件下,经过酶促3-氧化途彳空〔图 5- 8〕变成脂酰辅酶 A 和乙酰辅酶A,然后进入TCA 循环,最后完全氧化成二氧化碳和水.CH 3〔CH 2〕i6COOH + 260 2I8CO 2 + I8H 2O②在无氧氧化条件下, 脂肪酸通过酶促反响, 往往以其转化的中间产物作受氢体而被不完全 氧化,形成低级的有机酸、醇和二氧化碳等.〔3〕蛋白质的微生物降解①蛋白质水解成氨基酸: 蛋白质由胞外水解酶催化水解, 经多肽至二肽或氨基酸而被微生物 摄入细胞内.二肽在细胞内可继续水解形成氨基酸. ②氨基酸脱氨脱竣成脂肪酸: 氨基酸在细胞内的转化由于不同酶的作用而有多种途径,以脱氨脱竣形成脂肪酸为主.丙酮酸往往以其本身作受氢体被复原为乳酸, 全氧化生成低级的有机酸、醇及二氧化碳等.或以其转化的中间产物作受氢体, 发生不完CH 3CH(OH)COOH CO 2+CH 3CHO CH 3CH 20H CO 2+ CH 3CH 2OH其中1、持久性有机污染物〔POPs 〕的重要特性是什么?答:〔1〕能在环境中持久存在;〔2〕能蓄积在食物链中对较高营养等级的生物造成影响;〔3〕能够经过长距离迁移到达偏远的极地地区; 〔4〕在相应环境浓度下会对接触该物质的生物造成有害或有害效应.2、简述多氯联苯〔PCBs 〕在环境中的主要分布、迁移与转化规律.答:分布:多氯联苯在大气和水中含量极少.因其易被沉积物所吸附,所以在废水流入河 口附近的沉积物中,含量较高.迁移:水生植物通常可从水中快速吸收PCBs,并发生富集,通过食物链的传递,可到达水生生物和人体.PCBs 在使用和处理过程中,主要通过挥发进入大气,然后经干湿沉降 转入湖泊、海洋;转入水体后被沉积物吸附, 因此沉积物中的多氯联苯仍是今后假设干年内食物链污染的主要来源.转化:PCBs 属于环境中的持久性污染物,其在环境中的转化途径主要是光化学分解和 生物降解.3、简述多环芳煌〔PAH 〕的污染来源及在环境中的迁移与转化.答:来源:天然来源:陆地和水生植物、微生物的生物合成;森林、草原的天然火灾,火 山活动等.人为来源: 主要是矿物燃料、木材、纸张等含碳氢化合物的不完全燃烧或在还③脂肪酸继续转化〔4〕甲烷发酵简单的有机酸、醉乙酸、甲酸、&、co 2CHjCOO H CO +4HCH 4+CO ;CH 4+2H 2O。
环境化学期末考试复习资料一、名词解释:1、环境问题:人类各种活动或自然因素作用于环境而使环境质量发生变化,由此对人类的生产、生活、生存与持续发展造成不利影响的问题称为环境问题。
2、环境污染:由于人为因素使环境的构成或状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件,叫做环境污染。
3、富营养化:是指在人类活动的影响下,生物所需的氮、磷等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其它浮游生物迅速繁殖,水体溶解氧量下降,水质恶化,鱼类及其它生物大量死亡的现象。
4、分配系数:非离子性有机化合物可以通过溶解作用分配到土壤有机质中,并经过一段时间达到分配平衡,此时有机化合物在土壤有机质和水中的含量的比值称为分配系数。
5、标化分配系数:达分配平衡后,有机毒物在沉积物中和水中的平衡浓度之比称为标化分配系数。
6、辛醇-水分配系数:达分配平衡时,有机物在辛醇中的浓度和在水中的浓度之比称为有机物的辛醇-水分配系数。
7、生物浓缩因子:有机毒物在生物体内浓度与水中该有机物浓度之比。
8、亨利定律常数:化学物质在气——液相达平衡时,该化学物质在在水中的平衡浓度和其水面大气中的平衡分压之比。
9、水解常数:有机物在水中水解速率与其在水中浓度之比称为水解常数。
10、直接光解:有机化合物本身直接吸收太阳光而进行分解反应。
11、敏化光解:腐殖质等天然物质被光激发后,将激发的能量转移给有机化合物而导致分解反应。
12、光量子产率:进行光化学反应的光子占吸收总光子数之比称为光量子产率。
13、生长代谢:微生物可用有机化合物(有机污染物)作唯一碳源和能源从而使该化合物降解的代谢。
14、共代谢:某些有机污染物不能作为微生物的唯一用碳源和能源,须有另外的化合物提供微生物的碳源和能源,该化合物才能降解。
15、生物富集(Bio-enrichment):指生物通过非吞食方式(吸收、吸附等),从周围环境(水、土壤、大气)中蓄积某种元素或难降解的物质,使其在机体内的浓度超过周围环境中浓度的现象。
16、生物放大(Bio-magnification):同一食物链上的高营养级生物,通过吞食低营养级生物富集某种元素或难降解物质,使其在机体内的浓度随营养级数提高而增大的现象。
17、生物积累(Bio-accumulation) :指生物从周围环境(水、土壤、大气)和食物链蓄积某种元素或难降解物质,使其在机体中的浓度超过周围环境中浓度的现象。
18、半数有效剂量(ED50)和半数有效浓度(EC50):毒物引起一群受试生物的半数产生同一毒作用所需的毒物剂量和毒物浓度。
19、阈剂量:是指长期暴露在毒物下,引起机体受损害的最低剂量。
20、最高允许剂量:是指长期暴露在毒物下,不引起引起机体受损害的最高剂量。
15、基因突变:指DNA中碱基对的排列顺序发生改变。
包括碱基对的转换、颠换、插入和缺失四种类型。
16、遗传致癌物:1)直接致癌物:直接与DNA反应引起DNA基因突变的致癌物,如双氯甲醚。
2)间接致癌物(前致癌物):不能直接与DNA反应,需要机体代谢活化转变后才能与DNA反应导致遗传密码改变。
如二甲基亚硝胺、苯并(a)芘等。
17、半数有效剂量:ED50和EC50分别是毒物引起一群受试生物的半数产生同一毒作用所需的毒物剂量和毒物浓度。
18、阈剂量:是指长期暴露在毒物下,引起机体受损害的最低剂量。
19、汞的甲基化:在好氧或厌氧条件下,某些微生物将二价无机汞盐转变为一甲基汞和二甲基汞的过程称汞的甲基化。
20、促癌物:可使已经癌变细胞不断增殖而形成瘤块的物质。
如巴豆油中的巴豆醇二酯、雌性激素乙烯雌酚,免疫抑制剂硝基咪唑硫嘌呤等。
21、助致癌物:可加速细胞癌变和已癌变细胞增殖成瘤块的物质。
如二氧化硫、乙醇、儿茶酚、十二烷等,促癌物巴豆醇二酯同时也是助致癌物。
22、POPs(Persistent organic pollutants):持久性有机污染物,是一类具有环境持久性、生物累积性、长距离迁移能力和高生物毒性的特殊污染物。
23、PTS(Persistent Toxic Substances):持久性毒害污染物,是指一类具有很强的毒性,在环境中难降解,可远距离传输,并随食物链在动物和人体中累积、放大,具有内分泌干扰特性的污染物,包括POPs和某些重金属污染物。
24、PP(priority pollutants):优先污染物,是指毒性强、难降解、残留时间长、在环境中分布广的污染物优先进行控制。
25、PCBs:多氯联苯26、PCDDs/PCDFs:二恶英和呋喃类PCDD:多氯代二苯并二恶英PCDF:多氯代二苯并呋喃TCDD:2,3,7,8-四氯二苯并二恶英,是目前已知的有机物中毒性最强的物质。
27、EDCs(Endocrine disrupting compounds):环境内分泌干扰物,对天然激素的合成、分泌、传输、结合和清除功能起干扰作用的外源物质。
28、PAEs(Phthalate Esters):邻苯二甲酸酯。
29、PBDEs(Polybrominated Diphenyl Ethers ):多溴代联苯醚30、CFCs:氟氯烃类31、PAH:多环芳烃,是指两个以上苯环连在一起的化合物。
32、PAN:过氧乙酰基硝酸酯33、TSP(total suspended particulates):总悬浮颗粒物34、SPM(suspended particulate matters):飘尘35、IP(inhalable particles):可吸入粒子36、POM(Particulate organic matter):有机颗粒物37、BaP:苯并[a]芘二、填空题:1、常见持久性有机污染物:艾氏剂(Aldrin)、狄氏剂(Dieldrin)、异狄氏剂(Endrin)、滴滴涕(DDT)、氯丹(Chlordane)毒杀芬(Toxaphene)、六氯苯(Hexachlobenzene)、灭蚁灵(Mirex)、七氯(Heptachlor)、多氯联苯(PCBs)、二恶英和呋喃类(PCDDs/PCDFs)。
2、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占__80%-90%_。
3、环境化学研究的对象是:环境污染物。
4、环境中污染物的迁移主要有机械、物理-化学和生物迁移三种方式。
5、人为污染源可分为_工业_、__农业_、__交通_、和__生活_。
6、如按环境变化的性质划分,环境效应可分为环境物理、环境化学、环境生物三种。
7、属于环境化学效应的是 CA热岛效应B温室效应C土壤的盐碱化D噪声8、五十年代日本出现的痛痛病是由___A _污染水体后引起的A CdB HgC PbD As9、五十年代日本出现的水俣病是由_B__污染水体后引起的A CdB HgC PbD As10、对颗粒物性质最为关注的是其粒径,其次是它携带的化学物质。
11、写出下列物质的光离解反应方程式:(1)NO2+ hν NO + O(2)HNO2 + hν HO + NO 或HNO2 + hν H + NO2(3)HNO3 + hν HO + NO2(4)H 2CO + hν + HCO 或H2CO + hν H2+ CO(5)CH 3X + hν + X12、大气中的NO2可以转化成HNO2、NO3和HNO3等物质。
13、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
14、乙烯在大气中与O3的反应机理如下:CH2(O3)CH2O3 + CH2 == CH2H2CO+H2COO15、大气颗粒物的去除与颗粒物的粒度、化学组成和性质有关,去除方式有干沉降和湿沉降两种。
16、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln-1 + ClCl + O3O2 + ClOClO +O O2 + Cl17、当今世界上最引人瞩目的几个环境问题中的____温室效应_____、___臭氧层破坏__、光化学烟雾___等是由大气污染所引起的。
18、大气颗粒物的三模态为__爱根核模__、__积聚模___、_粗粒子模__。
19、大气中最重要的自由基为HO__。
20、能引起温室效应的气体主要有CO2_、CH4__、_N2O__、_氯氟烃___等。
21、CFC-11和Halon1211的分子式分别为__CFCl3____和__ CF2ClBr____。
22、大气的扩散能力主要受____风__和____湍流___的影响。
23、大气颗粒物按粒径大小可分为_总悬浮颗粒物__、_飘尘_、降尘、可吸入颗粒物。
24、根据温度垂直分布可将大气圈分为对流层、平流层、__中间层_、热层和逸散层。
25、伦敦烟雾事件是由SO2__、__颗粒物、硫酸盐颗粒物等污染物所造成的大气污染现象。
26、大气中CH4主要来自有机物的厌氧发酵、动物呼吸作用_、_原油及天然气的泄漏的排放。
27SO42-、__NO3-、__Cl-_、__HCO3-__。
28、由于通常化学键的键能大于167.4Kj/mol,所以波长大于700nm的光往往不能引起化学离解。
29、我国酸雨中关键性离子组分是SO42- 、Ca2+、NH4+。
30、大气中HO自由基的来源有 A C D 的光离解。
A O3B HCHOC H2O2D HNO231、烷烃与大气中的HO自由基发生氢原子摘除反应,生成 B C 。
A ROB R自由基C H2OD HO232、酸雨是指pH___C___的雨、雪或其它形式的降水。
A <6.0B <7.0C <5.6D <5.033、辐射一定时间产生的__A B_量可以衡量光化学烟雾的严重程度。
A O3B NO2C 碳氢化合物D SO234、大气逆温现象主要出现在___D___。
A 寒冷的夜间B 多云的冬季C 寒冷而晴朗的冬天D 寒冷而晴朗的夜间35、大气中还原态气体(如H2S)主要被__B_氧化。
A O2B HOC O3D高价金属离子36、根据Whittby的三模态模型,粒径小于 A μm的粒子称为爱根核模。
A 0.05B 0.1C 1D 237、随高度的增加气温 A 的现象,称为逆温。
A 升高B 降低C 不变38、气溶胶中粒径______D__μm的颗粒,称为可吸入颗粒物。
A >10B <5C >15D <1039、我国酸雨中关键性离子组分中,SO42-作为酸的指标。
A Ca2+B SO42-C NH4+40、天然水中的总碱度= [HCO3-] +2 [CO32-] + [OH-] —[H+]41、水环境中胶体颗粒物的吸附作用分为表面吸附、离子交换吸附和专属吸附。
42、天然水的PE随水中溶解氧的减少而降低,因而表层水呈氧化性环境。