各类免疫球蛋白的特性和功能
- 格式:ppt
- 大小:30.50 KB
- 文档页数:9

第三章免疫球蛋白免疫球蛋白(Ig):具有Ab活性或化学结构与Ab相似的球蛋白。
*抗体(Ab):有效Ag刺激BC使之分化增殖为浆C,产生能与相应Ag特异性结合的球蛋白。
Ag→BC→浆C→抗体(都是)免疫球蛋白(Ig):IgG、M、A、D、E免疫球蛋白不一定都是抗体1、存在:血清、组织液、外分泌液、某些淋巴C表面,如BC。
2、血清电泳:γ区、延伸至β、α2区。
3、性质:A、不耐热、需低温保存,对蛋白酶敏感。
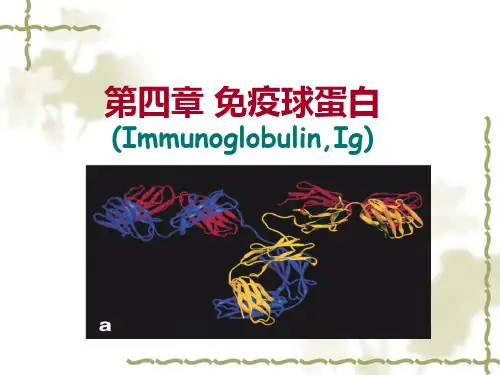
B、可被中性盐类沉淀:免疫血清50%(NH4)2SO4→Ig一、Ig的基本结构:(结合图7)(一)重链和轻链:各一对、由—S-S—相连、呈“T”或“Y”形。
两个末端:氨基端(N端)、羧基端(c端)。
(二)可变区和恒定区:1、可变区(V区):位于N端,高变区(HVR):在V区内,L链和H链各有三个HYR,是抗体与抗原结合部位。
*Ig的高变区(结构)与抗原结合部位(功能) 均在HVRIg独特型抗原决定簇(该区抗原性)2、恒定区(C区):位于C端。
(三)绞链区:在CH1与CH2之间,含脯氨酸较多,可自由转动,有助Ab与抗原决定簇结合、使Ig变构(“T”→Y)、暴露其上的补体C1q结合点,激活补体。
此区对蛋白酶敏感。
(四)Ig的水解片段:IgG木瓜蛋白酶→2Fab段与抗原结合1Fc段有多种生物功能IgG胃蛋白酶→F(ab')2段;→2F(ab')段pFc'段:小分子多肽、无免疫原性*在制备免疫制剂、疾病防治上有实际意义,如马血清抗毒素在胃蛋白酶作用下除去大部分Fc段、降低其(Fc段)免疫原性,减少血清过敏反应发生丙种球蛋白→胃蛋白酶作用后→静脉注射丙种球蛋白(五)J链和分泌片:1、J链:由合成IgA或IgM的浆C产生。
作用:稳定多聚体结构及参与体内运转。
2、分泌片(SP):由粘膜上皮C合成。
作用:保护slgA免受蛋白酶的水解,介导多聚IgA向黏膜上皮外输送。
二、Ig的抗原性(自学):三、Ig的生物学功能:(一)特异性结合抗原:(二)激活补体:(三)通过与细胞FcR结合发挥生物学效应:1、调理(促吞噬)作用:细菌等颗粒性Ag+IgG→通过其IgG的Fc段与吞噬C表面FcR结合→促进吞噬细菌等Ag 2、ADCC(发挥抗体依赖细胞介导的细胞毒作用):带有相应Ag的靶C(如病毒感染c、肿瘤c)+IgG促进对靶C的杀伤↓通过IgG的Fc段与NKC、巨噬C等细胞表面FcR结合3、介导I型超敏反应(四)中和作用: 1、抗毒素+游离外毒素→毒性中和2、中和Ab十V→可改变V表面结构,使其失去致病性(五)通过胎盘与黏膜(选择性传递): 1、母体IgG通过胎盘→胎儿2、SIgA通过粘膜→呼吸道、消化道(六)免疫调节:对IR具有正、负调节作用,如IgG的反馈调节作用;独特型网络的调节作用。

第四章免疫球蛋白第一节基本概念1、抗体:B淋巴细胞在有效的抗原刺激下分化为浆细胞,产生具有与相应抗原发生特异性结合功能的免疫球蛋白,这类免疫球蛋白称为抗体。
1937年,Tiselius用电泳方法将血清蛋白分为白蛋白、α1、α2、β及γ球蛋白等组分,其后又证明抗体的活性部分是在γ球蛋白部分。
因此,相当长一段时间内,抗体又被称为γ球蛋白(丙种球蛋白)。
实际上,抗体的活性除γ球蛋白外,还存在于α和β球蛋白处。
20世纪40年代初期,Tiselius和Kabat用肺炎球菌多糖免疫家兔,证实了抗体活性与血清丙种球蛋白组分相关。
肺炎球菌多糖免疫家兔后可获得高效价免疫血清。
然后加入相应抗原吸收以除去抗体,将除去抗体的血清进行电泳图谱分析,发现丙种球蛋白(γ-G)组分明显减少,从而证明了抗体活性是存在于丙种球蛋白内。
2、免疫球蛋白:具有抗体活性或化学结构与抗体相似的球蛋白统称为免疫球蛋白(immunoglobulin,Ig)。
区别:抗体都是免疫球蛋白,而免疫球蛋白并不都是抗体。
如骨髓瘤蛋白,巨球蛋白血症、冷球蛋白血症等患者血清中存在的异常免疫球蛋白结构与抗体相似,但无抗体活性。
免疫球蛋白可分为分泌型(secreted Ig,SIg)和膜型(membrane Ig, mIg)。
前者主要存在于血清及其他体液或外分泌液中,具有抗体的各种功能;后者是B细胞表面的抗原识别受体。
第二节免疫球蛋白结构一、免疫球蛋白的基本结构(一)重链和轻链免疫球蛋白分子是由两条相同的重链(heavy chain,H链)和两条相同的轻链(light chain,L链)通过链间二硫键连接而成的四肽链结构。
X 射线晶体结构分析发现,IgG分子由3个相同大小的节段组成。
1. 重链分子量约为50~75kD,由450~550个氨基酸残基组成。
免疫球蛋白重链恒定区由于氨基酸的组成和排列顺序不同,故其抗原性也不同。
据此,可将免疫球蛋白分为五类,即IgM、IgD、IgG、IgA和IgE,其相应的重链分别为μ链、δ链、γ链、α链和ε链。





医学免疫学免疫球蛋白大纲要求一、基本概念二、免疫球蛋白的结构三、免疫球蛋白的类型四、免疫球蛋白的功能五、各类免疫球蛋白的特性和功能六、抗体的制备一、基本概念(一)抗体(antibody, Ab)是B细胞接受抗原刺激后增殖分化为浆细胞所产生的糖蛋白,主要存在于血清等体液中,是介导体液免疫的重要效应分子。
(二)免疫球蛋白(immunoglobulin, Ig)指具有抗体活性的或化学结构与抗体相似的球蛋白。
二、免疫球蛋白(Ig)的结构(一)Ig的基本结构由两条相同的重链(H链)和两条相同的轻链(L链)借链间二硫键连接组成。
可变区(V区)和恒定区(C区)可变区:H链近氨基端(N端)1/4或1/5区域内的氨基酸、L链近N端1/2区域内的氨基酸序列多变,称为V区。
超变区(HVR):VH和VL各有3个区域的氨基酸组成和排列顺序高度可变,称为HVR,也称为互补决定区(CDR)。
一般CDR3变化程度更高。
骨架区(FR)恒定区:H链和L链靠近C端区域的氨基酸序列相对稳定,称为C区。
免疫球蛋白的类、亚类、型、亚型根据CH不同分为五类:CH:γαμδεIg: IgG IgA IgM IgD IgE亚类:IgG1~IgG4; IgA1、IgA2。
根据CL不同分为两型:κ型、λ型亚型:λ1~λ4(二)Ig的功能区L链:VL、CL。
H链:VH、CH1、CH2、CH3(IgA、IgG、IgD)VH、CH1、CH2、CH3、CH4(IgM、IgE)铰链区:位于CH1与CH2之间,易弯曲。
各功能区主要功能:VH、VL:与抗原特异性结合部位CH和CL:遗传标志所在处IgG的CH2和IgM的CH3:激活补体IgG的CH2/CH3和IgE的CH4:结合细胞(三)Ig的其他成分J链:浆细胞合成(IgM、SIgA)。
分泌片(SP):黏膜上皮细胞合成(存在于SIgA)。
使IgA分泌到黏膜表面,免受蛋白酶的降解。
(四)Ig的酶解片段木瓜蛋白酶水解片段2Fab(抗原结合片段)Fc(可结晶片段)胃蛋白酶水解片段F(ab’)2和pFc’既保留了双价结合抗原的活性,又避免了Fc段抗原性可能引起的副作用。



各类免疫球蛋白的特性与功能医学知识医学基础知识重点:各类免疫球蛋白的特性与功能2015-05-22 19:38:54| 医疗卫生人才网推荐:中公医学网医疗卫生考试网医学免疫学属于医学基础知识需要掌握的内容,中公卫生人才招聘考试网帮助大家梳理知识。
1.IgG(1)合成与分布特点血清和细胞外液中含量最高。
是再次免疫应答产生的主要抗体,是抗感染的主力军。
于出生后3个月开始合成,3~5岁接近成人水平。
IgG是血清中含量最高的Ig,占血清总Ig的75%~80%。
人IgG有IgG1~IgG4 4个亚类。
IgG半寿期长,约20~23天。
为再次免疫应答的主要抗体。
(2)主要生物学作用具有抗感染作用、通过胎盘、与细胞表面的Fcγc结合、激活补体、参与自身免疫性疾病与超敏反应。
2.IgM(1)合成特点分泌型IgM为五聚体,是分子量最大的Ig,易激活补体。
天然血型抗体为IgM。
发育过程中最早合成的抗体。
初次免疫应答最早出现的抗体,用于感染的早期诊断。
①合成早:在胚胎发育晚期的胎儿即能产生IgM,故脐带血IgM 增高提示胎儿有宫内感染。
②合成快:在抗原刺激诱导的体液免疫应答中,IgM也是最先产生的抗体。
感染过程中血清IgM水平升高,说明有近期感染,该指标有助于早期诊断。
(2)主要生物学作用:①抗感染作用:IgM是初次体液免疫应答早期阶段产生的主要Ig,在早期免疫防御中具有重要作用,是血管内抗感染的主要抗体。
②激活补体:IgM可通过经典途径激活补体。
③参与自身免疫性疾病与超敏反应。
3.IgA的特性和功能sIgA是外分泌液中的主要抗体类别,在局部抗感染免疫中发挥重要作用。
sIgA在粘膜表面有中和毒素的作用。
婴儿可从母亲初乳中获得sIgA,为重要的自然被动免疫。
4.IgE的特性和功能血清中含量最少的Ig。
为亲细胞抗体,可通过Fc段介导I型超敏反应。
IgE主要由呼吸道和消化道黏膜固有层中的浆细胞产生。
IgE的主要生物学作用有:诱发I型超敏反应、抗寄生虫作用。
各类免疫球蛋白的特性和功能免疫球蛋白(Immunoglobulin,Ig)是一类由B淋巴细胞产生的特异性抗体分子,在机体免疫防御中起着重要的作用。
根据其结构和功能的差别,免疫球蛋白可以进一步分为五个类别,分别是IgG、IgM、IgA、IgD和IgE。
以下将分别介绍它们的特性和功能。
1.IgG(免疫球蛋白G):IgG是体液免疫的主要抗体,占人体血液中抗体的75-80%。
其分子量为约150kDa,由两条重链和两条轻链构成。
IgG能够通过胎盘屏障,保护胎儿免受感染。
此外,IgG还可结合病毒、细菌及其他病原体,中和其毒性并促进其吞噬和清除。
2.IgM(免疫球蛋白M):IgM是人体内最早产生的抗体,被称为“自然抗体”。
其分子量为约900kDa,由五个单体形成的五聚体构成。
IgM的特点是反应速度快、效果明显,是早期免疫应答的主要抗体。
IgM可吸附在细胞表面,起着识别和介导固定补体的作用。
3.IgA(免疫球蛋白A):IgA主要存在于体液分泌物中,如唾液、泪液、乳汁和呼吸道分泌物等。
其分子量为约400kDa,由两条重链和两条轻链构成。
IgA的主要功能是保护黏膜免受细菌和病毒感染。
它可以阻止病原体与黏膜上皮细胞结合,从而阻碍其入侵。
4.IgD(免疫球蛋白D):IgD的分子量为约180kDa,其功能至今尚不完全清楚。
IgD主要存在于B细胞表面,作为其受体存在。
它可识别体内外的抗原,并通过诱导B细胞的成熟和激活,参与免疫应答。
5.IgE(免疫球蛋白E):IgE是体液免疫中的一种重要抗体,其分子量约为190kDa。
IgE主要与过敏反应和寄生虫感染有关。
当机体暴露在特定抗原上时,IgE会被B细胞产生并结合到体表的肥大细胞和嗜碱粒细胞上,在重新接触到抗原时,会引发进行了致敏的机体产生过敏反应。
免疫球蛋白的功能不仅仅限于上述描述,它们还具有其他作用。
例如,IgG和IgM可以通过结合病原体表面的抗原结构,促进其吞噬和清除,同时还能诱导补体的结合和激活。